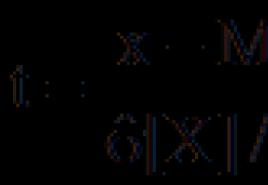Elementa daļa vielā. Kā aprēķināt vielas masas daļu
Zinot ķīmisko formulu, varat aprēķināt ķīmisko elementu masas daļu vielā. elements vielās tiek apzīmēts ar grieķu valodu. burts "omega" - ω E / V un tiek aprēķināts pēc formulas:
kur k ir šī elementa atomu skaits molekulā.
Kāda ir ūdeņraža un skābekļa masas daļa ūdenī (H 2 O)?
Risinājums:
M r (H 2 O) \u003d 2 * A r (H) + 1 * A r (O) \u003d 2 * 1 + 1 * 16 \u003d 18
2) Aprēķiniet ūdeņraža masas daļu ūdenī:
3) Aprēķiniet skābekļa masas daļu ūdenī. Tā kā ūdens sastāvā ir tikai divu ķīmisko elementu atomi, skābekļa masas daļa būs vienāda ar:

Rīsi. 1. 1. uzdevuma risinājuma formulēšana
Aprēķina elementu masas daļu vielā H 3 PO 4.
1) Aprēķiniet vielas relatīvo molekulmasu:
M r (H 3 RO 4) \u003d 3 * A r (H) + 1 * A r (P) + 4 * A r (O) \u003d 3 * 1 + 1 * 31 + 4 * 16 \u003d 98
2) Mēs aprēķinām ūdeņraža masas daļu vielā:
3) Aprēķiniet fosfora masas daļu vielā:
4) Aprēķiniet skābekļa masas daļu vielā:
1. Uzdevumu un vingrinājumu krājums ķīmijā: 8. klase: uz mācību grāmatu P.A. Oržekovskis un citi."Ķīmija, 8. klase" / P.A. Oržekovskis, N.A. Titovs, F.F. Hēgelis. - M.: AST: Astrel, 2006.
2. Ušakova O.V. Ķīmijas darba burtnīca: 8. klase: uz mācību grāmatu P.A. Oržekovskis un citi.“Ķīmija. 8. klase” / O.V. Ušakova, P.I. Bespalovs, P.A. Oržekovskis; zem. ed. prof. P.A. Oržekovskis - M .: AST: Astrel: Profizdat, 2006. (34.-36. lpp.)
3. Ķīmija: 8. klase: mācību grāmata. par ģenerāli iestādes / P.A. Oržekovskis, L.M. Meščerjakova, L.S. Pontaks. M.: AST: Astrel, 2005. (§15)
4. Enciklopēdija bērniem. Sējums 17. Ķīmija / Nodaļa. rediģēja V.A. Volodins, vadošais. zinātnisks ed. I. Lēnsone. - M.: Avanta +, 2003.
1. Vienota digitālā kolekcija izglītības resursi ().
2. Žurnāla "Ķīmija un dzīve" elektroniskā versija ().
4. Video nodarbība par tēmu "Ķīmiskā elementa masas daļa vielā" ().
Mājasdarbs
1. lpp.78 Nr.2 no mācību grāmatas "Ķīmija: 8. klase" (P.A. Oržekovskis, L.M. Meščerjakova, L.S. Pontak. M .: AST: Astrel, 2005).
2. Ar. 34-36 №№ 3.5 no Darba burtnīcaķīmijā: 8. klase: uz mācību grāmatu P.A. Oržekovskis un citi.“Ķīmija. 8. klase” / O.V. Ušakova, P.I. Bespalovs, P.A. Oržekovskis; zem. ed. prof. P.A. Oržekovskis - M.: AST: Astrel: Profizdat, 2006.
Kas ir masas daļa? Piemēram, ķīmiskā elementa masas daļa ir elementa masas attiecība pret visas vielas masu. Masas daļu var izteikt gan procentos, gan frakcijās.
Kur var izmantot masas daļu?
Šeit ir daži no norādījumiem:
Kompleksa elementārā sastāva noteikšana ķīmisks
Elementa masas atrašana pēc sarežģītas vielas masas
Aprēķiniem tiešsaistē tiek izmantots vielas molārās masas kalkulators ar paplašinātiem datiem, kurus var redzēt, ja izmantojat XMPP vaicājumu.
Līdzīgu iepriekš norādīto uzdevumu aprēķins, izmantojot šo lapu, kļūst vēl vienkāršāks, ērtāks un precīzāks. Par precizitāti runājot. Skolas mācību grāmatās nez kāpēc elementu molmasas ir noapaļotas līdz veseliem skaitļiem, kas ir diezgan noderīgi skolas uzdevumu risināšanai, lai gan patiesībā katra ķīmiskā elementa molmasas tiek periodiski koriģētas.
Mūsu kalkulators necenšas parādīt augstu precizitāti (virs 5 zīmēm aiz komata), lai gan tas nav grūti. Lielākoties ar tām elementu atommasām, kuras izmanto kalkulatoru, pietiek, lai atrisinātu uzdevumus, kas izvirzīti elementu masas daļu noteikšanai.
Bet tiem pedantiem :) kam rūp precizitāte, ieteiktu linku Atomu svari un izotopiskie sastāvi visiem elementiem kurā visi ķīmiskie elementi, to relatīvās atomu masas, kā arī katra elementa visu izotopu masas.
Tas ir viss, ko es gribētu pateikt. Tagad mēs apsvērsim konkrēti uzdevumi un kā tās atrisināt. Ņemiet vērā, ka, lai gan tie visi ir neviendabīgi, tie pēc būtības ir balstīti uz vielas molmasu un elementu masas daļām šajā vielā.
2017. gada rudens sākumā pievienoju vēl vienu kalkulatoru Vielas molu daļas un atomu skaits, kas palīdzēs atrisināt problēmas par tīras vielas masu kompleksā vielā, molu skaitu vielā un katrā elementā, kā arī atomu/molekulu skaits vielā.
Piemēri
Aprēķiniet elementu masas daļu vara sulfātā CuSO 4
Pieprasījums ir ļoti vienkāršs, vienkārši uzrakstiet formulu un iegūstiet rezultātu, kas būs mūsu atbilde
Kā jau minēts skolas mācību grāmatās, ir diezgan aptuvenas vērtības, tāpēc nebrīnieties, ja atbildes papīra grāmatas Tu redzēsi Cu = 40%, O = 40%, S = 20%. Tā ir, teiksim, vienkāršošanas "blakusparādība". skolas materiāls, studentiem. Reālām problēmām mūsu atbilde (bota atbilde) dabiski ir precīzāka.
Ja runa bija par to, ko izteikt daļdaļās, nevis procentos, tad katra elementa procentus dalām ar 100 un atbildi iegūstam daļdaļās.
Cik daudz nātrija ir 10 tonnās kriolīna Na3?
Mēs ieviešam kriolīna formulu un iegūstam šādus datus
No iegūtajiem datiem redzam, ka 209,9412 vielas daudzumi satur 68,96931 daudzumu nātrija.
Neatkarīgi no tā, vai mēs to mēram gramos, kilogramos vai tonnās, attiecībai nekas nemainās.
Tagad atliek izveidot citu korespondenci, kur mums ir 10 tonnas oriģinālās vielas un nezināms daudzums nātrija
Tā ir tipiska proporcija. Protams, varat izmantot botnu Proporciju un attiecību aprēķināšana, taču šī proporcija ir tik vienkārša, ka mēs to darīsim ar rokturiem.
209,9412 ir 10 (tonnām), jo 68,96391 ir nezināms skaitlis.
Tādējādi nātrija daudzums (tonnās) kriolīnā būs 68,96391*10/209,9412=3,2849154906231 tonnas nātrija.
Atkal, skolai dažkārt būs jānoapaļo līdz veselam skaitlim elementu masas saturs vielā, taču atbilde patiesībā īpaši neatšķiras no iepriekšējās.
69*10/210=3.285714
Precizitāte līdz simtdaļām ir tāda pati.
Aprēķiniet, cik daudz skābekļa satur 50 tonnas kalcija fosfāta Ca3(PO4)2?
Dotās vielas masas daļas ir šādas
Tāda pati proporcija kā iepriekšējā uzdevumā 310.18272 attiecas uz 50 (tonnām), kā arī 127.9952 uz nezināmo vērtību
atbilde 20,63 tonnas skābekļa atrodas noteiktā vielas masā.
Ja formulai pievienojam izsaukuma zīmi, norādot, ka uzdevums ir skola (tiek izmantota aptuvena atommasu noapaļošana līdz veseliem skaitļiem), tad mēs saņemam šādu atbildi:
Proporcija būs šāda
310 attiecas uz 50 (tonnām), kā arī 128 uz nezināmu daudzumu. Un atbilde
20,64 tonnas
Kaut kas tamlīdzīgs:)
Veiksmi aprēķinos!!
Ko nozīmē jēdziens "masas daļa"?
Masas daļu mēra procentos vai vienkārši desmitdaļās. Nedaudz augstāk mēs runājām par klasisko definīciju, ko var atrast uzziņu grāmatās, enciklopēdijās vai skolas ķīmijas mācību grāmatās. Taču izprast teiktā būtību nav tik vienkārši. Tātad, pieņemsim, ka mums ir 500 g kādas sarežģītas vielas. Komplekss šajā gadījumā nozīmē, ka tas pēc sastāva nav viendabīgs. Kopumā visas mūsu lietojamās vielas ir sarežģītas, pat vienkāršas galda sāls, kuras formula ir NaCl, tas ir, tā sastāv no nātrija un hlora molekulām. Ja mēs turpinām argumentāciju par galda sāls piemēru, tad varam pieņemt, ka 500 grami sāls satur 400 gramus nātrija. Tad tā masas daļa būs 80% vai 0,8.
Kāpēc dārzniekam tas vajadzīgs?
Es domāju, ka jūs jau zināt atbildi uz šo jautājumu. Visu veidu šķīdumu, maisījumu u.c. sagatavošana ir jebkura dārznieka saimnieciskās darbības neatņemama sastāvdaļa. Šķīdumu veidā tiek izmantoti mēslošanas līdzekļi, dažādi barības vielu maisījumi, kā arī citi preparāti, piemēram, augšanas stimulatori "Epin", "Kornevin" utt. Turklāt bieži vien ar iegādāto substrātu ir nepieciešams sajaukt sausas vielas, piemēram, cementu, smiltis un citus komponentus, vai parasto dārza augsni. Tajā pašā laikā ieteicamā šo līdzekļu un preparātu koncentrācija sagatavotajos šķīdumos vai maisījumos lielākajā daļā instrukciju ir norādīta masas daļās.
Tādējādi, zinot, kā aprēķināt elementa masas daļu vielā, vasaras iedzīvotājs varēs pareizi sagatavot nepieciešamo mēslojuma vai barības vielu maisījuma šķīdumu, un tas, savukārt, noteikti ietekmēs turpmāko ražu.
Aprēķinu algoritms
Tātad atsevišķas sastāvdaļas masas daļa ir tās masas attiecība pret šķīduma vai vielas kopējo masu. Ja iegūtais rezultāts ir jāpārvērš procentos, tad tas jāreizina ar 100. Tādējādi masas daļas aprēķināšanas formulu var uzrakstīt šādi:
W = vielas masa / šķīduma masa
W = (vielas masa / šķīduma masa) x 100%.
Masas daļas noteikšanas piemērs
Pieņemsim, ka mums ir šķīdums, kura pagatavošanai 5 g NaCl tika pievienots 100 ml ūdens, un tagad ir jāaprēķina galda sāls koncentrācija, tas ir, tā masas daļa. Mēs zinām vielas masu, un iegūtā šķīduma masa ir divu masu - sāls un ūdens - summa un ir vienāda ar 105 g. Tādējādi mēs dalām 5 g ar 105 g, reizinim rezultātu ar 100 un iegūstam vēlamo vērtību par 4,7%. Šī ir sāls šķīduma koncentrācija.
Praktiskāks uzdevums
Praksē vasaras iedzīvotājam bieži nākas saskarties ar cita veida uzdevumiem. Piemēram, ir nepieciešams sagatavot mēslošanas līdzekļa ūdens šķīdumu, kura masas koncentrācijai jābūt 10%. Lai precīzi ievērotu ieteicamās proporcijas, ir jānosaka, kāds vielas daudzums būs nepieciešams un kādā ūdens tilpumā tā būs jāizšķīdina.
Problēmas risinājums sākas apgrieztā secībā. Pirmkārt, masas daļa, kas izteikta procentos, jāsadala ar 100. Rezultātā mēs iegūstam W \u003d 0,1 - tā ir vielas masas daļa vienībās. Tagad apzīmēsim vielas daudzumu kā x, bet šķīduma galīgo masu – M. Šajā gadījumā pēdējo vērtību veido divi termini – ūdens masa un mēslojuma masa. Tas ir, M = Mv + x. Tādējādi mēs iegūstam vienkāršu vienādojumu:
W = x / (Mv + x)
Atrisinot to x, mēs iegūstam:
x \u003d W x Mv / (1 - W)
Aizvietojot pieejamos datus, mēs iegūstam šādu atkarību:
x \u003d 0,1 x Mv / 0,9
Tādējādi, ja šķīduma pagatavošanai ņemam 1 litru (tas ir, 1000 g) ūdens, tad vēlamās koncentrācijas šķīduma pagatavošanai būs nepieciešami aptuveni 111-112 g mēslojuma.
Problēmu risināšana ar atšķaidīšanu vai pievienošanu
Pieņemsim, ka mums ir 10 litri (10 000 g) gatava ūdens šķīduma ar noteiktas vielas koncentrāciju W1 = 30% vai 0,3. Cik daudz ūdens tam būs jāpievieno, lai koncentrācija pazeminātos līdz W2 = 15% vai 0,15? Šajā gadījumā formula palīdzēs:
Mv \u003d (W1x M1 / W2) - M1
Aizstājot sākotnējos datus, mēs iegūstam, ka pievienotā ūdens daudzumam jābūt:
Mv \u003d (0,3 x 10 000 / 0,15) - 10 000 \u003d 10 000 g
Tas ir, jums jāpievieno tie paši 10 litri.
Tagad iedomājieties apgriezto problēmu - ir 10 litri ūdens šķīduma (M1 = 10 000 g) ar koncentrāciju W1 = 10% vai 0,1. Ir nepieciešams iegūt šķīdumu ar mēslojuma masas daļu W2 = 20% vai 0,2. Cik daudz izejmateriāla jāpievieno? Lai to izdarītu, jums jāizmanto formula:
x \u003d M1 x (W2 - W1) / (1 - W2)
Aizstājot sākotnējo vērtību, mēs iegūstam x \u003d 1 125 g.
Tādējādi zināšanas par vienkāršākajiem skolas ķīmijas pamatiem palīdzēs dārzniekam pareizi sagatavot mēslojuma šķīdumus, barības vielu substrātus no vairākiem elementiem vai maisījumus būvdarbiem.
Jēdziens "dalīšanās" jums, iespējams, jau ir pazīstams.
Piemēram, attēlā redzamais arbūza gabals ir viena ceturtdaļa no visa arbūza, tas ir, tā daļa ir 1/4 jeb 25%.
Lai labāk saprastu, kas ir masas daļa, iedomājieties kilogramu saldumu (1000g), ko māte nopirka saviem trim bērniem. No šī kilograma jaunāks bērns dabūja pusi no visām konfektēm (protams, negodīgi!). Vecākais - tikai 200g, bet vidējais - 300g.
Tas nozīmē, ka saldumu masas daļa jaunākajam bērnam būs puse jeb 1/2 vai 50%. Vidējam bērnam būs 30%, bet vecākajam bērnam būs 20%. Jāuzsver, ka masas daļa var būt bezizmēra vērtība (ceturtdaļa, puse, trešdaļa, 1/5, 1/6 utt.), un to var izmērīt procentos (%). Risinot skaitļošanas uzdevumus, masas daļu labāk pārvērst bezizmēra daudzumā.
Vielas masas daļa šķīdumā

Jebkurš šķīdums sastāv no šķīdinātāja un izšķīdušās vielas. Ūdens ir visizplatītākais neorganiskais šķīdinātājs. Organiskie šķīdinātāji var būt spirts, acetons, dietilēteris uc Ja problēmas izklāstā šķīdinātājs nav norādīts, šķīdums tiek uzskatīts par ūdens šķīdumu.
Izšķīdušās vielas masas daļu aprēķina pēc formulas:
$\omega_\text(v-v)=\dfrac(m_\text(v-v))(m_\text(p-ra))(\cdot 100\%)$
Apsveriet problēmu risināšanas piemērus.
Cik gramus cukura un ūdens jāuzņem, lai pagatavotu 150 g 10% cukura šķīduma?
Risinājums
m(r-ra)=150g
$\omega$(cukurs)=10%=0,1
m(cukurs)=?
m(cukurs) = $\omega\textrm((cukurs)) \cdot m(p-pa) = 0,1 \cdot 150 \textrm(r) = 15 \textrm(r)$
m (ūdens) \u003d m (šķīdums) - m (cukurs) \u003d 150g - 15g \u003d 135g.
ATBILDE: jāņem 15 g cukura un 135 g ūdens.
Šķīdums ar tilpumu 350 ml. un blīvums 1,142 g/ml satur 28 g nātrija hlorīda. Atrodiet sāls masas daļu šķīdumā.
Risinājums
V(šķīdums)=350 ml.
$\rho$(šķīdums)=1,142 g/ml
$\omega(NaCl)$=?
m(r-ra) = V(r-ra) $\cdot \rho$(r-ra)=350 ml $\cdot$ 1,142 g/ml=400 g
$\omega(NaCl)=\dfrac(m(NaCl))(m\textrm((p-ra)))=\dfrac(28\textrm(r)) (400\textrm(r)) = 0,07 $= 7%
ATBILDE: nātrija hlorīda masas daļa $\omega(NaCl)$=7%
ELEMENTA MASAS DAĻA MOLEKULĀ
Ķīmiskās vielas formula, piemēram, $H_2SO_4$, satur daudz svarīga informācija. Tas apzīmē vai nu vienu vielas molekulu, ko raksturo relatīvā atommasa, vai 1 molu vielas, ko raksturo molārā masa. Formula parāda kvalitatīvo (sastāv no ūdeņraža, sēra un skābekļa) un kvantitatīvo sastāvu (sastāv no diviem ūdeņraža atomiem, sēra atoma un četriem skābekļa atomiem). Autors ķīmiskā formula var atrast molekulas masu kopumā (molekulmasu), kā arī aprēķināt molekulā esošo elementu masu attiecību: m(H) : m(S) : m(O) = 2: 32 : 64 = 1: 16: 32. Aprēķinot elementu masu attiecības, jāņem vērā to atommasa un atbilstošo atomu skaits: $m(H_2)=1*2=2$, $m(S )=32*1=32$, $m(O_4)=16*4=64$
Elementa masas daļas aprēķināšanas princips ir līdzīgs šķīdumā esošās vielas masas daļas aprēķināšanas principam un tiek atrasts, izmantojot līdzīgu formulu:
$\omega_\teksts(elements)=\dfrac(Ar_(\teksts(elements))\cdot n_(\textrm(atomi)))(m_\teksts(molekulas))(\cdot 100\%) $
Atrodiet sērskābē esošo elementu masas daļu.
Risinājums
1. metode (proporcija):
Atrodiet sērskābes molāro masu:
$M(H_2SO_4) = 1\cdot 2 + 32 + 16 \cdot 4=98\hspace(2pt)\textrm(g/mol)$
Viena sērskābes molekula satur vienu sēra atomu, tāpēc sēra masa sērskābē būs: $m(S) = Ar(S) \cdot n(S) = 32\textrm(g/mol) \cdot 1$= 32g/mol
Mēs ņemam visas molekulas masu kā 100%, bet sēra masu kā X% un veidojam proporciju:
$M(H_2SO_4)$=98 g/mol — 100%
m(S) = 32 g/mol - X%
No kurienes $X=\dfrac(32\textrm(g/mol) \cdot 100\%)(98\textrm(g/mol)) =32, 65\% =32\%$
2. metode (formula):
$\omega(S)=\dfrac(Ar_(\teksts(elements))\cdot n_(\textrm(atomi))))(m_\teksts(molekulas))(\cdot 100\%)=\dfrac( Ar( S)\cdot 1)(M(H_2SO_4))(\cdot 100\%)=\dfrac(32\textrm(g/mol)\cdot 1)(98\textrm(g/mol))(\cdot 100\ %) \apmēram32, 7\%$
Līdzīgi, izmantojot formulu, mēs aprēķinām ūdeņraža un skābekļa masas daļas:
$\omega(H)=\dfrac(Ar(H)\cdot 2)(M(H_2SO_4))(\cdot 100\%)=\dfrac(1\textrm(g/mol)\cdot 2)(98\ textrm(g/mol))(\cdot 100\%)\approx2\%$
$\omega(O)=\dfrac(Ar(O)\cdot 4)(M(H_2SO_4))(\cdot 100\%)=\dfrac(16\textrm(g/mol)\cdot 4)(98\ textrm(g/mol))(\cdot 100\%)\approx65, 3\%$
Risinājums Tiek saukts divu vai vairāku komponentu homogēns maisījums.
Vielas, kuras sajauc, veidojot šķīdumu, sauc sastāvdaļas.
Risinājuma sastāvdaļas ir šķīdinātājs, kas var būt vairāk nekā viens, un šķīdinātājs. Piemēram, ja ir cukura šķīdums ūdenī, cukurs ir šķīdinātājs un ūdens ir šķīdinātājs.
Dažreiz šķīdinātāja jēdzienu var vienādi attiecināt uz jebkuru no sastāvdaļām. Piemēram, tas attiecas uz tiem šķīdumiem, kas iegūti, sajaucot divus vai vairākus šķidrumus, kas ideāli šķīst viens otrā. Tātad, jo īpaši šķīdumā, kas sastāv no spirta un ūdens, gan spirtu, gan ūdeni var saukt par šķīdinātāju. Tomēr visbiežāk attiecībā uz ūdeni saturošiem šķīdumiem tradicionāli ir pieņemts saukt ūdeni par šķīdinātāju, bet otro komponentu par izšķīdušo vielu.
Kā šķīduma sastāva kvantitatīvs raksturlielums visbiežāk tiek izmantots šāds jēdziens kā masas daļa vielas šķīdumā. Vielas masas daļa ir šīs vielas masas attiecība pret šķīduma masu, kurā tā atrodas:
Kur ω (in-va) - šķīdumā esošās vielas masas daļa (g), m(v-va) - šķīdumā esošās vielas masa (g), m (p-ra) - šķīduma masa (g).
No formulas (1) izriet, ka masas daļa var iegūt vērtības no 0 līdz 1, tas ir, tā ir vienības daļa. Šajā sakarā masas daļu var izteikt arī procentos (%), un tieši šādā formātā tas parādās gandrīz visās problēmās. Masas daļu, kas izteikta procentos, aprēķina, izmantojot formulu, kas līdzīga formulai (1), ar vienīgo atšķirību, ka izšķīdušās vielas masas attiecība pret visa šķīduma masu tiek reizināta ar 100%:
Šķīdumam, kas sastāv tikai no diviem komponentiem, var attiecīgi aprēķināt izšķīdušās vielas masas daļu ω(r.v.) un šķīdinātāja masas daļu ω(šķīdinātājs).
To sauc arī par izšķīdušās vielas masas daļu šķīduma koncentrācija.
Divkomponentu šķīdumam tā masa ir izšķīdušās vielas un šķīdinātāja masu summa:
Arī divkomponentu šķīduma gadījumā izšķīdušās vielas un šķīdinātāja masas daļu summa vienmēr ir 100%:
Acīmredzot papildus iepriekš rakstītajām formulām būtu jāzina arī visas tās formulas, kas no tām ir tieši matemātiski atvasinātas. Piemēram:
Ir arī jāatceras formula, kas attiecas uz vielas masu, tilpumu un blīvumu:
m = ρ∙V
un jums arī jāzina, ka ūdens blīvums ir 1 g / ml. Šī iemesla dēļ ūdens tilpums mililitros ir skaitliski vienāds ar ūdens masu gramos. Piemēram, 10 ml ūdens ir 10 g, 200 ml - 200 g utt.
Lai veiksmīgi atrisinātu problēmas, papildus iepriekšminēto formulu pārzināšanai ir ārkārtīgi svarīgi to pielietošanas prasmes tuvināt automātiskumam. To var panākt, tikai risinot lielu skaitu dažādu uzdevumu. Uzdevumi no reālas IZMANTOT eksāmenus var atrisināt tēmu "Aprēķini, izmantojot jēdzienu" vielas masas daļa šķīdumā "".
Risinājumu uzdevumu piemēri
1. piemērs
Aprēķina kālija nitrāta masas daļu šķīdumā, kas iegūts, sajaucot 5 g sāls un 20 g ūdens.
Risinājums:
Mūsu gadījumā šķīdinātājs ir kālija nitrāts, un šķīdinātājs ir ūdens. Tāpēc formulas (2) un (3) var uzrakstīt attiecīgi šādi:
No nosacījuma m (KNO 3) \u003d 5 g un m (H 2 O) \u003d 20 g, tāpēc:
2. piemērs
Kāda ūdens masa jāpievieno 20 g glikozes, lai iegūtu 10% glikozes šķīdumu.
Risinājums:
No problēmas apstākļiem izriet, ka šķīdinātājs ir glikoze, bet šķīdinātājs ir ūdens. Tad formulu (4) mūsu gadījumā var uzrakstīt šādi:
No stāvokļa mēs zinām glikozes masas daļu (koncentrāciju) un pašas glikozes masu. Apzīmējot ūdens masu kā x g, mēs varam uzrakstīt šādu ekvivalentu vienādojumu, pamatojoties uz iepriekš minēto formulu:
Atrisinot šo vienādojumu, mēs atrodam x:
tie. m(H2O) \u003d x g \u003d 180 g
Atbilde: m (H 2 O) \u003d 180 g
3. piemērs
150 g 15% nātrija hlorīda šķīduma tika sajaukti ar 100 g tā paša sāls 20% šķīduma. Kāda ir sāls masas daļa iegūtajā šķīdumā? Norādiet atbildi līdz tuvākajam veselajam skaitlim.
Risinājums:
Lai atrisinātu problēmas risinājumu sagatavošanai, ir ērti izmantot šādu tabulu:
kur m r.v. , m r-ra un ω r.v. ir izšķīdušās vielas masas, šķīduma masas un izšķīdušās vielas masas daļas vērtības attiecīgi katram šķīdumam.
No nosacījuma mēs zinām, ka:
m (1) šķīdums = 150 g,
ω (1) r.v. = 15%,
m (2) šķīdums = 100 g,
ω (1) r.v. = 20%,
Ievietojot visas šīs vērtības tabulā, mēs iegūstam:
Mums jāatceras šādas aprēķiniem nepieciešamās formulas:
ω r.v. = 100% ∙ m r.v. /m šķīdums, m r.v. = m r-ra ∙ ω r.v. / 100% , m šķīdums = 100% ∙ m r.v. /ω r.v.
Sāksim aizpildīt tabulu.
Ja rindā vai kolonnā trūkst tikai vienas vērtības, tad to var saskaitīt. Izņēmums ir līnija ar ω r.v., zinot vērtības divās šūnās, vērtību trešajā nevar aprēķināt.
Pirmajā kolonnā trūkst vērtības tikai vienā šūnā. Tātad mēs varam aprēķināt:
m (1) r.v. = m (1) r-ra ∙ ω (1) r.v. /100% = 150 g ∙ 15%/100% = 22,5 g
Tāpat mēs zinām vērtības divās otrās kolonnas šūnās, kas nozīmē:
m (2) r.v. = m (2) r-ra ∙ ω (2) r.v. /100% = 100 g ∙ 20%/100% = 20 g
Ievadīsim aprēķinātās vērtības tabulā:
Tagad mums ir divas vērtības pirmajā rindā un divas vērtības otrajā rindā. Tātad mēs varam aprēķināt trūkstošās vērtības (m (3) r.v. un m (3) r-ra):
m (3) r.v. = m (1) r.v. + m (2)r.v. = 22,5 g + 20 g = 42,5 g
m (3) šķīdums = m (1) šķīdums + m (2) šķīdums = 150 g + 100 g = 250 g.
Ievadīsim tabulā aprēķinātās vērtības, iegūstam:
Tagad mēs esam nonākuši tuvu vēlamās vērtības ω (3) r.v aprēķināšanai. . Kolonnā, kurā tas atrodas, ir zināms pārējo divu šūnu saturs, tāpēc mēs varam to aprēķināt:
ω (3)r.v. = 100% ∙ m (3) r.v. / m (3) šķīdums = 100% ∙ 42,5 g / 250 g = 17%
4. piemērs
200 g 15% nātrija hlorīda šķīduma pievienoja 50 ml ūdens. Kāda ir sāls masas daļa iegūtajā šķīdumā. Norādiet atbildi ar precizitāti līdz tuvākajai simtajai daļai _______%
Risinājums:
Pirmkārt, jums vajadzētu pievērst uzmanību tam, ka pievienotā ūdens masas vietā mums tiek dots tā tilpums. Mēs aprēķinām tā masu, zinot, ka ūdens blīvums ir 1 g / ml:
m tālr. (H 2 O) = V ār. (H 2 O) ∙ ρ (H2O) = 50 ml ∙ 1 g/ml = 50 g
Ja mēs uzskatām ūdeni par 0% nātrija hlorīda šķīdumu, kas satur attiecīgi 0 g nātrija hlorīda, problēmu var atrisināt, izmantojot to pašu tabulu, kas norādīta iepriekš minētajā piemērā. Uzzīmēsim šādu tabulu un ievietosim tajā mums zināmās vērtības:
Pirmajā kolonnā ir zināmas divas vērtības, tāpēc mēs varam aprēķināt trešo:
m (1) r.v. = m (1)r-ra ∙ ω (1)r.v. /100% = 200 g ∙ 15%/100% = 30 g,
Otrajā rindā ir zināmas arī divas vērtības, tāpēc mēs varam aprēķināt trešo:
m (3) šķīdums = m (1) šķīdums + m (2) šķīdums = 200 g + 50 g = 250 g,
Ievadiet aprēķinātās vērtības attiecīgajās šūnās:
Tagad ir kļuvušas zināmas divas vērtības pirmajā rindā, kas nozīmē, ka mēs varam aprēķināt vērtību m (3) r.v. trešajā šūnā:
m (3) r.v. = m (1) r.v. + m (2)r.v. = 30 g + 0 g = 30 g
ω (3)r.v. = 30/250 ∙ 100% = 12%.