Dzelzs sulfāta 3 ķīmiskā formula. Dzelzs un tā savienojumi
17. d Dzelzs, vispārīgās īpašības, īpašības. Oksīdi un hidroksīdi, KO un OM, raksturīgi, biorols, spēja veidot kompleksus.
1. Vispārīgās īpašības.
Dzelzs - PSCE ceturtā perioda astotās grupas sekundārās apakšgrupas d-elements ar atomu skaitu 26.
Viens no visplašāk izplatītajiem metāliem zemes garozā (otrais pēc alumīnija).
Vienkārša viela dzelzs - kaļams sudrabaini baltas krāsas metāls ar augstu ķīmisko reaktivitāti: ātri dzelzs korodē augstā temperatūrā vai augstā gaisa mitrumā.
4Fe + 3O2 + 6H2O = 4Fe (OH) 3
Tīrā skābeklī dzelzs sadedzina, un smalki izkliedētā stāvoklī tas spontāni aizdegas gaisā.
3Fe + 2O2 = FeO + Fe2O3
3Fe + 4H2O = FeO * Fe2O3
FeO * Fe2O3 = Fe3O4 (dzelzs skala)
Faktiski dzelzi parasti sauc par tā sakausējumiem ar zemu piemaisījumu saturu (līdz 0,8%), kas saglabā tīra metāla maigumu un elastību. Bet praksē biežāk tiek izmantoti dzelzs sakausējumi ar oglekli: tērauds (līdz 2,14 masas% oglekļa) un čuguns (vairāk nekā 2,14 masas% oglekļa), kā arī nerūsējošais (leģētais) tērauds, pievienojot leģējumu metāli (hroms, mangāns, niķelis utt.). Dzelzs un tā sakausējumu īpašo īpašību kopums padara to par "metālu Nr. 1" cilvēkiem.
Dabā dzelzs tīrā veidā ir reti sastopama, visbiežāk tā ir dzelzs-niķeļa meteorītu sastāvā. Dzelzs izplatība zemes garozā ir 4,65% (4. vieta aiz O, Si, Al). Tiek arī uzskatīts, ka dzelzs veido lielāko daļu zemes kodola.
2. Īpašumi
1.Fiziskā sv-va. Dzelzs ir tipisks metāls, brīvā stāvoklī tas ir sudrabaini baltā krāsā ar pelēcīgu nokrāsu. Tīrs metāls ir elastīgs, dažādi piemaisījumi (jo īpaši - ogleklis) palielina tā cietību un trauslumu. Piemīt izteiktas magnētiskās īpašības. Bieži tiek izdalīta tā saucamā "dzelzs triāde" - trīs metālu grupa (dzelzs Fe, kobalts Co, niķelis Ni), kuriem ir līdzīgas fizikālās īpašības, atomu rādiuss un elektronegativitātes vērtības.
2.Chem.sv-va.
|
Oksidācijas stāvoklis |
Oksīds |
Hidroksīds |
Raksturs |
Piezīmes (rediģēt) |
|
Vājš pamata |
||||
|
Ļoti vāja bāze, dažreiz amfoteriska |
||||
|
Nav saņemts |
|
Skābe |
Spēcīgs oksidētājs |
Dzelzi raksturo dzelzs oksidācijas stāvokļi - +2 un +3.
Oksidācijas stāvoklis +2 atbilst melnajam oksīdam FeO un zaļajam hidroksīdam Fe (OH) 2. Tie ir pamata. Sāļos Fe (+2) ir kā katjons. Fe (+2) ir vājš reducētājs.
Oksidācijas stāvoklis +3 atbilst sarkanbrūnam oksīdam Fe 2 O 3 un brūnajam hidroksīdam Fe (OH) 3. Tie ir amfoteriski, lai gan skābi, un to pamatīpašības ir slikti izteiktas. Tātad, Fe 3+ joni pilnībā hidrolizēts pat skābā vidē. Fe (OH) 3 izšķīst (un pat tad ne pilnībā), tikai koncentrētos sārmos. Fe 2 O 3 reaģē ar sārmiem tikai saplūstot, dodot ferīti(neeksistējošas brīvas skābes HFeO 2 formālie skābes sāļi):
Dzelzs (+3) visbiežāk uzrāda vājas oksidējošas īpašības.
Oksidācijas stāvokļi +2 un +3 viegli pāriet, mainoties redoksa apstākļiem.
Turklāt ir oksīds Fe 3 O 4, formālais dzelzs oksidācijas stāvoklis, kurā ir +8/3. Tomēr šo oksīdu var uzskatīt arī par dzelzs (II) ferītu Fe +2 (Fe +3 O 2) 2.
Ir arī oksidācijas stāvoklis +6. Atbilstošais oksīds un hidroksīds brīvā formā neeksistē, bet ir iegūti sāļi - ferāti (piemēram, K 2 FeO 4). Dzelzs (+6) tajos ir anjona formā. Ferāti ir spēcīgi oksidētāji.
Tīrs metāla dzelzs ir stabils ūdenī un atšķaidītos šķīdumos sārmi... Dzelzs nešķīst aukstā koncentrētā sērskābē un slāpekļskābē, jo metāla virsma pasivējas ar spēcīgu oksīda plēvi. Karsta koncentrēta sērskābe, kas ir spēcīgāks oksidētājs, mijiedarbojas ar dzelzi.
AR fizioloģiskais šķīdums un atšķaidīts (apmēram 20%) sērskābe skābes dzelzs reaģē, veidojot dzelzs (II) sāļus:
Kad karsējot dzelzs reaģē ar aptuveni 70% sērskābi, tā veidojas dzelzs (III) sulfāts:
3. Oksīdi un hidroksīdi, KO un OM har-ka ...
Dzelzs (II) savienojumi
Dzelzs oksīdam (II) FeO ir pamata īpašības, tam atbilst bāze Fe (OH) 2. Dzelzs (II) sāļi ir gaiši zaļā krāsā. Uzglabājot, it īpaši mitrā gaisā, tie kļūst brūni oksidēšanās rezultātā par dzelzi (III). Tas pats process notiek, uzglabājot dzelzs (II) sāļu ūdens šķīdumus:
No dzelzs (II) sāļiem ūdens šķīdumos, stabils Mora sāls- amonija un dzelzs (II) (NH 4) 2 Fe (SO 4) 2 6H 2O dubultā sulfāts.
Reaģents Fe 2+ joniem šķīdumā var būt kālija heksacianoferāts (III) K 3 (sarkanais asins sāls). Kad Fe 2+ un 3− joni mijiedarbojas, veidojas nogulsnes turnboolean zils:
Dzelzs (II) kvantitatīvai noteikšanai šķīdumā izmantojiet fenantrolīns veidojot sarkanu FePhen 3 kompleksu ar dzelzi (II) plašā pH diapazonā (4-9)
Dzelzs (III) savienojumi
Dzelzs oksīds (III) Fe 2 O 3 vājš amfoterīns, uz to atbild vēl vājāka bāze nekā Fe (OH) 2, Fe (OH) 3, kas reaģē ar skābēm:
Fe 3+ sāļi ir pakļauti kristālisku hidrātu veidošanai. Tajos Fe 3+ jonu parasti ieskauj sešas ūdens molekulas. Šie sāļi ir rozā vai purpursarkanā krāsā.Fe 3+ jons ir pilnībā hidrolizēts pat skābā vidē. Pie pH> 4 šis jons ir gandrīz pilnībā nogulsnējies kā Fe (OH) 3:
Daļēji hidrolizējot Fe 3+ jonu, veidojas daudzkodolu okso un hidroksokācijas, kas padara šķīdumus brūnus.Dzelzs (III) hidroksīda Fe (OH) 3 galvenās īpašības ir ļoti vājas. Tas spēj reaģēt tikai ar koncentrētiem sārmu šķīdumiem:
Iegūtie dzelzs (III) hidroksokompleksi ir stabili tikai stipri sārmainos šķīdumos. Šķīdumus atšķaidot ar ūdeni, tie tiek iznīcināti, un Fe (OH) 3 nogulsnējas.
Leģējot ar sārmiem un citu metālu oksīdiem, Fe 2 O 3 veido dažādus ferīti:
Dzelzs (III) savienojumus šķīdumos reducē metāliskais dzelzs:
Dzelzs (III) spēj veidot dubultus sulfātus ar atsevišķi uzlādētu katjoni tipa alum, piemēram, KFe (SO 4) 2 - kālija dzelzs alum, (NH 4) Fe (SO 4) 2 - amonija dzelzs alum
Dzelzs (III) savienojumu kvalitatīvai noteikšanai šķīdumā izmanto Fe 3+ jonu kvalitatīvo reakciju ar tiocianāta joniem SCN − ... Kad Fe 3+ joni mijiedarbojas ar SCN - anjoniem, veidojas spilgti sarkano dzelzs 2+,+, Fe (SCN) 3, - kompleksu maisījums. Maisījuma sastāvs (un līdz ar to tā krāsas intensitāte) ir atkarīgs no dažādiem faktoriem; tādēļ šī metode nav piemērota precīzai dzelzs kvalitatīvai noteikšanai.
Vēl viens augstas kvalitātes reaģents Fe 3+ joniem ir kālija heksacianoferāts (II) K 4 (dzeltenais asins sāls). Fe 3+ un 4− jonu mijiedarbība rada spilgti zilas nogulsnes Prūšu zils:
Dzelzs (VI) savienojumi
Ferrata- esošās brīvās dzelzs skābes sāls H 2 FeO 4. Tie ir violetas krāsas savienojumi, kas oksidējošās īpašībās atgādina permanganātus un šķīdību-sulfātus. Ferātus iegūst ar gāzveida iedarbību hlors vai ozons uz Fe (OH) 3 suspensijas sārmos , piemēram, kālija ferāts (VI) K 2 FeO 4. Ferāti ir purpursarkani.
Ferrata var arī iegūt elektrolīze 30% sārmu šķīdums uz dzelzs anoda:
Ferāti ir spēcīgi oksidētāji. Skābā vidē tie sadalās, izdalot skābekli:
Ferātu oksidējošās īpašības tiek izmantotas ūdens dezinfekcija.
4 biorols
1) Dzīvos organismos dzelzs ir svarīgs mikroelements, kas katalizē skābekļa apmaiņas (elpošanas) procesus.
2) Parasti dzelzs ir iekļauta fermentos kompleksa veidā.Jo īpaši šis komplekss atrodas hemoglobīnā - vissvarīgākajā proteīnā, kas nodrošina skābekļa transportēšanu ar asinīm uz visiem cilvēku un dzīvnieku orgāniem. Un tieši viņš iekrāso asinis raksturīgā sarkanā krāsā.
4) Dzelzs pārmērīgai devai (200 mg vai vairāk) var būt toksiska iedarbība. Dzelzs pārdozēšana kavē organisma antioksidantu sistēmu, tāpēc veseliem cilvēkiem nav ieteicams lietot dzelzs piedevas.
- Apzīmējums - Fe (dzelzs);
- Periods - IV;
- Grupa - 8 (VIII);
- Atomu masa - 55,845;
- Atomu skaitlis - 26;
- Atoma rādiuss = 126 pm;
- Kovalentais rādiuss = 117 pm;
- Elektronu sadalījums - 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2;
- kušanas temperatūra = 1535 ° C;
- viršanas temperatūra = 2750 ° C;
- Elektronegativitāte (Paulings / Alpreds un Rohovs) = 1,83 / 1,64;
- Oksidācijas stāvoklis: +8, +6, +4, +3, +2, +1, 0;
- Blīvums (n. At.) = 7,874 g / cm 3;
- Mola tilpums = 7,1 cm 3 / mol.
Dzelzs savienojumi:
Dzelzs ir visizplatītākais metāls zemes garozā (5,1% no masas) pēc alumīnija.
Uz Zemes dzelzs brīvā stāvoklī ir atrodams nelielos daudzumos tīrradņu veidā, kā arī kritušos meteorītos.
Dzelzs tiek iegūts rūpnieciski pie dzelzsrūdas atradnēm, no dzelzi saturošiem minerāliem: magnētiskās, sarkanās, brūnās dzelzsrūdas.
Jāsaka, ka dzelzs ir daudzu dabisko minerālu sastāvdaļa, izraisot to dabisko krāsu. Minerālu krāsa ir atkarīga no dzelzs jonu Fe 2+ / Fe 3+ koncentrācijas un attiecības, kā arī no atomiem, kas ieskauj šos jonus. Piemēram, dzelzs jonu piemaisījumu klātbūtne ietekmē daudzu dārgakmeņu un pusdārgakmeņu krāsu: topāzs (no gaiši dzeltenas līdz sarkanai), safīri (no zila līdz tumši zilai), akvamarīni (no gaiši zila līdz zaļgani zilai) utt.
Dzelzs ir atrodams dzīvnieku un augu audos, piemēram, pieauguša cilvēka ķermenī ir aptuveni 5 g dzelzs. Dzelzs ir būtisks elements, tas ir daļa no proteīna hemoglobīna, piedalās skābekļa transportēšanā no plaušām uz audiem un šūnām. Ar dzelzs trūkumu cilvēka organismā attīstās anēmija (dzelzs deficīta anēmija).

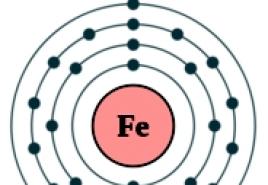
Rīsi. Dzelzs atoma uzbūve.
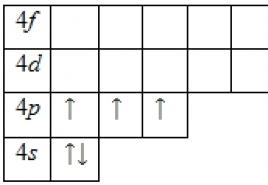
Dzelzs atoma elektroniskā konfigurācija ir 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 (sk. Atomu elektroniskā struktūra). Veidojot ķīmiskās saites ar citiem elementiem, 2 elektroni var piedalīties 3D apakšlīmeņa ārējā 4s līmenī + 6 elektronos (kopā 8 elektroni), tāpēc savienojumos dzelzs var iegūt oksidācijas pakāpes +8, +6, +4, +3, +2, +1, (visizplatītākie ir +3, +2). Dzelzs ir ar vidēju ķīmisko aktivitāti.

Rīsi. Dzelzs oksidācijas stāvokļi: +2, +3.
Dzelzs fizikālās īpašības:
- sudrabaini balts metāls;
- tīrā veidā tas ir diezgan mīksts un plastisks;
- piemīt laba siltuma un elektrības vadītspēja.
Dzelzs pastāv četru modifikāciju veidā (atšķiras pēc kristāla režģa struktūras): α-dzelzs; β-dzelzs; γ-dzelzs; δ-dzelzs.
Dzelzs ķīmiskās īpašības
- reaģē ar skābekli, atkarībā no temperatūras un skābekļa koncentrācijas var veidoties dažādi produkti vai dzelzs oksidācijas produktu maisījums (FeO, Fe 2 O 3, Fe 3 O 4):
3Fe + 2O 2 = Fe 3 O 4; - dzelzs oksidēšanās zemā temperatūrā:
4Fe + 3O 2 = 2Fe 2 O 3; - reaģē ar ūdens tvaikiem:
3Fe + 4H 2 O = Fe 3 O 4 + 4H 2; - smalki sasmalcināts dzelzs reaģē, karsējot ar sēru un hloru (dzelzs sulfīdu un hlorīdu):
Fe + S = FeS; 2Fe + 3Cl 2 = 2FeCl 3; - augstā temperatūrā reaģē ar silīciju, oglekli, fosforu:
3Fe + C = Fe 3C; - ar citiem metāliem un ar nemetāliem dzelzs var veidot sakausējumus;
- dzelzs izspiež no sāļiem mazāk aktīvos metālus:
Fe + CuCl 2 = FeCl 2 + Cu; - ar atšķaidītām skābēm dzelzs darbojas kā reducētājs, veidojot sāļus:
Fe + 2HCl = FeCl2 + H2; - ar atšķaidītu slāpekļskābi dzelzs atkarībā no tā koncentrācijas veido dažādus skābes reducēšanas produktus (N 2, N 2 O, NO 2).
Dzelzs iegūšana un lietošana
Tiek iegūts rūpnieciskais dzelzs kausēšanačuguns un tērauds.
Čuguns ir dzelzs sakausējums ar silīcija, mangāna, sēra, fosfora, oglekļa piemaisījumiem. Oglekļa saturs čugunā pārsniedz 2% (tēraudā mazāk nekā 2%).
Tīru dzelzi iegūst:
- čuguna skābekļa pārveidotājos;
- dzelzs oksīdu reducēšana ar ūdeņradi un divvērtīgu oglekļa monoksīdu;
- atbilstošo sāļu elektrolīze.
Čugunu iegūst no dzelzs rūdām, reducējot dzelzs oksīdus. Čugunu kausē domnās. Domnā kā siltuma avots tiek izmantots kokss.
Domnas ir ļoti sarežģīta tehniska struktūra, kuras augstums ir vairāki desmiti metru. Tas ir izklāts ar ugunsizturīgiem ķieģeļiem un aizsargāts ar ārējo tērauda apvalku. Sākot ar 2013. gadu, lielāko domnu Dienvidkorejā uzbūvēja tērauda ražošanas uzņēmums POSCO Gvanjanas tērauda rūpnīcā (krāsns tilpums pēc modernizācijas bija 6000 kubikmetru ar gada jaudu 5 700 000 tonnu).

Rīsi. Domnas.
Čuguna kausēšana domnā turpinās vairākas desmitgades, līdz krāsns sasniedz savu kalpošanas laiku.

Rīsi. Čuguna kausēšanas process domnā.
- labotās rūdas (magnētiskās, sarkanās, brūnās dzelzsrūdas) un koksu izlej caur augšpusi, kas atrodas domnas pašā augšpusē;
- dzelzs reducēšanās no rūdas oglekļa monoksīda (II) ietekmē notiek domnas (raktuves) vidējā daļā 450-1100 ° C temperatūrā (dzelzs oksīdi tiek reducēti līdz metālam):
- 450-500 ° C - 3Fe 2 O 3 + CO = 2Fe 3 O 4 + CO 2;
- 600 ° C - Fe 3 O 4 + CO = 3 FeO + CO 2;
- 800 ° C - FeO + CO = Fe + CO 2;
- daļa divvērtīgā dzelzs oksīda tiek reducēta ar koksu: FeO + C = Fe + CO.
- paralēli notiek silīcija un mangāna oksīdu reducēšanas process (tie ir iekļauti dzelzs rūdā piemaisījumu veidā), silīcijs un mangāns ir daļa no čuguna:
- SiO 2 + 2C = Si + 2CO;
- Mn 2 O 3 + 3C = 2Mn + 3CO.
- kaļķakmens termiskās sadalīšanās laikā (ievadīts domnā) veidojas kalcija oksīds, kas reaģē ar rūdā esošajiem silīcija un alumīnija oksīdiem:
- CaCO 3 = CaO + CO 2;
- CaO + SiO 2 = CaSiO 3;
- CaO + Al 2 O 3 = Ca (AlO 2) 2.
- pie 1100 ° C dzelzs reducēšanās process apstājas;
- zem vārpstas atrodas tvaicējošā, domnas platākā daļa, zem kuras seko plecs, kurā kokss izdeg un veidojas šķidri kausēšanas produkti - čuguns un izdedži, kas uzkrājas pašā krāsns apakšā - pavards;
- pavarda augšējā daļā 1500 ° C temperatūrā izpūstā gaisa plūsmā notiek intensīva koksa sadegšana: C + O 2 = CO 2;
- ejot cauri sarkanajam karstam koksam, oglekļa monoksīds (IV) tiek pārveidots par oglekļa monoksīdu (II), kas ir dzelzs reducētājs (sk. iepriekš): CO 2 + C = 2CO;
- sārņi, ko veido kalcija silikāti un aluminosilikāti, atrodas virs čuguna, pasargājot to no skābekļa iedarbības;
- caur īpašiem caurumiem, kas atrodas dažādos pavarda līmeņos, čuguns un izdedži tiek izvadīti ārā;
- Lielākā daļa čuguna nonāk tālākai pārstrādei - tērauda kausēšanai.
Tērauds tiek kausēts no čuguna un metāllūžņiem, izmantojot pārveidotāja metodi (kurtuve jau ir novecojusi, lai gan tā joprojām tiek izmantota) vai ar elektrisko kausēšanu (elektriskajās krāsnīs, indukcijas krāsnīs). Procesa būtība (čuguna pārdale) ir samazināt oglekļa un citu piemaisījumu koncentrāciju, oksidējot ar skābekli.
Kā minēts iepriekš, oglekļa koncentrācija tēraudā nepārsniedz 2%. Sakarā ar to tērauds, atšķirībā no čuguna, ir diezgan viegli kalts un velmēts, kas ļauj no tā izgatavot dažādus izstrādājumus ar augstu cietību un izturību.
Tērauda cietība ir atkarīga no oglekļa satura (jo vairāk oglekļa, jo cietāks ir tērauds) noteiktā tērauda kategorijā un termiskās apstrādes apstākļos. Rūdot (lēna dzesēšana), tērauds kļūst mīksts; kad rūdīts (rūdīts), tērauds ir ļoti ciets.
Lai tēraudam piešķirtu vēlamās specifiskās īpašības, tam pievieno liģējošas piedevas: hromu, niķeli, silīciju, molibdēnu, vanādiju, mangānu utt.
Čuguns un tērauds ir vissvarīgākie strukturālie materiāli lielākajā daļā valsts ekonomikas nozaru.
Dzelzs bioloģiskā loma:
- pieauguša cilvēka ķermenī ir apmēram 5 g dzelzs;
- dzelzs ir svarīga loma asinsrades orgānu darbā;
- dzelzs ir daļa no daudziem sarežģītiem proteīnu kompleksiem (hemoglobīns, mioglobīns, dažādi fermenti).
Pirmie priekšmeti, kas izgatavoti no dzelzs un tā sakausējumiem, tika atrasti izrakumu laikā un datējami ar aptuveni 4 tūkstošiem gadu pirms mūsu ēras. Tas ir, pat senie ēģiptieši un šumeri izmantoja šīs vielas meteorītu nogulsnes, lai izgatavotu rotaslietas un sadzīves priekšmetus, kā arī ieročus.
Mūsdienās visizplatītākās un lietotākās ir dažāda veida dzelzs savienojumi, kā arī tīrs metāls. Ne velti 20. gadsimts tika uzskatīts par dzelzi. Patiešām, pirms plastmasas un ar to saistīto materiālu parādīšanās un plaša izplatīšana tieši šim savienojumam bija izšķiroša nozīme cilvēkam. Kas ir šis elements un kādas vielas tas veido, mēs apsvērsim šajā rakstā.
Dzelzs ķīmiskais elements
Ja ņemam vērā atoma struktūru, tad periodiskajā tabulā vispirms jānorāda tā atrašanās vieta.
- Sērijas numurs ir 26.
- Periods ir ceturtais lielais.
- Astotā grupa, apakšgrupas puse.
- Atomu svars ir 55,847.
- Ārējā elektronu apvalka struktūru apzīmē ar formulu 3d 6 4s 2.
- - Fe.
- Nosaukums ir dzelzs, lasījums formulā ir "ferrum".
- Dabā ir četri aplūkojamā elementa stabili izotopi ar masas skaitļiem 54, 56, 57, 58.
Dzelzs ķīmiskajam elementam ir arī aptuveni 20 dažādi izotopi, kas nav ļoti stabili. Iespējamie oksidācijas stāvokļi, kādus konkrētais atoms var uzrādīt:
Svarīgs ir ne tikai pats elements, bet arī dažādi tā savienojumi un sakausējumi.
Fizikālās īpašības
Dzelzs kā vienkārša viela ir ar izteiktu metāliskumu. Tas ir, tas ir sudrabaini balts metāls ar pelēku nokrāsu ar augstu kaļamības un elastības pakāpi un augstu kušanas un viršanas temperatūru. Ja mēs sīkāk apsveram īpašības, tad:
- kušanas temperatūra - 1539 0 С;
- vārīšanās - 2862 0 С;
- aktivitāte - vidēja;
- ugunsizturība - augsta;
- piemīt izteiktas magnētiskās īpašības.
Atkarībā no apstākļiem un dažādām temperatūrām dzelzs veido vairākas izmaiņas. To fizikālās īpašības atšķiras no fakta, ka atšķiras kristāla režģi.

Visām modifikācijām ir dažāda veida kristāla režģu struktūras, kā arī atšķiras magnētiskās īpašības.
Ķīmiskās īpašības
Kā minēts iepriekš, vienkāršajai dzelzs vielai ir vidēja ķīmiskā aktivitāte. Tomēr smalki izkliedētā stāvoklī tas var spontāni aizdegties gaisā, un tīrā skābeklī pats metāls izdeg.
Korozijas spēja ir augsta, tāpēc šīs vielas sakausējumi ir pārklāti ar leģējošiem savienojumiem. Dzelzs spēj mijiedarboties ar:
- skābes;
- skābeklis (ieskaitot gaisu);
- pelēks;
- halogēni;
- karsējot - ar slāpekli, fosforu, oglekli un silīciju;
- ar mazāk aktīvo metālu sāļiem, samazinot tos līdz vienkāršām vielām;
- ar dzīvu tvaiku;
- ar dzelzs sāļiem oksidācijas stāvoklī +3.
Ir acīmredzams, ka, demonstrējot šādu aktivitāti, metāls spēj veidot dažādus savienojumus, kas ir dažādi un polāri. Un tā tas notiek. Dzelzs un tā savienojumi ir ārkārtīgi dažādi un atrodami pielietojumā dažādās zinātnes, tehnoloģiju un cilvēku rūpnieciskās darbības jomās.
Izplatīšana dabā
Dabiski dzelzs savienojumi ir diezgan izplatīti, jo tas ir otrais izplatītākais elements uz mūsu planētas aiz alumīnija. Tajā pašā laikā tīrā veidā metāls ir ārkārtīgi reti sastopams meteorītu sastāvā, kas norāda uz tā lielajām kopām telpā. Lielāko daļu satur rūdas, ieži un minerāli.

Ja mēs runājam par attiecīgā elementa procentuālo daudzumu dabā, tad var minēt šādus skaitļus.
- Sauszemes planētu kodoli - 90%.
- Zemes garozā - 5%.
- Zemes apvalkā - 12%.
- Zemes kodolā - 86%.
- Upes ūdenī - 2 mg / l.
- Jūrā un okeānā - 0,02 mg / l.
Visbiežāk sastopamie dzelzs savienojumi veido šādas minerālvielas:
- magnetīts;
- limonīts vai brūna dzelzsrūda;
- vivianīts;
- pirotīts;
- pirīts;
- siderīts;
- markazīts;
- lellingīts;
- nepareizs kodums;
- milanterīts un citi.
Šis joprojām ir garš saraksts, jo to ir patiešām daudz. Turklāt plaši izplatīti dažādi mākslīgie sakausējumi. Tie ir arī tādi dzelzs savienojumi, bez kuriem ir grūti iedomāties cilvēku mūsdienu dzīvi. Tie ietver divus galvenos veidus:
- čuguna izstrādājumi;
- kļūt.
Turklāt dzelzs ir vērtīga piedeva daudzos niķeļa sakausējumos.
Dzelzs (II) savienojumi
Tie ietver tos, kuros veidojošā elementa oksidācijas pakāpe ir +2. To ir diezgan daudz, jo tie ietver:
- oksīds;
- hidroksīds;
- binārie savienojumi;
- kompleksie sāļi;
- sarežģīti savienojumi.
Ķīmisko savienojumu formulas, kurās dzelzs uzrāda norādīto oksidācijas pakāpi, katrai klasei ir individuālas. Apskatīsim vissvarīgākos un izplatītākos.
- Dzelzs (II) oksīds. Melns pulveris, nešķīst ūdenī. Savienojuma raksturs ir pamata. Tas spēj ātri oksidēties, tomēr to var arī viegli reducēt līdz vienkāršai vielai. Tas izšķīst skābēs, veidojot atbilstošos sāļus. Formula - FeO.
- Dzelzs (II) hidroksīds. Tās ir baltas amorfas nogulsnes. Veidojas, sāļiem reaģējot ar bāzēm (sārmiem). Parāda vājās pamatīpašības, spēj ātri oksidēties gaisā līdz dzelzs savienojumiem +3. Formula - Fe (OH) 2.
- Elementa sāļi norādītajā oksidācijas stāvoklī. Viņiem, kā likums, ir gaiši zaļa šķīduma krāsa, tie ir labi oksidēti pat gaisā, iegūstot un nonākot dzelzs sāļos 3. Tie izšķīst ūdenī. Savienojumu piemēri: FeCL 2, FeSO 4, Fe (NO 3) 2.

Starp norādītajām vielām vairākiem savienojumiem ir praktiska nozīme. Pirmkārt, (II). Tas ir galvenais jonu piegādātājs anēmijas slimnieka ķermenim. Kad pacientam tiek diagnosticēta šāda slimība, viņam tiek izrakstītas sarežģītas zāles, kuru pamatā ir attiecīgais savienojums. Tādā veidā tiek papildināts dzelzs trūkums organismā.
Otrkārt, tas ir, dzelzs (II) sulfātu kopā ar varu izmanto kaitēkļu iznīcināšanai kultūrās. Metode ir pierādījusi savu efektivitāti vairāk nekā duci gadu, tāpēc dārznieki un dārznieki to ļoti novērtē.
Mora sāls
Šis ir savienojums, kas ir dzelzs un amonija sulfāta kristālisks hidrāts. Tās formula ir uzrakstīta kā FeSO 4 * (NH 4) 2 SO 4 * 6H 2 O. Viens no dzelzs (II) savienojumiem, kas tiek plaši izmantots praksē. Galvenās cilvēku izmantošanas jomas ir šādas.
- Farmaceitiskie līdzekļi.
- Zinātniskie pētījumi un laboratorijas titrimetriskās analīzes (lai noteiktu hroma, kālija permanganāta, vanādija saturu).
- Medicīna - kā uztura bagātinātājs, kad pacienta organismā trūkst dzelzs.
- Koka izstrādājumu impregnēšanai, jo Mora sāls aizsargā pret sabrukšanas procesiem.
Ir arī citas jomas, kurās šī viela tiek izmantota. Tā savu nosaukumu ieguva par godu vācu ķīmiķim, kurš pirmais atklāja izpaustās īpašības.
Vielas ar dzelzs oksidācijas pakāpi (III)
Dzelzs savienojumu īpašības, kurās tam ir oksidācijas pakāpe +3, nedaudz atšķiras no iepriekš aprakstītajām. Tātad atbilstošā oksīda un hidroksīda raksturs vairs nav pamata, bet izteikts amfoterisks. Sniegsim galveno vielu aprakstu.

Starp sniegtajiem piemēriem, no praktiskā viedokļa, ļoti svarīgs ir tāds kristālisks hidrāts kā FeCL 3 * 6H 2 O vai dzelzs (III) hlorīda heksahidrāts. To lieto medicīnā, lai apturētu asiņošanu un papildinātu dzelzs jonus organismā anēmijas gadījumā.
Dzelzs (III) sulfātu izmanto dzeramā ūdens attīrīšanai, jo tas darbojas kā koagulants.
Dzelzs (VI) savienojumi
Dzelzs ķīmisko savienojumu formulas, kur tam piemīt īpašs oksidācijas stāvoklis +6, var uzrakstīt šādi:
- K 2 FeO 4;
- Na 2 FeO 4;
- MgFeO 4 un citi.
Viņiem visiem ir kopīgs nosaukums - ferāti - un tiem ir līdzīgas īpašības (spēcīgi reducētāji). Tie ir arī dezinficējoši un tiem piemīt baktericīda iedarbība. Tas ļauj tos izmantot dzeramā ūdens attīrīšanai rūpnieciskā mērogā.
Kompleksi savienojumi
Īpašas vielas ir ļoti svarīgas ne tikai analītiskajā ķīmijā. Tādi, kas veidojas sāļu ūdens šķīdumos. Tie ir sarežģīti dzelzs savienojumi. Populārākie un labi pētītie ir šādi.
- Kālija heksacianoferāts (II) K 4. Vēl viens savienojuma nosaukums ir dzeltenais asins sāls. To izmanto, lai kvalitatīvi noteiktu dzelzs jonu Fe 3+ šķīdumā. Ekspozīcijas rezultātā šķīdums iegūst skaistu spilgti zilu krāsu, jo veidojas vēl viens komplekss - Prūsijas zilais KFe 3+. Kopš seniem laikiem to izmantoja kā
- Kālija heksacianoferāts (III) K 3. Vēl viens nosaukums ir sarkanais asins sāls. To izmanto kā augstas kvalitātes reaģentu dzelzs jonu Fe 2+ noteikšanai. Rezultāts ir zilas nogulsnes, ko sauc par turnboolean blue. Izmanto arī kā auduma krāsvielu.

Dzelzs organiskajās vielās
Dzelzs un tā savienojumi, kā mēs jau redzējām, ir ļoti praktiski nozīmīgi cilvēka ekonomiskajā dzīvē. Tomēr papildus tam bioloģiskā loma organismā ir ne mazāk liela, gluži pretēji.
Ir viens ļoti svarīgs proteīns, kas satur šo elementu. Tas ir hemoglobīns. Pateicoties viņam, tiek transportēts skābeklis un tiek veikta vienmērīga un savlaicīga gāzes apmaiņa. Tāpēc dzelzs loma dzīvībai svarīgā procesā - elpošanā - ir vienkārši milzīga.

Kopumā cilvēka ķermenī ir aptuveni 4 grami dzelzs, kas pastāvīgi jāpapildina no patērētās pārtikas.
DEFINĪCIJA
Dzelzs- D.I. Mendeļejeva ķīmisko elementu periodiskās tabulas ceturtā perioda astotās grupas elements.
Un vājš skaitlis ir 26. Simbols ir Fe (latīņu valodā “ferrum”). Viens no visplašāk izplatītajiem metāliem zemes garozā (otrais pēc alumīnija).
Dzelzs fizikālās īpašības
Dzelzs ir pelēks metāls. Tīrā veidā tas ir diezgan mīksts, kaļams un elastīgs. Ārējā enerģijas līmeņa elektroniskā konfigurācija - 3d 6 4s 2. Savos savienojumos dzelzs uzrāda oksidācijas pakāpes "+2" un "+3". Dzelzs kušanas temperatūra ir 1539 ° C. Dzelzs veido divas kristāliskas modifikācijas: α- un γ-dzelzi. Pirmajam no tiem ir kubveida ķermeņa centrā esošs režģis, otrajam-kubiskā sejas centrā esošais režģis. α-dzelzs ir termodinamiski stabils divos temperatūras diapazonos: zem 912 un no 1394C līdz kušanas temperatūrai. No 912 līdz 1394C γ-dzelzs ir stabils.
Dzelzs mehāniskās īpašības ir atkarīgas no tā tīrības - pat ļoti mazu citu elementu satura tajā. Cietajam dzelzim piemīt spēja izšķīdināt daudzus elementus.
Dzelzs ķīmiskās īpašības
Dzelzs ātri sarūsē mitrā gaisā; pārklāts ar brūnu hidratēta dzelzs oksīda ziedu, kas irdenuma dēļ neaizsargā dzelzi no turpmākas oksidēšanās. Dzelzs intensīvi korozē ūdenī; ar lielu skābekļa piekļuvi veidojas hidratētas dzelzs (III) oksīda formas:
2Fe + 3 / 2O 2 + nH 2 = Fe 2 O 3 × H 2 O.
Ja trūkst skābekļa vai ir grūti piekļūt, veidojas jaukts oksīds (II, III) Fe 3 O 4:
3Fe + 4H 2 O (v) ↔ Fe 3 O 4 + 4H 2.
Dzelzs izšķīst jebkuras koncentrācijas sālsskābē:
Fe + 2HCl = FeCl 2 + H 2.
Šķīdināšana atšķaidītā sērskābē notiek līdzīgi:
Fe + H 2 SO 4 = FeSO 4 + H 2.
Koncentrētos sērskābes šķīdumos dzelzs tiek oksidēts līdz dzelzs (III):
2Fe + 6H 2SO 4 = Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O.
Tomēr sērskābē, kuras koncentrācija ir tuvu 100%, dzelzs kļūst pasīva un praktiski nenotiek mijiedarbība. Atšķaidītos un vidēji koncentrētos slāpekļskābes šķīdumos dzelzs izšķīst:
Fe + 4HNO 3 = Fe (NO 3) 3 + NO + 2H 2O.
Pie lielām slāpekļskābes koncentrācijām šķīdināšana palēninās un dzelzs kļūst pasīva.
Tāpat kā citi metāli, dzelzs reaģē ar vienkāršām vielām. Sildot, dzelzs mijiedarbojas ar halogēniem (neatkarīgi no halogēna veida). Dzelzs mijiedarbība ar bromu notiek pie paaugstināta tvaika spiediena:
2Fe + 3Cl 2 = 2FeCl 3;
3Fe + 4I 2 = Fe 3 I 8.
Dzelzs mijiedarbība ar sēru (pulveri), slāpekli un fosforu notiek arī sildot:
6Fe + N2 = 2Fe 3N;
2Fe + P = Fe2P;
3Fe + P = Fe 3 P.
Dzelzs spēj reaģēt ar nemetāliem, piemēram, oglekli un silīciju:
3Fe + C = Fe 3C;
Starp dzelzs un sarežģītu vielu mijiedarbības reakcijām īpaša loma ir šādām reakcijām - dzelzs spēj reducēt metālus darbības secībā pa labi no sāls šķīdumiem (1), samazināt dzelzs (III) savienojumus (2):
Fe + CuSO4 = FeSO 4 + Cu (1);
Fe + 2FeCl 3 = 3FeCl 2 (2).
Dzelzs, paaugstinātā spiedienā, reaģē ar sāli neveidojošu oksīdu - CO, veidojot sarežģīta sastāva vielas - karbonilus - Fe (CO) 5, Fe 2 (CO) 9 un Fe 3 (CO) 12.
Dzelzs, ja nav piemaisījumu, ir stabils ūdenī un atšķaidītos sārmu šķīdumos.
Dzelzs iegūšana
Galvenā dzelzs ražošanas metode ir no dzelzsrūdas (hematīts, magnetīts) vai tās sāļu šķīdumu elektrolīze (šajā gadījumā tiek iegūts "tīrs" dzelzs, tas ir, dzelzs bez piemaisījumiem).
Problēmas risināšanas piemēri
1. PIEMĒRS
| Vingrinājums | Dzelzs skalu Fe 3 O 4, kas sver 10 g, vispirms apstrādāja ar 150 ml sālsskābes šķīduma (blīvums 1,1 g / ml) ar 20%ūdeņraža hlorīda masas daļu, un pēc tam iegūtajam šķīdumam pievienoja dzelzs pārpalikumu . Nosakiet šķīduma sastāvu (masas%). |
| Risinājums | Pierakstīsim reakcijas vienādojumus atbilstoši problēmas stāvoklim: 8HCl + Fe3O4 = FeCl2 + 2FeCl 3 + 4H 2O (1); 2FeCl 3 + Fe = 3FeCl 2 (2). Zinot sālsskābes šķīduma blīvumu un tilpumu, varat uzzināt tā masu: m sol (HCl) = V (HCl) × ρ (HCl); m sol (HCl) = 150 × 1,1 = 165 g. Aprēķināsim ūdeņraža hlorīda masu: m (HCl) = m sol (HCl) x ω (HCl) / 100%; m (HCl) = 165 × 20% / 100% = 33 g. Sālsskābes molārā masa (viena mola masa), kas aprēķināta, izmantojot D.I. ķīmisko elementu tabulu. Mendeļejevs - 36,5 g / mol. Atrodiet ūdeņraža hlorīda daudzumu: v (HCl) = m (HCl) / M (HCl); v (HCl) = 33/36,5 = 0,904 mol. Skalas molārā masa (viena mola masa), kas aprēķināta, izmantojot D.I. ķīmisko elementu tabulu. Mendeļejevs - 232 g / mol. Atrodiet mēroga vielas daudzumu: v (Fe 3 O 4) = 10/232 = 0,043 mol. Saskaņā ar 1. vienādojumu v (HCl): v (Fe 3 O 4) = 1: 8, tāpēc v (HCl) = 8 v (Fe 3 O 4) = 0,344 mol. Tad hlora vielas daudzums, kas aprēķināts pēc vienādojuma (0,344 mol), būs mazāks, nekā norādīts problēmas stāvoklī (0,904 mol). Tāpēc sālsskābes pārpalikums un notiks cita reakcija: Fe + 2HCl = FeCl 2 + H 2 (3). Nosakīsim pirmās reakcijas rezultātā izveidojušos dzelzs hlorīdu vielas daudzumu (mēs apzīmējam īpašu reakciju ar indeksiem): v 1 (FeCl 2): v (Fe 2 O 3) = 1: 1 = 0,043 mol; v 1 (FeCl 3): v (Fe 2 O 3) = 2: 1; v 1 (FeCl 3) = 2 × v (Fe 2 O 3) = 0,086 mol. Nosakīsim ūdeņraža hlorīda daudzumu, kas nereaģēja 1. reakcijā, un dzelzs (II) hlorīda vielas daudzumu, kas veidojas 3. reakcijas laikā: v rem (HCl) = v (HCl) - v 1 (HCl) = 0,904 - 0,344 = 0,56 mol; v 3 (FeCl 2): v rem (HCl) = 1: 2; v 3 (FeCl 2) = 1/2 × v rem (HCl) = 0,28 mol. Nosakīsim 2. reakcijas laikā izveidojušās vielas FeCl 2 daudzumu, kopējo vielas FeCl 2 daudzumu un tā masu: v 2 (FeCl 3) = v 1 (FeCl 3) = 0,086 mol; v 2 (FeCl 2): v 2 (FeCl 3) = 3: 2; v 2 (FeCl 2) = 3/2 × v 2 (FeCl 3) = 0,129 mol; v summa (FeCl 2) = v 1 (FeCl 2) + v 2 (FeCl 2) + v 3 (FeCl 2) = 0,043 + 0,129 + 0,28 = 0,452 mol; m (FeCl 2) = v summa (FeCl 2) × M (FeCl 2) = 0,452 × 127 = 57,404 g. Noskaidrosim vielas daudzumu un dzelzs masu, kas nonākusi 2. un 3. reakcijā: v 2 (Fe): v 2 (FeCl 3) = 1: 2; v 2 (Fe) = 1/2 × v 2 (FeCl 3) = 0,043 mol; v 3 (Fe): v rem (HCl) = 1: 2; v 3 (Fe) = 1/2 × v rem (HCl) = 0,28 mol; v summa (Fe) = v 2 (Fe) + v 3 (Fe) = 0,043 + 0,28 = 0,323 mol; m (Fe) = v summa (Fe) × M (Fe) = 0,323 × 56 = 18,088 g. Aprēķināsim vielas daudzumu un ūdeņraža masu, kas izdalās 3. reakcijā: v (H 2) = 1/2 × v rem (HCl) = 0,28 mol; m (H 2) = v (H 2) × M (H 2) = 0,28 × 2 = 0,56 g. Nosakiet iegūtā šķīduma m ’sol masu un FeCl 2 masas daļu tajā: m 'sol = m sol (HCl) + m (Fe 3 O 4) + m (Fe) - m (H 2); |
Dzelzs (II) sulfāts, dzelzs (III) sulfāts.
Ķīmiskās īpašības
Dzelzs sulfāts ir neorganisks savienojums, veidojas sāls sērskābe un dzelzs. Viela ir bez smaržas, nav gaistoša. Bezūdens formai ir bezkrāsaini, necaurspīdīgi, mazi hidrokopijas kristāli. Kristāliskajiem hidratiem ir raksturīga zaļgani zila krāsa, tetrahidrāti ir zaļi. Dzelzs sulfāta 2 ķīmiskā formula: FeSO4, racēmisks: O4SFe... Savienojuma garša ir savelkoša, ar metāla garšu. Produkts labi šķīst ūdenī. Molekulmasa = 151,9 grami uz molu.
Viela tiek atbrīvota no dzelzs sulfāts ... Risinājums sulfāts Fe (2) skābekļa ietekmē tas tiek oksidēts dzelzs sulfātā 3. Tas sadalās temperatūrā virs 480 grādiem pēc Celsija oksīdos.
Dzelzs sulfātu 2 var iegūt, pakļaujot atšķaidīšanai sērskābe dzelzs lūžņiem; kā blakusprodukts dzelzs loksņu kodināšanas reakcijā, atkaļķošanas laikā, pirīta oksidatīvās apdedzināšanas laikā.
Dzelzs sulfāta 2 hidrolīze notiek kā katjons skābā vidē. Hidrolīzes pirmais posms: Fe2 + + SO42- + HOH ↔ FeOH + + SO42- + H +; teorētiski var notikt arī hidrolīzes otrais posms: FeOH + + SO42- + HOH ↔ Fe (OH) 2 ↓ + SO42- + H +.
Vielu lieto:
- izstrādājumu un vilnas auduma krāsošanai melnā krāsā, tintes ražošanā, koksnes saglabāšanā;
- ķīmiskajā dozimetrijā, dārza koku apstrādei lauksaimniecībā;
- medicīnā ārstēšanas laikā dzelzs deficīta anēmija .
Dzelzs sulfāts 3 vai dzelzs tetrasulfīds 6 3 Ir gaiši dzelteni paramagnētiski smalki kristāli. Viela viegli šķīst ūdenī, lēnām - etilspirtā. Dzelzs sulfāta 3 ķīmiskā formula: Fe2 (SO4) 3, racēmisks: Fe2O12S3... Vielai ir spēja kristalizēties kristālisku hidrātu veidā Fe2 (SO4) 3 n H2O... Vissvarīgākais ir dzelzs (III) sulfāta nonahidrāts ... Ūdens šķīdumi iegūst sarkanbrūnu krāsu, pateicoties hidrolīzes reakcijai, kas notiek gar katjonu. Savienojums sadalās, pakļaujoties karstam ūdenim un augstām temperatūrām. Pie 98 grādiem bezhidrāts kļūst par tetrahidrāts , temperatūrā virs 125 grādiem - in monohidrāts un virs 175 - bezūdens Fe sulfāts , kas temperatūrā virs 600 grādiem sadalās sēra un dzelzs oksīdos.
Vielu lieto:
- vara rūdas pārstrādē, notekūdeņu, rūpniecisko un sadzīves notekūdeņu attīrīšanai;
- krāsojot audumus un miecējot ādas rūpniecībā;
- kā peldēšanas regulators, kā katalizators noteiktām reakcijām vai kā oksidētājs;
- medicīnā kā hemostatisks līdzeklis.
farmakoloģiskais efekts
Antianēmija, novēršot dzelzs deficītu. Hemostatisks (dzelzs sulfāts 3).
Farmakodinamika un farmakokinētika
Dzelzs ir galvenais mikroelements sastāvā, mioglobīns un citi asins komponenti. Viela piedalās redoksreakcijās, saista un pārnes skābekļa molekulas pa visu ķermeni, stimulē asinsradi un eritropoēze ... Dzelzs sulfāts nodrošina visu dzelzi saturošu metabolītu sintēzi. Pēc uzņemšanas Fe kopā ar pārtiku tas uzsūcas divpadsmitpirkstu zarnā un ar fermentu palīdzību tiek pārnests uz audu depo pārneses .
Pēc zāļu lietošanas iekšpusē tās aktīvās sastāvdaļas pilnībā uzsūcas organismā. Maksimālā koncentrācija asinīs tiek novērota pēc 2-4 stundām.
Lietošanas indikācijas
Instruments tiek izmantots:
- ārstēšanai un profilaksei dzelzs deficīta anēmija bērniem un pieaugušajiem;
- ja ir traucēta dzelzs uzsūkšanās no gremošanas trakta;
- pacientiem ar paaugstinātu nepieciešamību pēc dzelzs, zīdīšanas laikā, intensīvas augšanas laikā, ar nesabalansētu uzturu;
- ar hronisku, ko papildina sekrēcijas nepietiekamība;
- dažos ārstēšanas posmos B12 deficīta anēmija ;
- ar paasinājumu;
- rehabilitācijas laikā pēc kuņģa rezekcija ;
- priekšlaicīgi dzimušu bērnu ārstēšanai;
- stimulēšanai infekcijas slimību laikā un laikā;
- ārstējot pacientus ar achlorhidrija , hronisks, Krona slimība , sindroms malabsorbcija .
Kontrindikācijas
Dzelzs sulfāts 2 ir kontrindicēts lietošanai:
- objektā;
- pacientiem ar vielmaiņas traucējumiem organismā, ar hemosideroze , hemochromatosis ;
- pacienti ar kuņģa -zarnu trakta disfunkciju, kas traucē dzelzs uzsūkšanos;
- ar aplastisko un hemolītisko anēmija ;
- pacienti ar talasēmija .
Blakus efekti
Nevēlamās reakcijas ārstēšanas laikā ar dzelzs sulfātu nav izplatītas.
Var parādīties:
- , galvassāpes vispārējs vājums un aizkaitināmība, epilepsijas sindroms un ;
- spiediena sajūta krūtīs vai slikta dūša;
- zobu sāpes, sāpes epigastrālajā reģionā;
- izsitumi uz ādas, nieze, iekaisis kakls;
- ļoti reti - anafilaktiskas reakcijas .
Lietošanas instrukcija (metode un devas)
Zāles tiek parakstītas iekšķīgi. Minimālā efektīvā deva elementārā dzelzs izteiksmē ir 100 mg. Maksimālais zāļu daudzums, ko var lietot, ir līdz 400 mg.
Profilaktiskos nolūkos ieceļ no 30 līdz 60 mg elementārā dzelzs dienā.
Pārdozēšana
Pārdozēšanas gadījumā zāļu lietošanas laikā palielinās blakusparādības. Tur ir: caureja , slikta dūša, sāpes vēderā, vemšana un sirdsdarbības ātruma palielināšanās, iespējama kapilāru caurlaidības palielināšanās sirds un asinsvadu sabrukums ... Kā terapija kuņģis tiek mazgāts, injicēts deferoksamīns dzelzs jonu saistīšanai.
Mijiedarbība
Kombinācijā ar to uzlabojas dzelzs preparātu uzsūkšanās.
Kombinēta sulfāta un antacīdu uzņemšana ar magniju, alumīniju, kalciju, penicilamīns un holestyramine palēnina dzelzs uzsūkšanos.
Ja zāles tiek kombinētas ar kortikosteroīdiem, tās savstarpēji pastiprinās eritropoēze .
Uzglabāšanas apstākļi
Zāles tiek uzglabātas sausā, tumšā, vēsā vietā oriģinālajā iepakojumā. Nelietojiet zāles pēc derīguma termiņa beigām.
Speciālas instrukcijas
Ārstēšanas laikā ar dzelzs sulfātu II izkārnījumi var kļūt melni un zobu emalja kļūst tumšāka.
Nieru un aknu slimību gadījumā dzelzs var uzkrāties organismā.
Īpaša piesardzība jāievēro, ārstējot pacientus ar kuņģa un 12 zarnu peptiska čūla , plkst čūlainais kolīts un enterīts .