Kālija permanganāta alkāns skābā vidē. Dažādu klašu organisko savienojumu oksidēšana
Sanktpēterburgas Valsts tehnoloģiskais institūts
(Tehniskā universitāte)
nodaļa organiskā ķīmija 4. fakultāte
476. grupa
Kursa darbs
Alkēnu oksidēšana
Studente……………………………………… Rytina A.I.
Lektore………………………………… Piterskaya Yu.L.
Sanktpēterburga
Ievads
1. Epoksidēšana (N.A. Priļežajeva reakcija, 1909)
2. Hidroksilēšana
2.1anti- Hidroksilēšana
2.2sin- Hidroksilēšana
3. Alkēnu oksidatīvā šķelšanās
4.Ozonolīze
5. Alkēnu oksidēšana pallādija sāļu klātbūtnē
Secinājums
Izmantoto avotu saraksts
Ievads
Oksidācija ir viena no svarīgākajām un izplatītākajām organisko savienojumu transformācijām.
Organiskajā ķīmijā ar oksidāciju saprot procesus, kas noved pie savienojuma izsīkšanas ūdeņražā vai tā bagātināšanas ar skābekli. Šajā gadījumā no molekulas tiek noņemti elektroni. Attiecīgi reducēšana tiek saprasta kā atdalīšanās no organiskās skābekļa molekulas vai ūdeņraža pievienošana tai.
Redoksreakcijās oksidētāji ir savienojumi ar augstu elektronu afinitāti (elektrofili), bet reducētāji ir savienojumi, kuriem ir tendence ziedot elektronus (nukleofilus). Savienojuma oksidēšanās vieglums palielinās, palielinoties tā nukleofilitātei.
Organisko savienojumu oksidēšanās laikā, kā likums, nenotiek pilnīga elektronu pārnešana un attiecīgi oglekļa atomu valences izmaiņas. Tāpēc oksidācijas pakāpes jēdziens - atoma nosacīts lādiņš molekulā, kas aprēķināts, pamatojoties uz pieņēmumu, ka molekula sastāv tikai no joniem - ir tikai nosacīts, formāls.
Sastādot redoksreakciju vienādojumus, nepieciešams noteikt reducētāju, oksidētāju un doto un saņemto elektronu skaitu. Koeficientus parasti izvēlas, izmantojot elektronu jonu līdzsvara metodi (pusreakcijas metodi).
Šī metode ņem vērā elektronu pāreju no viena atoma vai jona uz otru, ņemot vērā vides raksturu (skābā, sārmainā vai neitrālā), kurā notiek reakcija. Lai izlīdzinātu skābekļa un ūdeņraža atomu skaitu, tiek ievadītas vai nu ūdens molekulas un protoni (ja vide ir skāba), vai ūdens molekulas un hidroksīda joni (ja vide ir sārmaina).
Tādējādi, rakstot reducēšanas un oksidācijas pusreakcijas, ir jāvadās no šķīdumā faktiski esošo jonu sastāva. Vielas, kas ir slikti disociētas, slikti šķīst vai attīstījušās kā gāze, jāraksta molekulārā formā.
Kā piemēru apsveriet etilēna oksidēšanas procesu ar atšķaidītu kālija permanganāta ūdens šķīdumu (Vāgnera reakcija). Šīs reakcijas laikā etilēns tiek oksidēts par etilēnglikolu, un kālija permanganāts tiek reducēts līdz mangāna dioksīdam. Divkāršās saites vietā pievieno divus hidroksilus 1:
3C2H4 + 2KMnO4 + 4H2O → 3C2H6O2 + 2MnO2 + 2KOH
Redukcijas pusreakcija: MnO 4 ¯ + 2H 2 O + 3 e → MnO 2 + 4OH ¯ 2
Oksidācijas pusreakcija: C 2 H 4 + 2OH − − 2 e → C 2 H 6 O 2 3
Visbeidzot, mums ir jonu formā:
2MnO 4 ¯ + 4H 2 O + 3C 2 H 4 + 6OH ¯ → 2MnO 2 + 8OH ¯ + 3C 2 H 6 O 2
Pēc tam, kad ir veikti nepieciešamie līdzīgu terminu samazinājumi, mēs rakstām vienādojumu molekulārā formā:
3C 2H 4 + 2KMnO 4 + 4 H 2 O \u003d 3C 2 H 6 O 2 + 2MnO 2 + 2KOH.
Dažu oksidētāju īpašības
Skābeklis
Gaisa skābekli plaši izmanto tehnoloģiskajos procesos, jo tas ir lētākais oksidētājs. Bet oksidēšana ar gaisa skābekli ir saistīta ar grūtībām, kas saistītas ar procesa kontroli, kas notiek dažādos virzienos. Oksidēšana parasti tiek veikta plkst paaugstināta temperatūra katalizatoru klātbūtnē.
Ozons
Ozonu O 3 izmanto aldehīdu un ketonu iegūšanai, ja tos ir grūti iegūt citos veidos. Visbiežāk ozonu izmanto, lai noteiktu nepiesātināto savienojumu struktūru. Ozons rodas, iedarbojoties uz klusu elektrisko izlādi uz skābekli. Viena no būtiskajām ozonēšanas priekšrocībām, salīdzinot ar hlorēšanu, ir toksīnu neesamība pēc apstrādes 2 .
Kālija permanganāts
Kālija permanganāts ir visbiežāk izmantotais oksidētājs. Reaģents šķīst ūdenī (6,0% 20ºC temperatūrā), kā arī metanolā, acetonā un etiķskābē. Oksidēšanai izmanto KMnO 4 ūdens (dažreiz acetona) šķīdumus neitrālā, skābā vai sārmainā vidē. Veicot procesu neitrālā vidē, reakcijas masai pievieno magnija, alumīnija sāļus vai laiž cauri oglekļa dioksīdu, lai neitralizētu reakcijas laikā izdalīto kālija hidroksīdu. KMnO 4 oksidēšanās reakcija skābā vidē visbiežāk tiek veikta sērskābes klātbūtnē. Sārmaino vidi oksidēšanās laikā rada reakcijas laikā izveidojies KOH, vai arī to sākotnēji pievieno reakcijas masai. Viegli sārmainā un neitrālā vidē KMnO 4 oksidējas saskaņā ar vienādojumu:
KMnO4+ 3 e+ 2H 2 O \u003d K + + MnO 2 + 4OH ¯
skābā vidē:
KMnO4+ 5 e+ 8H + = K + + Mn 2+ + 4H 2 O 3
Kālija permanganātu izmanto, lai iegūtu 1,2-diolus no alkēniem, primāro spirtu, aldehīdu un alkilarēnu oksidēšanā par karbonskābēm, kā arī oglekļa skeleta oksidatīvai šķelšanai pie vairākām saitēm.
Praksē parasti tiek izmantots diezgan liels KMnO 4 pārpalikums (vairāk nekā 100%). Tas ir saistīts ar faktu, ka normālos apstākļos KMnO 4 daļēji sadalās mangāna dioksīdā, atbrīvojoties no O 2 . Karsējot reducētāju klātbūtnē, eksplozīvi sadalās ar koncentrētu H 2 SO 4; sprādzienbīstami ir arī kālija permanganāta maisījumi ar organiskām vielām 4 .
Perskābes
Peretiķskābi un skudrskābi iegūst, 25-90% ūdeņraža peroksīdam reaģējot ar atbilstošo karbonskābi saskaņā ar šādu reakciju:
RCOOH + H 2 O 2 \u003d RCOOOH + H 2 O
Etiķskābes gadījumā šis līdzsvars tiek izveidots salīdzinoši lēni, un sērskābi parasti pievieno kā katalizatoru, lai paātrinātu perskābes veidošanos. Skudrskābe pati par sevi ir pietiekami spēcīga, lai nodrošinātu ātru līdzsvaru.
Pertrifluoretiķskābe, kas iegūta maisījumā ar trifluoretiķskābi, trifluoretiķskābes anhidrīdam reaģējot ar 90% ūdeņraža peroksīdu, ir vēl spēcīgāks oksidētājs. Līdzīgi, peretiķskābi var iegūt no etiķskābes anhidrīda un ūdeņraža peroksīda.
Ciets m-hloroperbenzoskābe, jo ar to ir samērā droši rīkoties, diezgan stabila un ilgstoši uzglabājama.
Oksidācija notiek atbrīvotā skābekļa atoma dēļ:
RCOOOH = RCOOH + [O]
Perskābes izmanto, lai iegūtu epoksīdus no alkēniem, kā arī laktonus no alicikliskajiem ketoniem.
Ūdeņraža peroksīds
Ūdeņraža peroksīds ir bezkrāsains šķidrums, kas sajaucas ar ūdeni, etanolu un dietilēteri. 30% H 2 O 2 šķīdumu sauc par perhidrolu. Augsti koncentrēts preparāts var sprādzienbīstami reaģēt ar organiskām vielām. Uzglabājot, tas sadalās skābeklī un ūdenī. Ūdeņraža peroksīda noturība palielinās līdz ar atšķaidīšanu. Oksidēšanai izmanto dažādu koncentrāciju ūdens šķīdumus (no 3 līdz 90%) neitrālā, skābā vai sārmainā vidē.
H 2 O 2 \u003d H 2 O + [O]
Šim reaģentam iedarbojoties uz α,β-nepiesātinātiem karbonilsavienojumiem sārmainā vidē, tiek iegūti atbilstošie epoksialdehīdi un ketoni, skābā vidē oksidējot karbonskābes, tiek sintezētas perskābes. 30% H 2 O 2 šķīdums etiķskābē oksidē alkēnus līdz 1,2-dioliem. Ūdeņraža peroksīdu izmanto: organisko un neorganisko peroksīdu, Na perborāta un perkarbonāta iegūšanai; kā oksidētājs raķešu degvielā; saņemot epoksīdus, hidrohinonu, pirokateholu, etilēnglikolu, glicerīnu, tiurama grupas vulkanizācijas paātrinātājus u.c.; eļļu, tauku, kažokādu, ādas, tekstilmateriālu, papīra balināšanai; germānija un silīcija pusvadītāju materiālu tīrīšanai; kā dezinfekcijas līdzeklis sadzīves un rūpniecisko notekūdeņu neitralizēšanai; medicīnā; kā O 2 avots zemūdenēs; H 2 O 2 ir daļa no Fenton reaģenta (Fe 2 + + H 2 O 2), ko izmanto kā OH brīvo radikāļu avotu organiskajā sintēzē 5 .
Rutēnija un osmija tetroksīdi
Osmija tetroksīds OsO 4 ir balts vai gaiši dzeltens pulveris ar mp. 40,6ºС; t. kip. 131,2ºС. Sublimējas jau istabas temperatūrā, šķīst ūdenī (7,47 g 100 ml pie 25ºС), СCl 4 (250 g 100 g šķīdinātāja pie 20ºС). Organisko savienojumu klātbūtnē tas kļūst melns, samazinoties līdz OsO 2 6 .
RuO 4 ir zeltaini dzeltena prizma ar tik pl. 25,4ºС, istabas temperatūrā jūtami sublimējas. Slikti šķīst ūdenī (2,03 g 100 ml pie 20ºС), ļoti labi šķīst CCl 4 . Spēcīgāks oksidētājs nekā OsO 4 . Virs 100ºС eksplodē. Tāpat kā osmija tetroksīdam, tam ir augsta toksicitāte un augstas izmaksas.
Šos oksidētājus izmanto alkēnu oksidēšanai par α-glikoliem vieglos apstākļos.
Dioksirāni
Visbiežāk izmanto dimetildioksirānu un metil(trifluormetil)dioksirānu.

Dioksirānus visbiežāk iegūst iekšā situ no atbilstošajiem ketoniem un KHSO 5 (vai K 2 SO 4 KHSO 4 2KHSO 5 (oksonu)) viegli sārmainā vidē 7:
Dioksirāni izceļas ar augstu reaktivitāti apvienojumā ar labu selektivitāti un tiek izmantoti neaktivētu C-H saišu oksidēšanai alkānos, epoksīdu iegūšanai no alkēniem, amīnu, oksīmu, sulfīdu, sulfoksīdu u.c. oksidēšanai.
Alkēnu oksidēšana var notikt vairākos virzienos:
1) ar molekulas oglekļa skeleta saglabāšanu; šādi notiek dubultsaites epoksidēšana un hidroksilēšana, izraisot vicinālo trans- vai cis-glikolu veidošanos.
2) ar dubultsaites pārrāvumu; šādi notiek ozonolīze un alkēnu pilnīga oksidēšana, kā rezultātā veidojas dažāda veida karbonilsavienojumi un karbonskābes.
Atkarībā no oksidēšanas veida tiek izmantoti dažādi oksidētāji.
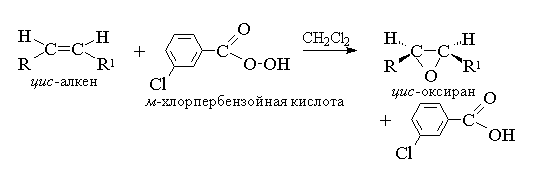
1. Epoksidēšana(N.A. Priļežajeva reakcija, 1909)
Acikliskie un cikliskie alkēni, mijiedarbojoties ar perskābēm (perskābēm) RCOOOH nepolārā, vienaldzīgā vidē, veido epoksīdus (oksirānus), tāpēc pašu reakciju sauc par epoksidācijas reakciju.

Saskaņā ar mūsdienu nomenklatūru IUPAC- trīs locekļu gredzenu ar vienu skābekļa atomu sauc par oksirānu.
Alkēnu epoksidēšana jāuzskata par sinhronu, koordinētu procesu, kurā nav iesaistīti jonu starpprodukti, piemēram, OH+ hidroksilkatjons. Citiem vārdiem sakot, alkēnu epoksidēšana ir process sin- viena skābekļa atoma pievienošana dubultai saitei, pilnībā saglabājot aizvietotāju konfigurāciju pie dubultās saites. 8

Epoksidēšanai ir ierosināts mehānisms, kas raksturīgs saskaņotiem procesiem.

Tā kā perskābes skābekļa atoma dubultsaites uzbrukums ir vienlīdz iespējams abās dubultās saites plaknes pusēs, iegūtie oksirāni ir vai nu mezo-enantiomēru formas vai maisījumi. Kā epoksidētājus izmanto šādas perskābes: perbenzoskābi, m-hlorperbenzoskābe, monoperftalskābe, peretiķskābe, trifluoroperetiķskābe un permetiķskābe. Aromātiskās perskābes tiek izmantotas kā atsevišķi reaģenti, savukārt alifātiskās perskābes - CH 3 CO 3 H, CF 3 CO 3 H un HCO 3 H nav izolētas individuāla forma, un tiek izmantoti pēc to veidošanās 30% vai 90% ūdeņraža peroksīda un atbilstošās karbonskābes mijiedarbībā. Perbenzoiskā un m-hlorperbenzoskābi iegūst, oksidējot benzoskābi un m-hlorbenzoskābe ar 70% ūdeņraža peroksīdu metānsulfonskābes šķīdumā vai no šo skābju skābju hlorīdiem un ūdeņraža peroksīda.


Monoperftalskābi iegūst ar līdzīgu metodi no ftalskābes anhidrīda un 30% ūdeņraža peroksīda.

Šobrīd plaši tiek izmantota monoperoksiftalskābe tās Mg sāls veidā, ko var izmantot organisko šķīdinātāju maisījumos ar ūdeni 9 .
Sākotnēji perbenzoskābes vai monoperftalskābes tika izmantotas, lai iegūtu oksirānus (epoksīdus) 10:

Pašlaik visbiežāk tiek izmantota epoksidēšana m-hlorperbenzoskābe. Atšķirībā no citām perskābēm, tas ir stabils ilgu laiku (līdz 1 gadam) uzglabājot un ir absolūti drošs lietošanai. Oksirānu raža, kas iegūta, oksidējot acikliskos un cikliskos alkēnus m-hlorperbenzoskābe metilēnhlorīda, hloroforma vai dioksāna šķīdumā parasti ir diezgan augsts 11 .



Perskābes bieži rodas tieši no 90% ūdeņraža peroksīda un karbonskābes reakcijas maisījuma metilēnhlorīdā.

Alkēni ar dubultsaiti, kas konjugēti ar karbonilgrupu vai citu akceptora aizvietotāju, ir neaktīvi un to oksidēšanai labāk izmantot spēcīgākus oksidētājus, piemēram, trifluoroperetiķskābi, kas iegūta no trifluoretiķskābes anhidrīda un 90% ūdeņraža peroksīda metilēnhlorīda sastāvā. Peroksikarboksimīnskābes RC(NH)OOH ir nestabili starpprodukti, kas veidojas nitrilu reakcijās ar ūdeņraža peroksīda 12 sārmainiem šķīdumiem:
Vienkāršākais oksirāns, etilēnoksīds, tiek ražots rūpnieciski, oksidējot etilēnu ar skābekli sudraba kā katalizatora klātbūtnē 13 .

2. Hidroksilēšana
Ir zināmi vairāki oksidējoši reaģenti, ar kuru palīdzību vieglos apstākļos alkēniem var pievienot divas hidroksilgrupas.
Alkēnu hidroksilēšanas reakcija, kas notiek aukstā kālija permanganāta šķīduma iedarbībā un ko pavada tā krāsas maiņa, ir pazīstama kā Vāgnera reakcija (1888). Pašlaik tam ir maz sintētisku pielietojumu, jo kopā ar to veidojas ievērojams skaits blakusproduktu. Tomēr šo reakciju var izmantot organiskā savienojuma struktūras izpētē kā kvalitatīvu dubultsaites pārbaudi. Cikloheksēna hidroksilēšanu, iedarbojoties ar kālija permanganāta ūdens šķīdumu aukstumā, vispirms veica V.V. Markovņikovs. Pašlaik alkēnu hidroksilēšanai visbiežāk izmanto osmija (VIII) oksīdu (Krīge reakcija, 1936) 14 .
Osmija tetroksīds OsO 4 ir bezkrāsaina kristāliska viela, kas kūst 40 o C temperatūrā un viegli šķīst ēterī. Cikloheksēnu oksidējot ar šī reaģenta ētera šķīdumu, veidojas melnas nogulsnes, kas ir osmīnskābes I 15 ciklisks esteris:
Ēteris veidojas alkēna oglekļa-oglekļa dubultsaites un metāla oksīda divu dubultsaišu vienlaicīgas atvēršanas rezultātā. Pēc tam šo esteri hidrolizē, kā katalizatoru izmantojot nātrija sulfītu. Hidrolīzes produkts ir cis-cikloheksāndiols-1,2(II), kurā hidroksili atrodas β-apgabalā, t.i. priekšā, un ūdeņraži α-reģionā, t.i. aiz muguras.
2.1 anti- Hidroksilēšana
Trīs locekļu oksirānu gredzens ir viegli atverams dažādu nukleofīlo reaģentu ietekmē. Oksirānu hidrolīzi katalizē gan skābes, gan bāzes. Abos gadījumos veidojas vicinālie dioli, t.i., glikoli. Skābās katalīzes laikā pirmajā posmā notiek oksirāna skābekļa atoma protonēšana, veidojoties cikliskam oksonija katjonam, kas atveras ūdens molekulas nukleofīlā uzbrukuma rezultātā 16:

Gredzena atvēršanas galvenais solis, kas nosaka visa procesa ātrumu, ir ūdens nukleofīlais uzbrukums oksirāna protonētajai formai. No mehānisma viedokļa šis process ir līdzīgs bromonija jona atvēršanai bromīda jona vai cita nukleofīlā aģenta nukleofīlā uzbrukuma laikā. No šīm pozīcijām stereoķīmiskajam rezultātam jābūt veidojumam transs-glikoli ciklisko epoksīdu šķelšanā. Patiešām, cikloheksēna oksīda vai ciklopentēna oksīda skābes katalizētās hidrolīzes laikā tikai transs-1,2-dioli.
Tādējādi divu posmu alkēna epoksidēšanas process, kam seko epoksīda skābes hidrolīze, kopumā atbilst reakcijai anti-alkēnu hidroksilēšana.
Abi posmi anti-alkēnu hidroksilēšanu var kombinēt, ja alkēnu apstrādā ar ūdeņraža peroksīda 30-70% ūdens šķīdumu skudrskābē vai trifluoretiķskābē. Abas šīs skābes ir pietiekami spēcīgas, lai atvērtu oksirāna gredzenu.

Oksirāna gredzena atvēršanās, ko katalizē bāze, arī izraisa ciklisku veidošanos. transs-glikoli.
Tāpēc divu posmu alkēnu epoksidēšanas process, kam seko epoksīdu sārmaina hidrolīze, arī ir reakcija anti-alkēnu hidroksilēšana.
2.2 sin- Hidroksilēšana
Daži pārejas metālu sāļi un oksīdi augstākās oksidācijas pakāpēs ir efektīvi reaģenti. sin-alkēna dubultsaites hidroksilēšana, kad abas hidroksilgrupas ir pievienotas tai pašai dubultsaites pusei. Alkēnu oksidēšana ar kālija permanganātu ir viena no vecākajām metodēm sin-divkāršo saišu hidroksilēšana - joprojām tiek plaši izmantota, neskatoties uz tai raksturīgajiem ierobežojumiem. cis-1,2-cikloheksāndiolu pirmo reizi ieguva V.V. Markovņikovs 1878. gadā, hidroksilējot cikloheksēnu ar kālija permanganāta ūdens šķīdumu 0 0 C temperatūrā.

Šī metode tika tālāk attīstīta krievu zinātnieka E.E. Tāpēc Vāgners sin-alkēnu hidroksilēšanu kālija permanganāta ūdens šķīduma ietekmē sauc par Vāgnera reakciju. Kālija permanganāts ir spēcīgs oksidētājs, kas var ne tikai hidroksilēt dubultsaiti, bet arī atšķelt iegūto vicinālo diolu. Lai pēc iespējas izvairītos no turpmākas glikolu sadalīšanās, rūpīgi jākontrolē reakcijas apstākļi. Glikola iznākums parasti ir zems (30-60%). Labākie rezultāti tiek panākti, hidroksilējot alkēnus nedaudz sārmainā vidē (рН~8 9) pie 0-5 0 С ar atšķaidītu 1% KMnO 4 17 ūdens šķīdumu.


Sākotnēji, alkēnus oksidējot ar kālija permanganātu, veidojas ciklisks permangānskābes esteris, kas uzreiz tiek hidrolizēts par vicinālo diolu.

Permangānskābes cikliskais esteris netika izolēts kā starpprodukts, bet tā veidošanās izriet no eksperimentiem ar iezīmēto 18 O kālija permanganātu: abi skābekļa atomi glikolā ir iezīmējušies, oksidējot alkēnu KMn 18 O 4 . Tas nozīmē, ka abi skābekļa atomi tiek pārnesti no oksidētāja, nevis no šķīdinātāja - ūdens, kas labi saskan ar piedāvāto mehānismu.
Vēl viena metode sin-alkēnu hidroksilēšanu osmija (VIII) oksīda OsO 4 iedarbībā ierosināja R. Krige 1936. gadā. Osmija tetroksīds ir bezkrāsaina, gaistoša, kristāliska viela, kas viegli šķīst ēterī, dioksānā, piridīnā un citos organiskos šķīdinātājos. Osmija tetroksīdam reaģējot ar alkēniem ēterī vai dioksānā, veidojas melnas osmīnskābes cikliskā estera nogulsnes - osmāts, ko var viegli izolēt atsevišķi. OsO 4 pievienošana dubultsaitei piridīna šķīdumā ir ievērojami paātrināta. Osmātu sadalīšanās par vicinālajiem glikoliem tiek panākta, iedarbojoties ar nātrija hidrosulfīta vai sērūdeņraža ūdens šķīdumu.

Produktu izvadi sin-alkēnu hidroksilēšana šajā metodē ir daudz augstāka nekā tad, ja kā oksidētāju izmanto permanganātu. Būtiska Krige metodes priekšrocība ir alkēnu oksidatīvās šķelšanās produktu trūkums, kas raksturīgs permanganāta oksidācijai 18 .
 19
19

Osmija tetroksīds ir ļoti dārgs un grūti iegūstams reaģents, turklāt tas ir toksisks. Tāpēc osmija (VIII) oksīds tiek izmantots nelielu daudzumu grūti sasniedzamu vielu sintēzē, lai iegūtu augstāko diola iznākumu. Lai vienkāršotu sin-alkēnu hidroksilēšanai OsO 4 iedarbībā tika izstrādāta tehnika, kas ļauj izmantot tikai šī reaģenta katalītiskos daudzumus. Alkēnu hidroksilēšana tiek veikta, izmantojot ūdeņraža peroksīdu OsO 4 klātbūtnē, piemēram:

Noslēgumā mēs varam norādīt stereoķīmiskās attiecības starp alkēnu cis- vai transs-iegūtā vicinālā diola konfigurācija un konfigurācija, kas var būt cis- vai transs-izomērs, eritro- vai treo- forma, mezo- vai D,L-forma atkarībā no aizvietotājiem alkēnā 20:

Līdzīgas stereoķīmiskās attiecības tiek novērotas arī citās reakcijās sin- vai anti- ūdeņraža, ūdeņraža halogenīdu, ūdens, halogēnu, bora hidrīdu un citu reaģentu vairāku saišu pievienošana.
3. Oksidatīvā šķelšanās alkēni
Alkēnu oksidēšanas laikā ar sārmainu kālija permanganāta ūdens šķīdumu karsējot vai ar KMnO 4 šķīdumu sērskābes ūdens šķīdumā, kā arī alkēnu oksidēšanas laikā ar hroma (VI) oksīda CrO 3 šķīdumu etiķskābē vai kālija dihromāts un sērskābe, sākotnēji izveidotais glikols tiek pakļauts oksidatīvai noārdīšanai. Gala rezultāts ir oglekļa skeleta sadalīšanās dubultās saites vietā un ketonu un/vai karbonskābju veidošanās kā galaprodukti atkarībā no dubultās saites aizvietotājiem. Ja abi oglekļa atomi pie dubultās saites satur tikai vienu alkilgrupu, pilnīgas oksidācijas galaprodukts būs karbonskābju maisījums, tetraaizvietotais alkēns pie dubultās saites tiek oksidēts līdz diviem ketoniem. Monoaizvietoti alkēni ar gala dubultsaiti tiek atdalīti līdz karbonskābei un oglekļa dioksīdam 21 .

 22
22
Sakarā ar zemo karbonskābju un ketonu iznākumu, alkēnu izsmeļošās oksidācijas reakcijas klasiskajā versijā nav atradušas plašu pielietojumu un iepriekš tika izmantotas galvenokārt sākotnējā alkēna struktūras noteikšanai no destruktīvas oksidācijas produktiem. Pašlaik alkēnu (R-CH=CH-R un R-CH=CH 2) oksidēšana par karbonskābēm (RCOOH) ar kālija permanganātu vai dihromātu tiek veikta fāzes pārneses katalīzes apstākļos. Karbonskābju iznākums šajā gadījumā pārsniedz 90%.

4. Alkēnu ozonolīze
Alkēnu reakcija ar ozonu ir vissvarīgākā metode alkēnu oksidatīvai šķelšanai pie dubultās saites. Daudzus gadu desmitus šī reakcija kalpoja kā galvenā metode sākotnējā ogļūdeņraža struktūras noteikšanai, kā arī atrada pielietojumu dažādu karbonila savienojumu sintēzē. Alkēna reakciju ar ozonu veic, izlaižot ~5% ozona un skābekļa maisījuma strāvu alkēna šķīdumā metilēnhlorīda vai etilacetāta -80 0 -100 0 C temperatūrā. Reakcijas beigas kontrolē ar brīvā ozona tests ar kālija jodīdu. Šīs savdabīgās un sarežģītās reakcijas mehānisms ir izveidots galvenokārt pateicoties Kriges darbam. Pirmais 1,3-dipolārās ciklopievienošanās produkts dubultai saitei ir tā sauktais molozonīds (1,2,3-trioksolāns). Šis produkts ir nestabils un tālāk spontāni sadalās, atverot gredzenu un veidojot parasto ozonīdu (1,2,4-trioksolānu) 23 kā galaproduktu.
 24
24
Tagad ir vispāratzīts, ka molozonīds pārvēršas parastā ozonīdā, izmantojot sadalīšanas-rekombinācijas mehānismu. Mollozonīds tiek pakļauts spontānai nestabilā 1,2,3-trioksolāna gredzena atvēršanai, veidojot karbonilsavienojumu un bipolāru jonu, kas pēc tam reaģē viens ar otru arī saskaņā ar 1,3-dipolārās cikloadedīcijas shēmu.

Doto molozonīda pārkārtošanās parasto ozonīdu shēmu apstiprina fakts, ka, ja reakcijas maisījumā kā bipolārā jona "pārtvērējs" atrodas cits karbonilsavienojums pirms pilnīgas ozonīda veidošanās, tad t.s. veidojas jaukts ozonīds". Piemēram, ozonizācijā cis-stilbēns benzaldehīda klātbūtnē, kas iezīmēts ar 18O izotopu, marķējums ir daļa no ētera, nevis ozonīda peroksīda tilts:
Šis rezultāts labi saskan ar jaukta ozonīda veidošanos pēc bipolārā jona rekombinācijas ar iezīmētu benzaldehīdu:

Ozonīdi ir ļoti nestabili savienojumi, kas sprādzienbīstami sadalās. Tie nav izolēti atsevišķi, bet sadalīti dažādu reģentu ietekmē. Ir nepieciešams atšķirt reduktīvo un oksidatīvo šķelšanos. Hidrolīzes laikā ozonīdi lēnām sadalās karbonilsavienojumos un ūdeņraža peroksīdā. Ūdeņraža peroksīds oksidē aldehīdus par karbonskābēm. Šī ir tā sauktā ozonīdu oksidatīvā sadalīšanās:

Tādējādi ozonīdu oksidatīvās sadalīšanās laikā karbonskābes un (vai) ketoni atkarībā no sākuma alkēna struktūras. Kā oksidētājus var izmantot gaisa skābekli, ūdeņraža peroksīdu, perskābes vai sudraba hidroksīdu. Visbiežāk sintētiskajā praksē šim nolūkam izmanto ūdeņraža peroksīdu etiķskābē vai skudrskābē, kā arī ūdeņraža peroksīdu sārmainā vidē.


Praksē karbonskābju iegūšanai galvenokārt izmanto ozonīdu oksidatīvās sadalīšanas metodi.
Daudz svarīgāka ir ozonīdu reducējošā šķelšanās. Visbiežāk izmantotie reducējošie līdzekļi ir cinks un etiķskābe, trifenilfosfīns vai dimetilsulfīds. Šajā gadījumā ozonolīzes galaprodukti ir aldehīdi vai ketoni atkarībā no sākuma alkēna struktūras.


 25
25
No iepriekš minētajiem piemēriem var redzēt, ka tetra-aizvietots alkēns pie dubultsaites veido divus ketonus ozonolīzes un sekojošās ozonīda reducējošās sadalīšanās laikā, bet trīsaizvietots alkēns veido ketonu un aldehīdu. Diaizvietots simetrisks alkēns ozonolīzes laikā veido divus aldehīdus, un alkēni ar gala saiti veido aldehīdu un formaldehīdu.
Interesanta ozonolīzes modifikācija ir metode, kurā par ozonīda reducētāju tiek izmantots nātrija borhidrīds.Šajā gadījumā galareakcijas produkti ir primārie vai sekundārie spirti, kas veidojas attiecīgi aldehīdu un kstonu reducēšanas laikā 26 .


Alkēnu ozonolīze ir sarežģīts, laikietilpīgs un sprādzienbīstams process, kam nepieciešams izmantot īpašu aprīkojumu. Šī iemesla dēļ ir izstrādātas citas metodes alkēnu oksidatīvai šķelšanai līdz karbonilsavienojumiem un karbonskābēm, kas sintētiskajā praksē veiksmīgi aizstāj ozonolīzes reakciju.
Vienu no modernajām sagatavošanas metodēm alkēnu oksidatīvai iznīcināšanai 1955. gadā ierosināja R. Lemjē. Šīs metodes pamatā ir alkēnu hidroksilēšana ar kālija permanganātu, kam seko vicinālā glikola šķelšana ar nātrija perjodātu NaIO 4 pie pH ~ 7 8. Periodāts pats ar alkēnu nedarbojas. Šīs divpakāpju oksidatīvās šķelšanās produkti ir ketoni vai karbonskābes, jo šajos apstākļos arī aldehīdi tiek oksidēti par karbonskābēm. Lemjē metodē nerodas darbietilpīga viena no reakcijas produktu, mangāna dioksīda, atdalīšanas problēma, jo gan dioksīds, gan manganāts atkal tiek oksidēti ar perjodātu par permanganāta jonu. Tas ļauj izmantot tikai katalītisku kālija permanganāta daudzumu. Tālāk ir sniegti daži tipiski alkēnu oksidatīvās šķelšanās piemēri ar Lemjē metodi.

Citronellols, spirts, kas ir daļa no rožu eļļas, ģerānijas un citronu eļļām, tiek oksidēts ar kālija permanganāta un nātrija perjodāta maisījumu acetona ūdens šķīdumā 5 10 0 C temperatūrā līdz 6-hidroksi-4-metilheksānkarbonskābei ar kvantitatīvu iznākumu.

Citā šīs metodes variācijā kālija permanganāta vietā izmanto katalītisku daudzumu osmija tetroksīda (Lemieux & Johnson 1956). Īpaša OsO 4 un NaIO 4 kombinācijas priekšrocība ir tā, ka tā ļauj apturēt oksidāciju aldehīda stadijā. Osmija tetroksīds pievienojas alkēna dubultsaitei, veidojot osmātu, ko nātrija perjodāts oksidē par karbonilsavienojumiem, reģenerējot osmija tetroksīdu.

Osmija tetroksīda vietā var izmantot arī rutēnija tetroksīdu RuO 4. Lemjē-Džonsona alkēnu oksidatīvā sadalīšanās rada tādus pašus produktus kā ozonolīze ar reducējošu ozonīdu šķelšanos.

Mūsdienu organiskajai ķīmijai raksturīgā izteiksmē tas nozīmē, ka OsO 4 -NaIO 4 kombinācija ir sintētiskais ekvivalents alkēnu ozonolīze, kam seko reduktīva šķelšanās. Tāpat alkēnu oksidēšana ar permanganāta un perjodāta maisījumu ir sintētisks ekvivalents ozonolīzei ar ozonīdu oksidatīvo noārdīšanos.
Tādējādi alkēnu oksidēšana ir ne tikai sagatavošanas metožu kopums spirtu, epoksīdu, diolu, aldehīdu, ketonu un karbonskābju iegūšanai, bet arī viens no iespējamiem veidiem, kā noteikt sākuma alkēna struktūru. Tātad pēc alkēna oksidatīvās noārdīšanās rezultāta var noteikt dubultās saites stāvokli molekulā, savukārt stereoķīmisko rezultātu. sin- vai anti- alkēna hidroksilēšana ļauj izdarīt secinājumus par tā ģeometriju.
5. Alkēnu oksidēšana pallādija sāļu klātbūtnē
Alkēnu oksidēšana par karbonilsavienojumiem, izmantojot pallādija hlorīdu, ir bijusi daudzu pētījumu priekšmets, galvenokārt tāpēc, ka rūpniecībai ir svarīga reakcija uz acetaldehīda ražošanu no etilēna (Vacker process). Oksidēšanas laikā palādija hlorīds tiek reducēts par palādiju, un šāds process būtu ierobežots, ja vien dārgu pallādija hlorīdu var izmantot katalītiskā daudzumā otra oksidētāja, visbiežāk vara(II) hlorīda klātbūtnē. , kas oksidē pallādiju par pallādiju. (II), bet pats tiek redukts par varu (I). Vara (I) reoksidāciju par varu (II) var veikt ar atmosfēras skābekli, lai kopējais process būtu ļoti pievilcīgs. rūpnieciskās oksidēšanas metode 27 .
Etilēns viegli oksidējas līdz acetaldehīdam 28:
Ieteicamais 29. mehānisms:
Reakcija notiek skābā vidē, to nepavada oglekļa atomu skaita izmaiņas etilēna molekulā, un šobrīd tā ir galvenais acetaldehīda avots rūpniecībā.
Etilēna homologu oksidēšanās tādos pašos apstākļos notiek pie divkāršās saites vismazāk hidrogenētā oglekļa atoma, veidojot ketonus. Jo īpaši, kad tiek oksidēts propēns, tiek iegūts acetons, bet, oksidējot cikloheksēnu, tiek iegūts cikloheksanons.
Secinājums
Oksidācijas reakcija ir svarīga dubultsaišu reakciju grupa. Kopumā oksidācijas reakcijas ieņem īpašu vietu organiskajā ķīmijā. Apsverot šīs reakcijas, jāņem vērā ne tikai oksidējamā organiskā savienojuma raksturs, bet arī oksidētāja īpašības, katalizatora klātbūtne vai neesamība, vide, kurā notiek reakcija utt.
Tāpēc bieži vien ir jāiegaumē oksidētāji un to lietošanas nosacījumi, lai iegūtu vēlamo oksidācijas produktu. Piemēram, alkēnu oksidācijas reakcija ar atšķaidītu kālija permanganāta šķīdumu izraisa diolu (glikolu) veidošanos, savukārt koncentrēts kālija permanganāta šķīdums iznīcina alkēna molekulu pie dubultās saites, veidojot skābekli saturošus produktus. Tādējādi viens un tas pats oksidētājs dažādās vidēs rada dažādus oksidācijas produktus.
No oksidācijas reakcijām par svarīgāko tiek uzskatīta mūsu uzskatītā ozonēšanas reakcija, kas ļauj no galaproduktiem noteikt sākotnējā alkēna struktūru. Šajā darbā tika apskatītas galvenās alkēnu oksidācijas reakcijas un katalizatori, kas tiek izmantoti oksidācijas procesos.
Izmantoto avotu saraksts:
1) Reutovs O. A. Organiskā ķīmija 4 daļās Ch. 1.-M.: BINOM. Zināšanu laboratorija, 2004.-567lpp.
2) Remijs G. Neorganiskās ķīmijas kurss. T. 1. M.: Ārzemju literatūras apgāds, 1963. - 920 lpp.
3) D.V.Kazakovs, A.I.Vološins, V.P.Kazakovs, V.V.Šerešovecs, N.N.Kabaļnova. Dioksirānu ķīmija un hemiluminiscence. Maskava: Nauka, 1999
4) Traven V.F . Organiskā ķīmija: mācību grāmata vidusskolām: 2 sējumos / VF Traven. - M .: ICC "Akademkniga", 2004. - T. 1
5) Haynes A. Organisko savienojumu oksidēšanas metodes. Alkāni, alkēni, alkīni un arēni. M.: Mir, 1988.
6) Morisons R., Boids R. "Organiskā ķīmija" M.: Mir, 1974.
7) Šabarovs Yu.S. "Organiskā ķīmija" 1.daļa M.: Ķīmija 1994.g
8) Petrovs A.A., Baljans H.V., Troščenko A.T. Organiskā ķīmija: mācību grāmata universitātēm - 5. izdevums, pārskatīts. Un papildus - Sanktpēterburga: "Ivans Fjodorovs", 2002.-624 lpp.
9) L. Spalviņa, M. Fizer organiskā ķīmija. Padziļināts kurss. 1.-M sējums, "Ķīmija", 1969, 688 lpp.
10) Plotņikovs V.F., Sanktpēterburga Yu.L. Alkēni.Pamācība.-SPb: SPbGTI(TU)-2003.-20 lpp.
11) Neiland O. Ya. II nodaļa. Alkēni // Organiskā ķīmija: Proc. par ķīmiju. universitātes. - M .: "Augstskola", 1990.
12) marts D. Organiskā ķīmija: 4 sējumos / Per. no angļu valodas. - M.: Mir, 1987. - T. 4. 470 lpp.
13) Ternijs A. Mūsdienu organiskā ķīmija: 2 sējumos - M .: Mir, 1981.
14) Hauptman Z., Grefe Yu., Remane H. "Organiskā ķīmija" M.: Khimiya, 1979
15) Drjuks V.G., Maļinovskis M.S. "Organiskās ķīmijas kurss" Kijeva: Viščas skola 1987
16) http://www.chemistry.ssu.samara.ru/chem2/u442.htm
17) http://www.xumuk.ru/
1 Petrovs A.A., Baljans H.V., Troščenko A.T. Organiskā ķīmija: Mācību grāmata augstskolām, 85.lpp
26 26 Traven Abstract >> Ķīmija
CH2 + 3O2 2CO2 + 2H2O b) Pie oksidēšanās alkēni atšķaidīts kālija permanganāta šķīdums veidojas ... uz dubultsaites. c) Kad grūti oksidēšanās alkēni verdošs kālija permanganāta šķīdums skābā ...
Vispārējās ķīmijas teorija ar mācību metodikas elementiem
Apkrāptu lapa >> ĶīmijaKarbonil savienojumu iegūšanas metode - oksidēšanās spirti. Kā oksidētājs jūs varat ... iegūt ~ 90%) 5. Oksidācija alkēni. Aldehīdi un ketoni ir oksidēšanās etilēna sērijas ogļūdeņraži ... nav hidratēti. 7. Reakcijas oksidēšanās. Aldehīdi un ketoni...
Oksirāni (epoksīdi)
Abstract >> Ķīmija...) 3,4-epoksi-1-butēns Oksirānu iegūšanas metodes Oksidācija alkēni perskābes Visplašāk izmantotā metode... 1,2-epoksiciklo-m-hlorbenzoskābe heksānskābe Oksidācija alkēni organiskās perskābes tiek pievienotas skābekļa ...
Vispārīga informācija par alkoholu. Polioli
Abstract >> Ķīmija...) var iegūt oksidēšanās alkēni kālija permanganāts vai tetrokisdom .... Aprakstiet reakcijas mehānismu Oksidācija polioli Oksidācija etilēnglikols norit dažādi, ... mehānismi: (m 21) Periodisks oksidēšanās glicerīns izraisa formaldehīda veidošanos ...
Šo materiālu pašmācības ceļā var būt grūti apgūt lielā informācijas daudzuma, daudzo nianšu, visādu BET un JA dēļ. Izlasiet uzmanīgi!
Kas tieši tiks apspriests?
Papildus pilnīgai oksidācijai (sadegšanai) dažām organisko savienojumu klasēm raksturīgas daļējas oksidācijas reakcijas, savukārt tās pārvēršas citās klasēs.
Katrai klasei ir specifiski oksidētāji: CuO (spirtiem), Cu (OH) 2 un OH (aldehīdiem) un citi.
Bet ir divi klasiski oksidētāji, kas, tā sakot, ir universāli daudzām klasēm.
Tas ir kālija permanganāts - KMnO 4. Un kālija dihromāts (dihromāts) - K 2 Cr 2 O 7. Šīs vielas ir spēcīgi oksidētāji, jo mangāns oksidācijas stāvoklī ir attiecīgi +7 un hroms oksidācijas stāvoklī +6.
Reakcijas ar šiem oksidētājiem ir diezgan izplatītas, taču nekur nav sniegts holistisks ceļvedis, kā izvēlēties šādu reakciju produktus.
Praksē ir ļoti daudz faktoru, kas ietekmē reakcijas gaitu (temperatūra, vide, reaģentu koncentrācija utt.). Bieži tiek iegūts produktu maisījums. Tāpēc ir gandrīz neiespējami paredzēt, kāds produkts veidojas.
Bet tas nav piemērots vienotajam valsts eksāmenam: tur nevar rakstīt "varbūt vai nu tas, vai tas, vai citādi, vai produktu maisījums". Ir jābūt specifikai.
Uzdevumu sastādītāji ir ieguldījuši noteiktu loģiku, noteiktu principu, pēc kura būtu jāraksta konkrēts produkts. Diemžēl viņi ne ar vienu nedalījās.
Šis jautājums lielākajā daļā rokasgrāmatu ir diezgan slidens: kā piemērs ir norādītas divas vai trīs reakcijas.
Šajā rakstā es prezentēju to, ko var saukt par USE uzdevumu izpētes-analīzes rezultātiem. Oksidācijas reakciju kompilēšanas loģika un principi ar permanganātu un dihromātu ir atšķetināti ar diezgan augstu precizitāti (saskaņā ar USE standartiem). Par visu kārtībā.
Oksidācijas pakāpes noteikšana.
Pirmkārt, saskaroties ar redoksreakcijām, vienmēr ir oksidētājs un reducētājs.
Oksidētājs ir mangāns permanganātā vai hroms dihromātā, reducētājs ir atomi organiskajā (proti, oglekļa atomi).
Nepietiek ar produktu definēšanu, reakcija ir jāizlīdzina. Izlīdzināšanai tradicionāli tiek izmantota elektroniskā bilances metode. Lai izmantotu šo metodi, ir jānosaka reducētāju un oksidētāju oksidācijas pakāpes pirms un pēc reakcijas.
Plkst neorganiskās vielas mēs zinām oksidācijas pakāpi no 9. klases:
Bet bioloģiskajā, iespējams, 9. klasē tos nenoteica. Tāpēc, pirms iemācīties rakstīt OVR organiskajā ķīmijā, jums jāiemācās noteikt oglekļa oksidācijas pakāpi organiskajās vielās. Tas tiek darīts nedaudz savādāk nekā neorganiskajā ķīmijā.
Oglekļa maksimālais oksidācijas līmenis ir +4, minimālais -4. Un tas var parādīt jebkuru šī intervāla oksidācijas pakāpi: -4, -3, -2, -1, 0, +1, +2, +3, +4.
Vispirms jums jāatceras, kas ir oksidācijas stāvoklis.
Oksidācijas stāvoklis ir nosacīts lādiņš, kas rodas uz atoma, pieņemot, ka elektronu pāri ir pilnībā novirzīti uz elektronnegatīvāko atomu.
Tāpēc oksidācijas pakāpi nosaka pārvietoto elektronu pāru skaits: ja tas tiek nobīdīts uz doto atomu, tad tas iegūst lieko mīnus (-) lādiņu, ja no atoma, tad iegūst lieko plus (+) lādiņu. . Principā šī ir visa teorija, kas jums jāzina, lai noteiktu oglekļa atoma oksidācijas pakāpi.
Lai noteiktu savienojumā esošā oglekļa atoma oksidācijas pakāpi, mums jāapsver KATRA no tā saitēm un jāredz, kurā virzienā elektronu pāris pārvietosies un kāds pārmērīgais lādiņš (+ vai -) no tā radīsies uz oglekļa atoma. .
Apskatīsim konkrētus piemērus:
Pie oglekļa trīs ūdeņraža saites. Ogleklis un ūdeņradis - kas ir vairāk elektronnegatīvs? Ogleklis, tad gar šīm trim saitēm elektronu pāris novirzīsies uz oglekli. Ogleklis paņem vienu negatīvu lādiņu no katra ūdeņraža: izrādās -3
Ceturtā saite ir ar hloru. Ogleklis un hlors - kas ir elektronnegatīvāks? Hlors, kas nozīmē, ka virs šīs saites elektronu pāris pāries uz hloru. Ogleklim ir viens pozitīvs +1 lādiņš.
Tad jums vienkārši jāpievieno: -3 + 1 = -2. Šī oglekļa atoma oksidācijas pakāpe ir -2.

Noteiksim katra oglekļa atoma oksidācijas pakāpi:

Ogleklim ir trīs saites ar ūdeņradi. Ogleklis un ūdeņradis - kas ir vairāk elektronnegatīvs? Ogleklis, tad gar šīm trim saitēm elektronu pāris novirzīsies uz oglekli. Ogleklis paņem vienu negatīvu lādiņu no katra ūdeņraža: izrādās -3
Un vēl viena saite ar citu oglekli. Ogleklis un cits ogleklis - to elektronegativitāte ir vienāda, tāpēc nav elektronu pāra nobīdes (saite nav polāra). 

Šim atomam ir divas saites ar vienu skābekļa atomu un vēl viena saite ar citu skābekļa atomu (kā daļa no OH grupas). Vairāk elektronnegatīvu skābekļa atomu trīs saitēs izvelk elektronu pāri no oglekļa, un oglekļa lādiņš ir +3.
Ar ceturto saiti ogleklis ir savienots ar citu oglekli, kā jau teicām, elektronu pāris nepārvietojas pa šo saiti.


Ogleklis ir saistīts ar ūdeņraža atomiem ar divām saitēm. Ogleklis kā elektronnegatīvāks katrai saitei ar ūdeņradi izvelk vienu elektronu pāri, iegūst lādiņu -2.
Oglekļa dubultsaite ir saistīta ar skābekļa atomu. Jo vairāk elektronnegatīvs skābeklis piesaista vienu elektronu pāri katrai saitei. Kopā no oglekļa tiek izvilkti divi elektronu pāri. Ogleklis iegūst +2 lādiņu.
Kopā sanāk +2 -2 = 0.

Noteiksim šī oglekļa atoma oksidācijas pakāpi:
Trīskāršā saite ar elektronnegatīvāku slāpekli dod ogleklim lādiņu +3; elektronu pāra saite ar oglekli nepārvietojas.

Oksidēšana ar permanganātu.
Kas notiks ar permanganātu?
Redoksreakcija ar permanganātu var notikt dažādās vidēs (neitrālā, sārmainā, skābā). Un tas ir atkarīgs no vides, kā tieši reakcija noritēs un kādi produkti šajā gadījumā veidojas.
Tāpēc tas var virzīties trīs virzienos:

Permanganāts, kas ir oksidētājs, tiek reducēts. Šeit ir viņa atveseļošanās produkti:
- skāba vide.
Vidi paskābina ar sērskābi (H 2 SO 4). Mangāns tiek reducēts līdz +2 oksidācijas stāvoklim. Un atkopšanas produkti būs:
KMnO 4 + H 2 SO 4 → MnSO 4 + K 2 SO 4 + H 2 O
- Sārmaina vide.
Lai izveidotu sārmainu vidi, pievieno diezgan koncentrētu sārmu (KOH). Mangāns tiek reducēts līdz oksidācijas pakāpei +6. Atveseļošanas produkti
KMnO 4 + KOH → K 2 MnO 4 + H 2 O
- Neitrāla vide(un nedaudz sārmains).
Neitrālā vidē papildus permanganātam reakcijā nonāk arī ūdens (ko rakstām vienādojuma kreisajā pusē), mangāns tiks samazināts līdz +4 (MnO 2), reducēšanas produkti būs:
KMnO 4 + H 2 O → MnO 2 + KOH
Un nedaudz sārmainā vidē (zemas koncentrācijas KOH šķīduma klātbūtnē):
KMnO 4 + KOH → MnO 2 + H 2 O

Kas notiks ar organisko vielu?
Pirmais, kas jāiemācās, ir tas, ka viss sākas ar alkoholu! Šis ir sākotnējais oksidācijas posms. Ogleklis, pie kura ir piesaistīta hidroksilgrupa, tiek oksidēts.
Oksidējot, oglekļa atoms "iegūst" saiti ar skābekli. Tāpēc, pierakstot oksidācijas reakcijas shēmu, viņi raksta [O] virs bultiņas:
primārais alkohols vispirms oksidējas par aldehīdu, pēc tam par karbonskābi:

Oksidācija sekundārais alkohols pārtraukumi otrajā posmā. Tā kā ogleklis atrodas vidū, veidojas ketons, nevis aldehīds (oglekļa atoms ketonu grupā vairs nevar fiziski veidot saiti ar hidroksilgrupu):

Ketoni, terciārie spirti Un karbonskābes vairs nav oksidēts

Oksidācijas process notiek pakāpeniski – kamēr ir kur oksidēties un tam ir visi apstākļi – reakcija turpinās. Viss beidzas ar produktu, kas noteiktos apstākļos neoksidējas: terciārais spirts, ketons vai skābe.
Ir vērts atzīmēt metanola oksidācijas posmus. Pirmkārt, tas tiek oksidēts līdz atbilstošajam aldehīdam, pēc tam par attiecīgo skābi:

Šī produkta (skudrskābes) iezīme ir tāda, ka ogleklis karboksilgrupā ir saistīts ar ūdeņradi, un, ja paskatās uzmanīgi, jūs varat redzēt, ka tā nav nekas vairāk kā aldehīda grupa:

Un aldehīda grupa, kā mēs noskaidrojām iepriekš, tiek oksidēta tālāk par karboksilgrupu:

Vai atpazināt iegūto vielu? Tā bruto formula ir H 2 CO 3 . Šis ogļskābe, kas sadalās oglekļa dioksīdā un ūdenī:
H 2 CO 3 → H 2 O + CO 2
Tāpēc metanols, skudrskābes aldehīds un skudrskābe(aldehīdu grupas dēļ) tiek oksidēti līdz oglekļa dioksīdam.
viegla oksidēšanās.
Viegla oksidēšanās ir oksidēšana bez spēcīgas karsēšanas neitrālā vai viegli sārmainā vidē (0 ir rakstīts virs reakcijas ° vai 20 °) .
Ir svarīgi atcerēties, ka spirti neoksidējas vieglos apstākļos. Tāpēc, ja tie veidojas, oksidēšanās uz tiem apstājas. Kādas vielas nonāks vieglā oksidācijas reakcijā?
- Kas satur C=C dubultsaiti (Vāgnera reakcija).
Šajā gadījumā π-saite pārtrūkst un "uzsēžas" uz atbrīvotajām saitēm gar hidroksilgrupu. Izrādās, divvērtīgais spirts:

Uzrakstīsim etilēna (etēna) vieglas oksidēšanās reakciju. Pierakstīsim sākotnējās vielas un prognozēsim produktus. Tajā pašā laikā mēs vēl nerakstām H 2 O un KOH: tie var parādīties gan vienādojuma labajā, gan kreisajā pusē. Un mēs nekavējoties nosakām OVR iesaistīto vielu oksidācijas pakāpi:

Izveidosim elektronisko svaru (ar to domājam, ka reducētājā ir divi vai divi oglekļa atomi, tie tiek oksidēti atsevišķi):

Nosakām koeficientus:

Beigās pievienojiet trūkstošos produktus (H 2 O un KOH). Labajā pusē nav pietiekami daudz kālija - tas nozīmē, ka sārms būs labajā pusē. Mēs liekam priekšā koeficientu. Kreisajā pusē nav pietiekami daudz ūdeņraža, tāpēc kreisajā pusē ir ūdens. Mēs ievietojam koeficientu priekšā:

Darīsim to pašu ar propilēnu (propēnu):


Cikloalkēns bieži tiek paslīdēts. Ļaujiet viņam jūs nemulsināt. Tas ir parasts ogļūdeņradis ar dubultsaiti:

Lai kur būtu šī dubultā saite, oksidēšana notiks tādā pašā veidā:

- satur aldehīda grupu.
Aldehīda grupa ir reaktīvāka (vieglāk reaģē) nekā spirta grupa. Tāpēc aldehīds oksidēsies. Pirms skābes:

Apsveriet acetaldehīda (etanāla) piemēru. Pierakstīsim reaģentus un produktus un sakārtosim oksidācijas stāvokļus. Izveidosim līdzsvaru un liksim koeficientus reducētāja un oksidētāja priekšā:

Neitrālā vidē un nedaudz sārmainā reakcijas gaita būs nedaudz atšķirīga.
Neitrālā vidē, kā mēs atceramies, vienādojuma kreisajā pusē rakstām ūdeni, bet vienādojuma labajā pusē (veidojas reakcijas laikā) sārmu:

Šajā gadījumā tajā pašā maisījumā tuvumā atrodas skābe un sārmi. Notiek neitralizācija.

Tie nevar pastāvēt blakus un reaģēt, veidojas sāls:
Turklāt, ja aplūkosim vienādojuma koeficientus, mēs sapratīsim, ka skābes ir 3 moli, bet sārmi ir 2 moli. 2 moli sārmu var neitralizēt tikai 2 molus skābes (veidojas 2 moli sāls). Un paliek viens mols skābes. Tātad galīgais vienādojums būs:

Viegli sārmainā vidē sārmi ir pārāk daudz - to pievieno pirms reakcijas, tāpēc visa skābe tiek neitralizēta:

Līdzīga situācija rodas arī metanāla oksidēšanā. Kā mēs atceramies, tas tiek oksidēts līdz oglekļa dioksīdam:

Jāpatur prātā, ka oglekļa monoksīds (IV) CO 2 ir skābs. Un reaģēs ar sārmu. Un tā kā ogļskābe ir divbāziska, var veidoties gan skābes sāls, gan vidējais sāls. Tas ir atkarīgs no sārmu un oglekļa dioksīda attiecības:
Ja sārms ir saistīts ar oglekļa dioksīdu kā 2:1, tad būs vidējais sāls:
Vai arī sārmu var būt ievērojami vairāk (vairāk nekā divas reizes). Ja tas ir vairāk nekā divas reizes, tad atlikušais sārms paliks:
3KOH + CO 2 → K 2 CO 3 + H 2 O + KOH
Tas notiks sārmainā vidē (kur ir sārmu pārpalikums, jo tas tika pievienots reakcijas maisījumam pirms reakcijas) vai neitrālā vidē, kad veidojas daudz sārmu.
Bet, ja sārms ir saistīts ar oglekļa dioksīdu kā 1:1, tad būs skābes sāls:
KOH + CO 2 → KHCO 3
Ja oglekļa dioksīda ir vairāk nekā nepieciešams, tas paliek pāri:
KOH + 2CO 2 → KHCO 3 + CO 2
Tas būs neitrālā vidē, ja veidojas maz sārmu.
Mēs pierakstām izejvielas, produktus, sastādām bilanci, noliekam oksidētāja, reducētāja un no tiem veidošanās produktu priekšā oksidācijas pakāpi:

Neitrālā vidē labajā pusē veidosies sārms (4KOH):

Tagad mums ir jāsaprot, kas veidosies, kad mijiedarbojas trīs moli CO 2 un četri moli sārmu.
3CO 2 + 4KOH → 3KHCO 3 + KOH
KHCO 3 + KOH → K 2 CO 3 + H 2 O
Tātad tas izrādās šādi:
3CO 2 + 4KOH → 2KHCO 3 + K 2 CO 3 + H 2 O
Tāpēc vienādojuma labajā pusē mēs ierakstām divus molus hidrokarbonāta un vienu molu karbonāta:

Un nedaudz sārmainā vidē šādu problēmu nav: sārmu pārpalikuma dēļ veidojas vidējais sāls:

Tas pats notiks ar skābeņskābes aldehīda oksidēšanu:

Tāpat kā iepriekšējā piemērā, veidojas divvērtīgā skābe, un saskaņā ar vienādojumu ir jāiegūst 4 moli sārmu (jo 4 moli permanganāta).
Neitrālā vidē atkal ar visu sārmu nepietiek, lai pilnībā neitralizētu visu skābi.
Trīs moli sārmu veido skābes sāli, paliek viens mols sārmu:
3HOOC–COOH + 4KOH → 3KOOC–COOH + KOH
Un šis viens mols sārmu nonāk mijiedarbībā ar vienu molu skābes sāls:
KOOC–COOH + KOH → KOOC–COOK + H2O
Tas izrādās šādi:
3HOOC–COOH + 4KOH → 2KOOC–COOH + KOOC–COOK + H2O
Galīgais vienādojums:

Vāji sārmainā vidē sārmu pārpalikuma dēļ veidojas vidējais sāls:

- kas satur trīskāršo saitiC≡ C.
Atcerieties, kas notika divkāršo saišu savienojumu vieglas oksidēšanas laikā? Ja neatceraties, ritiniet atpakaļ - atcerieties.
π-saite pārtrūkst, pievienojas oglekļa atomiem pie hidroksilgrupas. Šeit tas pats princips. Vienkārši atcerieties, ka trīskāršā saitē ir divas pi saites. Pirmkārt, tas notiek pie pirmās π-saites:
Tad uz citu π-saiti:

Struktūra, kurā vienam oglekļa atomam ir divas hidroksilgrupas, ir ārkārtīgi nestabila. Ja ķīmijā kaut kas ir nestabils, tas mēdz no kaut kā “nokrist”. Ūdens nokrīt šādi:

Tā rezultātā veidojas karbonilgrupa.
Apsveriet piemērus:
Etīns (acetilēns). Apsveriet šīs vielas oksidācijas posmus:

Ūdens sadalīšana:




Tāpat kā iepriekšējā piemērā, vienā reakcijas maisījumā skābe un sārms. Notiek neitralizācija – veidojas sāls. Kā redzams no koeficienta sārmu permanganāta priekšā, būs 8 moli, tas ir, tas ir pilnīgi pietiekami, lai neitralizētu skābi. Galīgais vienādojums:

Apsveriet butīna-2 oksidāciju:

Ūdens sadalīšana:

Šeit neveidojas skābe, tāpēc nevajag muļļāties ar neitralizāciju.
Reakcijas vienādojums:

Šīs atšķirības (starp oglekļa oksidāciju ķēdes malā un vidū) skaidri parāda pentīna piemērs:

Ūdens sadalīšana:

Izrādās interesantas struktūras viela:

Aldehīda grupa turpina oksidēties:
Pierakstīsim izejvielas, produktus, noteiksim oksidācijas pakāpi, sastādīsim bilanci, noliksim oksidētāja un reducētāja priekšā koeficientus:

Sārmiem vajadzētu veidot 2 molus (jo koeficients permanganāta priekšā ir 2), tāpēc visa skābe tiek neitralizēta:

Cieta oksidēšana.
Cietā oksidēšana ir oksidēšana skābs, stipri sārmains vidi. Un arī iekšā neitrāls (vai nedaudz sārmains), bet sildot.
Skābā vidē tās dažkārt arī karsē. Bet, lai cietā oksidēšana nenotiktu skābā vidē, priekšnoteikums ir karsēšana.
Kādas vielas tiks pakļautas spēcīgai oksidācijai? (Vispirms mēs analizēsim tikai skābā vidē - un pēc tam pievienosim nianses, kas rodas oksidācijas laikā stipri sārmainā un neitrālā vai nedaudz sārmainā (karsētā) vidē).
Ar cieto oksidēšanu process notiek maksimāli. Kamēr ir ko oksidēt, oksidēšanās turpinās.
- Alkoholi. Aldehīdi.
Apsveriet etanola oksidēšanu. Pakāpeniski tas oksidējas par skābi:

Mēs pierakstām vienādojumu. Mēs pierakstām izejvielas, OVR produktus, noliekam oksidācijas pakāpes, sastādam bilanci. Izlīdziniet reakciju:

Ja reakcija tiek veikta aldehīda viršanas temperatūrā, kad tas veidojas, tas iztvaiko (aizlidos) no reakcijas maisījuma bez laika tālākai oksidēšanai. To pašu efektu var panākt ļoti maigos apstākļos (zemā siltumā). Šajā gadījumā mēs rakstām aldehīdu kā produktu:

Apsveriet sekundārā spirta oksidēšanu, izmantojot propanola-2 piemēru. Kā jau minēts, oksidēšana beidzas otrajā posmā (karbonilsavienojuma veidošanās). Tā kā veidojas ketons, kas nav oksidēts. Reakcijas vienādojums:

Apsveriet aldehīdu oksidēšanu etanāla izteiksmē. Tas arī oksidējas par skābi:

Reakcijas vienādojums:

Metanols un metanols, kā minēts iepriekš, tiek oksidēti līdz oglekļa dioksīdam:

Metāls:

- Satur vairākas saites.
Šajā gadījumā ķēde pārtrūkst gar daudzkārtējo saiti. Un atomi, kas to veidoja, tiek oksidēti (iegūst saiti ar skābekli). Oksidējiet pēc iespējas vairāk.
Pārraujot dubultsaiti, no fragmentiem veidojas karbonilsavienojumi (shēmā zemāk: no viena fragmenta - aldehīds, no otra - ketons)

![]()
Analizēsim pentēna-2 oksidāciju:

"Lūžņu" oksidēšana:

Izrādās, ka veidojas divas skābes. Pierakstiet izejmateriālus un produktus. Noteiksim atomu oksidācijas pakāpi, kas to maina, sastādīsim līdzsvaru, izlīdzināsim reakciju: 
Sastādot elektronisko svaru, mēs domājam, ka reducētājā ir divi vai divi oglekļa atomi, tie tiek oksidēti atsevišķi:

Skābe ne vienmēr veidosies. Apsveriet, piemēram, 2-metilbutēna oksidēšanu:

Reakcijas vienādojums:

Absolūti tas pats princips savienojumu ar trīskāršo saiti oksidēšanā (tikai oksidēšanās notiek uzreiz, veidojoties skābei, bez starpposma aldehīda veidošanās):

Reakcijas vienādojums:

Ja daudzkārtēja saite atrodas tieši vidū, tad tiek iegūti nevis divi produkti, bet viens. Tā kā "lūžņi" ir vienādi un tiek oksidēti līdz tiem pašiem produktiem:

Reakcijas vienādojums:

- Dubultā koronaskābe.
Ir viena skābe, kurā karboksilgrupas (kroņi) ir savienotas viena ar otru:
Šī ir skābeņskābe. Divas kronas blakus ir grūti iztikt. Tas noteikti ir stabils normālos apstākļos. Bet, ņemot vērā to, ka tajā ir divas viena ar otru savienotas karboksilgrupas, tas ir mazāk stabils nekā citas karbonskābes.
Un tāpēc īpaši skarbos apstākļos tas var oksidēties. Saiknē starp "divām kronām" ir pārtraukums:

Reakcijas vienādojums:

- Benzola homologi (un to atvasinājumi).
Pats benzols neoksidējas, jo aromātiskums padara šo struktūru ļoti stabilu. 
Bet tā homologi ir oksidēti. Šajā gadījumā arī ķēde pārtrūkst, galvenais ir zināt, kur tieši. Ir spēkā daži principi:
- Pats benzola gredzens netiek iznīcināts un paliek neskarts līdz beigām, saite tiek pārrauta radikālā.
- Atoms, kas tieši saistīts ar benzola gredzenu, tiek oksidēts. Ja pēc tam turpināsies oglekļa ķēde radikālā, tad sprauga būs pēc tās.


Analizēsim metilbenzola oksidēšanos. Tur viens oglekļa atoms radikālā tiek oksidēts: 
Reakcijas vienādojums:

Analizēsim izobutilbenzola oksidēšanos:

Reakcijas vienādojums:

Analizēsim sek-butilbenzola oksidāciju:

Reakcijas vienādojums:

Oksidējot benzola homologus (un homologu atvasinājumus) ar vairākiem radikāļiem, veidojas divas-trīs un vairāk bāzes aromātiskās skābes. Piemēram, 1,2-dimetilbenzola oksidēšana:

Tādā pašā veidā tiek oksidēti benzola homologu atvasinājumi (kuru benzola gredzenā ir radikāļi, kas nav ogļūdeņraži). Cita funkcionālā grupa uz benzola gredzena netraucē:


Starpsumma. Algoritms "kā pierakstīt cietās oksidācijas reakciju ar permanganātu skābā vidē":
- Pierakstiet izejvielas (organiskās vielas + KMnO 4 + H 2 SO 4).
- Pierakstiet organiskās oksidācijas produktus (tiks oksidēti savienojumi, kas satur spirtu, aldehīdu grupas, daudzkārtējās saites, kā arī benzola homologus).
- Reģistrē permanganāta reducēšanas produktu (MnSO 4 + K 2 SO 4 + H 2 O).
- Nosakiet OVR dalībnieku oksidācijas pakāpi. Sastādiet bilanci. Nosakiet koeficientus oksidētājam un reducētājam, kā arī vielām, kas no tiem veidojas.
- Pēc tam ieteicams aprēķināt, cik sulfātu anjonu ir vienādojuma labajā pusē, saskaņā ar to kreisajā pusē novietojiet koeficientu sērskābes priekšā.
- Beigās ielieciet koeficientu ūdens priekšā.
Spēcīga oksidēšanās stipri sārmainā vidē un neitrālā vai nedaudz sārmainā vidē (karsējot)..
Šīs reakcijas ir daudz retāk sastopamas. Var teikt, ka šādas reakcijas ir eksotiskas. Un, kā jau pienākas jebkurām eksotiskām reakcijām, šīs bija vispretrunīgākās.
Cietā oksidēšanās ir smaga arī Āfrikā, tāpēc organiskās vielas oksidējas tāpat kā skābā vidē.
Atsevišķi mēs neanalizēsim reakcijas katrai klasei, jo vispārējais princips jau tika minēts iepriekš. Mēs analizēsim tikai nianses.
Stipri sārmaina vide :
Spēcīgi sārmainā vidē permanganāts tiek samazināts līdz oksidācijas pakāpei +6 (kālija manganāts):
KMnO 4 + KOH → K 2 MnO 4.
Stipri sārmainā vidē vienmēr ir sārmu pārpalikums, tāpēc notiks pilnīga neitralizācija: ja veidojas oglekļa dioksīds, būs karbonāts, ja veidojas skābe, tad būs sāls (ja skābe ir daudzbāzu – vidējais sāls).
Piemēram, propēna oksidēšana:

Etilbenzola oksidēšana:

Sildot nedaudz sārmains vai neitrāls :
Arī šeit vienmēr ir jāņem vērā neitralizācijas iespēja.
Ja oksidēšanās notiek neitrālā vidē un veidojas skābs savienojums (skābe vai oglekļa dioksīds), tad iegūtais sārms neitralizēs šo skābo savienojumu. Bet ne vienmēr pietiek ar sārmu, lai pilnībā neitralizētu skābi.
Ja, piemēram, tiek oksidēti aldehīdi, ar to nepietiek (oksidēšana notiks tāpat kā vieglos apstākļos - temperatūra vienkārši paātrinās reakciju). Tāpēc veidojas gan sāls, gan skābe (rupji sakot, paliek pāri).
Mēs to apspriedām, kad mēs apspriedām vieglu aldehīdu oksidāciju.
Tāpēc, ja jums ir skābe neitrālā vidē, jums rūpīgi jāpārbauda, vai ar to pietiek, lai neitralizētu visu skābi. Īpaša uzmanība jāpievērš daudzbāzisko skābju neitralizācijai.
Vāji sārmainā vidē pietiekama daudzuma sārmu dēļ veidojas tikai vidēji sāļi, jo ir sārmu pārpalikums.
Parasti pietiek ar sārmu oksidācijas laikā neitrālā vidē. Un reakcijas vienādojums, ka neitrālā vidē, kas nedaudz sārmainā vidē, būs vienāds.
Piemēram, apsveriet etilbenzola oksidēšanu:


Ar sārmu pietiek, lai pilnībā neitralizētu iegūtos skābes savienojumus, saglabāsies pat pārpalikums:

Tiek patērēti 3 moli sārmu - 1 paliek.
Galīgais vienādojums:

Šī reakcija neitrālā un nedaudz sārmainā vidē noritēs tādā pašā veidā (viegli sārmainā vidē nav sārmu kreisajā pusē, bet tas nenozīmē, ka tā neeksistē, tā vienkārši neiestājas reakcijā).
Redoksreakcijas, kas saistītas ar kālija dihromātu (bihromātu).
Bihromātam eksāmenā nav tik daudz dažādu organisko oksidācijas reakciju.
Oksidēšanu ar dihromātu parasti veic tikai skābā vidē. Tajā pašā laikā hroms tiek atjaunots līdz +3. Atveseļošanās produkti:
Oksidācija būs smaga. Reakcija būs ļoti līdzīga permanganāta oksidēšanai. Oksidēsies tās pašas vielas, kuras skābā vidē oksidē permanganāts, veidosies tie paši produkti.
Apskatīsim dažas reakcijas.
Apsveriet alkohola oksidēšanos. Ja oksidēšanu veic aldehīda viršanas temperatūrā, tad tas atstās reakcijas maisījumu, neoksidējoties:

Pretējā gadījumā spirtu var tieši oksidēt par skābi.
Iepriekšējā reakcijā iegūto aldehīdu var "saķert" un padarīt to oksidētu skābē:

Cikloheksanola oksidēšana. Cikloheksanols ir sekundārs spirts, tāpēc veidojas ketons:

Ja ir grūti noteikt oglekļa atomu oksidācijas pakāpi, izmantojot šo formulu, uz melnraksta varat rakstīt:

Reakcijas vienādojums:

Apsveriet ciklopentēna oksidēšanos.
Divkāršā saite pārtrūkst (cikls atveras), to veidojošie atomi tiek maksimāli oksidēti (šajā gadījumā līdz karboksilgrupai):


Dažas LIETOŠANAS oksidācijas pazīmes, kurām mēs pilnībā nepiekrītam.
Mēs uzskatām, ka tie "noteikumi", principi un reakcijas, kas tiks apspriesti šajā sadaļā, nav pilnīgi pareizi. Tie ir pretrunā ne tikai ar patieso lietu stāvokli (ķīmija kā zinātne), bet arī ar iekšējo loģiku skolas mācību programma un jo īpaši LIETOŠANA.
Bet, neskatoties uz to, mēs esam spiesti sniegt šo materiālu tādā formā, kādā to pieprasa USE.
Mēs runājam par CIETU oksidāciju.
Atcerieties, kā skarbos apstākļos oksidējas benzola homologi un to atvasinājumi? Visi radikāļi tiek izbeigti – veidojas karboksilgrupas. Lūžņi tiek oksidēti jau "neatkarīgi":

Tātad, ja pēkšņi uz radikāļa parādās hidroksilgrupa vai daudzkārtēja saite, jums ir jāaizmirst, ka tur ir benzola gredzens. Reakcija notiks TIKAI pa šo funkcionālo grupu (vai daudzkārtēju saiti).
Funkcionālā grupa un daudzkārtējā saite ir svarīgākas par benzola gredzenu.

Analizēsim katras vielas oksidēšanos:
Pirmā viela:

Nepieciešams nepievērst uzmanību tam, ka ir benzola gredzens. No eksāmena viedokļa tas ir tikai sekundārs alkohols. Sekundārie spirti tiek oksidēti par ketoniem, un ketoni tālāk netiek oksidēti:

Ļaujiet šo vielu oksidēt ar dihromātu:

Otrā viela:

Šī viela tiek oksidēta, tāpat kā savienojums ar dubultsaiti (benzola gredzenam mēs nepievēršam uzmanību):

Karsējot ļaujiet tai oksidēties neitrālā permanganātā:

Ar iegūto sārmu pietiek, lai pilnībā neitralizētu oglekļa dioksīdu:
2KOH + CO 2 → K 2 CO 3 + H 2 O
Galīgais vienādojums:

Trešās vielas oksidēšana:

Ļaujiet oksidēt ar kālija permanganātu skābā vidē:

Ceturtās vielas oksidēšana:

Ļaujiet tai oksidēties stipri sārmainā vidē. Reakcijas vienādojums būs šāds:

Visbeidzot, vinilbenzols tiek oksidēts šādi:

Un tas oksidējas līdz benzoskābei, jāņem vērā, ka saskaņā ar Vienotās valsts pārbaudes loģiku tā oksidējas ne tāpēc, ka ir benzola atvasinājums. Jo tas satur dubultsaiti.
Secinājums.
Tas ir viss, kas jums jāzina par redoksreakcijām, kurās organiskajās vielās tiek iesaistīts permanganāts un dihromāts.
Nebrīnieties, ja dažus šajā rakstā izklāstītos punktus dzirdat pirmo reizi. Kā jau minēts, šī tēma ir ļoti plaša un pretrunīga. Un, neskatoties uz to, nez kāpēc tam tiek pievērsta ļoti maza uzmanība.
Kā jūs, iespējams, redzējāt, divas vai trīs reakcijas neizskaidro visus šo reakciju modeļus. Šeit jums ir nepieciešama integrēta pieeja un detalizēts visu punktu skaidrojums. Diemžēl mācību grāmatās un interneta resursos tēma nav pilnībā izpausta vai netiek izpausta vispār.
Es mēģināju novērst šos trūkumus un trūkumus un izskatīt šo tēmu kopumā, nevis daļēji. Ceru, ka man izdevās.
Paldies par uzmanību, visu to labāko jums! Panākumi attīstībā ķīmijas zinātne un eksāmenu nokārtošanu!
Kā jau minēts, organisko vielu oksidēšana ir skābekļa ievadīšana tās sastāvā un (vai) ūdeņraža izvadīšana. Atgūšana ir apgriezts process (ūdeņraža ievadīšana un skābekļa izvadīšana). Ņemot vērā alkānu sastāvu (СnH2n+2), varam secināt, ka tie nespēj piedalīties reducēšanās reakcijās, bet var piedalīties oksidēšanās reakcijās.
Alkāni ir savienojumi ar zemu oglekļa oksidācijas pakāpi, un atkarībā no reakcijas apstākļiem tos var oksidēt, veidojot dažādus savienojumus.
Parastā temperatūrā alkāni nereaģē pat ar spēcīgiem oksidētājiem (H2Cr2O7, KMnO4 utt.). Ievadot atklātā liesmā, alkāni sadedzina. Tajā pašā laikā skābekļa pārpalikumā tie pilnībā oksidējas līdz CO2, kur ir ogleklis augstākā pakāpe oksidācija +4, un ūdens. Ogļūdeņražu sadegšana noved pie visu plīsumu C-C savienojumi un C-H, un to pavada liela siltuma daudzuma izdalīšanās (eksotermiska reakcija).
Ir vispārpieņemts, ka alkānu oksidēšanās mehānisms ietver radikāļu ķēdes procesu, jo skābeklis pats par sevi nav īpaši reaktīvs, lai no alkāna atdalītu ūdeņraža atomu, ir nepieciešama daļiņa, kas ierosinās alkilradikāļa veidošanos. reaģē ar skābekli, veidojot peroksīda radikāli. Pēc tam peroksiradikālis var iegūt ūdeņraža atomu no citas alkāna molekulas, veidojot alkilhidroperoksīdu un radikāli.

Ir iespējams oksidēt alkānus ar atmosfēras skābekli 100-150 ° C temperatūrā katalizatora - mangāna acetāta klātbūtnē, šo reakciju izmanto rūpniecībā. Oksidācija notiek, kad gaisa strāva tiek izpūsta caur kausētu parafīnu, kas satur mangāna sāli.
Jo reakcijas rezultātā veidojas skābju maisījums, pēc tam tās tiek atdalītas no nereaģējušā parafīna, izšķīdinot sārmu ūdenī, un pēc tam neitralizē ar minerālskābi.
Tieši rūpniecībā šo metodi izmanto etiķskābes iegūšanai no n-butāna:
Alkēnu oksidēšana
Alkēnu oksidācijas reakcijas iedala divās grupās: 1) reakcijas, kurās saglabājas oglekļa karkass, 2) molekulas oglekļa karkasa pa dubultsaiti oksidatīvās iznīcināšanas reakcijas.
Alkēnu oksidācijas reakcijas ar oglekļa skeleta saglabāšanu
1. Epoksidācija (Priļežajeva reakcija)
Acikliskie un cikliskie alkēni, mijiedarbojoties ar perskābēm nepolārā vidē, veido epoksīdus (oksirānus).
Arī oksirānus var iegūt, oksidējot alkēnus ar hidroperoksīdiem molibdēnu, volframu, vanādiju saturošu katalizatoru klātbūtnē:

Vienkāršākais oksirāns, etilēnoksīds, tiek ražots rūpnieciski, oksidējot etilēnu ar skābekli sudraba vai sudraba oksīda kā katalizatora klātbūtnē.

2. antihidroksilēšana (epoksīdu hidrolīze)
Skābā (vai sārmainā) epoksīdu hidrolīze noved pie oksīdu cikla atvēršanas, veidojot transdiolus.

Pirmajā posmā epoksīda skābekļa atoma protonēšana notiek, veidojoties cikliskam oksonija katjonam, kas atveras ūdens molekulas nukleofīlā uzbrukuma rezultātā.
Bāzes katalizēta epoksīda gredzena atvēršana arī izraisa trans-glikolu veidošanos.

3. sin-hidroksilēšana
Viena no vecākajām metodēm alkēnu oksidēšanai ir Vāgnera reakcija (oksidēšana ar kālija permanganātu). Sākotnēji oksidācijas laikā veidojas ciklisks permanganāta esteris, kas tiek hidrolizēts par vicinālo diolu:

Papildus Vāgnera reakcijai ir vēl viena metode alkēnu sin-hidroksilēšanai osmija (VIII) oksīda iedarbībā, ko ierosināja Krige. Osmija tetroksīda iedarbībā uz alkēnu ēterī vai dioksānā veidojas melnas osmīnskābes cikliskā estera nogulsnes - osmāts. Tomēr OsO4 pievienošana daudzkārtējai saitei ir ievērojami paātrināta piridīnā. Iegūtās melnās osmāta nogulsnes viegli sadalās, iedarbojoties ar nātrija hidrosulfīta ūdens šķīdumu:

Kālija permanganāts vai osmija (VIII) oksīds oksidē alkēnu par cis-1,2-diolu.
Alkēnu oksidatīvā šķelšanās
Alkēnu oksidatīvā šķelšanās ietver to mijiedarbības reakcijas ar kālija permanganātu sārmainā vai sērskābē, kā arī oksidēšanu ar hroma trioksīda šķīdumu etiķskābē vai kālija dihromātu un sērskābi. Šādu pārvērtību galarezultāts ir oglekļa skeleta sadalīšanās dubultās saites vietā un karbonskābju vai ketonu veidošanās.
Monoaizvietoti alkēni ar gala dubultsaiti tiek atdalīti līdz karbonskābei un oglekļa dioksīdam:

Ja abi oglekļa atomi dubultsaitē satur tikai vienu alkilgrupu, tad veidojas karbonskābju maisījums:

Bet, ja alkēns, kas tetraaizvietots ar dubultsaiti, ir ketons:

Alkēnu ozonolīzes reakcija ir ieguvusi daudz lielāku preparatīvo nozīmi. Daudzus gadu desmitus šī reakcija kalpoja kā galvenā metode sākuma alkēna struktūras noteikšanai. Šo reakciju veic, izlaižot ozona šķīduma skābeklī, alkēna šķīduma metilēnhlorīda vai etilacetāta strāvu -80 ... -100 ° C temperatūrā. Šīs reakcijas mehānismu noteica Krige:


Ozonīdi ir nestabili savienojumi, kas sadalās sprādzienā. Ir divi ozonīdu sadalīšanās veidi - oksidatīvā un reducējošā.
Hidrolīzes laikā ozonīdi tiek sadalīti karbonilsavienojumos un ūdeņraža peroksīdā. Ūdeņraža peroksīds oksidē aldehīdus par karbonskābēm - tā ir oksidatīvā sadalīšanās:

Daudz svarīgāka ir ozonīdu reducējošā sadalīšana. Ozonolīzes produkti ir aldehīdi vai ketoni atkarībā no sākuma alkēna struktūras:
Papildus iepriekšminētajām metodēm ir vēl viena metode, ko 1955. gadā ierosināja Lemjē:
Lemjē metodē mangāna dioksīda atdalīšanai nav laikietilpīgu procedūru, jo dioksīds un manganāts atkal tiek oksidēti ar perjodātu par permanganāta jonu. Tas ļauj izmantot tikai katalītisku kālija permanganāta daudzumu.
4.5. Alkēnu oksidēšana
Alkēna oksidācijas reakcijas ieteicams iedalīt divās lielās grupās: reakcijas, kurās tiek saglabāts oglekļa karkass, un molekulas oglekļa skeleta oksidatīvās iznīcināšanas reakcijas gar dubultsaiti. Pirmajā reakciju grupā ietilpst epoksidēšana, kā arī hidroksilēšana, kas izraisa vicinālo diolu (glikolu) veidošanos. Ciklisko alkēnu gadījumā hidroksilēšana veido vicinālu transs- vai cis-dioli. Citā grupā ietilpst ozonolīze un alkēnu pilnīgas oksidācijas reakcijas, kas izraisa dažādu karbonilsavienojumu un karbonskābju veidošanos.
4.5.a. Alkēnu oksidācijas reakcijas ar oglekļa skeleta saglabāšanu
1. Epoksidēšana (N.A. Priļežajeva reakcija, 1909)
Acikliskie un cikliskie alkēni, mijiedarbojoties ar perskābēm (perskābēm) RCOOOH nepolārā, vienaldzīgā vidē, veido epoksīdus (oksirānus), tāpēc pašu reakciju sauc par epoksidācijas reakciju.
Saskaņā ar mūsdienu nomenklatūru IUPAC- trīs locekļu gredzenu ar vienu skābekļa atomu sauc par oksirānu.
Alkēnu epoksidēšana jāuzskata par sinhronu, koordinētu procesu, kurā nav iesaistīti jonu starpprodukti, piemēram, OH+ hidroksilkatjons. Citiem vārdiem sakot, alkēnu epoksidēšana ir process sin- viena skābekļa atoma pievienošana dubultai saitei, pilnībā saglabājot aizvietotāju konfigurāciju pie dubultās saites.

Epoksidēšanai ir ierosināts mehānisms, kas raksturīgs saskaņotiem procesiem.

Tā kā perskābes skābekļa atoma dubultsaites uzbrukums ir vienlīdz iespējams abās dubultās saites plaknes pusēs, iegūtie oksirāni ir vai nu mezo-enantiomēru formas vai maisījumi. Kā epoksidētājus izmanto šādas perskābes: perbenzoskābi, m-hlorperbenzoskābe, monoperftalskābe, peretiķskābe, trifluoroperetiķskābe un permetiķskābe. Aromātiskās perskābes tiek izmantotas kā atsevišķi reaģenti, savukārt alifātiskās perskābes - CH 3 CO 3 H, CF 3 CO 3 H un HCO 3 H netiek izolētas atsevišķi, bet tiek izmantotas pēc to veidošanās 30% vai 90% ūdeņraža peroksīda mijiedarbībā un atbilstošā karbonskābe. Perbenzoiskā un m-hlorperbenzoskābi iegūst, oksidējot benzoskābi un m-hlorbenzoskābe ar 70% ūdeņraža peroksīdu metānsulfonskābes šķīdumā vai no šo skābju skābju hlorīdiem un ūdeņraža peroksīda.


Monoperftalskābi iegūst ar līdzīgu metodi no ftalskābes anhidrīda un 30% ūdeņraža peroksīda.

Sākotnēji oksirānu (epoksīdu) iegūšanai izmantoja perbenzoskābes vai monoperftalskābes:

Pašlaik visbiežāk tiek izmantota epoksidēšana m-hlorperbenzoskābe. Atšķirībā no citām perskābēm, tas ir stabils ilgu laiku (līdz 1 gadam) uzglabājot un ir absolūti drošs lietošanai. Oksirānu raža, kas iegūta, oksidējot acikliskos un cikliskos alkēnus m-hlorperbenzoskābes metilēnhlorīda, hloroforma vai dioksāna šķīdumā parasti ir diezgan augsts.



Perskābes bieži rodas tieši no 90% ūdeņraža peroksīda un karbonskābes reakcijas maisījuma metilēnhlorīdā.


Alkēni ar dubultsaiti, kas konjugēti ar karbonilgrupu vai citu akceptora aizvietotāju, ir neaktīvi un to oksidēšanai labāk izmantot spēcīgākus oksidētājus, piemēram, trifluoroperetiķskābi, kas iegūta no trifluoretiķskābes anhidrīda un 90% ūdeņraža peroksīda metilēnhlorīda sastāvā. Vienkāršākais oksirāns, etilēnoksīds, tiek ražots rūpnieciski, oksidējot etilēnu ar skābekli sudraba kā katalizatora klātbūtnē.

2. anti- Hidroksilēšana
Trīs locekļu oksirānu gredzens ir viegli atverams dažādu nukleofīlo reaģentu ietekmē. Šīs reakcijas tiks detalizēti apskatītas sadaļā par acikliskajiem un cikliskajiem ēteriem. Šeit tiks ņemta vērā tikai oksirānu hidrolīze. Oksirānu hidrolīzi katalizē gan skābes, gan bāzes. Abos gadījumos veidojas vicinālie dioli, t.i., glikoli. Skābās katalīzes laikā pirmajā posmā notiek oksirāna skābekļa atoma protonēšana, veidojoties cikliskam oksonija katjonam, kas atveras ūdens molekulas nukleofīlā uzbrukuma rezultātā:

Gredzena atvēršanas galvenais solis, kas nosaka visa procesa ātrumu, ir ūdens nukleofīlais uzbrukums oksirāna protonētajai formai. No mehānisma viedokļa šis process ir līdzīgs bromonija jona atvēršanai bromīda jona vai cita nukleofīlā aģenta nukleofīlā uzbrukuma laikā. No šīm pozīcijām stereoķīmiskajam rezultātam jābūt veidojumam transs-glikoli ciklisko epoksīdu šķelšanā. Patiešām, cikloheksēna oksīda vai ciklopentēna oksīda skābes katalizētās hidrolīzes laikā tikai transs-1,2-dioli.

Tādējādi divu posmu alkēna epoksidēšanas process, kam seko epoksīda skābes hidrolīze, kopumā atbilst reakcijai anti-alkēnu hidroksilēšana.
Abi posmi anti-alkēnu hidroksilēšanu var kombinēt, ja alkēnu apstrādā ar ūdeņraža peroksīda 30-70% ūdens šķīdumu skudrskābē vai trifluoretiķskābē. Abas šīs skābes ir pietiekami spēcīgas, lai atvērtu oksirāna gredzenu.

Oksirāna gredzena atvēršanās, ko katalizē bāze, arī izraisa ciklisku veidošanos. transs-glikoli.

Tāpēc divu posmu alkēnu epoksidēšanas process, kam seko epoksīdu sārmaina hidrolīze, arī ir reakcija anti-alkēnu hidroksilēšana.
3. sin- Hidroksilēšana
Daži pārejas metālu sāļi un oksīdi augstākās oksidācijas pakāpēs ir efektīvi reaģenti. sin-alkēna dubultsaites hidroksilēšana, kad abas hidroksilgrupas ir pievienotas tai pašai dubultsaites pusei. Alkēnu oksidēšana ar kālija permanganātu ir viena no vecākajām metodēm sin-divkāršo saišu hidroksilēšana - joprojām tiek plaši izmantota, neskatoties uz tai raksturīgajiem ierobežojumiem. cis-1,2-cikloheksāndiolu pirmo reizi ieguva V.V. Markovņikovs 1878. gadā, hidroksilējot cikloheksēnu ar kālija permanganāta ūdens šķīdumu 0 0 C temperatūrā.

Šī metode tika tālāk attīstīta krievu zinātnieka E.E. Tāpēc Vāgners sin-alkēnu hidroksilēšanu kālija permanganāta ūdens šķīduma ietekmē sauc par Vāgnera reakciju. Kālija permanganāts ir spēcīgs oksidētājs, kas var ne tikai hidroksilēt dubultsaiti, bet arī atšķelt iegūto vicinālo diolu. Lai pēc iespējas izvairītos no turpmākas glikolu sadalīšanās, rūpīgi jākontrolē reakcijas apstākļi. Glikola iznākums parasti ir zems (30-60%). Vislabākos rezultātus iegūst, hidroksilējot alkēnus vāji sārmainā vidē (рН~8 9) pie 0-5 0 С ar atšķaidītu 1% KMnO 4 ūdens šķīdumu.


Sākotnēji, alkēnus oksidējot ar kālija permanganātu, veidojas ciklisks permangānskābes esteris, kas uzreiz tiek hidrolizēts par vicinālo diolu.

Permangānskābes cikliskais esteris netika izolēts kā starpprodukts, bet tā veidošanās izriet no eksperimentiem ar iezīmēto 18 O kālija permanganātu: abi skābekļa atomi glikolā ir iezīmējušies, oksidējot alkēnu KMn 18 O 4 . Tas nozīmē, ka abi skābekļa atomi tiek pārnesti no oksidētāja, nevis no šķīdinātāja - ūdens, kas labi saskan ar piedāvāto mehānismu.
Vēl viena metode sin-alkēnu hidroksilēšanu osmija (VIII) oksīda OsO 4 iedarbībā ierosināja R. Krige 1936. gadā. Osmija tetroksīds ir bezkrāsaina, gaistoša, kristāliska viela, kas viegli šķīst ēterī, dioksānā, piridīnā un citos organiskos šķīdinātājos. Osmija tetroksīdam reaģējot ar alkēniem ēterī vai dioksānā, veidojas melnas osmīnskābes cikliskā estera nogulsnes - osmāts, ko var viegli izolēt atsevišķi. OsO 4 pievienošana dubultsaitei piridīna šķīdumā ir ievērojami paātrināta. Osmātu sadalīšanās par vicinālajiem glikoliem tiek panākta, iedarbojoties ar nātrija hidrosulfīta vai sērūdeņraža ūdens šķīdumu.

Produktu izvadi sin-alkēnu hidroksilēšana šajā metodē ir daudz augstāka nekā tad, ja kā oksidētāju izmanto permanganātu. Būtiska Krige metodes priekšrocība ir alkēnu oksidatīvās šķelšanās produktu trūkums, kas raksturīgs permanganāta oksidācijai.


Osmija tetroksīds ir ļoti dārgs un grūti iegūstams reaģents, turklāt tas ir toksisks. Tāpēc osmija (VIII) oksīds tiek izmantots nelielu daudzumu grūti sasniedzamu vielu sintēzē, lai iegūtu augstāko diola iznākumu. Lai vienkāršotu sin-alkēnu hidroksilēšanai OsO 4 iedarbībā tika izstrādāta tehnika, kas ļauj izmantot tikai šī reaģenta katalītiskos daudzumus. Alkēnu hidroksilēšana tiek veikta, izmantojot ūdeņraža peroksīdu OsO 4 klātbūtnē, piemēram:

Lai noslēgtu šo sadaļu, mēs piedāvājam stereoķīmiskās attiecības starp alkēnu cis- vai transs-iegūtā vicinālā diola konfigurācija un konfigurācija, kas var būt cis- vai transs-izomērs, eritro- vai treo- forma, mezo- vai D,L-veidojas atkarībā no alkēna aizvietotājiem:

Līdzīgas stereoķīmiskās attiecības tiek novērotas arī citās reakcijās sin- vai anti- ūdeņraža, ūdeņraža halogenīdu, ūdens, halogēnu, bora hidrīdu un citu reaģentu vairāku saišu pievienošana.
Redoksreakciju vienādojumu sastādīšana ar organiskām vielām
IN saistība ar ievadu kā vienīgo formu galīgā sertifikācija absolventi vidusskola vienota valsts eksāmens(IZMANTOŠANA) un pāreja vidusskola specializētajai izglītībai arvien svarīgāka kļūst vidusskolēnu sagatavošana punktu ziņā “C” daļas “dārgāko” uzdevumu veikšanai. LIETOŠANAS testsķīmijā. Neskatoties uz to, ka pieci “C” daļas uzdevumi tiek uzskatīti par atšķirīgiem: neorganisko vielu ķīmiskās īpašības, organisko savienojumu transformāciju ķēdes, skaitļošanas uzdevumi, tie visi zināmā mērā ir saistīti ar redoksreakcijām (ORR). Ja tiek apgūtas OVR teorijas pamatzināšanas, tad pirmo un otro uzdevumu iespējams pareizi izpildīt pilnībā, bet trešo – daļēji. Mūsuprāt, liela daļa no panākumiem "C" daļas īstenošanā slēpjas tieši tajā. Pieredze rāda, ja, studējot neorganisko ķīmiju, studenti pietiekami labi tiek galā ar OVR vienādojumu rakstīšanas uzdevumiem, tad līdzīgi uzdevumi organiskajā ķīmijā viņiem sagādā lielas grūtības. Tāpēc visa organiskās ķīmijas kursa apguves laikā specializētajās klasēs cenšamies vidusskolēniem attīstīt OVR vienādojumu sastādīšanas prasmes.
Studējot salīdzinošās īpašības neorganisko un organisko savienojumu, mēs iepazīstinām studentus ar oksidācijas pakāpes (s.o.) izmantošanu (organiskajā ķīmijā, galvenokārt ogleklis) un kā to noteikt:
1) vidējā s.d. ogleklis organiskās vielas molekulā;
2) s.d definīcija. katrs oglekļa atoms.
Mēs precizējam, kādos gadījumos labāk izmantot vienu vai otru metodi.
Raksts tika publicēts ar uzņēmuma "GEO-Engineering" atbalstu, kas piedāvā produktus tirgū ar zīmolu "ProfKresla". Uzņēmuma darbības joma ir dažādu zāļu krēslu un krēslu ražošana, tirdzniecība un uzstādīšana. Darbinieku augstā profesionalitāte un mūsu pašu ražotnes ļauj ātri un efektīvi īstenot jebkuras sarežģītības projektus. Visi produkti ar zīmolu "ProfKresla" neatkarīgi no tā, vai tie ir teātra krēsli, sēdvietas uzgaidāmajām telpām vai krēsli izglītības iestādēm, izceļas ar modernu un ergonomisku dizainu, kā arī augstu nodilumizturību, izturību un komfortu. No milzīgā produktu klāsta, kas atrodams vietnes profkresla.ru katalogā, jūs vienmēr varat izvēlēties modeļus, kas vislabāk atbilst jūsu uzņēmumā pieņemtajam korporatīvajam stilam. Ja tomēr ir grūtības ar izvēli, tad uzņēmuma speciālisti vienmēr ir gatavi sniegt padomu, palīdzēt noteikt modeli, un pēc tam sagatavot projektu, veikt visus nepieciešamos mērījumus un uzstādīšanu uz vietas.
P Izpētot tēmu “Alkāni”, mēs parādām, ka oksidēšanās, sadegšanas, halogenēšanas, nitrēšanas, dehidrogenēšanas un sadalīšanās procesi ir redoksprocesi. Rakstot organisko vielu degšanas un sadalīšanās reakciju vienādojumus, labāk izmantot vidējo vērtību s.d. ogleklis. Piemēram:
Mēs pievēršam uzmanību elektroniskā līdzsvara pirmajai pusei: pie oglekļa atoma s.d. saucējs ir 4, tāpēc mēs aprēķinām elektronu pārnesi, izmantojot šo koeficientu.
Citos gadījumos, pētot tēmu “Alkāni”, mēs nosakām s.d. katrs savienojuma oglekļa atoms, vienlaikus pievēršot studentu uzmanību ūdeņraža atomu aizstāšanas secībai primārajos, sekundārajos un terciārajos oglekļa atomos:


Tādējādi mēs novedam studentus pie secinājuma, ka sākumā aizvietošanas process notiek pie terciārajiem, tad sekundārajiem un, visbeidzot, primārajiem oglekļa atomiem.
P Pētot tēmu “Alkēni”, tiek ņemti vērā oksidācijas procesi atkarībā no alkēna struktūras un reakcijas vides.
Kad alkēnus oksidē ar koncentrētu kālija permanganāta KMnO 4 šķīdumu skābā vidē (cieta oksidēšana), - un - saites pārtrūkst, veidojoties karbonskābēm, ketoniem un oglekļa monoksīdam (IV). Šo reakciju izmanto, lai noteiktu dubultās saites pozīciju.
Ja dubultsaite atrodas molekulas galā (piemēram, butēnā-1), tad viens no oksidācijas produktiem ir skudrskābe, kas viegli oksidējas līdz oglekļa dioksīdam un ūdenim:

Uzsveram, ja alkēna molekulā oglekļa atoms pie dubultsaites satur divus oglekļa aizvietotājus (piemēram, 2-metilbutēna-2 molekulā), tad tā oksidēšanās laikā veidojas ketons, jo notiek tāda atoma transformācija. karboksilgrupas atomā nav iespējams nesaraujot C-C saiti, kas ir relatīvi stabila šādos apstākļos:

Noskaidrojam, ka, ja alkēna molekula ir simetriska un molekulas vidū atrodas dubultsaite, tad oksidēšanās laikā veidojas tikai viena skābe:

Mēs ziņojam, ka alkēnu oksidācijas iezīme, kurā oglekļa atomi dubultsaitē satur divus oglekļa radikāļus, ir divu ketonu veidošanās:


Ņemot vērā alkēnu oksidēšanos neitrālā vai nedaudz sārmainā vidē, vidusskolēnu uzmanību pievēršam tam, ka šādos apstākļos oksidēšanos pavada diolu (dihidrospirtu) veidošanās, un tiem oglekļa atomiem pievienojas hidroksilgrupas. starp kurām bija dubultā saite:

IN Līdzīgā veidā mēs aplūkojam acetilēna un tā homologu oksidēšanu atkarībā no vides, kurā process notiek. Tātad, mēs precizējam, ka skābā vidē oksidācijas procesu pavada karbonskābju veidošanās:

Reakciju izmanto, lai noteiktu alkīnu struktūru ar oksidācijas produktiem:

Neitrālā un nedaudz sārmainā vidē acetilēna oksidēšanu pavada atbilstošo oksalātu (skābeņskābes sāļu) veidošanās, un homologu oksidēšanos pavada trīskāršās saites pārrāvums un karbonskābju sāļu veidošanās:

IN Visi noteikumi tiek izstrādāti kopā ar studentiem uz konkrētiem piemēriem, kas nodrošina labāku teorētiskā materiāla asimilāciju. Līdz ar to, pētot arēnu oksidēšanos dažādās vidēs, studenti patstāvīgi var izdarīt pieņēmumus, ka skābā vidē jārēķinās ar skābju, bet sārmainā – sāļu veidošanos. Skolotājam būs tikai jāprecizē, kādi reakcijas produkti veidojas atkarībā no atbilstošās arēnas uzbūves.
Ar piemēriem mēs parādām, ka benzola homologi ar vienu sānu ķēdi (neatkarīgi no tās garuma) tiek oksidēti ar spēcīgu oksidētāju par benzoskābi pie oglekļa atoma. Karsējot benzola homologus neitrālā vidē oksidē ar kālija permanganātu, veidojot aromātisko skābju kālija sāļus.
5C6H5-CH3 + 6KMnO4 + 9H2SO4 \u003d 5C6H5COOH + 6MnSO4 + 3K2SO4 + 14H2O,
5C 6 H 5 - C 2 H 5 + 12 KMnO 4 + 18 H 2 SO 4 \u003d 5C 6 H 5 COOH + 5CO 2 + 12 MnSO 4 + 6K 2 SO 4 + 28 H 2 O,
C 6 H 5 - CH 3 + 2 KMnO 4 \u003d C 6 H 5 COOK + 2 MnO 2 + KOH + H 2 O.
Uzsveram, ja arēna molekulā ir vairākas sānu ķēdes, tad skābā vidē katra no tām oksidējas pie a-oglekļa atoma līdz karboksilgrupai, kā rezultātā veidojas daudzbāziskas aromātiskās skābes:

P Iegūtās prasmes OVR vienādojumu sastādīšanā ogļūdeņražiem dod iespēju tos izmantot sadaļas “Skābekli saturoši savienojumi” izpētē.
Tātad, pētot tēmu “Alkoholi”, studenti patstāvīgi sastāda spirtu oksidēšanās vienādojumus, izmantojot šādus noteikumus:
1) primārie spirti tiek oksidēti par aldehīdiem
3CH3-CH2OH + K2Cr2O7 + 4H2SO4 \u003d 3CH3-CHO + K2SO4 + Cr2(SO4)3 + 7H2O;
2) sekundārie spirti tiek oksidēti par ketoniem

3) terciārajiem spirtiem oksidācijas reakcija nav raksturīga.
Lai sagatavotos LIETOT skolotāju par šiem īpašumiem vēlams sniegt papildu informāciju, kas neapšaubāmi noderēs studentiem.
Metanolu oksidējot ar paskābinātu kālija permanganāta vai kālija dihromāta šķīdumu, veidojas CO 2, primārie spirti oksidēšanās laikā atkarībā no reakcijas apstākļiem var veidot ne tikai aldehīdus, bet arī skābes. Piemēram, etanola oksidēšana ar kālija dihromātu aukstumā beidzas ar etiķskābes veidošanos un, karsējot, acetaldehīdu:
3CH 3 -CH 2 OH + 2K 2 Cr 2 O 7 + 8H 2 SO 4 \u003d 3CH 3 -COOH + 2K 2 SO 4 + 2Cr 2 (SO 4) 3 + 11 H 2 O,
3CH 3 -CH 2 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 3CH 3 - CHO + K 2 SO 4 + Cr 2 ( SO 4 ) 3 + 7 H 2 O.
Atgādināsim vēlreiz par vides ietekmi uz spirta oksidēšanās reakciju produktiem, proti: karsts neitrāls KMnO 4 šķīdums oksidē metanolu par kālija karbonātu, bet atlikušos spirtus par atbilstošo karbonskābju sāļiem:

Apgūstot tēmu “Aldehīdi un ketoni”, pievēršam studentu uzmanību tam, ka aldehīdi vieglāk oksidējas par spirtiem atbilstošās karbonskābēs ne tikai spēcīgu oksidētāju iedarbībā (gaisa skābeklis, paskābināti KMnO 4 un K 2 Cr 2 O 7), bet vāja (sudraba oksīda vai vara (II) hidroksīda amonjaka šķīduma) ietekmē:
5CH3-CHO + 2KMnO4 + 3H2SO4 \u003d 5CH3-COOH + 2MnSO4 + K2SO4 + 3H2O,
3CH 3 -CHO + K 2Cr 2 O 7 + 4H 2 SO 4 \u003d 3CH 3 -COOH + Cr 2 (SO 4) 3 + K 2 SO 4 + 4H 2 O,
CH3-CHO + 2OH CH3-COONH4 + 2Ag + 3NH3 + H2O.
Mēs pievēršam īpašu uzmanību metanāla oksidēšanai ar sudraba oksīda amonjaka šķīdumu, kopš šajā gadījumā veidojas amonija karbonāts, nevis skudrskābe:
HCHO + 4OH \u003d (NH 4) 2 CO 3 + 4Ag + 6NH 3 + 2H 2 O.
Kā liecina mūsu ilggadējā pieredze, piedāvātā metode vidusskolēnu mācīšanai, kā rakstīt OVR vienādojumus ar organisko vielu piedalīšanos, palielina viņu galīgo vērtību. IZMANTOT rezultātuķīmijā par dažiem punktiem.