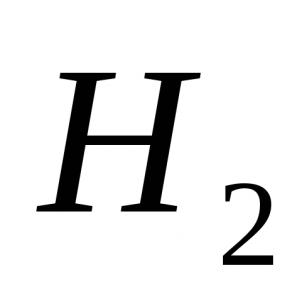Oglekļa iegūšana. Piesātināto vienbāzisko karbonskābju ķīmiskās īpašības
Karbonskābes ir ogļūdeņražu atvasinājumi, kas satur vienu vai vairākas karboksilgrupas.
Karboksilgrupu skaits raksturo skābes bāziskumu.
Atkarībā no karboksilgrupu skaita karbonskābes iedala vienbāziskajās karbonskābēs (satur vienu karboksilgrupu), divbāziskajās (satur divas karboksilgrupas) un daudzbāziskās.
Atkarībā no radikāļu veida, kas saistīts ar karboksilgrupu, karbonskābes iedala piesātinātās, nepiesātinātās un aromātiskās. Ierobežojošās un nepiesātinātās skābes tiek apvienotas ar vispārīgo nosaukumu alifātiskās vai taukskābes.
Vienbāziskās karbonskābes
1.1. Homologās sērijas un nomenklatūra
Vienbāzisko piesātināto karbonskābju (dažreiz sauktas par taukskābēm) homologā sērija sākas ar skudrskābi
Homologās sērijas formula
IUPAC nomenklatūra ļauj saglabāt daudzas skābes ar to triviālajiem nosaukumiem, kas parasti norāda dabisko avotu, no kura šī vai cita skābe tika izolēta, piemēram, skudrskābe, etiķskābe, sviestskābe, baldriīns utt.
Sarežģītākos gadījumos skābju nosaukumus atvasina no ogļūdeņražu nosaukuma ar tādu pašu oglekļa atomu skaitu kā skābes molekulā, pievienojot galotni -ovaja un vārdi skābe. Skudrskābi H-COOH sauc par metanskābi, etiķskābi CH 3 -COOH sauc par etānskābi utt.
Tādējādi skābes tiek uzskatītas par ogļūdeņražu atvasinājumiem, no kuriem viena saite tiek pārveidota par karboksilgrupu:

Nosaucot sazarotās ķēdes skābes pēc racionālās nomenklatūras, tās tiek uzskatītas par etiķskābes atvasinājumiem, kuru molekulā ūdeņraža atomi aizvietoti ar radikāļiem, piemēram, trimetiletiķskābe (CH 3) 3 C - COOH.
1.2. Karbonskābju fizikālās īpašības
Tikai no tīri formālām pozīcijām karboksilgrupu var uzskatīt par karbonilgrupu un hidroksilgrupu funkciju kombināciju. Faktiski to savstarpējā ietekme vienam uz otru ir tāda, ka tas pilnībā maina to īpašības.
C=0 divkāršās saites polarizācija, kas raksturīga karbonilgrupai, stipri palielinās brīvā elektronu pāra papildu kontrakcijas dēļ no blakus esošā hidroksilgrupas skābekļa atoma:

Tā sekas ir ievērojama O-H saites vājināšanās hidroksilgrupā un ūdeņraža atoma atdalīšana no tā protona (H +) veidā. Samazināta elektronu blīvuma (δ+) parādīšanās uz karboksilgrupas centrālā oglekļa atoma izraisa arī blakus esošās C-C saites σ-elektronu kontrakciju ar karboksilgrupu un parādās (kā aldehīdos un ketonos). samazināts elektronu blīvums (δ +) uz skābes α-oglekļa atoma .
Visas karbonskābes ir skābas (noteiktas ar indikatoriem) un veido sāļus ar metālu hidroksīdiem, oksīdiem un karbonātiem, kā arī ar aktīvajiem metāliem:
Karbonskābes ūdens šķīdumā vairumā gadījumu disociē tikai nelielā mērā un ir vājas skābes, kas ir ievērojami zemākas par tādām skābēm kā sālsskābe, slāpekļskābe un sērskābe. Tātad, izšķīdinot vienu molu 16 litros ūdens, skudrskābes disociācijas pakāpe ir 0,06, etiķskābes - 0,0167, savukārt sālsskābe ar šo atšķaidījumu tiek gandrīz pilnībā atdalīta.
Lielākajai daļai vienbāzisko karbonskābju RK a \u003d 4,8, tikai skudrskābei ir zemāka pKa vērtība (apmēram 3,7), kas izskaidrojams ar to, ka alkilgrupām nav elektronu ziedošanas efekta.
Bezūdens minerālskābēs karbonskābes tiek protonētas pie skābekļa, veidojot karbokācijas:

Elektronu blīvuma nobīde nedisociētās karbonskābes molekulā, kas tika minēta iepriekš, samazina elektronu blīvumu uz hidroksilskābekļa atoma un palielina to uz karbonilskābes atoma. Šī nobīde vēl vairāk palielinās skābes anjonā:

Nobīdes rezultāts ir pilnīga lādiņu izlīdzināšana anjonā, kas faktiski pastāv A formā - karboksilāta anjona rezonanse.
Pirmie četri karbonskābes sērijas pārstāvji ir mobilie šķidrumi, kas visos aspektos sajaucas ar ūdeni. Skābes, kuru molekula satur no pieciem līdz deviņiem oglekļa atomiem (kā arī izosviestskābe), ir eļļaini šķidrumi, to šķīdība ūdenī ir zema.
Augstākās skābes (no C 10) ir cietas vielas, praktiski nešķīst ūdenī, destilējot normālos apstākļos, tās sadalās.
Skudrskābēm, etiķskābēm un propionskābēm ir asa smarža; sērijas vidējiem pārstāvjiem ir nepatīkama smaka, augstākajām skābēm nav smakas.

Karbonskābju fizikālās īpašības ietekmē ievērojama asociācijas pakāpe ūdeņraža saišu veidošanās dēļ. Skābes veido spēcīgas ūdeņraža saites, jo tajās esošās O-H saites ir ļoti polarizētas. Turklāt karbonskābes spēj veidot ūdeņraža saites, piedaloties karbonildipola skābekļa atomam, kuram ir ievērojama elektronegativitāte. Patiešām, cietā un šķidrā stāvoklī karbonskābes galvenokārt pastāv ciklisku dimēru veidā:
Šādas dimēra struktūras zināmā mērā saglabājas pat gāzveida stāvoklī un atšķaidītos šķīdumos nepolāros šķīdinātājos.
13.1.1. Ogļūdeņražu oksidēšana. Ir divi veidi: zemāko alkānu C4-C8 oksidēšana galvenokārt līdz etiķskābei un cietā parafīna oksidēšana, veidojot sintētiskās taukskābes (FFA) ar taisnu oglekļa atomu ķēdi C10-C20, kas ir izejvielas virsmaktīvo vielu sintēzei (virsmaktīvās vielas) .
Process notiek šķidrā fāzē, kad to karsē vai katalizatoru klātbūtnē. Alkānu oksidēšanās laikā notiek iznīcināšana pa saitēm starp sekundārajiem oglekļa atomiem, tāpēc etiķskābe galvenokārt veidojas no n-butāna, un kā blakusprodukti veidojas metiletilketons un etilacetāts.
13.1.2. Sintēzes uz oglekļa monoksīda bāzes (II). Karbonskābes iegūst no oglekļa monoksīda karbonilēšanas reakcijā:
Divkāršās saites pievienošana skābes katalīzē vienmēr notiek pēc Markovņikova likuma, kā rezultātā taisnas ķēdes skābe tiek iegūta tikai no etilēna, bet α-metilaizvietotās skābes no tā homologiem. Šī metode ir īpaši interesanta skābju sintēzei ar terciāro radikāļu (ne-skābēm) no sazarotiem olefīniem. (Koča reakcija):

Reakcijas mehānisms sastāv no alkēna sākotnējās protonēšanas ar skābi, veidojot karbēnija jonu, tā mijiedarbībā ar CO, lai iegūtu acilijs - katjons un pēdējo reakcijas ar ūdeni, veidojot karbonskābi:
Neoskābēm un to sāļiem ir ļoti augsta šķīdība un viskozitāte, un to esteriem ir hidrolīzes stabilitāte, kas nodrošina to plašu pielietojumu vairākās nozarēs.
Spirtu karbonilēšanu katalizē metālu kompleksi (Ni, Co, Fe, Pd). Process ir ieviests rūpniecībā etiķskābes sintēzei no metanola, un to raksturo augsts ekonomiskais sniegums.
Skābes iegūst arī, oksidējot aldehīdus (oksosintēzes produktu).
Laboratorijas metodes karbonskābju iegūšanai
Alkānu oksidēšana.
Alkēnu oksidēšana.
13.2.3. Primāro spirtu oksidēšana.
13.2.4. Aldehīdu un ketonu oksidēšana. Aldehīdi oksidējas daudz vieglāk nekā ketoni. Turklāt aldehīdu oksidēšanās rezultātā veidojas skābes ar tādu pašu oglekļa atomu skaitu, savukārt ketonu oksidēšanās notiek, pārtraucot oglekļa-oglekļa saites (veidojas divas skābes vai skābe un ketons):

Oksidētāji ir kālija permanganāts vai dihromāts. Ketonu oksidēšanai nepieciešami stingrāki apstākļi nekā aldehīdu oksidēšanai.
13.2.5. Nitrilu hidrolīze. Nitrilus iegūst, mijiedarbojoties haloalkāniem ar kālija cianīdu, hidrolīzi veic ar skābju vai sārmu ūdens šķīdumiem. Skābā vidē slāpeklis izdalās amonija sāls veidā:

sārmainā - amonija hidroksīda veidā, kas sadalās, izdalot amonjaku, skābi iegūst sāls veidā:

13.2.6. Grignarda sintēze. Magnija organiskajiem savienojumiem mijiedarbojoties ar oglekļa dioksīdu, veidojas karbonskābju sāļi:
Spēcīga skābe (parasti HCl) pārvērš sāli skābē:
Tauku hidrolīze
Tauki ir karbonskābju un glicerīna (triglicerīdu) esteri. Karbonskābēm, kas veido taukus, ir oglekļa ķēde no 3 līdz 18 oglekļa atomiem.
Tauku vai eļļu vārīšana ar sārmu (NaOH, KOH) ūdens šķīdumiem izraisa karbonskābju un glicerīna sāļu veidošanos.
Šo darbību sauc par pārziepjošanu, jo ziepju pagatavošanai izmanto karbonskābju sāļus.
Karbonskābju atvasinājumu hidrolīze.
Fizikālās īpašības
Zemākās skābes ar līdz 3 oglekļa atomiem ir gaistoši, bezkrāsaini šķidrumi ar raksturīgu asu smaku, sajaucas ar ūdeni jebkurā attiecībā. Lielākā daļa skābju C 4 - C 9 ir eļļaini šķidrumi ar nepatīkamu smaku. Šķīdība ūdenī ievērojami samazinās, palielinoties molārajai masai. Skābes no C10 un augstākas ir cietas vielas, kas nešķīst ūdenī. Skudrskābes un etiķskābes blīvums ir lielāks par vienu, pārējās ir mazākas par vienu. Viršanas temperatūra palielinās, palielinoties molārajai masai, ar vienādu oglekļa atomu skaitu normālas struktūras skābes vārās augstāk nekā skābes ar sazarotu oglekļa skeletu. Skābju un spirtu ar vienādu oglekļa atomu skaitu viršanas punktu salīdzinājums parādīja, ka skābes vārās daudz augstākā temperatūrā nekā spirti. Tas norāda uz lielāku skābju molekulu saistību, salīdzinot ar spirtiem, jo veidojas ūdeņraža saites.
Karbonskābes, tāpat kā spirti, spēj veidot ūdeņraža saites. Ja akceptors ir pietiekami spēcīga bāze, ūdeņraža saites veidošanās notiek pirms pilnīgas protona pārneses uz bāzi. Pēc Bronsteda teiktā, savienojums, kas ir ūdeņraža donors, tiek uzskatīts par "skābi". Tas, vai konkrētais savienojums būs “ūdeņraža donors” (“skābe”), ir atkarīgs no “ūdeņraža akceptora” (“bāzes”) rakstura. Jo stiprāka ir bāze, jo lielāka iespēja, ka savienojums pret to izturēsies kā skābe:

Starpmolekulārās ūdeņraža saites, kas rodas starp karbonskābju molekulām, ir tik spēcīgas, ka pat gāzveida stāvoklī ievērojama daļa molekulu pastāv dimēru veidā:

Pieaugot ogļūdeņražu ķēdei, skābju spēja veidot ūdeņraža saites samazinās.
DEFINĪCIJA
Tiek sauktas organiskās vielas, kuru molekulas satur vienu vai vairākas karboksilgrupas, kas saistītas ar ogļūdeņraža radikāli karbonskābes.
Pirmie trīs homologās karbonskābju sērijas locekļi, tostarp propionskābe, ir šķidrumi, kuriem ir asa smaka un kas labi šķīst ūdenī. Sekojošie homologi, sākot ar sviestskābi, arī ir šķidrumi, kuriem ir asa nepatīkama smaka, bet slikti šķīst ūdenī. Augstākās skābes ar oglekļa atomu skaitu 10 vai vairāk ir cietas vielas, bez smaržas, nešķīst ūdenī. Kopumā homologu sērijās, palielinoties molekulmasai, samazinās šķīdība ūdenī, samazinās blīvums un palielinās viršanas temperatūra (1. tabula).
1. tabula. Karbonskābju homologās sērijas.
Karbonskābju iegūšana
Karbonskābes iegūst, oksidējot piesātinātos ogļūdeņražus, spirtus, aldehīdus. Piemēram, etiķskābe - karsējot oksidējot etanolu ar kālija permanganāta šķīdumu skābā vidē:
Karbonskābju ķīmiskās īpašības
Karbonskābju ķīmiskās īpašības galvenokārt ir saistītas ar to struktūras īpatnībām. Tātad ūdenī šķīstošās skābes spēj sadalīties jonos:
R-COOH↔R-COO - + H + .
Sakarā ar H + jonu klātbūtni ūdenī, tiem ir skāba garša, tie spēj mainīt indikatoru krāsu un vadīt elektrību. Ūdens šķīdumā šīs skābes ir vāji elektrolīti.
Karbonskābēm piemīt ķīmiskās īpašības, kas raksturīgas neorganisko skābju šķīdumiem, t.i. mijiedarbojas ar metāliem (1), to oksīdiem (2), hidroksīdiem (3) un vājajiem sāļiem (4):
2CH 3 -COOh + Zn → (CH 3 COO) 2 Zn + H2 (1);
2CH 3 -COOH + CuO → (CH 3 COO) 2 Cu + H 2 O (2);
R-COOH + KOH → R-COOK + H2O (3);
2CH 3 -COOH + NaHCO 3 → CH 3 COONa + H 2 O + CO 2 (4).
Īpaša ierobežojošo, kā arī nepiesātināto karbonskābju īpašība, kas izpaužas funkcionālās grupas dēļ, ir mijiedarbība ar spirtiem.
Karsējot un koncentrētas sērskābes klātbūtnē, karbonskābes reaģē ar spirtiem. Piemēram, ja etiķskābei pievieno etilspirtu un nedaudz sērskābes, tad, karsējot, parādās etiķskābes etilestera (etilacetāta) smarža:
CH 3 -COOH + C 2 H 5 OH ↔CH 3 -C (O) -O-C 2 H 5 + H 2 O.
Īpaša piesātināto karbonskābju īpašība, kas izpaužas radikāļu dēļ, ir halogenēšanas (hlorēšanas) reakcija.

Karbonskābju pielietojums
Karbonskābes kalpo kā izejviela ketonu, skābju halogenīdu, vinilesteru un citu svarīgu organisko savienojumu klašu ražošanai.
Skudrskābi plaši izmanto, lai iegūtu esterus, ko izmanto parfimērijā, ādas (miecēšanā), tekstilrūpniecībā (kā kodinātāju krāsošanā), kā šķīdinātāju un konservantu.
Etiķskābes ūdens šķīdumu (70-80%) sauc par etiķa esenci, bet 3-9% ūdens šķīdumu sauc par galda etiķi. Esenci bieži izmanto etiķa pagatavošanai mājās, atšķaidot.
Problēmu risināšanas piemēri
1. PIEMĒRS
| Exercise | Kādas ķīmiskās reakcijas var izmantot, lai veiktu šādas pārvērtības: a) CH 4 → CH 3 Cl → CH 3 OH → HCHO → HCOOH → HCOOK. Uzrakstiet reakciju vienādojumus, norādiet to rašanās nosacījumus. |
| Atbilde | a) Metāna hlorēšana gaismas klātbūtnē izraisa hlormetāna veidošanos: CH 4 + Cl 2 → CH 3 Cl + HCl. Alkānu halogēnu atvasinājumi tiek hidrolizēti ūdens vai sārmainā vidē, veidojot spirtus: CH 3 Cl + NaOH → CH 3 OH + NaCl. Primāro spirtu oksidēšanas rezultātā, piemēram, ar kālija dihromātu skābā vidē katalizatora (Cu, CuO, Pt, Ag) klātbūtnē, veidojas aldehīdi: CH3OH+ [O] →HCHO. Aldehīdus viegli oksidē līdz atbilstošām karbonskābēm, piemēram, ar kālija permanganātu: HCHO + [O] → HCOOH. Karbonskābēm piemīt visas vājajām minerālskābēm raksturīgās īpašības, t.i. spēj mijiedarboties ar aktīviem metāliem, veidojot sāļus: 2HCOOH+ 2K→2HCOOK + H2. |
2. PIEMĒRS
| Exercise | Uzrakstiet reakcijas vienādojumus starp šādām vielām: a) 2-metilpropānskābe un hlors; b) etiķskābe un propanols-2; c) akrilskābes un broma ūdens; d) 2-metilbutānskābe un fosfora (V) hlorīds. Norādiet reakcijas apstākļus. |
| Atbilde | a) 2-metilpropānskābes un hlora mijiedarbības reakcijas rezultātā ogļūdeņraža radikālā, kas atrodas a-pozīcijā, tiek aizstāts ūdeņraža atoms; Veidojas 2-metil-2-hlorpropānskābe H 3 C-C (CH 3) H-COOH + Cl 2 → H 3 C-C (CH 3) Cl-COOH + HCl (kat \u003d P). b) etiķskābes un propanola-2 mijiedarbības reakcijas rezultātā veidojas esteris - etiķskābes izopropilesteris. CH3-COOH + CH3-C(OH)H-CH3 → CH3-C(O)-O-C (CH3)-CH3. c) akrilskābes un broma ūdens mijiedarbības reakcijas rezultātā halogēna pievienošana dubultsaites vietā saskaņā ar Markovņikova likumu; Veidojas 2,3-dibrompropānskābe CH 2 \u003d CH-COOH + Br 2 → CH 2 Br-CHBr-COOH d) 2-metilbutānskābes un fosfora (V) hlorīda mijiedarbības reakcijas rezultātā veidojas atbilstošais skābes hlorīds CH 3 -CH 2 -C (CH 3) H-COOH + PCl 5 → CH 3 -CH 2 -C (CH 3) H-COOCl + POCl 3 + HCl. |
Klasifikācija
a) Pēc bāziskuma (t.i., karboksilgrupu skaita molekulā):
Vienbāziska (monokarbonskābes) RCOOH; Piemēram:
CH3CH2CH2COOH;
HOOS-CH 2 -COOH propāndijskābe (malonskābe).

Trīsbāzu (trikarbonskābes) R (COOH) 3 utt.
b) Atbilstoši ogļūdeņraža radikāļa struktūrai:
Alifātisks
limits; piemēram: CH 3 CH 2 COOH;
nepiesātināts; piemēram: CH 2 \u003d CHCOOH propēnskābe (akrilskābe).

Aliciklisks, piemēram:

Aromātisks, piemēram:

Ierobežojiet monokarbonskābju daudzumu
(monobāziskās piesātinātās karbonskābes) - karbonskābes, kurās piesātināts ogļūdeņraža radikālis ir saistīts ar vienu karboksilgrupu -COOH. Viņiem visiem ir vispārīgā formula C n H 2n+1 COOH (n ≥ 0); vai CnH 2n O 2 (n≥1)
Nomenklatūra
Vienbāzisko piesātināto karbonskābju sistemātiskie nosaukumi tiek doti ar atbilstošā alkāna nosaukumu, pievienojot sufiksu -ovaya un vārdu skābe.
1. HCOOH metāns (skudrskābe).
2. CH 3 COOH etānskābe (etiķskābe).
3. CH 3 CH 2 COOH propānskābe (propionskābe).
izomerisms
Skeleta izomērija ogļūdeņraža radikālā izpaužas, sākot ar butānskābi, kurai ir divi izomēri:

Starpklases izomerisms izpaužas, sākot ar etiķskābi:
CH 3 -COOH etiķskābe;
H-COO-CH 3 metilformiāts (skudrskābes metilesteris);
HO-CH2-COH hidroksietanāls (hidroksietiķskābes aldehīds);
HO-CHO-CH 2 hidroksietilēna oksīds.
homologās sērijas
Triviāls nosaukums |
IUPAC nosaukums |
|
Skudrskābe |
Metānskābe |
|
Etiķskābe |
Etānskābe |
|
propionskābe |
propānskābe |
|
Sviestskābe |
Butānskābe |
|
Valerīnskābi |
Pentānskābe |
|
Kaproīnskābe |
Heksānskābe |
|
Enantīnskābe |
Heptānskābe |
|
Kaprilskābe |
Oktānskābe |
|
Pelargonskābe |
Nonanoskābe |
|
kaprīnskābe |
Dekānskābe |
|
Undecilskābe |
undekānskābe |
|
Palmitīnskābe |
Heksadekānskābe |
|
Stearīnskābe |
Oktadekānskābe |
Skābju atlikumi un skābes radikāļi
skābes atlikums |
Skābais radikālis (acils) |
|
UNSD |
NSOO- |
|
CH 3 COOH |
CH 3 SOO- |
|
CH 3 CH 2 COOH |
CH 3 CH 2 COO- |
|
CH 3 (CH 2) 2 COOH |
CH 3 (CH 2) 2 COO- |
|
CH 3 (CH 2) 3 COOH |
CH 3 (CH 2) 3 COO- |
|
CH 3 (CH 2) 4 COOH |
CH 3 (CH 2) 4 COO- |
Karbonskābes molekulu elektroniskā struktūra

Formulā parādītā elektronu blīvuma nobīde pret karbonilskābekļa atomu izraisa spēcīgu O-H saites polarizāciju, kā rezultātā tiek veicināta ūdeņraža atoma atslāņošanās protona formā - ūdens šķīdumos notiek ūdeņraža atoma atdalīšanās process. Skābes disociācija notiek:
RCOOH ↔ RCOO - + H +
Karboksilāta jonā (RCOO -) notiek hidroksilgrupas skābekļa atoma vientuļo elektronu pāra p, π-konjugācija ar p-mākoņiem, veidojot π-saiti, kā rezultātā π-saite tiek delokalizēta. un negatīvais lādiņš ir vienmērīgi sadalīts starp diviem skābekļa atomiem:

Šajā sakarā karbonskābēm, atšķirībā no aldehīdiem, pievienošanas reakcijas nav raksturīgas.
Fizikālās īpašības

Skābju viršanas temperatūras ir daudz augstākas nekā spirtu un aldehīdu viršanas temperatūras ar vienādu oglekļa atomu skaitu, kas izskaidrojams ar ciklisku un lineāru asociēto savienojumu veidošanos starp skābes molekulām ūdeņraža saišu dēļ:
Ķīmiskās īpašības
I. Skābju īpašības
Skābju stiprums samazinās sērijā:
HCOOH → CH 3 COOH → C 2 H 6 COOH → ...
1. Neitralizācijas reakcijas
CH 3 COOH + KOH → CH 3 COOK + n 2 O
2. Reakcijas ar bāzes oksīdiem
2HCOOH + CaO → (HCOO) 2 Ca + H2O
3. Reakcijas ar metāliem
2CH 3 CH 2 COOH + 2Na → 2CH 3 CH 2 COONa + H 2
4. Reakcijas ar vājāku skābju sāļiem (ieskaitot karbonātus un bikarbonātus)
2CH 3 COOH + Na 2 CO 3 → 2CH 3 COONa + CO 2 + H 2 O
2HCOOH + Mg(HCO 3) 2 → (HCOO) 2 Mg + 2CO 2 + 2H 2 O
(HCOOH + HCO 3 - → HCOO - + CO2 + H2O)
5. Reakcijas ar amonjaku
CH 3 COOH + NH 3 → CH 3 COONH 4
II. -OH grupas aizstāšana
1. Mijiedarbība ar spirtiem (esterifikācijas reakcijas)

2. Mijiedarbība ar NH3 karsējot (veidojas skābes amīdi)

Skābes amīdi  hidrolizē, veidojot skābes:
hidrolizē, veidojot skābes:

vai to sāļi:

3. Skābju halogenīdu veidošanās
Skābju hlorīdiem ir vislielākā nozīme. Hlorēšanas reaģenti - PCl 3 , PCl 5 , tionilhlorīds SOCl 2 .

4. Skābju anhidrīdu veidošanās (starpmolekulārā dehidratācija)

Skābes anhidrīdi veidojas arī skābju hlorīdu mijiedarbībā ar karbonskābju bezūdens sāļiem; šajā gadījumā var iegūt dažādu skābju jauktus anhidrīdus; Piemēram:

III. Ūdeņraža atomu aizvietošanas reakcijas pie α-oglekļa atoma

Skudrskābes struktūras un īpašību iezīmes
Molekulas struktūra

Skudrskābes molekula, atšķirībā no citām karbonskābēm, savā struktūrā satur aldehīdu grupu.
Ķīmiskās īpašības
Skudrskābe iesaistās reakcijās, kas raksturīgas gan skābēm, gan aldehīdiem. Parādot aldehīda īpašības, tas viegli oksidējas par ogļskābi:
Jo īpaši HCOOH tiek oksidēts ar Ag 2 O un vara (II) hidroksīda Сu (OH) 2 amonjaka šķīdumu, t.i. dod kvalitatīvas reakcijas uz aldehīdu grupu:

Sildot ar koncentrētu H 2 SO 4, skudrskābe sadalās oglekļa monoksīdā (II) un ūdenī:

Skudrskābe ir ievērojami spēcīgāka nekā citas alifātiskās skābes, jo tajā esošā karboksilgrupa ir saistīta ar ūdeņraža atomu, nevis ar elektronu donoru alkilgrupu.
Piesātināto monokarbonskābju iegūšanas metodes
1. Spirtu un aldehīdu oksidēšana
Vispārējā shēma spirtu un aldehīdu oksidēšanai:
Kā oksidētāji tiek izmantoti KMnO 4, K 2 Cr 2 O 7, HNO 3 un citi reaģenti.
Piemēram:
5C 2H 5OH + 4KMnO 4 + 6H 2 S0 4 → 5CH 3 COOH + 2K 2 SO 4 + 4 MnSO 4 + 11 H 2 O
2. Esteru hidrolīze

3. Divkāršo un trīskāršo saišu oksidatīvā šķelšana alkēnos un alkīnos

HCOOH iegūšanas metodes (specifiskas)
1. Oglekļa monoksīda (II) mijiedarbība ar nātrija hidroksīdu
CO + NaOH → HCOONa nātrija formiāts
2HCOONa + H2SO4 → 2HCOOH + Na2SO4
2. Skābeņskābes dekarboksilēšana

CH3COOH iegūšanas metodes (specifiskas)
1. Butāna katalītiskā oksidēšana

2. Sintēze no acetilēna

3. Metanola katalītiskā karbonilēšana

4. Etanola etiķskābes fermentācija
Tādā veidā tiek iegūta pārtikas etiķskābe.
Augstāku karbonskābju iegūšana
Dabisko tauku hidrolīze

Nepiesātinātās monokarbonskābes
Galvenie pārstāvji
Alkēnskābes vispārīgā formula: C n H 2n-1 COOH (n ≥ 2)
CH 2 \u003d CH-COOH propēnskābe (akrilskābe).

Augstākas nepiesātinātās skābes
Šo skābju radikāļi ir daļa no augu eļļām.
C 17 H 33 COOH - oleīnskābe, vai cis-oktadiēn-9-eļskābe

Transs-oleīnskābes izomēru sauc par elaīnskābi.
C 17 H 31 COOH - linolskābe, vai cis, cis-oktadiēn-9,12-eļskābe

C 17 H 29 COOH - linolēnskābe, vai cis, cis, cis-oktadekatrien-9,12,15-eīnskābi
Papildus vispārīgajām karbonskābju īpašībām nepiesātinātajām skābēm ir raksturīgas pievienošanās reakcijas pie vairākām saitēm ogļūdeņraža radikālā. Tātad nepiesātinātās skābes, piemēram, alkēni, tiek hidrogenētas un atkrāso broma ūdeni, piemēram:

Atsevišķi dikarbonskābju pārstāvji
Ierobežojošās dikarbonskābes HOOC-R-COOH
HOOC-CH 2 -COOH propāndijskābe (malonskābe), (sāļi un esteri - malonāti)
HOOC-(CH 2) 2 -COOH butadīnskābe (dzintarskābe, sāļi un esteri - sukcināti)
HOOC-(CH 2) 3 -COOH pentadīnskābe (glutārskābe), (sāļi un esteri - glutorāti)
HOOC-(CH2)4-COOH heksadioskābe (adipīnskābe), (sāļi un esteri - adipināti)
Ķīmisko īpašību pazīmes
Dikarbonskābes daudzējādā ziņā ir līdzīgas monokarbonskābēm, taču tās ir stiprākas. Piemēram, skābeņskābe ir gandrīz 200 reizes spēcīgāka par etiķskābi.
Dikarbonskābes uzvedas kā divvērtīgās skābes un veido divas sāļu sērijas - skābo un vidēju:
HOOC-COOH + NaOH → HOOC-COONa + H 2 O
HOOC-COOH + 2NaOH → NaOOC-COONa + 2H 2O
Karsējot, skābeņskābe un malonskābe viegli dekarboksilējas: