Reakcijas ātruma atkarība no temperatūras. Van't Hoff noteikums. Reakcijas ātruma temperatūras koeficients un tā pazīmes bioķīmiskiem procesiem.
Faktori, kas ietekmē reakcijas gaitu
Cilvēka organismā dzīvā šūnā notiek tūkstošiem enzīmu reakciju. Tomēr daudzpakāpju procesu ķēdē atšķirība starp atsevišķu reakciju ātrumiem ir diezgan liela. Tādējādi pirms olbaltumvielu molekulu sintēzes šūnā ir vēl vismaz divi posmi: pārneses RNS sintēze un ribosomu sintēze. Bet laiks, kurā tRNS molekulu koncentrācija dubultojas, ir 1,7 minūtes, olbaltumvielu molekulu - 17 minūtes, bet ribosomu - 170 minūtes. Lēnas (ierobežojošās) stadijas kopējā procesa ātrums, mūsu piemērā ribosomu sintēzes ātrums. Ierobežojošas reakcijas klātbūtne nodrošina augstu uzticamību un elastību, kontrolējot tūkstošiem šūnā notiekošo reakciju. Pietiek novērot un regulēt tikai lēnākos no tiem. Šo daudzpakāpju sintēzes ātruma kontroles metodi sauc par minimālo principu. Tas ļauj būtiski vienkāršot un padarīt uzticamāku šūnā esošās autoregulācijas sistēmu.
Kinētikā izmantotās reakciju klasifikācijas: reakcijas, homogēnas, heterogēnas un mikroheterogēnas; vienkāršas un sarežģītas reakcijas (paralēlas, secīgas, konjugētas, ķēdes). Reakcijas elementārā akta molekularitāte. Kinētiskie vienādojumi. Reakcijas secība. Pus dzīve

Mikroheterogēnas reakcijas -

Reakcijas molekularitāti nosaka to molekulu skaits, kuras reakcijas elementārajā aktā nonāk ķīmiskā mijiedarbībā. Pamatojoties uz to, reakcijas tiek sadalītas monomolekulārās, bimolekulārās un trimolekulārās.
Tad A -> B tipa reakcijas būs monomolekulāras, piemēram:
a) C 16 H 34 (t ° C) -> C g H 18 + C 8 H 16 - ogļūdeņraža krekinga reakcija;
b) CaC0 3 (t ° C) -> CaO + C0 2 - kalcija karbonāta termiskā sadalīšanās.
Tādas reakcijas kā A + B -> C vai 2A -> C ir bimolekulāras, piemēram:
a) C + 0 2 -> C0 2; b) 2Н 2 0 2 -> 2Н 2 0 + 0 2 utt.
Trimolekulārās reakcijas apraksta ar vispārīgiem vienādojumiem:
a) A + B + C D; b) 2A + B D; c) 3A D.
Piemēram: a) 2Н 2 + 0 2 2Н 2 0; b) 2NO + H2N20 + H20.
Reakcijas ātrums atkarībā no molekularitātes tiks izteikts ar vienādojumiem: a) V = k C A - monomolekulārai reakcijai; b) V \u003d uz C A C vai c) V \u003d uz C 2 A - bimolekulārai reakcijai; d) V \u003d k C C C e) V \u003d k C 2 A C vai e) V \u003d k C 3 A - trimolekulārai reakcijai.

Molekulitāte ir molekulu skaits, kas reaģē vienā elementārā ķīmiskā aktā.



Bieži vien ir grūti noteikt reakcijas molekularitāti, tāpēc tiek izmantota formālāka zīme - ķīmiskās reakcijas secība.
Reakcijas secība ir vienāda ar koncentrāciju eksponentu summu vienādojumā, kas izsaka reakcijas ātruma atkarību no reaģentu koncentrācijas (kinētiskais vienādojums).
Reakcijas secība visbiežāk nesakrīt ar molekularitāti, jo reakcijas mehānisms, t.i., reakcijas "elementārais akts" (skat. molekularitātes zīmes definīciju), ir grūti nosakāms.
Apsveriet vairākus piemērus, kas ilustrē šo pozīciju.
1. Kristālu šķīšanas ātrumu apraksta nulles kārtas kinētikas vienādojumi, neskatoties uz reakcijas monomolekulāro raksturu: AgCl (TB) -> Ag + + CI", V = k C (AgCl (TB p = k " C (AgCl (ra)) - p - blīvums un ir nemainīga vērtība, t.i., šķīšanas ātrums nav atkarīgs no izšķīdušās vielas daudzuma (koncentrācijas).
2. Saharozes hidrolīzes reakcija: CO + H 2 0 -> C 6 H 12 0 6 (glikoze) + C 6 H 12 0 6 (fruktoze) ir bimolekulāra reakcija, bet tās kinētiku raksturo pirmās kārtas kinētika. vienādojums: V \u003d k * C cax , jo eksperimentālos apstākļos, arī organismā, ūdens koncentrācija ir nemainīga vērtība С(Н 2 0) - konst.
3.  Ūdeņraža peroksīda sadalīšanās reakcijai, kurā piedalās katalizatori, gan neorganiskie joni Fe 3+, gan metāla platīna Cu 2+, gan bioloģiskie enzīmi, piemēram, katalāze, ir vispārīgā formā:
Ūdeņraža peroksīda sadalīšanās reakcijai, kurā piedalās katalizatori, gan neorganiskie joni Fe 3+, gan metāla platīna Cu 2+, gan bioloģiskie enzīmi, piemēram, katalāze, ir vispārīgā formā:
2H 2 0 2 -\u003e 2H 2 0 + O e, t.i., ir bimolekulārs.
Reakcijas ātruma atkarība no koncentrācijas. Pirmās, otrās un nulles kārtas reakciju kinētiskie vienādojumi. Eksperimentālās metodes reakciju ātruma un ātruma konstantes noteikšanai.





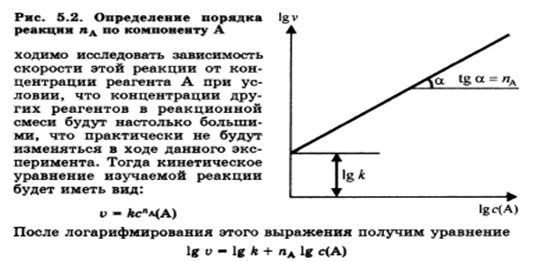

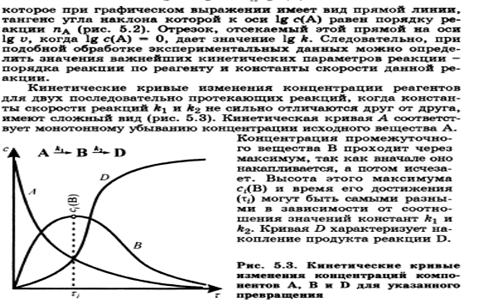
Reakcijas ātruma atkarība no temperatūras. Van't Hoff noteikums. Reakcijas ātruma temperatūras koeficients un tā pazīmes bioķīmiskiem procesiem.

γ ir reakcijas ātruma temperatūras koeficients.

γ vērtības fizikālā nozīme ir tāda, ka tā parāda, cik reizes mainās reakcijas ātrums, mainoties temperatūrai ik pēc 10 grādiem.

 15. Aktīvo sadursmju teorijas jēdziens. Reakcijas enerģētiskais profils; aktivizācijas enerģija; Arrēnija vienādojums. Steriskā faktora loma. Pārejas stāvokļa teorijas jēdziens.
15. Aktīvo sadursmju teorijas jēdziens. Reakcijas enerģētiskais profils; aktivizācijas enerģija; Arrēnija vienādojums. Steriskā faktora loma. Pārejas stāvokļa teorijas jēdziens.




Ātruma konstantes, aktivācijas enerģijas un temperatūras attiecību apraksta Arrēnija vienādojums: k T \u003d k 0 *Ae ~ E / RT, kur k t un k 0 ir ātruma konstantes temperatūrā T un T e e ir bāze naturālais logaritms, A ir steriskais faktors.
Steriskais faktors A nosaka divu reaģējošu daļiņu sadursmes varbūtību molekulas aktīvajā centrā. Šis faktors ir īpaši svarīgs bioķīmiskajām reakcijām ar biopolimēriem. Skābju-bāzes reakcijās H + jonam jāreaģē ar terminālo karboksilgrupu - COO. Tomēr ne katra H + jona sadursme ar proteīna molekulu novedīs pie šādas reakcijas. Tikai tās sadursmes, kas notiek tieši noteiktās vietās. makromolekulu punkti būs efektīvi, ko sauc par aktīvajiem centriem.
No Arrēnija vienādojuma izriet, ka jo lielāka ir ātruma konstante, jo zemāka ir aktivācijas enerģija E un augstāka procesa temperatūra T.








