Metodiskā izstrāde patstāvīgam darbam par tēmu "hibridizācijas veidi"
VALSTS AUTONOMĀS IZGLĪTĪBAS IESTĀDE
NOVOSIBIRSK REĢIONA VIDĒJĀ PROFESIONĀLĀ IZGLĪTĪBA
"KUPINSKY MEDICAL TECHNICUM"
TOOLKIT
« »
studentu patstāvīgam darbam
pēc disciplīnas Ķīmija
Sadaļa: Organiskā ķīmija
Tēma: Organiskās ķīmijas priekšmets.
Organisko savienojumu struktūras teorija
Specialitāte: 34.02.01 "Māsu" 1 kurss
Kupino
2015. mācību gads
Sēdē izskatīts
priekšmets - cikliski metodiskā komisija ieslēgta
vispārējās izglītības disciplīnas, vispārējās humanitārās un
sociālekonomiskā, matemātiskā
un dabaszinātņu cikls
2015. gada protokols
Priekšsēdētājs __________________ / _________________________ /
Irina V. Vede
Metodiskās rokasgrāmatas skaidrojoša piezīme
Rokasgrāmata ir paredzēta tēmas padziļinātai izpētei. « Oglekļa hibridizācijas veidi ».
Prakse rāda, ka daudziem studentiem, pētot organiskos savienojumus, ir grūti noteikt oglekļa atomu hibridizācijas veidus un ķīmisko saišu veidus.
Rokasgrāmatas mērķis ir palīdzēt skolēniem atpazīt oglekļa atomu hibridizācijas veidus un ķīmisko saišu veidus organiskajos savienojumos.Šī rokasgrāmata ir ieteicama specialitātes 1. kursa studentiem 34.02.01 Māsu. Rokasgrāmatā ir teorētisks materiāls par šo tēmu, tabulas zināšanu organizēšanai, vingrinājumi patstāvīgam darbam un detalizētas atbildes uz katru no uzdevumiem.
Rokasgrāmata ir vērsta uz prasmju attīstīšanu patstāvīgi strādāt ar izglītojošu materiālu, meklēt un izmantot informāciju, veidot un attīstīt radošo potenciālu, palielināt interesi par disciplīnu.
Es vienmēr esmu gatavs mācīties
bet man ne vienmēr patīk
kad mani māca
V. Čērčils
Oglekļa hibridizācijas veidi
Oglekļa atoma elektroniskā uzbūve pamata stāvoklī ir 1s 2 2s 2 2p 2, 2.līmeņa p-orbitālēs ir divi nepāra elektroni. Tas ļauj oglekļa atomam ar apmaiņas mehānismu veidot tikai divas kovalentās saites. Tomēr visos organiskajos savienojumos ogleklis veido četras kovalentās saites, kas kļūst iespējams atomu orbitāļu hibridizācijas rezultātā.
Hibridizācija ir atomu orbitāļu mijiedarbība ar tuvām enerģijas vērtībām, ko pavada jaunu "hibrīdu" orbitāļu veidošanās.
Hibridizācija ir process, kas prasa enerģijas patēriņu, taču šīs izmaksas vairāk nekā kompensē enerģija, kas izdalās, veidojot lielāku skaitu kovalento saišu. iegūtajām "hibrīda" orbitālēm ir asimetriska hanteles forma un tās krasi atšķiras no oglekļa atoma sākotnējām orbitālēm.
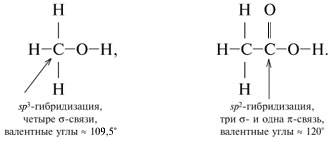
Oglekļa atomam ir iespējami trīs hibridizācijas veidi: sp 3 -hibridizācija- mijiedarbojošās orbitāles ir parādītas ar zilām bultiņām:
sp 2 -hibridizācija:
sp-hibridizācija:
Oglekļa atoma hibrīdās orbitāles spēj piedalīties tikai β-saišu veidošanā, savukārt p-orbitāle, ko neietekmē hibridizācija, veido tikai β-saites. Tieši šī īpašība nosaka organisko vielu molekulu telpisko struktūru.
Hibridizācija
oglekļa atomu orbitāles
Kovalentā ķīmiskā saite tiek veidota, izmantojot šāda veida parastos saistošos elektronu pārus:
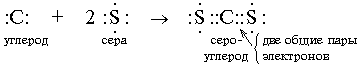
Veidojiet ķīmisko saiti, t.i. tikai nepāra elektroni var izveidot kopīgu elektronu pāri ar "svešu" elektronu no cita atoma. Rakstot elektroniskās formulas, orbitālajā šūnā pa vienam atrodas nepāra elektroni.
Atomu orbitāle Tā ir funkcija, kas apraksta elektronu mākoņa blīvumu katrā telpas punktā ap atoma kodolu. Elektronu mākonis ir telpas apgabals, kurā ar lielu varbūtību var atrast elektronu.
Lai saskaņotu oglekļa atoma elektronisko struktūru un šī elementa valenci, tiek izmantots oglekļa atoma ierosmes jēdziens. Parastā (neuzbudinātā) stāvoklī oglekļa atomam ir divi nesapāroti 2 R 2 -elektronu. Uzbudinātā stāvoklī (kad tiek absorbēta enerģija) viens no 2 s 2 elektroni var iet uz brīvo R- orbitāls. Tad oglekļa atomā parādās četri nepāra elektroni:
Atgādiniet, ka atoma elektroniskajā formulā (piemēram, oglekļa 6 С - 1 s 2 2s 2 2lpp 2) lieli cipari burtu priekšā - 1, 2 - norāda enerģijas līmeņa numuru. Vēstules s un R norāda elektronu mākoņa (orbītas) formu, un cipari labajā pusē virs burtiem norāda elektronu skaitu šajā orbitālā. Viss s- sfēriskas orbitāles:
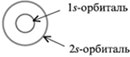
Otrajā enerģijas līmenī, izņemot 2 s-orbitāli ir trīs 2 R- orbitāls. Šie 2 R-orbitālēm ir elipsoidāla forma, līdzīga hantelēm, un tās ir orientētas telpā 90 ° leņķī viena pret otru. 2 R-Orbitāles apzīmē 2 R NS , 2R g un 2 R z pēc asīm, pa kurām atrodas šīs orbitāles.
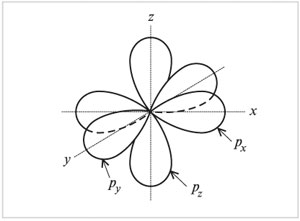
Forma un orientācija
p-elektronu orbitāles
Veidojot ķīmiskās saites, elektronu orbitāles iegūst tādu pašu formu. Tātad, piesātinātajos ogļūdeņražos viens s-orbitāls un trīs R-oglekļa atoma orbitāli, veidojot četrus identiskus (hibrīdus) sp 3-orbitāles:
![]()
Tas - sp 3-hibridizācija.
Hibridizācija- atomu orbitāļu izlīdzināšana (sajaukšana) s un R), veidojot jaunas atomu orbitāles, ko sauc hibrīda orbitāles.
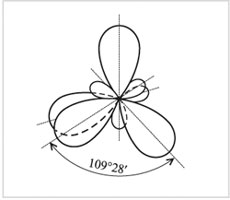
Četras sp 3 -hibrīda orbitāles
oglekļa atoms
Hibrīdajām orbitālēm ir asimetriska forma, kas ir izstiepta pret pievienoto atomu. Elektronu mākoņi atgrūž viens otru un atrodas telpā pēc iespējas tālāk viens no otra. Šajā gadījumā četras asis sp 3-hibrīda orbitāles izrādās vērsti uz tetraedra virsotnēm (regulāra trīsstūrveida piramīda).
Attiecīgi leņķi starp šīm orbitālēm ir tetraedriski, vienādi ar 109 ° 28 ".
Elektronu orbitāļu virsotnes var pārklāties ar citu atomu orbitālēm. Ja elektronu mākoņi pārklājas pa līniju, kas savieno atomu centrus, tad tiek saukta šāda kovalenta saite sigma (
) -savienojums... Piemēram, C 2 H 6 etāna molekulā ķīmiska saite veidojas starp diviem oglekļa atomiem, pārklājot divas hibrīda orbitāles. Tas ir savienojums. Turklāt katram no oglekļa atomiem ir savi trīs sp 3 orbitāles pārklājas ar s-triju ūdeņraža atomu orbitāles, veidojot trīs -saites.
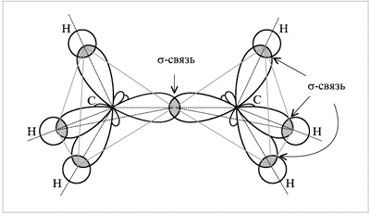
Elektronu mākoņu pārklāšanās diagramma
etāna molekulā
Kopumā oglekļa atomam ir iespējami trīs valences stāvokļi ar dažādiem hibridizācijas veidiem. izņemot sp Pastāv 3-hibridizācija sp 2 - un sp-hibridizācija.
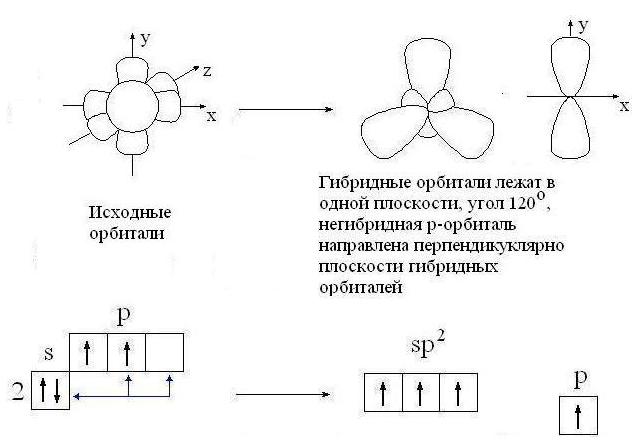
sp 2 -Hibridizācija- sajaucot vienu s- un divi R- orbitāles. Rezultātā trīs hibrīdi sp 2 -orbitāli. Šīs sp 2 -orbitāli atrodas vienā plaknē (ar asīm NS, plkst) un novirzīts uz trijstūra virsotnēm ar leņķi starp orbitālēm 120 °. Nehibridizēts
R-orbitāls perpendikulārs trīs hibrīda plaknei sp 2 -orbitāli (orientēti gar asi z). Augšējā puse R-orbitāls atrodas virs plaknes, apakšējā puse ir zem plaknes.
Veids sp Oglekļa 2-hibridizācija notiek savienojumos ar dubultsaiti: C = C, C = O, C = N. Turklāt tikai viena no saitēm starp diviem atomiem (piemēram, C = C) var būt saite. (Pārējās atoma saistošās orbitāles ir vērstas pretējos virzienos.) Otro saiti veido pārklāšanās, kas nav hibrīds R-orbitāles abās pusēs līnijai, kas savieno atomu kodolus.
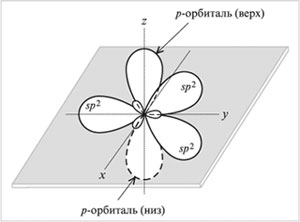
Orbitāles (trīs sp 2 un viena p)
oglekļa atoms sp 2 -hibridizācijā
Kovalentā saite, ko veido sānu pārklāšanās R-sauc par blakus esošo oglekļa atomu orbitālēm pi ( ) -savienojums.
Izglītība
-savienojums
Tā kā orbītas pārklājas mazāk, β-saite ir mazāk spēcīga nekā β-saite.
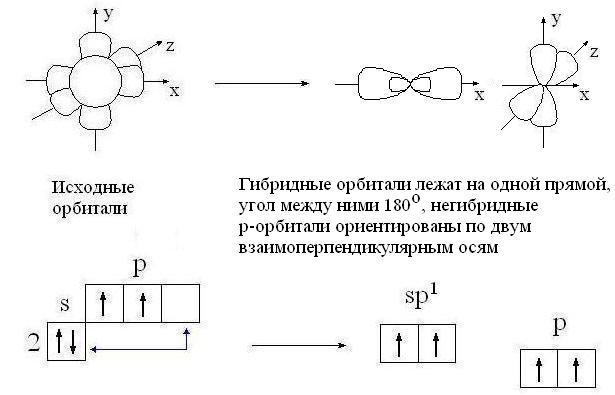
sp-Hibridizācija Vai sajaukšana (formas un enerģijas saskaņošana) ir viena s- un viens
R-orbitāli ar divu hibrīdu veidošanos sp- orbitāles. sp-Orbitāles atrodas vienā līnijā (180 ° leņķī) un ir vērstas pretējos virzienos no oglekļa atoma kodola. Divi
R-orbitāles paliek nehibridizētas. Tie ir novietoti savstarpēji perpendikulāri
komunikācijas virzieni. Uz attēla sp-orbitāles ir parādītas gar asi g, un nehibridizēti divi
R-orbitāli - gar asīm NS un z.
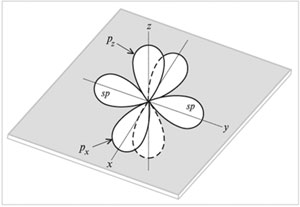
Atomu orbitāles (divi sp un divi p)
sp-hibridizēts ogleklis
CC trīskāršā oglekļa-oglekļa saite sastāv no β-saites, kas rodas pārklāšanās rezultātā
sp-hibrīda orbitāles un divas obligācijas.
Sakarība starp tādiem oglekļa atoma parametriem kā piesaistīto grupu skaits, hibridizācijas veids un izveidoto ķīmisko saišu veidi ir parādīti 4. tabulā.
Kovalentās oglekļa saites
Grupu skaits
saistīts
ar oglekli
Veids
hibridizācija
Veidi
piedaloties
ķīmiskās saites
Salikto formulu piemēri
sp 3
Četri - komunikācija
sp 2
Trīs - komunikācijas un
viens - obligācija
sp
Divi - komunikācija
un divi -savienojumi
H – CC – H
Vingrinājumi.
1. Kādus atomu elektronus (piemēram, oglekli vai slāpekli) sauc par pāriem?
2. Ko nozīmē “parasto elektronu pāru” jēdziens savienojumos ar kovalentu saiti (piemēram, CH 4 vai H 2 S. )?
3. Kādi ir atomu elektroniskie stāvokļi (piemēram, AR vai N ) sauc par pamata, un kuras ir satrauktas?
4. Ko nozīmē cipari un burti atoma elektroniskajā formulā (piemēram, AR vai N )?
5. Kas ir atomu orbitāle? Cik orbitāļu ir atoma otrajā enerģijas līmenī AR un kā tie atšķiras?
6. Kāda ir atšķirība starp hibrīda orbitālēm un sākotnējām orbitālēm, no kurām tās tika izveidotas?
7. Kādi hibridizācijas veidi ir zināmi oglekļa atomam un kādi tie ir?
Atbildes uz vingrinājumiem
1. Elektronus, kas orbītā atrodas pa vienam, sauc par nepāra elektroniem. Piemēram, ierosinātā oglekļa atoma elektronu difrakcijas formulā ir četri nepāra elektroni, savukārt slāpekļa atomam ir trīs:
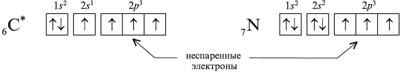
2. Divus elektronus, kas piedalās vienas ķīmiskās saites veidošanā, sauc par kopējo elektronu pāri. Parasti pirms ķīmiskās saites veidošanās viens no šī pāra elektroniem piederēja vienam atomam, bet otrs elektrons piederēja citam atomam:
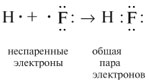
3. Atomu elektronisko stāvokli, kurā tiek ievērota elektronu orbitāļu piepildīšanās secība: 1s 2, 2s 2, 2p 2, 3s 2, 3p 2, 4s 2, 3d 2, 4p 2 utt., sauc par zemi. Valsts. Uzbudinātā stāvoklī viens no atoma valences elektroniem aizņem brīvu orbitāli ar augstāku enerģiju, šādu pāreju pavada pārī savienotu elektronu atdalīšana. Shematiski tas ir uzrakstīts šādi:
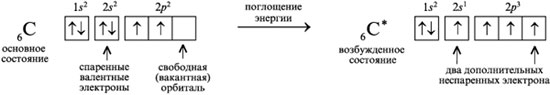
Kamēr pamata stāvoklī bija tikai divi valences nepāra elektroni, ierosinātā stāvoklī ir četri šādi elektroni.
5.
Atomu orbitāle ir funkcija, kas apraksta elektronu mākoņa blīvumu katrā telpas punktā ap dotā atoma kodolu. Otrajā oglekļa atoma enerģijas līmenī ir četras orbitāles - 2s, 2p x, 2p y, 2p z. Šīs orbitāles ir atšķirīgas:
a) elektronu mākoņa forma (s - bumba, p - hantele);
b) p-orbitālēm ir dažādas orientācijas telpā - pa savstarpēji perpendikulārām asīm x, y un z, tās apzīmē ar p x, p y, p z.
6.
Hibrīdās orbitāles atšķiras no oriģinālajām (nehibrīdajām) orbitālēm pēc formas un enerģijas. Piemēram, s-orbitāle ir sfēras forma, p ir simetrisks astoņnieks, sp-hibrīda orbitāle ir asimetrisks astoņnieks.
Enerģijas atšķirība: E (s)< E(sр) < E(р). Таким образом, sp-орбиталь – усредненная по форме и энергии орбиталь, полученная смешиванием исходных s- и p-орбиталей.
7. Oglekļa atomam ir zināmi trīs hibridizācijas veidi: sp 3, sp 2 un sp (sk. tekstu 5. nodarbībā).
9.
-saite - kovalentā saite, ko veido orbitāļu tieša pārklāšanās pa līniju, kas savieno atomu centrus.
-saite - kovalentā saite, ko veido p-orbitāļu sānu pārklāšanās abās atomu centrus savienojošās līnijas pusēs.
-Bondu parāda otrā un trešā domuzīme starp savienotajiem atomiem.
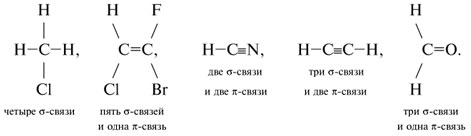
10.