Parunāsim par to, kā noteikt hibridizācijas veidu
Parunāsim par to, kā noteikt hibridizācijas veidu, kā arī apsvērsim molekulas ģeometrisko struktūru.
Termina parādīšanās vēsture
Divdesmitā gadsimta sākumā L. Paulingls ierosināja teoriju par molekulu ģeometriju ar kovalento saiti. Elektronu mākoņu pārklāšanās tika ņemta par pamatu saites veidošanai. Šo metodi sāka saukt par valences saitēm. Kā noteikt savienojumos esošo atomu hibridizācijas veidu? Teorijas autors ierosināja ņemt vērā hibrīdu orbitāļu sajaukšanos.
Definīcija
Lai saprastu, kā noteikt savienojumu hibridizācijas veidu, analizēsim, ko nozīmē šis termins.
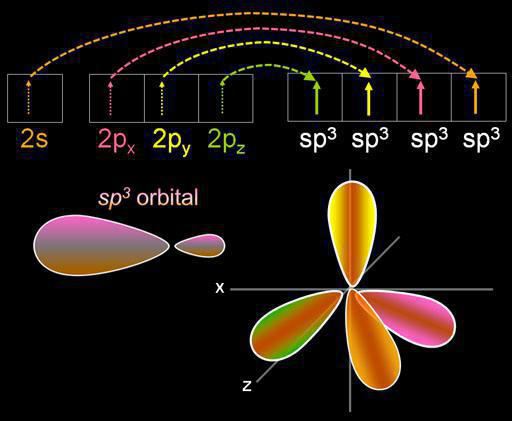
Hibridizācija ir elektronu orbitāļu sajaukšanās. Šo procesu pavada enerģijas sadalījums tajos, to formas maiņa. Atkarībā no sajaukto s- un p-orbitāļu daudzuma, hibridizācijas veids var būt atšķirīgs. Organiskajos savienojumos oglekļa atoms var pastāvēt sp, sp2, sp3 stāvoklī. Ir arī sarežģītākas formas, kurās papildus sp ir iesaistīta d orbitāle.
Noteikumi neorganisko vielu noteikšanai molekulās
Ir iespējams identificēt hibridizācijas variantu savienojumiem ar ABp tipa kovalento ķīmisko saiti. A ir galvenais atoms, B ir ligands, n ir skaitlis no diviem vai vairāk. Šādā situācijā hibridizācijā nonāks tikai galvenā atoma valences orbitāles.
Noteikšanas metodes
Parunāsim sīkāk par to, kā noteikt hibridizācijas veidu. Ķīmiskā nozīmē šis termins nozīmē izmaiņas orbitāļu enerģijā un formā. Līdzīgs process vērojams gadījumos, kad saites veidošanai tiek izmantoti dažāda veida elektroni.
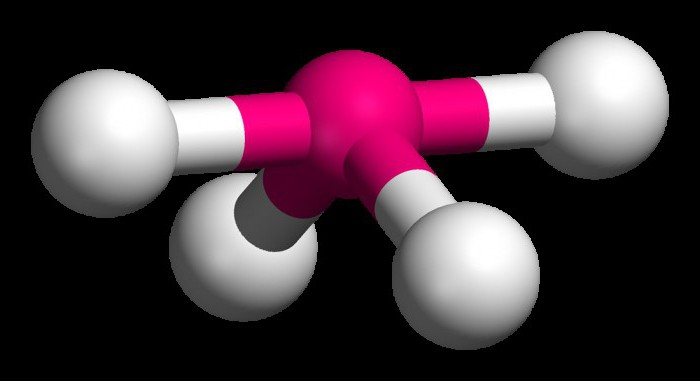
Lai saprastu, kā noteikt hibridizācijas veidu, apsveriet metāna molekulu. Šī viela ir pirmais homologās piesātināto (piesātināto) ogļūdeņražu sērijas pārstāvis. Kosmosā CH4 molekula ir tetraedrs. Viens oglekļa atoms veido saites ar ūdeņražiem, kas ir līdzīgi pēc enerģijas un garuma. Lai izveidotu šādus hibrīdmākoņus, tiek izmantoti trīs p- un viens es-elektrons.
Sajaucas četri mākoņi, un ir četras identiskas (hibrīdas) sugas, kurām ir neregulāra astoņnieka forma. Šo hibridizācijas veidu sauc par sp3. Visiem ogļūdeņražiem, kas satur tikai vienkāršas (vienas) saites, ir raksturīga šāda veida oglekļa atoma hibridizācija. Saites leņķis ir 109 grādi 28 minūtes.
Turpināsim runāt par to, kā noteikt hibridizācijas veidu. Etilēna sērijas piemēri sniedz priekšstatu par sp2 hibridizāciju. Piemēram, etilēna molekulā no četrām tikai trīs tiek izmantotas ķīmiskās saites veidošanā. Atlikušais nehibrīdais p-elektrons tiek tērēts dubultās saites veidošanai.
Acetilēns ir vienkāršākais СН2п-2 klases pārstāvis. Šīs ogļūdeņražu klases iezīme ir trīskāršās saites klātbūtne. No četriem oglekļa atoma valences elektroniem tikai divi maina savu formu un enerģiju, kļūstot par hibrīdiem. Divi atlikušie elektroni piedalās divu dubultsaišu veidošanā, kas nosaka šīs organisko savienojumu klases nepiesātināto raksturu.
Secinājums
Apsverot jautājumu par bioloģisko un ņemot vērā hibridizāciju, kamēr notiek to enerģijas un formas saskaņošana. Elektronu, kas atrodas netālu no saistītā atoma kodola, raksturo orbitāļu kopa, kurai ir vienāda informācija par hibridizācijas veidu, ļauj novērtēt vielas ķīmiskās īpašības.







