§ 7. Atomu orbitāļu hibridizācija un molekulu ģeometrija
Kovalentā saite ir visizplatītākā organisko vielu pasaulē, to raksturo piesātinājums, polarizējamība un virziens telpā.
Kovalentās saites piesātinājums ir tāds, ka kopējo elektronu pāru skaits, ko var veidot konkrēts atoms, ir ierobežots. Sakarā ar to kovalentajiem savienojumiem ir stingri noteikts sastāvs. Tāpēc, piemēram, ir H 2, N 2, CH 4 molekulas, bet nav H 3, N 4, CH 5 molekulu.
Kovalentās saites polarizējamība ir molekulu (un tajās esošo atsevišķu saišu) spēja ārējā elektriskā lauka iedarbībā mainīt savu polaritāti - polarizēties.
Polarizācijas rezultātā nepolārās molekulas var kļūt polāras, bet polārās – vēl polārākās līdz pilnīgai atsevišķu saišu pārrāvumam ar jonu veidošanos:
Kovalentās saites virziens ir saistīts ar to, ka p-, d- un f-mākoņi ir noteiktā veidā orientēti telpā. Kovalentās saites virziens ietekmē vielu molekulu formu, to lielumu, starpatomiskos attālumus, saites leņķi, t.i., molekulu ģeometriju.
Pilnīgāku priekšstatu par organisko un neorganisko vielu molekulu formu var izveidot, pamatojoties uz hipotēzi par atomu orbitāļu hibridizāciju. To ierosināja L. Paulings (ASV), lai izskaidrotu visu ķīmisko saišu ekvivalences faktu un to simetrisko izvietojumu attiecībā pret CH 4, BF 3, BeCl 2 molekulu centru, kas noteikts, izmantojot vielu fizikālās izpētes metodes. σ-saišu veidošanā katrā gadījumā no centrālā atoma (C, B, Be) bija jāpiedalās elektroniem dažādos stāvokļos (s un p), tāpēc tie nevarēja būt līdzvērtīgi. Teorija izrādījās nespēja izskaidrot faktus, radās pretruna, kas tika atrisināta ar jaunas hipotēzes palīdzību. Šis ir viens no piemēriem, kas parāda cilvēka apkārtējās pasaules izziņas attīstības ceļu, iespēju arvien dziļāk iekļūt parādību būtībā.
Jūs iepazināties ar hipotēzi par atomu orbitāļu hibridizāciju organiskās ķīmijas kursā, izmantojot oglekļa atoma piemēru. Atgādināsim šo vēl vienu reizi.
Kad veidojas metāna CH4 molekula, oglekļa atoms no pamatstāvokļa pāriet ierosinātā:
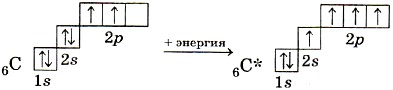
Ierosinātā oglekļa atoma ārējais elektronu slānis satur vienu s- un trīs nepāra p-elektronus, kas veido četras σ-saites ar četriem s-elektroniem ūdeņraža atomiem. Jārēķinās, ka trīs C-H saitēm, kas veidojas, savienojoties pārī trīs oglekļa atoma p-elektroniem ar trim s-elektroniem no trīs ūdeņraža atomiem (s-p σ-saite), pēc stiprības jāatšķiras no ceturtās (ss) saites. , garums, virziens. Elektronu blīvuma izpēte metāna molekulās parāda, ka visas saites tā molekulā ir līdzvērtīgas un vērstas uz tetraedra virsotnēm (10. att.). Saskaņā ar hipotēzi par atomu orbitāļu hibridizāciju, metāna molekulas četras kovalentās saites veidojas nevis ar oglekļa atoma “tīro” s- un p-mākoņu piedalīšanos, bet gan ar tā sauktā hibrīda līdzdalību. tas ir, vidēji ekvivalenti elektronu mākoņi.
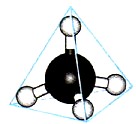
Rīsi. 10. Metāna molekulas lodīšu un nūju modelis
Saskaņā ar šo modeli hibrīdu atomu orbitāļu skaits ir vienāds ar sākotnējo "tīro" orbitāļu skaitu. Atbilstošie hibrīdmākoņi ir ģeometriski izdevīgāki par s- un p-mākoņiem, to elektronu blīvums ir atšķirīgi sadalīts, kas nodrošina pilnīgāku pārklāšanos ar ūdeņraža atomu s-mākoņiem, nekā tas būtu "tīro" s- un p-mākoņu gadījumā. mākoņi.
Metāna molekulā un citos alkānos, kā arī visās organisko savienojumu molekulās vienas saites vietā oglekļa atomi atrodas sp 3 -hibridizācijas stāvoklī, ti, vienam s- un trīs p-atomu mākoņiem ir tika veikta hibridizācija pie oglekļa atoma un četrām identiskām hibrīda sp 3 -atomu mākoņu orbitālēm.
Atbilstošo četru oglekļa atoma hibrīdu sp 3 -mākoņu pārklāšanās rezultātā ar četru ūdeņraža atomu s-mākoņiem veidojas tetraedriska metāna molekula ar četrām identiskām σ-saitēm, kas atrodas 109 ° 28 "leņķī. (11. att.).
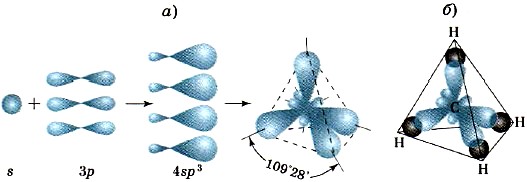
Rīsi. vienpadsmit.
Valences elektronu mākoņu sp 3 -hibridizācijas shēmas (a) un saišu veidošanās metāna molekulā (b)
Šāda veida atomu hibridizācija un līdz ar to arī tetraedriskā struktūra raksturos oglekļa analogo savienojumu molekulas - silīciju: SiH 4, SiCl 4.
Veidojot ūdens un amonjaka molekulas, notiek arī skābekļa un slāpekļa atomu valences atomu orbitāļu sp 3 -hibridizācija. Taču, ja pie oglekļa atoma visus četrus hibrīda sp 3 -mākoņus aizņem kopīgi elektronu pāri, tad pie slāpekļa atoma vienu sp 3 -mākoni aizņem vientuļš elektronu pāris, bet pie skābekļa atoma tos jau aizņem divi. sp 3 -mākoņi (12. att.).
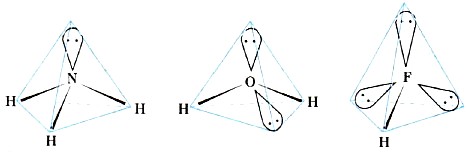
Rīsi. 12.
Amonjaka, ūdens un fluorūdeņraža molekulu formas
Vientuļo elektronu pāru klātbūtne izraisa saites leņķu samazināšanos (8. tabula), salīdzinot ar tetraedriskiem (109 ° 28 ").
8. tabula
Saikne starp vientuļo elektronu pāru skaitu un saites leņķi molekulās

sp 3 -Hibridizācija ir novērojama ne tikai atomos sarežģītās vielās, bet arī atomos vienkāršās vielās. Piemēram, tādas oglekļa alotropās modifikācijas atomi kā dimants.
Dažu bora savienojumu molekulās notiek bora atoma valences atomu orbitāļu sp 2 -hibridizācija.
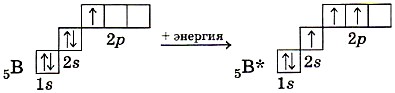
Uzbudinātā bora stāvoklī hibridizācijā piedalās viena s un divas p orbitāles, kā rezultātā veidojas trīs sp 2 hibrīda orbitāles, atbilstošo hibrīdu mākoņu asis atrodas plaknē 120° leņķī pret katru. cits (13. att.).
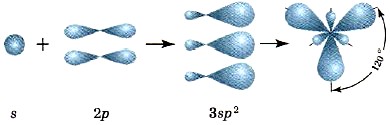
Rīsi. trīspadsmit.
8p 2 -hibridizācijas shēmas un sp 2 -mākoņu izvietojums kosmosā
Tāpēc šādu savienojumu molekulām, piemēram, BF3, ir plakana trīsstūra forma (14. att.).
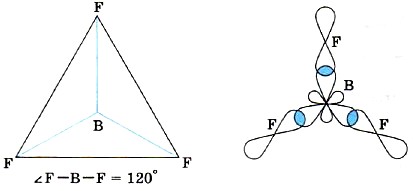
Rīsi. 14.
BF3 molekulas struktūra
Organiskajos savienojumos, kā zināms, sp 2 -hibridizācija ir raksturīga oglekļa atomiem alkēnos dubultsaites vietā, kas izskaidro šo molekulu daļu, kā arī diēnu un arēnu molekulu plakano struktūru. sp 2 -Hibridizācija tiek novērota arī pie oglekļa atomiem un tādā oglekļa alotropā modifikācijā kā grafīts.
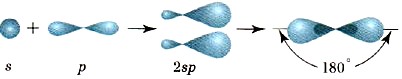
Dažu berilija savienojumu molekulās tiek novērota berilija atoma valences orbitāļu sp-hibridizācija ierosinātā stāvoklī.
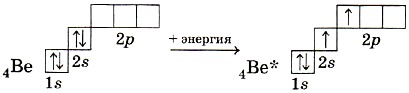
Divi hibrīdmākoņi ir orientēti viens pret otru 180° leņķī (15. att.), un tāpēc berilija hlorīda molekulai BeCl 2 ir lineāra forma.
Rīsi. 15.
Sp-hibridizācijas shēmas un sp-mākoņu izvietojums kosmosā
Līdzīga veida atomu orbitāļu hibridizācija pastāv oglekļa atomiem alkīnās - acetilēna sērijas ogļūdeņražos - trīskāršās saites vietā.
Šāda orbitāļu hibridizācija ir raksturīga oglekļa atomiem citā tās alotropiskajā modifikācijā - karbīnā:
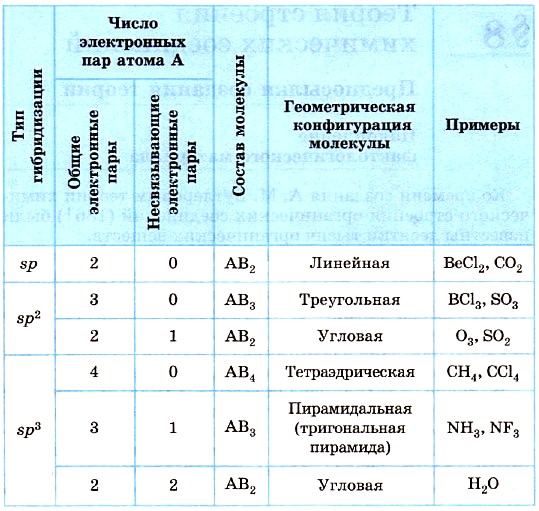
9. tabulā parādīti molekulu ģeometrisko konfigurāciju veidi, kas atbilst dažiem centrālā atoma A orbitāļu hibridizācijas veidiem, ņemot vērā brīvo (nesaistošo) elektronu pāru skaita ietekmi.
9. tabula
Molekulu ģeometriskās konfigurācijas, kas atbilst dažādiem centrālā atoma ārējo elektronu orbitāļu hibridizācijas veidiem
Jautājumi un uzdevumi 7.§
- Oglekļa, slāpekļa un skābekļa ūdeņraža savienojumu molekulās, kuru formulas ir CH 4, NH 3 un H 2 O, nemetālu centrālo atomu valences orbitāles atrodas sp 3 -hibridizācijas stāvoklī, bet saites leņķi ir dažādi - attiecīgi 109 ° 28 "107 ° 30" un 104 ° 27 ". Kā to izskaidrot?
- Kāpēc grafīts nav elektriski vadošs un dimants ne?
- Kāda ģeometriskā forma būs divu fluorīdu – bora un slāpekļa (attiecīgi BF 3 un NF 3) – molekulām? Sniedziet argumentētu atbildi.
- Silīcija fluorīda molekulai SiF 4 ir tetraedriska struktūra, bet broma hlorīda ВСl 3 molekulai ir trīsstūra forma - plakana. Kāpēc?







