Kālija permanganāta sadalīšanās. Mangānskābes sāļu īpašības
Redoksprocesi ir pamatā svarīgākajām dzīvās un nedzīvās dabas parādībām: sadegšana, sarežģītu vielu sadalīšanās, organisko savienojumu sintēze. Kālija permanganāts, kura īpašības mēs pētīsim mūsu rakstā, attiecas uz tām, ko izmanto laboratorijas un rūpnieciskos apstākļos. Tā oksidēšanas spēja ir atkarīga no atoma oksidācijas stāvokļa, kas mainās reakcijas laikā. Apskatīsim to konkrētos piemēros, kas notiek, piedaloties KMnO 4 molekulām.
Vielas raksturojums
Savienojums, kuru apsveram (kālija permanganāts) ir viena no rūpniecībā visbiežāk lietotajām vielām – mangāna savienojumi. Sāli attēlo kristāli regulāru tumši violetas krāsas prizmu veidā. Tas labi šķīst ūdenī un veido aveņu krāsas šķīdumu ar izcilām baktericīdām īpašībām. Tāpēc viela ir atradusi plašu pielietojumu gan medicīnā, gan ikdienas dzīvē kā baktericīds līdzeklis. Tāpat kā citi septiņvērtīgie mangāna savienojumi, sāls spēj oksidēt daudzus organiskos un neorganiskos savienojumus. Kālija permanganāta sadalīšanos izmanto ķīmiskajās laboratorijās, lai iegūtu nelielu daudzumu tīra skābekļa. Savienojums oksidē sulfītskābi par sulfātu. Rūpniecībā KMnO 4 izmanto, lai atdalītu gāzveida hloru no sālsskābes. Tas arī oksidē lielāko daļu organisko vielu, spēj pārvērst dzelzs sāļus trīsvērtīgo savienojumu formā.
Eksperimenti ar kālija permanganātu
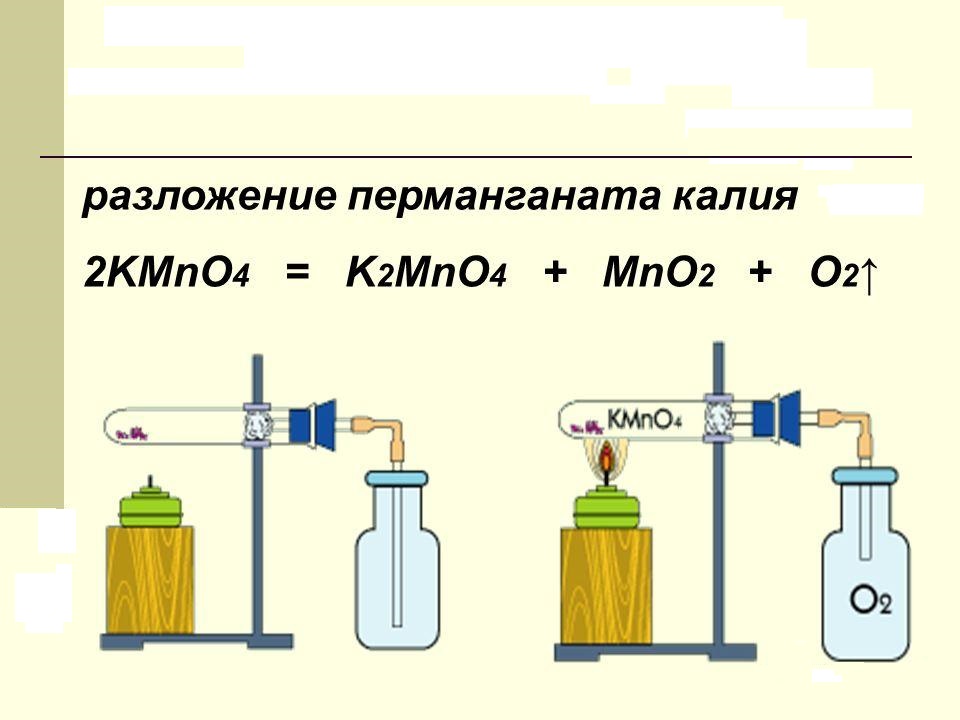
Viela, ko ikdienā sauc par kālija permanganātu, karsējot sadalās. Reakcijas produkti satur brīvo skābekli, mangāna dioksīdu un jaunu sāli - K 2 MnO 4. Laboratorijā šo procesu veic, lai iegūtu tīru skābekli. Kālija permanganāta sadalīšanās ķīmisko vienādojumu var attēlot šādi:
2KMnO 4 = K 2 MnO 4 + MnO 2 + O 2.
Sausā viela, kas ir purpursarkani kristāli regulāru prizmu veidā, tiek uzkarsēta līdz +200 ° C temperatūrai. Sālī esošā mangāna katjona oksidācijas pakāpe ir +7. Reakcijas produktos tas samazinās līdz vērtībām +6 un +4, attiecīgi.
Etilēna oksidēšana
Gāzveida ogļūdeņražiem, kas pieder pie dažādām organisko savienojumu klasēm, molekulās ir gan viena, gan vairākas saites starp oglekļa atomiem. Kā noteikt pi saišu klātbūtni, kas ir organiskā savienojuma nepiesātinātības pamatā? Šim nolūkam tiek veikti ķīmiskie eksperimenti, pārbaudāmo vielu (piemēram, etēnu vai acetilēnu) izlaižot cauri violetai, un tiek novērota tās krāsas maiņa, jo tiek iznīcināta nepiesātinātā saite. Etilēna molekula tiek oksidēta un no nepiesātināta ogļūdeņraža tiek pārveidota par divvērtīgu piesātinātu spirtu - etilēnglikolu. Šī reakcija ir kvalitatīva dubulto vai trīskāršo saišu klātbūtnei.
KMnO4 ķīmisko izpausmju iezīmes
Ja mainās reaģentu un reakcijas produktu oksidācijas pakāpe, notiek redoksreakcija. Tas ir balstīts uz elektronu kustības fenomenu no viena atoma uz otru. Tāpat kā kālija permanganāta sadalīšanās gadījumā un citās reakcijās, vielai ir izteiktas oksidētāja īpašības. Piemēram, paskābinātā nātrija sulfīta un kālija permanganāta šķīdumā veidojas nātrija, kālija un mangāna sulfāti, kā arī ūdens:
5Na 2 SO 3 + 2 KMnO 4 + 3H 2 SO 4 = 2 MnSO 4 + 5 Na 2 SO 4 + K 2 SO 4 + 3H 2 0.
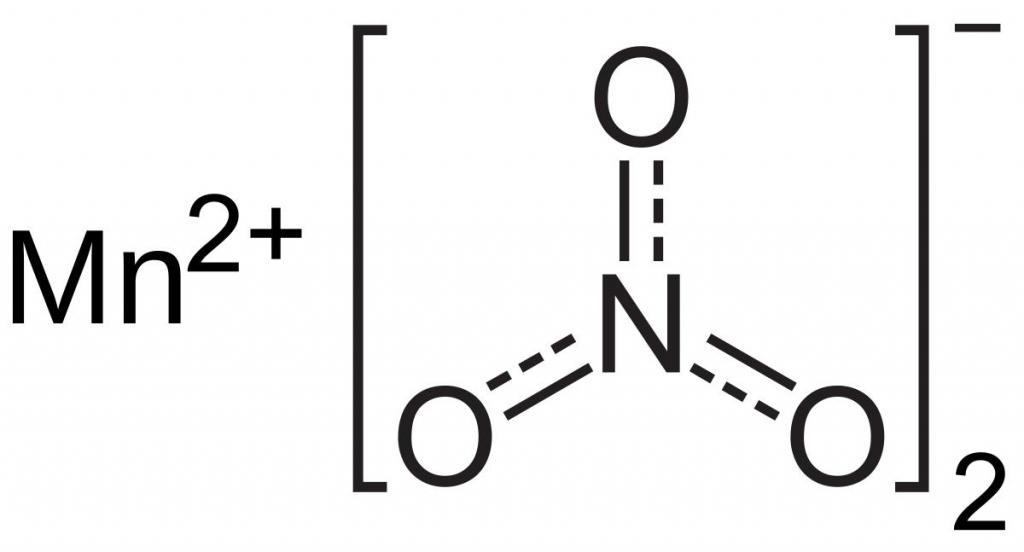
Šajā gadījumā sēra jons ir reducētājs, un mangānam, kas ir daļa no kompleksā anjona MnO 4 -, piemīt oksidētāja īpašības. Tas pieņem piecus elektronus, tāpēc tā oksidācijas pakāpe samazinās no +7 līdz +2.
Vides ietekme uz ķīmiskās reakcijas gaitu
Atkarībā no ūdeņraža jonu vai hidroksilgrupu koncentrācijas izšķir skābo, sārmainu vai neitrālu šķīduma raksturu, kurā notiek redoksreakcija. Piemēram, ar pārmērīgu ūdeņraža katjonu saturu mangāna jons ar oksidācijas pakāpi +7 kālija permanganātā pazemina to līdz +2. Sārmainā vidē ar augstu hidroksilgrupu koncentrāciju nātrija sulfīts, mijiedarbojoties ar kālija permanganātu, tiek oksidēts līdz sulfātam. Mangāna jons ar oksidācijas pakāpi +7 pāriet katjonā ar lādiņu +6, kas ir K 2 MnO 4 sastāvā, kura šķīdumam ir zaļa krāsa. Neitrālā vidē nātrija sulfīts un kālija permanganāts reaģē viens ar otru, bet mangāna dioksīds tiek nogulsnēts. Mangāna katjona oksidācijas pakāpe samazinās no +7 līdz +4. Reakcijas produkti satur arī nātrija sulfātu un sārmu-nātrija hidroksīdu.

Mangānskābes sāļu izmantošana
Rūpniecībā bieži izmanto karsētu kālija permanganātu un citus redoksprocesus, kuros iesaistīti mangānskābes sāļi. Piemēram, daudzu organisko savienojumu oksidēšana, gāzveida hlora izdalīšanās no sālsskābes, dzelzs sāļu pārvēršana par dzelzi. Lauksaimniecībā KMnO 4 šķīdumu izmanto sēklu un augsnes pirmssējas apstrādei, medicīnā – brūču virsmas apstrādei, iekaisušo deguna dobuma gļotādu dezinficēšanai un personīgās higiēnas priekšmetu dezinfekcijai.
Mūsu rakstā mēs ne tikai detalizēti pētījām kālija permanganāta sadalīšanos, bet arī pārbaudījām tā oksidējošās īpašības un izmantošanu ikdienas dzīvē un rūpniecībā.







