Tipisku uzdevumu risināšanas piemēri. Cik reizes palielinās reakcijas ātrums:
1. piemērs
Cik reizes palielinās reakcijas ātrums:
a) C+2H2=CH4
b) 2 NO + Cl 2 = 2 NOCl
kad spiediens sistēmā trīskāršojas?
Risinājums:
Trīskāršs spiediena pieaugums sistēmā ir līdzvērtīgs katras gāzveida sastāvdaļas koncentrācijas trīskāršam palielinājumam.
Saskaņā ar masu iedarbības likumu mēs pierakstām katras reakcijas kinētiskos vienādojumus.
a) Ogleklis ir cieta fāze, un ūdeņradis ir gāzveida fāze. Neviendabīgas reakcijas ātrums nav atkarīgs no cietās fāzes koncentrācijas, tāpēc tas nav iekļauts kinētiskajā vienādojumā. Pirmās reakcijas ātrumu apraksta vienādojums
Lai sākotnējā ūdeņraža koncentrācija būtu NS, tad v 1 = kx 2. Trīs reizes palielinot spiedienu, ūdeņraža koncentrācija kļuva par 3 NS un reakcijas ātrumu v 2 = k (3x) 2 = 9 x 2. Tālāk mēs atrodam ātrumu attiecību:
1. versija: 2. versija = 9 x 2: 2. x = 9.
Tātad reakcijas ātrums palielināsies 9 reizes.
b) Otrās reakcijas kinētisko vienādojumu, kas ir viendabīgs, var uzrakstīt kā 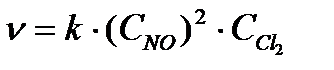 ... Ļaujiet sākuma koncentrācijai NĒ ir vienāds ar NS, un sākotnējā koncentrācija Сl 2 ir vienāds ar plkst, tad v 1 = kx 2 y; v 2 = k (3x) 2 3 g = 27 kx 2 g;
... Ļaujiet sākuma koncentrācijai NĒ ir vienāds ar NS, un sākotnējā koncentrācija Сl 2 ir vienāds ar plkst, tad v 1 = kx 2 y; v 2 = k (3x) 2 3 g = 27 kx 2 g;
v 2:v 1 = 27.
Reakcijas ātrums palielināsies 27 reizes.
2. piemērs
Reakcija starp vielām A un B notiek saskaņā ar vienādojumu 2A + B = C. Vielas A koncentrācija ir 6 mol / l, un vielas B ir 5 mol / l. Reakcijas ātruma konstante ir 0,5 (l 2 ∙ mol -2 ∙ s -1). Aprēķināt ķīmiskās reakcijas ātrumu sākuma momentā un brīdī, kad reakcijas maisījumā paliek 45% vielas B.
Risinājums:
Pamatojoties uz efektīvo masu likumu, ķīmiskās reakcijas ātrums sākotnējā brīdī ir vienāds ar:
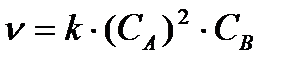 = 0,5 ∙ 6 2 ∙ 5 = 90,0 mol ∙ s -1 ∙ l -1
= 0,5 ∙ 6 2 ∙ 5 = 90,0 mol ∙ s -1 ∙ l -1
Pēc kāda laika reakcijas maisījumā paliks 45% vielas B, tas ir, vielas B koncentrācija kļūs vienāda ar 5. 0,45 = 2,25 mol / l. Tas nozīmē, ka B vielas koncentrācija ir samazinājusies par 5,0 - 2,25 = 2,75 mol / l.
Tā kā vielas A un B mijiedarbojas viena ar otru attiecībā 2:1, vielas A koncentrācija samazinājās par 5,5 mol / l (2,75 ∙ 2 = 5,5) un kļuva vienāda ar 0,5 mol / l (6, 0 - 5,5 = 0,5).
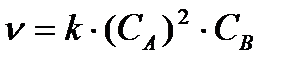 = 0,5 (0,5) 2 ∙ 2,25 = 0,28 mol ∙ s -1 ∙ l -1.
= 0,5 (0,5) 2 ∙ 2,25 = 0,28 mol ∙ s -1 ∙ l -1.
Atbilde: 0,28 mol ∙ s -1 ∙ l -1
3. piemērs
Temperatūras reakcijas ātruma koeficients g ir 2.8. Par cik grādiem tika paaugstināta temperatūra, ja reakcijas laiks tika samazināts 124 reizes?
Risinājums:
Saskaņā ar Van't Hoff likumu v 1 = v 2 ×... Reakcijas laiks t ir lielums, kas ir apgriezti proporcionāls ātrumam, tad v 2 / v 1 = t 1 / t 2 = 124.
t 1 / t 2 = = 124
Ņemsim pēdējās izteiksmes logaritmu:
lg ( )= lg 124;
DТ / 10× lgg = lg 124;
DT = 10× lg124 / lg2.8 » 47 0 .
Temperatūra tika paaugstināta par 47 0.
4. piemērs
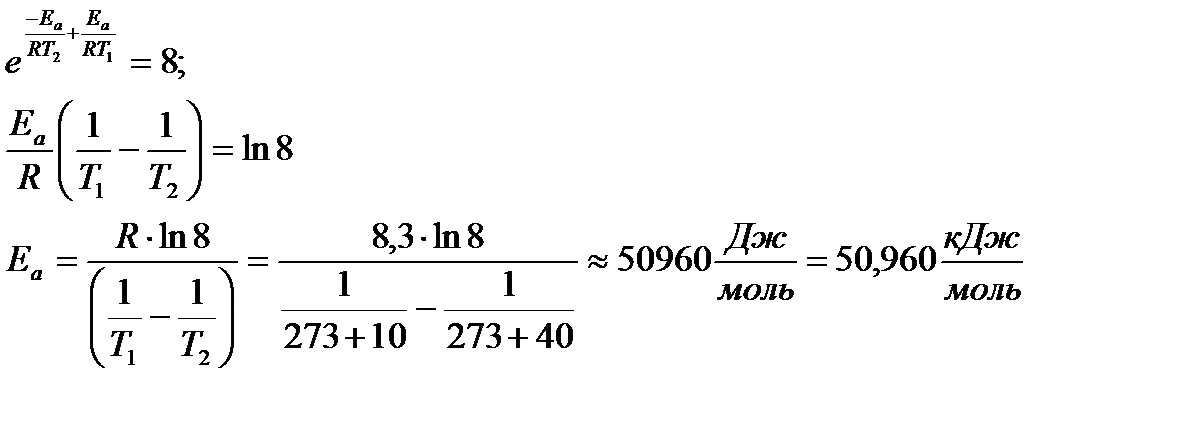
Paaugstinoties temperatūrai no 10 0 С līdz 40 0 С, reakcijas ātrums palielinājās 8 reizes. Kāda ir reakcijas aktivācijas enerģijas vērtība?
Risinājums:
Reakcijas ātrumu attiecība dažādās temperatūrās ir vienāda ar ātruma konstantu attiecību vienādās temperatūrās un ir vienāda ar 8. Saskaņā ar Arrēnija vienādojumu
k 2 / k 1 = A × / A = 8
Tā kā preeksponenciālais faktors un aktivizācijas enerģija ir praktiski neatkarīgi no temperatūras, tad
5. piemērs
973 grādu temperatūrā UZ reakcijas līdzsvara konstante
NiO + H2 = Ni + H2O (g)
Risinājums:
Mēs pieņemam, ka sākotnējā ūdens tvaiku koncentrācija bija nulle. Šīs neviendabīgās reakcijas līdzsvara konstantes izteiksme ir šāda: 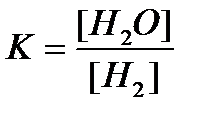 .
.
Pieņemsim, ka līdzsvara brīdim ūdens tvaiku koncentrācija ir kļuvusi vienāda ar x mol / l. Pēc tam saskaņā ar reakcijas stehiometriju ūdeņraža koncentrācija samazinājās par x mol / l un kļuva līdzvērtīgs (3 - x) mol / l.
Aizstāt līdzsvara koncentrācijas izteiksmē līdzsvara konstanti un atrast NS:
K = x / (3 - x); x / (3 - x) = 0,32; x = 0,73 mol / l.
Tātad ūdens tvaiku līdzsvara koncentrācija ir 0,73 mol/l,ūdeņraža līdzsvara koncentrācija ir 3 - 0,73 = 2,27 mol / l.
6. piemērs
Kā reakcija ietekmēs līdzsvaru? 2SO 2 + O 2 ⇄ 2 SO 3; DH = -172,38 kJ:
1) paaugstināta koncentrācija SO 2, 2) spiediena palielināšanās sistēmā,
3) sistēmas dzesēšana, 4) katalizatora ievadīšana sistēmā?
Risinājums:
Pēc Le Šateljē principa, pieaugot koncentrācijai SO 2 līdzsvars novirzīsies uz procesu, kas noved pie izdevumiem SO 2, tas ir, pret veidošanās tiešo reakciju SO 3.
Reakcija nāk ar skaita izmaiņām kurmis gāzveida vielas, tāpēc spiediena izmaiņas izraisīs līdzsvara maiņu. Palielinoties spiedienam, līdzsvars pārvietosies uz procesu, kas neitralizē šīs izmaiņas, tas ir, notiek ar skaita samazināšanos. kurmis gāzveida vielas, un līdz ar to ar spiediena samazināšanos. Saskaņā ar reakcijas vienādojumu, skaitlis kurmis gāzveida izejmateriāli ir vienāds ar trīs, un skaitlis kurmis tiešās reakcijas produkti ir vienādi ar diviem. Tāpēc, palielinoties spiedienam, līdzsvars virzīsies uz tiešo veidošanās reakciju SO 3.
Jo DН< 0, tad tiešā reakcija notiek ar siltuma izdalīšanos (eksotermiska reakcija). Reversā reakcija turpināsies ar siltuma absorbciju (endotermiskā reakcija). Saskaņā ar Le Šateljē principu dzesēšana izraisīs līdzsvara pāreju uz reakciju, kas notiek ar siltuma izdalīšanos, tas ir, uz tiešu reakciju.
Katalizatora ievadīšana sistēmā neizraisa ķīmiskā līdzsvara maiņu.
7. piemērs
10 0 C temperatūrā reakcija beidzas 95 s, bet 20 0 C - 60 s. Aprēķiniet šīs reakcijas aktivācijas enerģiju.
Risinājums:
Reakcijas laiks ir apgriezti proporcionāls tā ātrumam. Tad 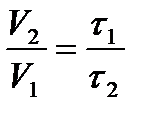 .
.
Sakarību starp reakcijas ātruma konstanti un aktivācijas enerģiju nosaka Arrēnija vienādojums:
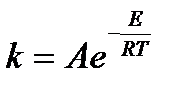
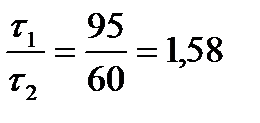
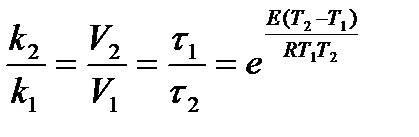 = 1,58.
= 1,58.
ln1,58 = 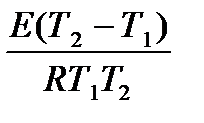 ;
;
Atbilde: 31,49 kJ / mol.
8. piemērs
Amonjaka N 2 + 3H 2 2NH 3 sintēzē līdzsvars tika izveidots pie šādām reaģentu koncentrācijām (mol / l):
Aprēķiniet šīs reakcijas līdzsvara konstanti un slāpekļa un ūdeņraža sākotnējās koncentrācijas.
Risinājums:
Nosakiet šīs reakcijas līdzsvara konstanti KC:
K C= 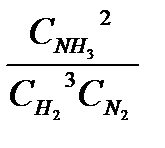 = (3,6) 2 / 2,5 (1,8) 3 = 0,89
= (3,6) 2 / 2,5 (1,8) 3 = 0,89
Slāpekļa un ūdeņraža sākotnējās koncentrācijas tiek noteiktas, pamatojoties uz reakcijas vienādojumu. Lai veidotos 2 mol NH 3, tiek patērēts 1 mols slāpekļa, un 3,6 mol amonjaka veidošanai bija nepieciešams 3,6 / 2 = 1,8 mol slāpekļa. Ņemot vērā slāpekļa līdzsvara koncentrāciju, mēs atrodam tā sākotnējo koncentrāciju:
C ref (H2) = 2,5 + 1,8 = 4,3 mol/l
Lai izveidotu 2 molus NH 3, ir nepieciešams patērēt 3 molus ūdeņraža, un, lai iegūtu 3,6 molus amonjaka, nepieciešams 3 ∙ 3,6: 2 = 5,4 mol.
C ref (H2) = 1,8 + 5,4 = 7,2 mol/l.
Tādējādi reakcija sākās koncentrācijās (mol / l): C (N 2) = 4,3 mol / l; C (H2) = 7,2 mol/l
3. tēmas uzdevumu saraksts
1. Reakcija notiek saskaņā ar shēmu 2A + 3B = C. A koncentrācija samazinājās par 0,1 mol/l. Kā mainījās vielu B un C koncentrācijas?
2. Reakcijā CO + H 2 O = CO 2 + H 2 iesaistīto vielu sākotnējās koncentrācijas bija vienādas (mol / l, no kreisās uz labo): 0,3; 0,4; 0,4; 0,05. Kādas ir visu vielu koncentrācijas brīdī, kad ir reaģējusi ½ daļa no sākotnējās CO koncentrācijas?
3. Cik reizes mainīsies reakcijas ātrums 2A + B C, ja vielas A koncentrāciju palielina 2 reizes, bet vielas B koncentrāciju samazina par 3?
4. Kādu laiku pēc reakcijas sākuma 3A + B 2C + D vielu koncentrācija bija (mol / l, no kreisās uz labo): 0,03; 0,01; 0,008. Kādas ir vielu A un B sākotnējās koncentrācijas?
5. CO + Cl 2 sistēmā COCl 2, CO koncentrācija tika palielināta no 0,03 līdz 0,12 mol / l, bet hlora - no 0,02 līdz 0,06 mol / L. Cik reizes ir palielinājies tiešās reakcijas ātrums?
6. Cik reizes jāpalielina B vielas koncentrācija 2A + B sistēmā? A 2 B, lai, A vielas koncentrācijai samazinoties 4 reizes, tiešās reakcijas ātrums nemainās?
7. Cik reizes jāpalielina oglekļa monoksīda (II) koncentrācija 2CO sistēmā? CO 2 + C, lai reakcijas ātrums palielinātos 100 reizes? Kā mainīsies reakcijas ātrums, palielinoties spiedienam 5 reizes?
8. Cik ilgs laiks būs nepieciešams, lai pabeigtu reakciju pie 18 0 С, ja pie 90 0 С tā tiek pabeigta 20 sekundēs, un reakcijas ātruma temperatūras koeficients γ = 3,2?
9. Pie 10 0 С reakcija beidzas pēc 95 s, bet pie 20 0 С pēc 60 s. Aprēķiniet aktivizācijas enerģiju.
10. Cik reizes palielināsies reakcijas ātrums, temperatūrai paaugstinoties no 30 0 līdz 50 0 C, ja aktivācijas enerģija ir 125,5 kJ / mol?
11. Kāda ir reakcijas aktivācijas enerģijas vērtība, kuras ātrums 300 K temperatūrā ir 10 reizes lielāks nekā 280 K temperatūrā?
12. Kāda ir reakcijas aktivācijas enerģija, ja tās ātrums dubultojas, temperatūrai paaugstinoties no 290 līdz 300 K?
13. Dažas reakcijas aktivācijas enerģija ir 100 kJ / mol. Cik reizes mainīsies reakcijas ātrums, temperatūrai paaugstinoties no 27 līdz 37 0 С?
14. Reakcijā N 2 + 3H 2 = 2NH 3 iesaistīto vielu sākotnējās koncentrācijas ir vienādas (mol / l, no kreisās uz labo): 0,2; 0,3; 0. Kādas ir slāpekļa un ūdeņraža koncentrācijas brīdī, kad amonjaka koncentrācija kļūst vienāda ar 0,1 mol/l.
15. Cik reizes mainīsies reakcijas ātrums 2A + B C, ja vielas A koncentrāciju palielina 3 reizes, bet vielas B koncentrāciju samazina 2 reizes?
16. Vielu A un B sākotnējās koncentrācijas reakcijā A + 2B C bija attiecīgi 0,03 un 0,05 mol/l. Reakcijas ātruma konstante ir 0,4. Atrodiet sākotnējo reakcijas ātrumu un ātrumu pēc noteikta laika, kad vielas A koncentrācija samazinās par 0,01 mol / L.
17. Kā mainīsies reakcijas ātrums 2NO + O 2 2NO 2, ja: a) palielina spiedienu sistēmā 3 reizes; b) samazināt sistēmas apjomu 3 reizes?
18. Cik reizes palielināsies pie 298 K notiekošās reakcijas ātrums, ja aktivācijas enerģiju samazina par 4 kJ/mol?
19. Kādā temperatūrā reakcija beigsies 45 minūtēs, ja pie 293 K tas aizņem 3 stundas? Reakcijas temperatūras koeficients ir 3,2.
20. Reakcijas NO 2 = NO + 1 / 2O 2 aktivācijas enerģija ir vienāda ar 103,5 kJ / mol. Šīs reakcijas ātruma konstante pie 298K ir 2,03 ∙ 10 4 s -1. Aprēķiniet šīs reakcijas ātruma konstanti 288 K temperatūrā.
21. Reakcija CO + Cl 2 COCl 2 notiek 10 litru tilpumā. Līdzsvara maisījuma sastāvs: 14 g CO; 35,6 g Cl 2 un 49,5 g COCl 2. Aprēķiniet reakcijas līdzsvara konstanti.
22. Atrodiet reakcijas N 2 O 4 2NO 2 līdzsvara konstanti, ja sākotnējā N 2 O 4 koncentrācija ir 0,08 mol / l un līdz līdzsvara sasniegšanai 50% N 2 O 4 ir atdalījušies.
23. Reakcijas A + B C + D līdzsvara konstante ir vienāda ar vienu. Sākotnējā koncentrācija [A] o = 0,02 mol / l. Cik procentus no A transformējas, ja B, C un D sākotnējās koncentrācijas ir 0,02; 0,01 un 0,02 mol / L, attiecīgi?
24. Reakcijai Н 2 + Вr 2 2HBr noteiktā temperatūrā K = 1. Nosakiet līdzsvara maisījuma sastāvu, ja sākotnējais maisījums sastāvēja no 3 moliem H 2 un 2 moliem broma.
25. Pēc gāzu A un B sajaukšanas sistēmā A + B C + D līdzsvars tiek izveidots pie šādām koncentrācijām (mol / l): [B] = 0,05; [C] = 0,02. Reakcijas līdzsvara konstante ir 4 ∙ 10 3. Atrodiet A un B sākotnējās koncentrācijas.
26. Reakcijas A + B C + D līdzsvara konstante ir vienāda ar vienu. Sākotnējā koncentrācija [A] = 0,02 mol / l. Cik procentus no A transformējas, ja sākotnējā koncentrācija [B] ir 0,02; 0,1 un 0,2 mol / l?
27. Reakcijas amonjaka sintēzes sākuma brīdī koncentrācijas bija (mol / l): = 1,5; = 2,5; = 0. Kāda ir slāpekļa un ūdeņraža koncentrācija pie amonjaka koncentrācijas 0,15 mol/l?
28. Līdzsvars H 2 + I 2 2HI sistēmā tika izveidots pie šādām koncentrācijām (mol / l): = 0,025; = 0,005; = 0,09. Noteikt joda un ūdeņraža sākotnējās koncentrācijas, ja reakcijas sākuma brīdī nebija HI.
29. Karsējot oglekļa dioksīda un ūdeņraža maisījumu slēgtā traukā, tika izveidots līdzsvars CO 2 + H 2 CO + H 2 O. Līdzsvara konstante noteiktā temperatūrā ir 1. Cik procenti no CO 2 pārvērtīsies par CO, ja vienā un tajā pašā temperatūrā sajaucat 2 molus CO 2 un 1 molu H 2.
30. Reakcijas FeO + CO Fe + CO 2 līdzsvara konstante noteiktā temperatūrā ir vienāda ar 0,5. Atrodiet CO un CO 2 līdzsvara koncentrāciju, ja šo vielu sākotnējās koncentrācijas bija attiecīgi 0,05 un 0,01 mol / L.
Risinājumi
Teorētiskie skaidrojumi
Šķīduma koncentrācija ir izšķīdušās vielas relatīvais saturs šķīdumā. Ir divi veidi, kā izteikt šķīdumu koncentrāciju - frakcionēti un koncentrācijas.
Frakcionēta metode
Vielas masas daļa ω - bezizmēra vērtība vai izteikta procentos, aprēķināta pēc formulas
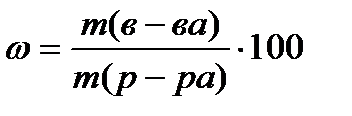 %, (4.1.1)
%, (4.1.1)
kur m (in-va)- vielas masa, G;
m (risinājums)- šķīduma masa, G.
Molu daļa χ
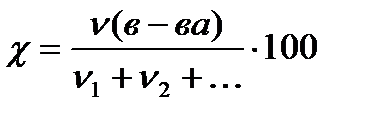 %, (4.1.2)
%, (4.1.2)
kur ν (in-va)- vielas daudzums, kurmis;
ν 1+ν 2+ ... ir visu šķīdumā esošo vielu, ieskaitot šķīdinātāju, daudzumu summa, kurmis.
Tilpuma daļa φ - daudzums ir bezizmēra vai izteikts procentos, aprēķināts pēc formulas
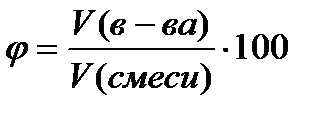 %, (4.1.3)
%, (4.1.3)
kur V (in-va)- vielas tilpums, l;
V (maisījumi)- maisījuma tilpums, l.
Koncentrācijas metode
Molārā koncentrācija C M , mol / L, aprēķina pēc formulas
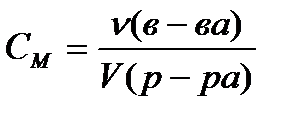 , (4.1.4)
, (4.1.4)
kur ν (in-va)- vielas daudzums, kurmis;
V (risinājums)- šķīduma tilpums, l.
Saīsinātais apzīmējums 0,1 M nozīmē 0,1 molāru šķīdumu (koncentrācija 0,1 mol / l).
Normāla koncentrācija S N , mol / L, aprēķina pēc formulas
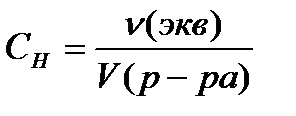 vai
vai 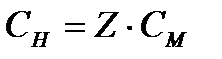 , (4.1.5)
, (4.1.5)
kur ν (ekviv.)- vielas ekvivalenta daudzums, kurmis;
V (risinājums)- šķīduma tilpums, l;
Z Ir līdzvērtīgs skaitlis.
Saīsinātais apzīmējums 0.1n. nozīmē 0,1 normālu šķīdumu (koncentrācija 0,1 mol ekv / l).
Molārā koncentrācija C b , mol / kg, aprēķina pēc formulas
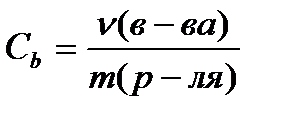 (4.1.6)
(4.1.6)
kur ν (in-va)- vielas daudzums, kurmis;
m (p-la)- šķīdinātāja masa, Kilograms.
Titrs T , g / ml, aprēķina pēc formulas
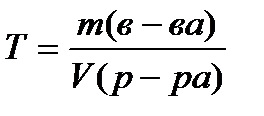 (4.1.7)
(4.1.7)
kur m (in-va)- vielas masa, G;
V (risinājums)- šķīduma tilpums, ml.
Apskatīsim atšķaidītu šķīdumu īpašības, kas ir atkarīgas no izšķīdušās vielas daļiņu skaita un šķīdinātāja daudzuma, bet praktiski nav atkarīgas no izšķīdušo daļiņu rakstura (koligatīvās īpašības). ) .
Šīs īpašības ietver: šķīdinātāja piesātināto tvaiku spiediena pazemināšanu virs šķīduma, viršanas temperatūras paaugstināšanu, šķīduma sasalšanas temperatūras pazemināšanu salīdzinājumā ar tīru šķīdinātāju, osmozi.
Osmoze ir vienvirziena vielu difūzija no šķīdumiem caur puscaurlaidīgu membrānu, kas atdala šķīdumu un tīru šķīdinātāju vai divus dažādu koncentrāciju šķīdumus.
Šķīdinātāja-šķīduma sistēmā šķīdinātāja molekulas var pārvietoties pa deflektoru abos virzienos. Bet šķīdinātāja molekulu skaits, kas nonāk šķīdumā laika vienībā, ir lielāks nekā molekulu skaits, kas pārvietojas no šķīduma uz šķīdinātāju. Rezultātā šķīdinātājs caur puscaurlaidīgu membrānu nonāk koncentrētākā šķīdumā, to atšķaidot.
Tiek saukts spiediens, kas jāpieliek koncentrētākam šķīdumam, lai šķīdinātājs pārstātu tajā iekļūt osmotiskais spiediens .
Tiek saukti risinājumi, kuriem raksturīgs vienāds osmotiskais spiediens izotonisks .
Osmotisko spiedienu aprēķina, izmantojot Van't Hoff formulu
kur ν - vielas daudzums, kurmis;
R- gāzes konstante, kas vienāda ar 8,314 J / (mol K);
T- absolūtā temperatūra, UZ;
V- šķīduma tilpums, m 3;
AR- molārā koncentrācija, mol / l.
Saskaņā ar Raula likumu, piesātinātā tvaika spiediena relatīvais samazinājums virs šķīduma ir vienāds ar izšķīdušās negaistošās vielas molāro daļu:
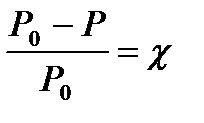 (4.1.9)
(4.1.9)
Šķīdumu viršanas temperatūras paaugstināšanās un sasalšanas temperatūras pazemināšanās, salīdzinot ar tīru šķīdinātāju, saskaņā ar Raula likumu ir tieši proporcionāla izšķīdušās vielas molārajai koncentrācijai:
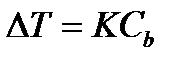 (4.1.10)
(4.1.10)
kur ir temperatūras izmaiņas;
Molārā koncentrācija, mol / kg;
UZ- proporcionalitātes koeficientu viršanas temperatūras paaugstināšanās gadījumā sauc par ebulioskopisko konstanti, un, lai pazeminātu sasalšanas temperatūru, to sauc par krioskopisko.
Šīs konstantes, kas skaitliski atšķiras vienam un tam pašam šķīdinātājam, raksturo viena molāra šķīduma viršanas temperatūras paaugstināšanos un sasalšanas temperatūras pazemināšanos, t.i. izšķīdinot 1 molu negaistoša elektrolīta 1 kg šķīdinātāja. Tāpēc tos bieži sauc par molālu viršanas temperatūras paaugstināšanos un šķīduma sasalšanas temperatūras pazemināšanos.
Krioskopiskās un ebulioskopiskās konstantes nav atkarīgas no izšķīdušās vielas rakstura, bet ir atkarīgas no šķīdinātāja rakstura, un tās raksturo izmēri 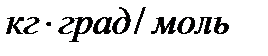 .
.
Tabula 4.1.1. Krioskopiskās K K un ebulioskopiskās K E konstantes dažiem šķīdinātājiem
Krioskopija un ebulioskopija- Metodes noteiktu vielu īpašību, piemēram, izšķīdušo vielu molekulmasas, noteikšanai. Šīs metodes ļauj noteikt molekulmasu vielām, kas neizšķīst, pazeminot sasalšanas temperatūru un paaugstinot zināmas koncentrācijas šķīdumu viršanas temperatūru:
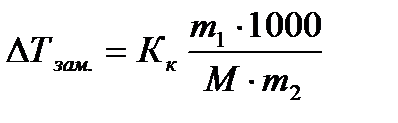 (4.1.11)
(4.1.11)
kur ir izšķīdušās vielas masa gramos;
Šķīdinātāja svars gramos;
Izšķīdušās vielas molārā masa g/mol;
1000 - pārrēķina koeficients no šķīdinātāja gramiem uz kilogramiem.
Tad neelektrolīta molāro masu nosaka pēc formulas
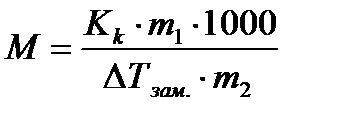 (4.1.12)
(4.1.12)
Šķīdība S parāda, cik gramu vielas var izšķīdināt 100 g ūdens noteiktā temperatūrā. Cietvielu šķīdība, kā likums, palielinās, palielinoties temperatūrai, un gāzveida vielām tā samazinās.
Cietām vielām ir daudz dažādu šķīdību. Kopā ar šķīstošām vielām ir nedaudz šķīstoša un praktiski nešķīstoša ūdenī. Tomēr dabā nav absolūti nešķīstošu vielu.
Piesātinātā slikti šķīstošā elektrolīta šķīdumā starp nogulsnēm un šķīdumā esošajiem joniem tiek izveidots neviendabīgs līdzsvars:
A m B n  mA n + + nB m -.
mA n + + nB m -.
nogulsnes  piesātināts šķīdums
piesātināts šķīdums
Piesātinātā šķīdumā šķīdināšanas un kristalizācijas ātrums ir vienāds , un jonu koncentrācija virs cietās fāzes ir līdzsvarota noteiktā temperatūrā.
Šī neviendabīgā procesa līdzsvara konstanti nosaka tikai šķīdumā esošo jonu aktivitāšu reizinājums, un tā nav atkarīga no cietās sastāvdaļas aktivitātes. Viņa ieguva vārdu šķīdības produkts PR .
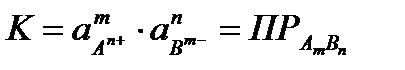 (4.1.13)
(4.1.13)
Tādējādi jonu aktivitāšu reizinājums slikti šķīstoša elektrolīta piesātinātā šķīdumā noteiktā temperatūrā ir nemainīga vērtība.
Ja elektrolītam ir ļoti zema šķīdība, tad jonu koncentrācija tā šķīdumā ir niecīga. Šajā gadījumā starpjonu mijiedarbību var neņemt vērā un jonu koncentrāciju var uzskatīt par līdzvērtīgu to aktivitātēm. Tad šķīdības reizinājumu var izteikt kā elektrolītu jonu līdzsvara molārās koncentrācijas:
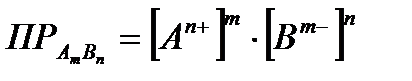 . (4.1.14)
. (4.1.14)
Šķīdības produkts, tāpat kā jebkura līdzsvara konstante, ir atkarīgs no elektrolīta rakstura un temperatūras, bet nav atkarīgs no jonu koncentrācijas šķīdumā.
Palielinoties viena jona koncentrācijai slikti šķīstoša elektrolīta piesātinātā šķīdumā, piemēram, cita elektrolīta, kas satur to pašu jonu, ievadīšanas rezultātā, jonu koncentrācijas reizinājums kļūst lielāks par vērtību. no šķīdības produkta. Šajā gadījumā līdzsvars starp cieto fāzi un šķīdumu novirzās uz nogulšņu veidošanos. Nogulsnes veidosies, līdz izveidosies jauns līdzsvars, pie kura nosacījums (4.1.14.) atkal ir izpildīts, bet ar dažādām jonu koncentrāciju attiecībām. Palielinoties viena jona koncentrācijai piesātinātā šķīdumā virs cietās fāzes, otra jona koncentrācija samazinās tā, ka šķīdības produkts nemainīgos apstākļos paliek nemainīgs.
Tātad nokrišņu nosacījums ir:
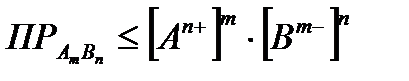 . (4.1.15)
. (4.1.15)
Ja kāda tā jona koncentrācija tiek samazināta slikti šķīstoša elektrolīta piesātinātā šķīdumā, tad NS jonu koncentrācijas reizinājums kļūst lielāks. Līdzsvars virzīsies uz nogulšņu izšķīšanu. Izšķīdināšana turpināsies, līdz atkal tiek izpildīts nosacījums (4.1.14.).







