Kovalentā saite. Molekulārā struktūra
6.2.1. Ķīmiskās saites veida noteikšana pēc starpības
saiti veidojošo atomu elektronegativitātes
Dažādu veidu ķīmisko saišu veidošanās ir atkarīga no atomu spējas ziedot vai piesaistīt elektronus. Šo spēju raksturo elektronegativitātes (EO) lielums. Jo lielāka ir EO vērtība. jo lielāka ir atomu spēja piesaistīt elektronus. Ja EO (ΔEO) atšķirība starp diviem atomiem, kas veido saiti, ir nulle (ΔEO = 0), tad šāda saite ir nepolāra kovalenta. 0< ΔЭО < 2 связь полярная ковалентная. Ионная связь образуется при Δ ЭО > 2.
3. piemērs. Nosakiet, kāda veida saite ir savienojumos KC1, H 2, SO 2.
Risinājums. Izmantojot katra atoma EO vērtības (pielikums, A4 tabula), mēs atrodam ΔEO.
Vispolārākā ir Na – H saite, jo šajā gadījumā ΔEO vērtība ir vislielākā.
6.2.2. Saites dipola un molekulas elektriskā momenta atrašana
Lai novērtētu saites un molekulas polaritāti, tiek izmantots dipola elektriskais moments μ, kas ir vienāds ar dipola garuma un elektriskā lādiņa reizinājumu. q (q= 1,602 10 -19 C), t.i. μ = 1 q... Polārajām saitēm un molekulām μ> 0, nepolārajām μ = 0. Dipola - divu vienādu un pretēju elektrisko lādiņu sistēmas zīmē - elektriskais moments ir vektora lielums, kas virzīts no pozitīva uz negatīvu lādiņu. Mērvienība μ - Debye ( D): D= 3,33 · 10 –30 Kl · m.Diatomiskās molekulas dipola elektriskais moments ir vienāds ar saites dipola elektrisko momentu. Daudzatomu molekulas dipola elektriskais moments ir vienāds ar visu saišu dipolu elektrisko momentu vektoru summu.
5. piemērs. Nosakiet HF molekulas dipola elektrisko momentu un tā virzienu, ja saites μ ir 1,9 D(Pielikums, A5 tabula).
Risinājums. HF molekula ir diatomiska, tai ir lineāra struktūra: H – F. Līdz ar to saites dipola elektriskais moments ir vienāds ar molekulas dipola elektrisko momentu (1.91 D) un tiek virzīts no ūdeņraža, kuram ir pozitīvs lādiņš, uz negatīvu fluoru: H®F (EO H = 2,1; EO F = 4,0).
6. piemērs. BeН 2 molekulai ir lineāra struktūra. Saites leņķis Н – Ве – Н ir 180 °. Be – H saites ir polāras (EO Be = 1,5; EO H = 2,1). Н 2 О molekulai ir leņķiskā struktūra (saites leņķis Н – О – Н ir 104 ° 30 "). Н – О saites ir polāras (EO H = 2,1; EO O = 3,5). Vai abas molekulas būs polāras?
Risinājums. BeH 2 molekulā saites ir polāras un Be – H 2 saites dipola elektriskā momenta vektors ir vērsts no (+) uz (-); no berilija ar zemāku EO līdz ūdeņradim ar augstāku EO, proti, H. Saites dipolu elektrisko momentu vektora summa, kas ir vienāda ar lielumu un ir pretēja pēc zīmes, ir vienāda ar nulli. Tāpēc molekula ir nepolāra (= 0).
Н 2 О molekulā polārās Н – О saites atrodas 104 ° 30 " (1. att.) leņķī. Tāpēc to saites dipolu elektriskie momenti nav savstarpēji saistīti.Rīsi. 1. Dipola elektriskais moments
molekulas Н 2 О
Risinājums. Elektriskais lādiņš q= 1,602 · 10 -19 C. Molekulas dipola elektrisko momentu nosaka pēc formulas
μ = 1 q= 1,602 · 10 -19 · 3,37 · 10 -11 = 5,4 · 10 -30 C · m (1,63 D).
Atbilde: 5,4 · 10 –30 C · m. = (1,63 D).
6.2.3. Molekulu struktūras skaidrojums ar valences saišu metodi (BC)
Molekulu veidošanās ar VS metodi var notikt ar apmaiņas vai donora-akceptora mehānismu. Pirmais ir balstīts uz viena elektrona atomu orbitāļu pārklāšanos; otrais ir saistīts ar donoru atomu klātbūtni, kuriem ir elektronu pāris, un akceptoru atomiem, kuriem ir brīvas atomu orbitāles.
8. piemērs. Izskaidrojiet ķīmisko saišu veidošanos NH 3 molekulā un tās struktūru apmaiņas mehānismā.
Risinājums . Lai izskaidrotu ķīmisko saišu veidošanos NH 3 molekulā ar apmaiņas mehānismu, nepieciešams uzrakstīt slāpekļa un ūdeņraža atomu elektroniskās formulas; nosaka to valences elektronus un katra atoma kovalenci.
Slāpeklis 7 N 1 s 2 2s 2 2R 3 – Rs 2 2R 3. Atoma kovalence ir trīs 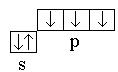 ... Tāpēc veidojas trīs kovalentās saites.
... Tāpēc veidojas trīs kovalentās saites.
Ūdeņradis 1 H 1 s 1 – ss 1 ; Kovalence ir 1, atoms veido vienu kovalento saiti.
Veidojot trīs ķīmiskās saites N – H NH 3 molekulā, trīs viena elektrona R-slāpekļa atoma un viena elektrona orbitāles s- katra no trim ūdeņraža atomiem orbitāle. Pārklāšanās s-p orbitāles notiek vislielākā pagarinājuma virzienā R-orbitāles telpā, kas atrodas 90 ° leņķī. Pēc pārklāšanās NH 3 molekulas forma ir trigonāla piramīda ar H – N – H saites leņķi, kas vienāds ar 107 ° 20 "(2. att.).
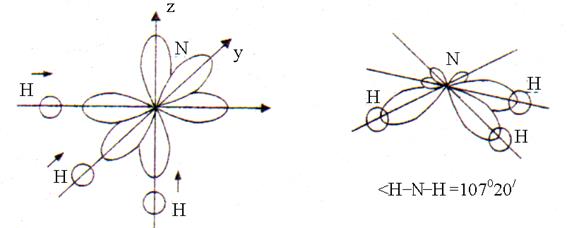
Rīsi. 2. Amonjaka molekulas uzbūve
Leņķa novirze no 90° ir saistīta ar to, ka N – H saite ir polāra (EO N = 3,0; EO H = 2,1). Saistošie elektronu pāri ir nedaudz nobīdīti no ūdeņraža atomiem uz slāpekļa atomiem (EO N> EO H). Tāpēc pozitīvi lādētie ūdeņraža atomi, kā arī trīs N-H saišu elektronu pāri atgrūž viens otru, kā rezultātā saites leņķis palielinās līdz 107 ° 20 ".
9. piemērs. Izskaidrojiet amonija jona NH 4 + veidošanos no amonjaka molekulas NH 3 un ūdeņraža jona H + veidošanos donora-akceptora mehānismā.
Risinājums. Saišu veidošanās NH 3 molekulā ar apmaiņas mehānismu ir dota 8. piemērā. Kā izriet no paskaidrojumiem, trīs valences viena elektrona dēļ apmaiņas mehānismā veidojas trīs kovalentās saites. R-slāpekļa atoma orbitāles. Bet turklāt slāpekļa atomam ir arī divu elektronu valence s-orbitālā (2 s 2), kas var būt donors attiecībā pret akceptoru - ūdeņraža jonu ar brīvu orbitāli. Tāpēc slāpekļa atoms var veidot ceturto kovalento saiti, izmantojot donora-akceptora mehānismu. Ceturtās kovalentās saites (donora-akceptora) veidošanos amonija jonā NH 4 + var attēlot ar šādu shēmu:
Donoru akceptētājs
Amonija jonam ir tetraedra forma, jo s 1 R 3 -hibridizācija (sk. 6.2.4. punktu).
6.2.4. Atomu orbitāļu hibridizācijas veida noteikšana
un molekulas telpiskā konfigurācija ar VS metodi
10. piemērs. Noteikt atomu orbitāļu hibridizācijas veidu, BH 3 molekulas telpisko konfigurāciju un polaritāti.
Risinājums.
Bor: 5 V l s 2 2s 2 2lpp 1 – R-elements; valences elektroni 2 s 2 2lpp 1 ; atoma kovalence normālā (neuzbudinātā) stāvoklī ir vienāda ar vienu 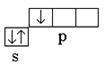 .
.
Ūdeņradis 1 H 1 s 1 – s-elements; valences elektroni 1 s 1 ; kovalence ir vienāda ar vienu. Normālā stāvoklī bora atoms var izveidot tikai vienu ķīmisko saiti vienas nepāra dēļ R- elektrons. Taču BH 3 molekulas sastāvs liecina, ka bors veido trīs ķīmiskās saites, t.i. tā kovalence ir trīs. Tas ir iespējams, kad atoms tiek pārnests no normāla stāvokļa uz ierosinātu (3. att.).
Rīsi. 3. Bora atoma hibrīdu orbitāļu veidošanās
Trīs hibrīdorbitāles atrodas simetriski telpā 120 0 leņķī viena pret otru un ir vērstas uz regulāra trīsstūra virsotnēm. Ar vienu elektronu veidojas trīs bora atoma hibrīda orbitāles s-triju ūdeņraža atomu orbitāles, trīs ķīmiskās saites BH 3 molekulā, kurai ir regulāra trīsstūra forma (4. att.).
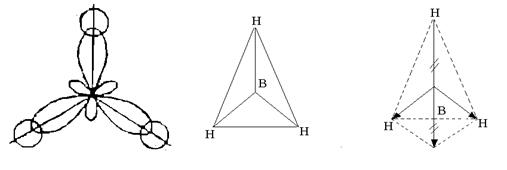
Rīsi. 4. BH 3 molekulas uzbūve
Neskatoties uz to, ka B – H saites ir polāras (EO B = 2,0; EO H = 2,1), molekula ir nepolāra, jo ir simetriska struktūra. Trīs B – H saišu dipolu elektrisko momentu vektora summa ir nulle (sk. 4. att.).
Atomu orbitāļu hibridizācija nosaka molekulu un jonu telpisko konfigurāciju (2. tabula).
2. tabula
Dažu molekulu un jonu telpiskās struktūras
6.2.5. B 2 tipa divatomu molekulu veidošanās un īpašību skaidrojums ar molekulāro orbitāļu (MO) metodi
Saskaņā ar MO metodi molekulā nav atomu orbitāļu (AO), bet ir savienojošie un antisaistošie MO, kas iegūti, lineāri kombinējot (sajaucot) AO. Apvienojot n Izveidojas AO n MO, kurā saistvielu skaits ir vienāds ar AO enerģijas skaitu. Saistošo MO enerģija ir mazāka par AO enerģiju, un antisavienojošo MO enerģija ir lielāka par AO enerģiju. Elektronu novietošanas procedūra uz MO ir tāda pati kā AO gadījumā; pirmkārt, MO ar zemu enerģiju (minimālās enerģijas princips) piepilda saskaņā ar Pauli principu un Gunda likumu.
Vienkāršākais MO veidošanās gadījums notiek, ja tiek apvienota viena un tā paša elementa (B2) divu atomu AO. Ar divu kombināciju s-s AO veidojas divi MO, ko sauc par σ (sigma) orbitālēm. Viens no tiem ir saistošs (), otrs ir atslābinošs (). Divus s-MO iegūst arī, apvienojot divus p x-p x AO (s). Abu kombinācija r y-r y un divi p z -p z AO veido divi p sv -MO (un) un divi p reizes -MO (un).
MO veidošanos no atomiem un to enerģijas izmaiņas var attēlot enerģijas diagrammas veidā, kur orbitāļu enerģijas vērtības ir attēlotas pa vertikāli (5. att.).
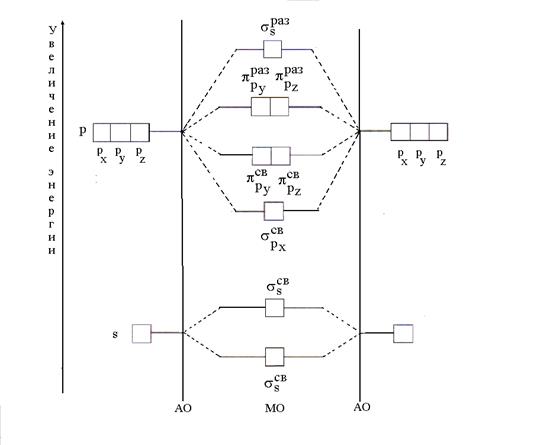
Rīsi. 5. MO veidošanās enerģētiskā shēma ar viena un tā paša elementa divu atomu AO kombināciju (B2)
MO metode ļauj noteikt molekulas magnētismu. Tātad nepāra elektronu klātbūtne molekulā nosaka tās paramagnētismu, bet tāda neesamība - diamagnētismu. Izmantojot MO metodi, jūs varat atrast saziņas biežumu. Daudzkārtība w ir vienāda ar saitē esošo elektronu skaita pusi starpību n sv un atslābināšana n reizes MO:
Ja elektronu skaits uz savienojošajiem un antisaistošajiem MO ir vienāds, tad saites reizinājums ir nulle. Līdz ar to šie elektroni neietekmē ķīmiskās saites veidošanos.
MO metode var izskaidrot arī molekulas stabilitāti. Molekulas stabilitāte ir saistīta ar visu saistošo un antisaistošo elektronu enerģijas līdzsvaru. Aptuveni mēs varam pieņemt, ka viens pretsaites elektrons anulē viena savienojošā elektrona iedarbību. Tādējādi, jo vairāk elektronu uz savienojošajiem MO un mazāk elektronu uz antisavienojošajiem MO, jo stabilāka ir molekula.
11. piemērs. Ar MO metodi izskaidrot O 2 molekulas veidošanos. Nosakiet savienojuma daudzveidību un tā magnētismu.
Risinājums. O 2 molekula sastāv no viena un tā paša elementa - skābekļa atoma. Tā elektroniskā formula ir šāda: 8 O 1 s 2 2s 2 2lpp 4 . Skābekļa atoma valences elektroni 2 s 2 2lpp 4 piedalās ķīmiskās saites veidošanā, t.i. MO iegūst ar lineāru kombināciju 2 s- un 2 R- divu skābekļa atomu AO.
Divpadsmit valences elektronu sadalījums skābekļa molekulā notiek saskaņā ar minimālās enerģijas principu. Pirmkārt, MO ir piepildīti ar diviem elektroniem, katrs ar pretparalēliem spiniem (Pauli princips). Tad seši elektroni tiks novietoti uz trim savienojošiem MO (;;), divi elektroni katrs ar antiparalēliem spiniem. Atlikušos divus elektronus aizņems antisaites MO (s), katrs ar vienu elektronu ar paralēliem spiniem saskaņā ar Gunda likumu. Pēc elektronu novietošanas uz MO skābekļa molekulas enerģijas diagrammai būs šāda forma (6. att.).
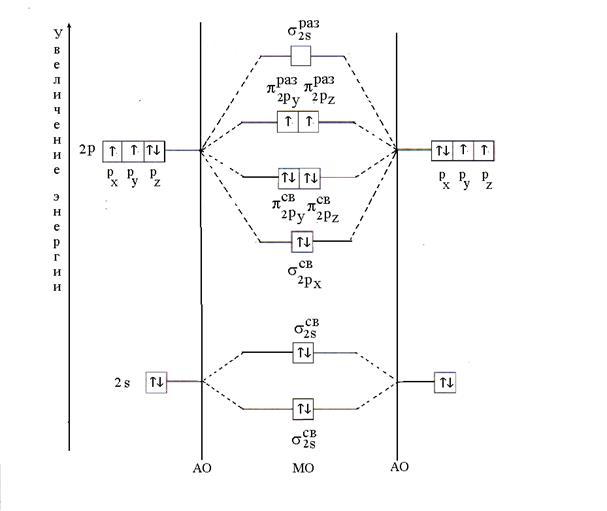
Rīsi. 6. O 2 molekulas enerģijas diagramma
Skābekļa molekulā esošās saites daudzveidība, kas aprēķināta pēc formulas (2), ir vienāda ar divi. Divu nepāra elektronu klātbūtne nosaka molekulas paragnetismu.
KONTROLES UZDEVUMI
101. Etīna (acetilēna) C 2 H 2 molekulā starp oglekļa atomiem ir trīskāršā saite: viena s un divas p saites. Divu p saišu veidošanās notiek pārklāšanās dēļ r y-r y un divi p z -p z atomu orbitāles. Kā rodas saite? Nosakiet hibridizācijas veidu s saites veidošanā. Uzzīmējiet etīna molekulas struktūru un aprēķiniet saistīšanas enerģiju, izmantojot tabulas datus. 3.
Atbilde: Δ H= - 245 kJ / mol.
102. Izmantojot ar MO metodi iegūto enerģijas diagrammu, paskaidro, kāpēc molekula ir nestabila, bet jons ir stabils. Aprēķiniet savienojuma biežumu abos gadījumos. Kā un kāpēc ķīmiskās saites enerģija mainās, dodoties uz.
103. Izskaidrot ķīmisko saišu veidošanos H2O molekulā ar BC metodi. Uzzīmējiet molekulas telpisko konfigurāciju. Aprēķiniet Н – О saites garumu, izmantojot 2. tabulas datus. Atbilde: 0,97 · 10 -10 m.
104. Izskaidrojiet CH 4 molekulas uzbūvi pēc BC metodes. Nosakiet hibridizācijas veidu ķīmisko saišu veidošanā. Izmantojot 4. tabulas datus, pierādiet, ka saites molekulā ir kovalenti polāras. Kāpēc molekulas dipola elektriskais moments ir nulle? ... Kurš atoms darbojas kā donors un kurš kā akceptors?
108. Izskaidrojiet СCl 4 molekulas uzbūvi pēc BC metodes. Nosakiet hibridizācijas veidu ķīmisko saišu veidošanā. Aprēķiniet C – Cl saites garumu šajā molekulā, izmantojot tabulas datus. 2. Atbilde: 1,765 · 10 -10 m.
109. Izskaidrojiet CO 2 molekulas uzbūvi pēc BC metodes. Uzzīmējiet molekulas telpisko konfigurāciju. Nosakiet hibridizācijas veidu ķīmisko saišu veidošanā. Izmantojot tabulas datus. 4, pierādiet, ka saites ir kovalentās polāras. Kāpēc CO 2 molekula ir nepolāra?
110. BF 3 molekulai ir plakana trīsstūrveida konfigurācija, savukārt NF 3 molekulai ir trīsdimensiju (piramīdas) konfigurācija. Izmantojot VS metodi, paskaidrojiet, kāds ir šo molekulu struktūras atšķirības iemesls? Kura molekula ir nepolāra un kāpēc? Apstipriniet rezultātu ar molekulu dipolu elektrisko momentu vērtībām (skatīt 5. tabulu).
111. CH 4 molekulai un jonam ir vienāda telpiskā konfigurācija. Kā to var izskaidrot ar centrālā atoma atomu orbitāļu hibridizāciju? Kāpēc CH 4 molekulas dipola elektriskais moments ir vienāds ar nulli?
112. Izmantojot valences saišu metodi, izskaidro etāna molekulas C 2 H 6 (H 3 C – CH 3) uzbūvi. Kāds ir ķīmiskās saites hibridizācijas veids? Aprēķināt C – C saites enerģiju, ja C 2 H 6 veidošanās standarta entalpija no gāzveida oglekļa un ūdeņraža ir - 2798,8 kJ / mol, bet C - H saites enerģija ir -411,3 kJ / mol.
Atbilde: Δ H= - 331,0 kJ / mol.
113. Izmantojot BC metodi, paskaidrojiet, kāpēc Н 2 О un Н 2 S molekulām ir leņķiskā struktūra, savukārt saites leņķis<(H–O–H) = 104 0 30¢ больше валентного угла <(H–S–H) = 92 0 . На основании данных табл.5 вычислите длины диполей молекул и покажите направления электрических моментов диполей связей в них.
Atbilde: 3,83 · 10 –11 un 1,55 · 10 –11 m.
114. Izmantojot BC metodi, izskaidro PCl 3 un AlCl 3 molekulāro uzbūvi. Kāda ir atšķirība starp molekulu ģeometriskajām konfigurācijām? Kāpēc PCl 3 molekula ir polāra un AlCl 3 elektriskā dipola moments ir nulle?
115. Izmantojot BC metodi, izskaidro CS 2 molekulas uzbūvi. Nosakiet hibridizācijas veidu. Kāda ir molekulas ģeometriskā konfigurācija? Kāpēc dipola elektriskais moments ir nulle?
; ... Aprēķināt saziņas biežumu un noteikt, kurš no tiem būs visstabilākais?120. Izmantojot MO metodi, veidot enerģijas diagrammas priekš; ; ... Aprēķināt saišu daudzveidību un to magnētiskās īpašības.







