Ķīmiskais līdzsvars: ķīmiskā līdzsvara konstante un tā izteikšanas veidi
1885. gadā tika atvasināts franču fiziķis un ķīmiķis Le Šateljē, bet 1887. gadā vācu fiziķis Brauns pamatoja ķīmiskā līdzsvara likumu un ķīmiskā līdzsvara konstanti, kā arī pētīja to atkarību no dažādu ārējo faktoru ietekmes.
Ķīmiskā līdzsvara būtība
Līdzsvars ir stāvoklis, kas nozīmē, ka lietas vienmēr ir kustībā. Produkti tiek sadalīti reaģentos un reaģenti tiek apvienoti produktos. Lietas kustas, bet koncentrācija paliek nemainīga. Reakcija tiek uzrakstīta ar dubulto bultiņu, nevis vienādības zīmi, lai norādītu, ka tā ir atgriezeniska.

Klasiskie raksti
Pat pagājušajā gadsimtā ķīmiķi atklāja noteiktus modeļus, kas nodrošina reakcijas virziena maiņas iespējamību tajā pašā traukā. Zināšanas par to, kā notiek ķīmiskās reakcijas, ir neticami svarīgas gan laboratorijas pētījumos, gan rūpnieciskajā ražošanā. Tajā pašā laikā liela nozīme ir spējai kontrolēt visas šīs parādības. Cilvēkam ir dabiski iejaukties daudzos dabas procesos, īpaši atgriezeniskajos, lai pēc tam tos izmantotu savā labā. Zināšanas par ķīmiskajām reakcijām būs noderīgākas, ja tās lieliski kontrolēsiet.
Ķīmiķi izmanto masu iedarbības likumu ķīmijā, lai pareizi aprēķinātu reakciju ātrumu. Tas sniedz skaidru priekšstatu, ka neviens netiks ievērots, ja tas notiks slēgtā sistēmā. Iegūto vielu molekulas atrodas pastāvīgā un neregulārā kustībā, un drīzumā var notikt reversa reakcija, kurā tiks samazinātas izejmateriāla molekulas.
Rūpniecībā visbiežāk izmanto atvērtās sistēmas. Kuģi, aparāti un citi konteineri, kuros notiek ķīmiskās reakcijas, paliek neaizslēgti. Tas nepieciešams, lai šo procesu laikā būtu iespējams iegūt vēlamo produktu un atbrīvoties no nederīgiem reakcijas produktiem. Piemēram, ogles sadedzina atklātās krāsnīs, cementu ražo atvērtā tipa krāsnīs, domnas darbojas ar pastāvīgu gaisa padevi, un amonjaks tiek sintezēts ar nepārtrauktu paša amonjaka atdalīšanu.

Atgriezeniskas un neatgriezeniskas ķīmiskas reakcijas
Pamatojoties uz nosaukumu, var dot atbilstošas definīcijas: reakcijas tiek uzskatītas par neatgriezeniskām, ja tās tiek veiktas līdz galam, nemaina virzienu un turpinās pa noteiktu trajektoriju neatkarīgi no spiediena kritumiem un temperatūras svārstībām. To atšķirīgā iezīme ir tāda, ka daži produkti var atstāt reakcijas sfēru. Tā, piemēram, ir iespējams iegūt gāzi (CaCO 3 = CaO + CO 2), nogulsnes (Cu (NO 3) 2 + H 2 S = CuS + 2HNO 3) vai arī citas tiks uzskatītas par neatgriezeniskām, ja liels daudzums procesa laikā izdalās siltumenerģija, piemēram: 4P + 5O 2 = 2P 2 O 5 + Q.
Gandrīz visas reakcijas, kas notiek dabā, ir atgriezeniskas. Neatkarīgi no ārējiem apstākļiem, piemēram, spiediena un temperatūras, gandrīz visi procesi var noritēt vienlaicīgi dažādos virzienos. Kā saka masu iedarbības likums ķīmijā, absorbētā siltuma daudzums būs vienāds ar izdalīto daudzumu, kas nozīmē, ka, ja viena reakcija bija eksotermiska, tad otrā (reversā) būs endotermiska.
Ķīmiskais līdzsvars: ķīmiskā līdzsvara konstante
Reakcijas ir ķīmijas "darbības vārdi" - darbība, ko pēta ķīmiķi. Daudzas reakcijas tiek pabeigtas un pēc tam apstājas, kas nozīmē, ka reaģenti tiek pilnībā pārvērsti produktos, nespējot atgriezties sākotnējā stāvoklī. Dažos gadījumos reakcija patiešām ir neatgriezeniska, piemēram, ja sadegšana mainās gan fizikāli, gan ķīmiski.Tomēr ir daudzi citi apstākļi, kuros tā ir ne tikai iespējama, bet arī nepārtraukta, jo pirmās reakcijas produkti kļūst par reaģentiem. otrais.
Dinamisku stāvokli, kurā reaģentu un produktu koncentrācija paliek nemainīga, sauc par līdzsvaru. Vielu uzvedību ir iespējams prognozēt, izmantojot noteiktus likumus, kas tiek piemēroti nozarēs, kas cenšas samazināt konkrētu ķīmisko vielu ražošanas izmaksas. Lai izprastu procesus, kas saglabā vai potenciāli apdraud cilvēka veselību, noder arī ķīmiskā līdzsvara jēdziens. Ķīmiskā līdzsvara konstante ir reakcijas faktora vērtība, kas ir atkarīga no jonu stipruma un temperatūras, un nav atkarīga no reaģentu un produktu koncentrācijas šķīdumā.

Līdzsvara konstantes aprēķināšana
Šis daudzums ir bezizmēra, tas ir, tam nav noteikta vienību skaita. Lai gan aprēķinu parasti raksta diviem reaģentiem un diviem produktiem, tas darbojas jebkuram reakcijas dalībnieku skaitam. Līdzsvara konstantes aprēķināšana un interpretācija ir atkarīga no tā, vai ķīmiskā reakcija ir saistīta ar homogēnu vai neviendabīgu līdzsvaru. Tas nozīmē, ka visas reaģējošās sastāvdaļas var būt tīri šķidrumi vai gāzes. Reakcijām, kas sasniedz neviendabīgu līdzsvaru, parasti nav viena, bet vismaz divas fāzes. Piemēram, šķidrumi un gāzes vai šķidrumi.

Līdzsvara konstantes vērtība
Jebkurai noteiktai temperatūrai ir tikai viena līdzsvara konstantes vērtība, kas mainās tikai tad, ja temperatūra, kurā notiek reakcija, mainās vienā vai otrā virzienā. Dažas prognozes par ķīmisko reakciju var izdarīt, pamatojoties uz to, vai līdzsvara konstante ir liela vai maza. Ja vērtība ir ļoti liela, tad līdzsvars veicina reakciju uz labo pusi un tiek iegūts vairāk produktu nekā bija reaģenti. Reakciju šajā gadījumā var saukt par "pilnīgu" vai "kvantitatīvu".
Ja līdzsvara konstantes vērtība ir maza, tad tas veicina reakciju pa kreisi, kur reaģentu daudzums bija lielāks par iegūtajiem produktiem. Ja šai vērtībai ir tendence uz nulli, mēs varam pieņemt, ka reakcija nenotiek. Ja līdzsvara konstantes vērtības tiešajai un apgrieztajai reakcijai ir gandrīz vienādas, tad arī reaģentu un produktu daudzums būs gandrīz vienāds. Šāda veida reakcija tiek uzskatīta par atgriezenisku.
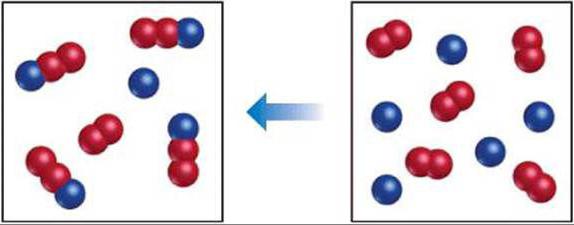
Apsveriet īpašu atgriezenisku reakciju
Ņemsim divus ķīmiskos elementus, piemēram, jodu un ūdeņradi, kas, sajaucoties, dod jaunu vielu – jodūdeņradi.
V 1 ņemsim tiešās reakcijas ātrumu, v 2 - apgrieztās reakcijas ātrumu, k - līdzsvara konstanti. Izmantojot masu darbības likumu, mēs iegūstam šādu izteiksmi:
v 1 = k 1 * c (H 2) * c (I 2),
v 2 = k 2 * c 2 (HI).
Sajaucot joda (I 2) un ūdeņraža (H 2) molekulas, sākas to mijiedarbība. Sākotnējā posmā šo elementu koncentrācija ir maksimālā, bet līdz reakcijas beigām jaunā savienojuma, jodūdeņraža (HI) koncentrācija būs maksimālā. Attiecīgi arī reakcijas ātrumi būs atšķirīgi. Pašā sākumā tie būs maksimāli. Laika gaitā pienāk brīdis, kad šīs vērtības ir vienādas, un tas ir stāvoklis, ko sauc par ķīmisko līdzsvaru.
Ķīmiskā līdzsvara konstantes izteiksmi parasti apzīmē ar kvadrātiekavām:,,. Tā kā līdzsvara stāvoklī ātrumi ir vienādi, tad:
k 1 = k 2 2,
Tātad mēs iegūstam ķīmiskā līdzsvara konstantes vienādojumu:
k 1 / k 2 = 2 / = K.

Le Chatelier-Brown princips
Pastāv šāda shēma: ja tiek veikta noteikta ietekme uz sistēmu, kas atrodas līdzsvarā (lai mainītu ķīmiskā līdzsvara apstākļus, piemēram, mainot temperatūru vai spiedienu), tad līdzsvars mainīsies, lai daļēji neitralizētu izmaiņas. Papildus ķīmijai šis princips dažādās formās attiecas arī uz farmakoloģijas un ekonomikas jomām.

Ķīmiskā līdzsvara konstante un tās izteikšanas veidi
Līdzsvara izteiksmi var izteikt kā produktu un reaģentu koncentrāciju. Līdzsvara formulā ir iekļautas tikai ķīmiskās vielas ūdens un gāzveida fāzē, jo šķidrumu un cieto vielu koncentrācija nemainās. Kādi faktori ietekmē ķīmisko līdzsvaru? Ja tajā ir iesaistīts tīrs šķidrums vai cieta viela, tiek uzskatīts, ka tā K = 1, un attiecīgi to vairs neņem vērā, izņemot ļoti koncentrētus šķīdumus. Piemēram, tīra ūdens aktivitāte ir 1.
Vēl viens piemērs ir cietais ogleklis, kas var veidoties, reaģējot divām oglekļa monoksīda molekulām, veidojot oglekļa dioksīdu un oglekli. Faktori, kas var ietekmēt līdzsvaru, ietver reaģenta vai produkta pievienošanu (koncentrācijas izmaiņas ietekmē līdzsvaru). Reaģenta pievienošana var radīt līdzsvaru ķīmiskā vienādojuma labajā pusē, kur parādās vairāk produktu formu. Produkta pievienošana var radīt līdzsvaru kreisajā pusē, jo kļūst arvien vairāk reaģentu.

Līdzsvars rodas, ja reakcijai abos virzienos ir nemainīga produktu un reaģentu attiecība. Kopumā ķīmiskais līdzsvars ir statisks, jo produktu un reaģentu kvantitatīvā attiecība ir nemainīga. Tomēr, papētot rūpīgāk, atklājas, ka līdzsvars patiesībā ir ļoti dinamisks process, jo reakcija virzās abos virzienos vienādā tempā.
Dinamiskais līdzsvars ir līdzsvara stāvokļa funkcijas piemērs. Sistēmai līdzsvara stāvoklī pašreiz novērotā uzvedība turpināsies arī nākotnē. Tāpēc, tiklīdz reakcija sasniedz līdzsvaru, produkta un reaģenta koncentrācijas attiecība paliek nemainīga, lai gan reakcija turpinās.

Cik viegli ir pastāstīt par grūto?
Tādus jēdzienus kā ķīmiskais līdzsvars un ķīmiskā līdzsvara konstante ir grūti saprast. Ņemsim reālās dzīves piemēru. Vai esat kādreiz iestrēdzis uz tilta starp divām pilsētām un pamanījis, ka satiksme otrā virzienā ir gluda un mērena, kamēr esat bezcerīgi iestrēdzis satiksmē? Tas nav labi.
Kā būtu, ja mašīnas kustētos vienmērīgi un ar tādu pašu ātrumu uz abām pusēm? Vai automašīnu skaits abās pilsētās paliktu nemainīgs? Ja abās pilsētās iebraukšanas un izbraukšanas ātrums ir vienāds un automašīnu skaits katrā pilsētā laika gaitā ir stabils, tas nozīmē, ka viss process ir dinamiskā līdzsvarā.







