Halogēni: fizikālās īpašības, ķīmiskās īpašības. Halogēnu un to savienojumu izmantošana
Halogēni periodiskajā tabulā atrodas pa kreisi no cēlgāzēm. Šie pieci toksiskie nemetāliskie elementi ir periodiskās tabulas 7. grupā. Tie ietver fluoru, hloru, bromu, jodu un astatīnu. Lai gan astatīns ir radioaktīvs un tam ir tikai īslaicīgi izotopi, tas uzvedas kā jods un bieži tiek saukts par halogēnu. Tā kā halogēna elementiem ir septiņi valences elektroni, tiem ir nepieciešams tikai viens papildu elektrons, lai izveidotu pilnīgu oktetu. Šī īpašība padara tos aktīvākus nekā citas nemetālu grupas.
vispārīgās īpašības
Halogēni veido diatomiskas molekulas (formas X 2, kur X apzīmē halogēna atomu) - stabilu halogēnu eksistences formu brīvu elementu veidā. Šo divatomu molekulu saites ir nepolāras, kovalentas un vienas. ļauj tiem viegli apvienoties ar lielāko daļu elementu, tāpēc dabā tie nekad nav saistīti. Fluors ir visaktīvākais halogēns, bet astatīns ir vismazāk.
Visi halogēni veido I grupas sāļus ar līdzīgām īpašībām. Šajos savienojumos halogēni ir kā halogēna anjoni ar lādiņu -1 (piemēram, Cl -, Br -). Beigas -id norāda uz halogenīdu anjonu klātbūtni; piemēram, Cl - sauc par "hlorīdu".
Turklāt halogēnu ķīmiskās īpašības ļauj tiem darboties kā oksidētājiem – oksidēt metālus. Lielākā daļa ķīmisko reakciju, kurās ir iesaistīti halogēni, ir redokss ūdens šķīdumā. Halogēni veido atsevišķas saites ar oglekli vai slāpekli, kur to oksidācijas pakāpe (CO) ir -1. Kad halogēna atoms organiskā savienojumā tiek aizstāts ar kovalenti saistītu ūdeņraža atomu, halogēna prefiksu var lietot vispārīgā nozīmē vai fluora, hlora, broma, joda prefiksus konkrētiem halogēniem. Halogēni elementi var savstarpēji savienoties, veidojot diatomiskas molekulas ar polārām kovalentām atsevišķām saitēm.
Hlors (Cl 2) bija pirmais halogēns, kas tika atklāts 1774. gadā, kam sekoja jods (I 2), broms (Br 2), fluors (F 2) un astatīns (At, pēdējais atklāts 1940. gadā). Nosaukums "halogēns" cēlies no grieķu saknēm hal- ("sāls") un -gen ("veidot"). Kopā šie vārdi nozīmē "sāļu veidošanās", uzsverot faktu, ka halogēni reaģē ar metāliem, veidojot sāļus. Halīts ir akmens sāls nosaukums, dabīgs minerāls, kas sastāv no nātrija hlorīda (NaCl). Un visbeidzot sadzīvē tiek izmantoti halogēni – fluoru satur zobu pasta, hlors dezinficē dzeramo ūdeni, bet jods veicina vairogdziedzera hormonu veidošanos.
Ķīmiskie elementi
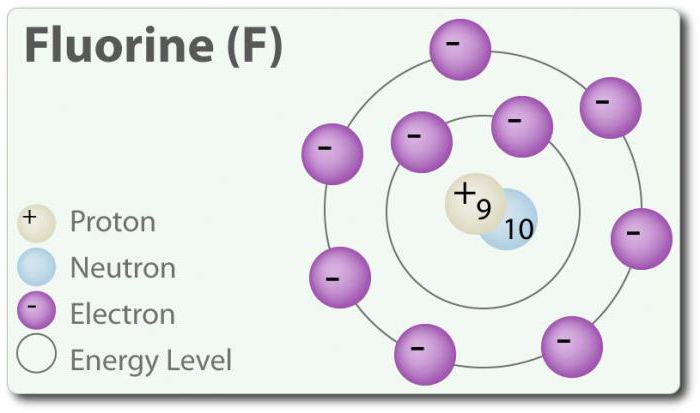
Fluors ir elements ar atomskaitli 9, kas apzīmēts ar simbolu F. Elementārais fluors pirmo reizi tika atklāts 1886. gadā, atdalot to no fluorūdeņražskābes. Brīvā stāvoklī fluors pastāv kā divatomu molekula (F 2) un ir visizplatītākais halogēns zemes garozā. Fluors ir viselektronegatīvākais elements periodiskajā tabulā. Tā ir gaiši dzeltena gāze istabas temperatūrā. Fluoram ir arī salīdzinoši mazs atomu rādiuss. Tā CO ir -1, izņemot elementāro diatomisko stāvokli, kurā tā oksidācijas pakāpe ir nulle. Fluors ir ārkārtīgi reaktīvs un tieši mijiedarbojas ar visiem elementiem, izņemot hēliju (He), neonu (Ne) un argonu (Ar). H 2 O šķīdumā fluorūdeņražskābe (HF) ir vāja skābe. Lai gan fluors ir ļoti elektronnegatīvs, tā elektronegativitāte nenosaka skābumu; HF ir vāja skābe, jo fluora jons ir bāzisks (pH> 7). Turklāt fluors rada ļoti spēcīgus oksidētājus. Piemēram, fluors var reaģēt ar inerto gāzi ksenonu, veidojot spēcīgu oksidētāju ksenona difluorīdu (XeF 2). Fluoram ir daudz pielietojumu.
Hlors ir elements ar atomskaitli 17 un ķīmisko simbolu Cl. Atklāja 1774. gadā, izolējot to no sālsskābes. Elementārajā stāvoklī tas veido diatomisku molekulu Cl 2. Hloram ir vairāki CO: -1, +1, 3, 5 un 7. Istabas temperatūrā tā ir gaiši zaļa gāze. Tā kā saite, kas veidojas starp diviem hlora atomiem, ir vāja, Cl 2 molekulai ir ļoti augsta spēja veidot savienojumus. Hlors reaģē ar metāliem, veidojot sāļus, ko sauc par hlorīdiem. Hlora joni ir visizplatītākie jūras ūdenī sastopamie joni. Hloram ir arī divi izotopi: 35 Cl un 37 Cl. Nātrija hlorīds ir visizplatītākais no visiem hlorīdiem.
Broms ir ķīmisks elements ar atomskaitli 35 un simbolu Br. Pirmo reizi tas tika atklāts 1826. gadā. Savā elementārajā formā broms ir Br 2 diatomiskā molekula. Tas ir sarkanbrūns šķidrums istabas temperatūrā. Tā CO ir -1, +1, 3, 4 un 5. Broms ir aktīvāks par jodu, bet mazāk aktīvs par hloru. Turklāt bromam ir divi izotopi: 79 Br un 81 Br. Broms ir atrodams bromīdā, kas izšķīdināts jūras ūdenī. Pēdējos gados bromīda ražošana pasaulē ir ievērojami palielinājusies, pateicoties tā pieejamībai un ilgajam kalpošanas laikam. Tāpat kā citi halogēni, broms ir oksidētājs un ļoti toksisks.
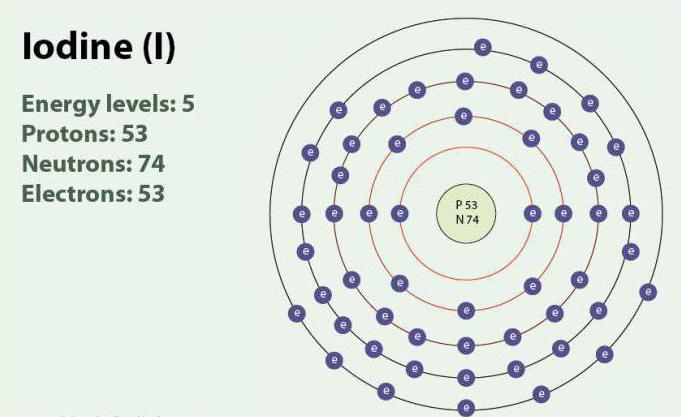
Jods ir ķīmiskais elements ar atomskaitli 53 un simbolu I. Jodam ir oksidācijas pakāpes: -1, +1, +5 un +7. Tā pastāv kā diatomiskā molekula, I 2. Istabas temperatūrā tā ir violeta cieta viela. Jodam ir viens stabils izotops - 127 I. Pirmo reizi tas tika atklāts 1811. gadā ar aļģu un sērskābes palīdzību. Pašlaik joda joni var izdalīties jūras ūdenī. Neskatoties uz to, ka jods ūdenī slikti šķīst, tā šķīdība var palielināties, izmantojot atsevišķus jodīdus. Jodam ir svarīga loma organismā, piedaloties vairogdziedzera hormonu ražošanā.

Astatīns ir radioaktīvs elements ar atomskaitli 85 un simbolu At. Tā iespējamie oksidācijas stāvokļi ir -1, +1, 3, 5 un 7. Vienīgais halogēns, kas nav divatomu molekula. Normālos apstākļos tā ir melna metāliska cieta viela. Astatīns ir ļoti rets elements, tāpēc par to ir maz zināms. Turklāt astatīnam ir ļoti īss pusperiods, ne ilgāks par dažām stundām. Iegūts 1940. gadā sintēzes rezultātā. Tiek uzskatīts, ka astatīns ir līdzīgs jodam. Ir savādāka
Zemāk esošajā tabulā parādīta halogēna atomu struktūra, elektronu ārējā slāņa struktūra.
Šāda elektronu ārējā slāņa struktūra padara halogēnu fizikālās un ķīmiskās īpašības līdzīgas. Tajā pašā laikā, salīdzinot šos elementus, tiek novērotas arī atšķirības.
Periodiskās īpašības halogēnu grupā
Vienkāršu vielu, halogēnu, fizikālās īpašības mainās, palielinoties elementa kārtas skaitlim. Labākai asimilācijai un lielākai skaidrībai piedāvājam vairākas tabulas.
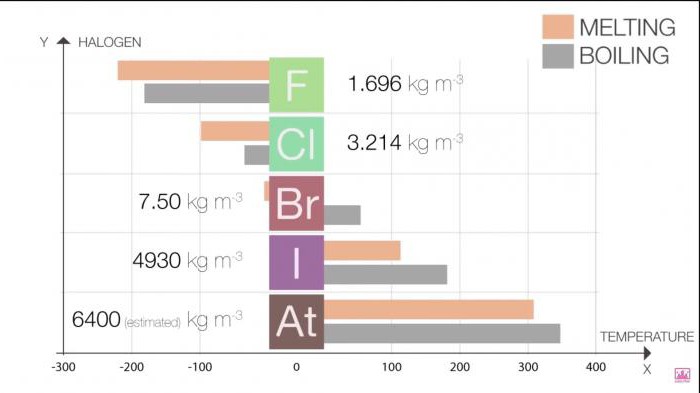
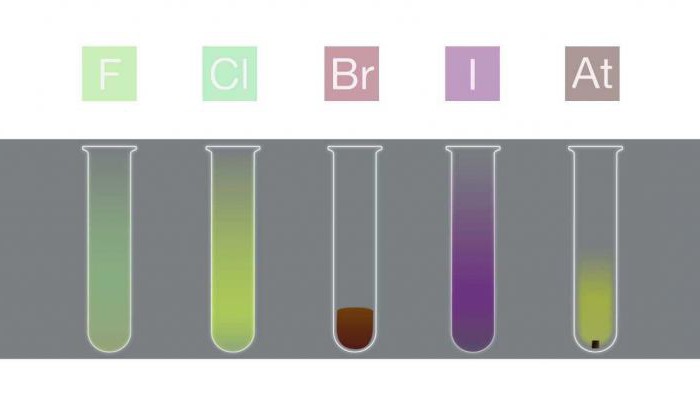
Kušanas un viršanas temperatūra grupā palielinās, palielinoties molekulas izmēram (F 1. tabula. Halogēni. Fizikālās īpašības: kušanas un viršanas temperatūra Halogēns Kušanas temperatūra (˚C) Vārīšanās punkts (˚C) Kodola izmērs palielinās (F< Cl < Br < I < At), так как увеличивается число протонов и нейтронов. Кроме того, с каждым периодом добавляется всё больше уровней энергии. Это приводит к большей орбитали, и, следовательно, к увеличению радиуса атома. 2. tabula. Halogēni. Fizikālās īpašības: atomu rādiusi Kovalentais rādiuss (pm) Jonu (X -) rādiuss (pm) Ja ārējie valences elektroni neatrodas tuvu kodolam, tad nav nepieciešams daudz enerģijas, lai tos pārvietotu prom no tā. Tādējādi ārējā elektrona izstumšanai nepieciešamā enerģija elementu grupas apakšējā daļā nav tik liela, jo šeit ir vairāk enerģijas līmeņu. Turklāt augstā jonizācijas enerģija liek elementam izrādīt nemetāliskas īpašības. Jodam un displeja astatam piemīt metāliskas īpašības, jo samazinās jonizācijas enerģija (At< I < Br < Cl < F). 3. tabula. Halogēni. Fizikālās īpašības: jonizācijas enerģija Valences elektronu skaits atomā palielinās, palielinoties enerģijas līmenim pakāpeniski zemākā līmenī. Elektroni pakāpeniski attālinās no kodola; Tātad gan kodols, gan elektroni netiek piesaistīti viens otram. Tiek novērots ekranēšanas palielinājums. Tāpēc elektronegativitāte samazinās, palielinoties periodam (At< I < Br < Cl < F). 4. tabula. Halogēni. Fizikālās īpašības: elektronegativitāte Tā kā atoma izmērs ar periodu palielinās, elektronu afinitāte, kā likums, samazinās (B< I < Br < F < Cl). Исключение - фтор, сродство которого меньше, чем у хлора. Это можно объяснить меньшим размером фтора по сравнению с хлором. 5. tabula. Halogēnu elektronu afinitāte Halogēnu reaktivitāte samazinās, palielinoties periodam (At Halogenīds veidojas, kad halogēns reaģē ar citu, mazāk elektronegatīvu elementu, veidojot bināru savienojumu. Ūdeņradis reaģē ar halogēniem, veidojot HX halogenīdus: Ūdeņraža halogenīdi viegli izšķīst ūdenī, veidojot ūdeņraža halogenīdu (fluorūdeņražskābi, sālsskābi, bromūdeņradi, jodūdeņradi). Šo skābju īpašības ir parādītas zemāk. Skābes veidojas sekojošā reakcijā: HX (aq) + H 2 O (l) → X - (aq) + H 3 O + (aq). Visi ūdeņraža halogenīdi, izņemot HF, veido spēcīgas skābes. Halogenūdeņražskābju skābums palielinās: HF Fluorūdeņražskābe spēj ilgstoši iegravēt stiklu un dažus neorganiskus fluorīdus. Var šķist pretrunīgi, ka HF ir vājākā halūdeņražskābe, jo fluoram ir vislielākā elektronegativitāte. Tomēr H-F saite ir ļoti spēcīga, padarot skābi ļoti vāju. Spēcīgu saiti nosaka īss saites garums un augsta disociācijas enerģija. No visiem ūdeņraža halogenīdiem HF ir īsākais saites garums un lielākā saites disociācijas enerģija. Halogēna oksoskābes ir skābes ar ūdeņraža, skābekļa un halogēna atomiem. To skābumu var noteikt ar struktūras analīzi. Halogēna oksoskābes ir uzskaitītas zemāk: Katrā no šīm skābēm protons ir saistīts ar skābekļa atomu, tāpēc protonu saišu garumu salīdzināšana šeit ir bezjēdzīga. Šeit dominējošo lomu spēlē elektronegativitāte. Skābā aktivitāte palielinās, palielinoties skābekļa atomu skaitam, kas saistīti ar centrālo atomu. Halogēnu galvenās fizikālās īpašības var apkopot nākamajā tabulā. Vielas stāvoklis (istabas temperatūrā) Halogēns Izskats violets sarkanbrūns gāzveida gaiši dzeltenbrūns bāli zaļš Halogēnu krāsa ir molekulu redzamās gaismas absorbcijas rezultāts, kas izraisa elektronu ierosmi. Fluors absorbē violeto gaismu un tāpēc izskatās gaiši dzeltens. No otras puses, jods absorbē dzelteno gaismu un izskatās purpursarkanā krāsā (dzeltenā un violetā ir papildu krāsas). Halogēnu krāsa kļūst tumšāka, palielinoties periodam. Slēgtos traukos šķidrais broms un cietais jods atrodas līdzsvarā ar saviem tvaikiem, ko var novērot kā krāsainu gāzi. Lai gan astatīna krāsa nav zināma, tiek pieņemts, ka saskaņā ar novēroto modeli tai jābūt tumšākai par jodu (t.i., melnai). Tagad, ja jums jautās: "Aprakstiet halogēnu fizikālās īpašības", jums būs ko teikt. Halogēna valences vietā bieži izmanto oksidācijas stāvokli. Parasti oksidācijas pakāpe ir -1. Bet, ja halogēns ir saistīts ar skābekli vai citu halogēnu, tas var iegūt citus stāvokļus: CO skābeklim-2 ir prioritāte. Gadījumā, ja divi dažādi halogēna atomi ir savienoti kopā, dominē elektronegatīvāks atoms un ņem CO -1. Piemēram, joda hlorīdā (ICl) hloram ir CO -1 un jodam +1. Hlors ir vairāk elektronegatīvs nekā jods, tāpēc tā CO ir -1. Bromskābē (HBrO 4) skābeklī ir CO -8 (-2 x 4 atomi = -8). Ūdeņraža vispārējais oksidācijas stāvoklis ir +1. Šo vērtību pievienošana dod CO -7. Tā kā savienojuma galīgajam CO ir jābūt nulle, broma CO ir +7. Trešais noteikuma izņēmums ir halogēna oksidācijas pakāpe elementārā formā (X 2), kur tā CO ir nulle. Halogēns CO savienojumos 1, +1, +3, +5, +7 1, +1, +3, +4, +5 1, +1, +3, +5, +7 Elektronegativitāte palielinās, palielinoties periodam. Tāpēc fluoram ir visaugstākā elektronegativitāte no visiem elementiem, par ko liecina tā atrašanās vieta periodiskajā tabulā. Tā elektroniskā konfigurācija ir 1s 2 2s 2 2p 5. Ja fluors iegūst citu elektronu, visattālākās p-orbitāles ir pilnībā piepildītas un veido pilnu oktetu. Tā kā fluors ir ļoti elektronnegatīvs, tas var viegli noņemt elektronu no blakus esošā atoma. Fluors šajā gadījumā ir izoelektronisks pret inertu gāzi (ar astoņiem valences elektroniem), visas tā ārējās orbitāles ir piepildītas. Šajā stāvoklī fluors ir daudz stabilāks. Dabā halogēni ir anjonu stāvoklī, tāpēc brīvos halogēnus iegūst, oksidējot ar elektrolīzi vai izmantojot oksidētājus. Piemēram, hloru iegūst nātrija hlorīda šķīduma hidrolīzē. Halogēnu un to savienojumu izmantošana ir daudzveidīga.
Ūdeņradis + halogēni
Halogēna oksoskābes
Vielas izskats un stāvoklis
Izskata skaidrojums
Halogēnu oksidācijas stāvoklis savienojumos
Kāpēc fluora CO vienmēr ir -1?
Halogēnu iegūšana un izmantošana








