9.2 Standarta ūdeņraža elektrods. Elektrodu potenciāls.
Ir iespējams ar augstu precizitāti izmērīt EML ķēdei, kas sastāv no diviem elektrodiem. Tomēr nevar ne izmērīt, ne aprēķināt absolūto potenciālu starpību metāla šķīduma saskarnē. Praktiskiem nolūkiem pietiek ar nosacītām vērtībām, kas raksturo dažādu elektrodu potenciālu, kas attiecas uz noteikta elektroda potenciālu, kas izvēlēts kā standarta.
Kā nosacīti nulle izvēlēta jauda standarta ūdeņraža elektroda potenciāls:
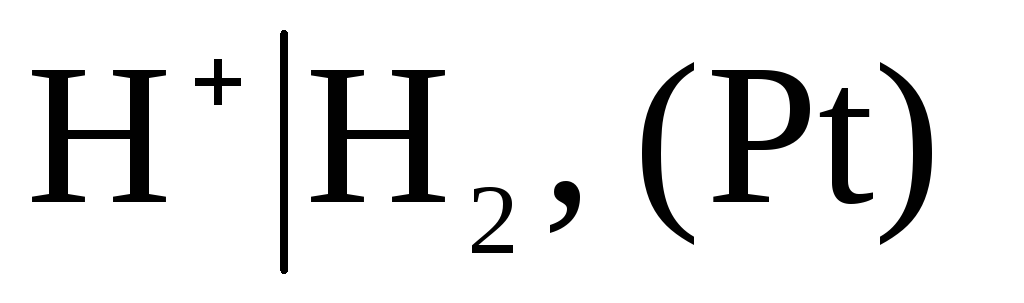 ,
,
kurā izpūstā ūdeņraža spiediens ir 1 atm, un ūdeņraža jonu aktivitāte šķīdumā ir vienāda ar vienību (1. att.). Jebkurā temperatūrā 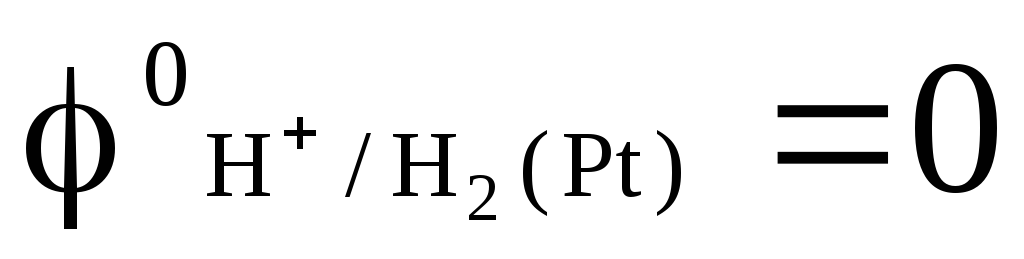 .
.
Ūdeņraža elektroda elektrodu reakcija ir uzrakstīta šādi:
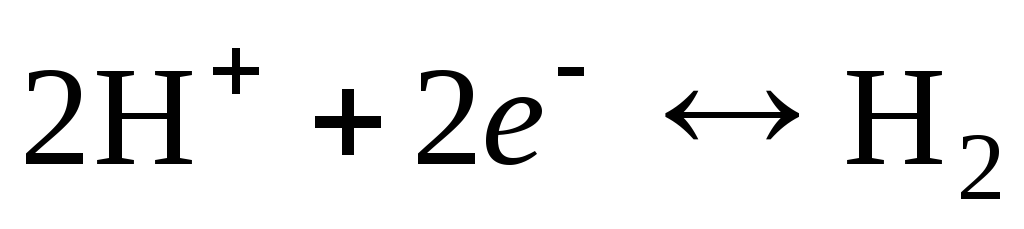 .
.
![]()
Rīsi. 1. Ūdeņraža elektroda vispārīgs skats.
Jebkura elektroda elektroda potenciālam tika nolemts ņemt EMF ķēdei, kas sastāv no attiecīgā elektroda un standarta ūdeņraža elektroda. Šajā gadījumā aplūkojamais elektrods atrodas ķēdes labajā pusē, bet standarta ūdeņraža elektrods - kreisajā pusē.
Piemērs 9.1. Izveidojiet GE, lai noteiktu Cu 2+ / Cu un Zn 2+ / Zn elektrodu standarta elektrodu potenciālu.
1). Izgatavosim galvanisko elementu no standarta ūdeņraža un vara elektrodiem:
Kopējā potenciālu veidojošā reakcija:, t.i. elektronu pārnešana ķēdē notiek no kreisās puses uz labo (no kreisā elektroda uz labo). Standarta apstākļos 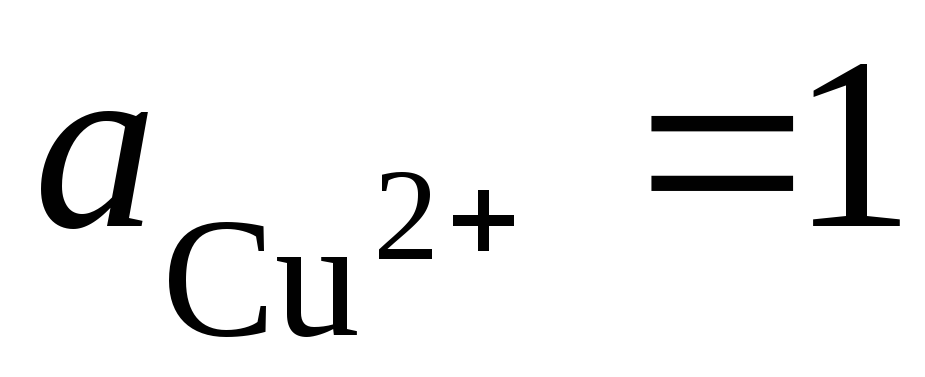 , Šī elementa EML būs E = 0,337 V. Tāpēc
, Šī elementa EML būs E = 0,337 V. Tāpēc
![]() .
.
2). Tādā pašā veidā atstāsim galvanisko elementu, kas izgatavots no standarta ūdeņraža un cinka elektrodiem:
Kopējā reakcija:, t.i. elektronu pārnešana ķēdē notiek no labās uz kreiso pusi. Standarta apstākļos 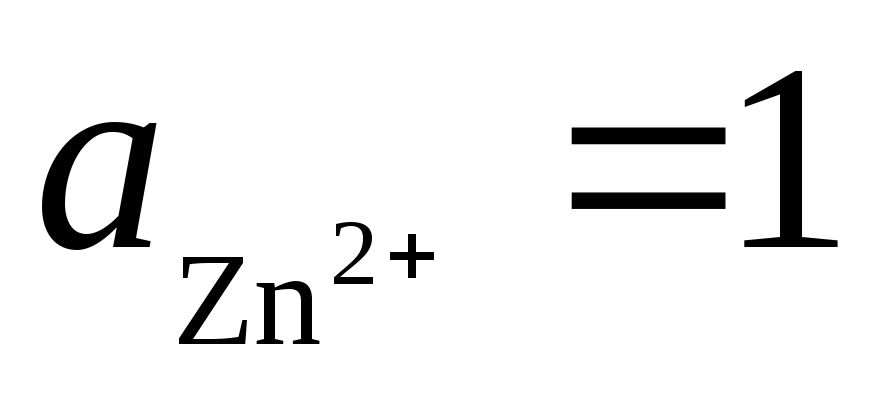
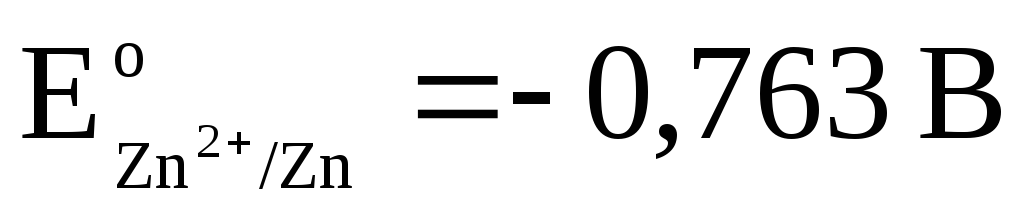 .
.
9.3. Nernsta vienādojums galvaniskā elementa elektromotora spēkam.
Elektroda elektriskās īpašības ir elektrodu potenciāls, un galvaniskais elements (elektroķīmiskā ķēde) - elektromotora spēks (EMF),
Pareizi atvērtas elektroķīmiskās ķēdes EMF, ja nav difūzijas potenciāla, atbilst labā (pozitīvā) un kreisā (negatīvā) elektroda potenciāla starpībai un vienmēr ir pozitīva.
Galvaniskā elementa EMF
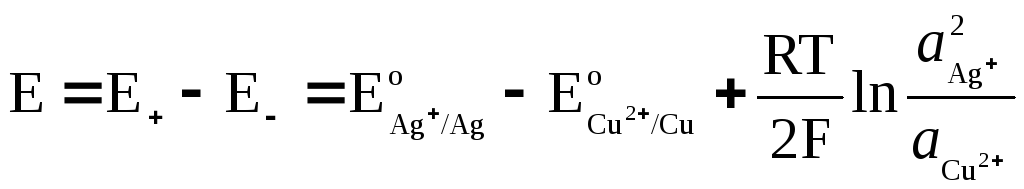
kur 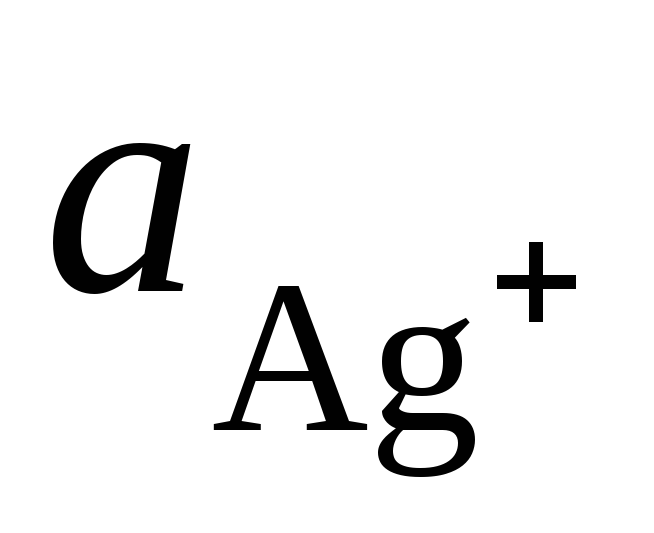 un
un 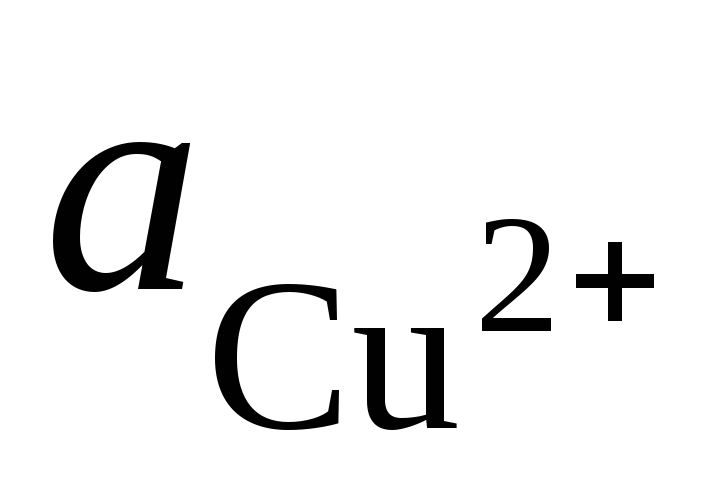 - Ag + un Cu 2+ jonu aktivitāte to sāļu šķīdumos.
- Ag + un Cu 2+ jonu aktivitāte to sāļu šķīdumos.
Mēs apzīmējam
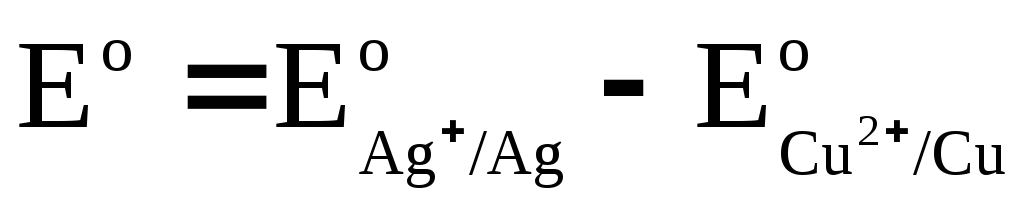 ,
,
kur E o - galvaniskā elementa standarta EMF. Tad
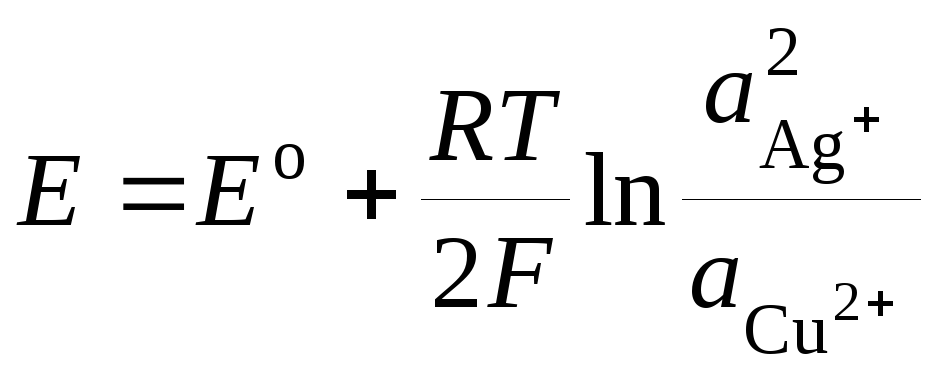 .(3)
.(3)
Vienādojumu (3) sauc Nernsta vienādojumi galvaniskā elementa EML.
Ja galvaniskajā šūnā notiek atgriezeniska ķīmiska reakcija
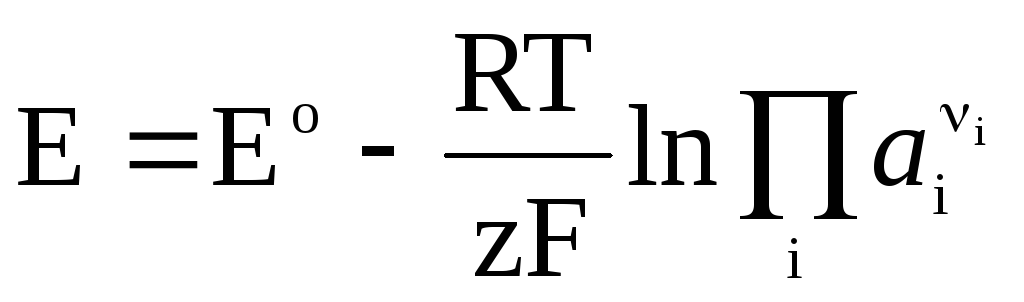 , (4)
, (4)
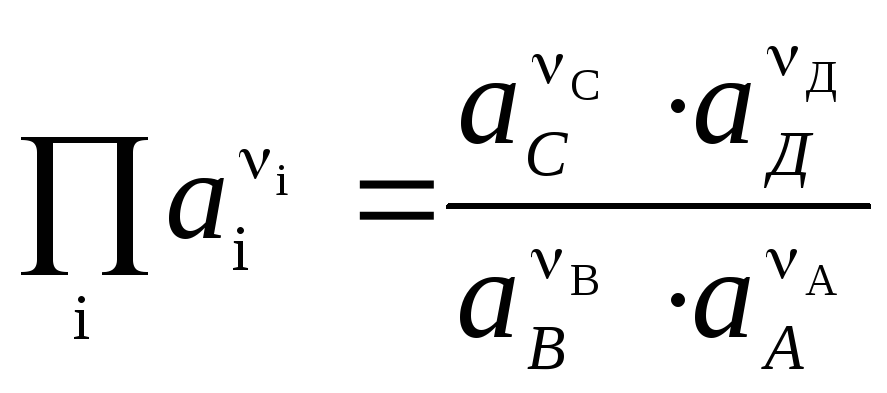
Nernsta vienādojums formā (4) ir piemērojams, lai aprēķinātu jebkura galvaniskā elementa EML (pēc kopējās ķīmiskās reakcijas) un jebkura elektroda potenciāla (ar elektrodu reakciju). EML ir saistīts ar reakcijas termodinamiskajām īpašībām. Ir zināms, ka
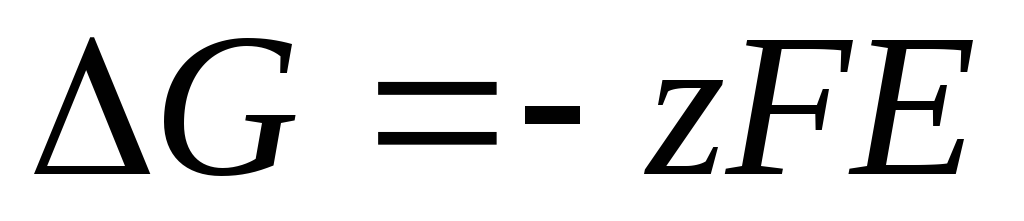 .
.
9.4. Reversīvo elektrodu klasifikācija.
Atgriezenisko elektrodu klasifikācija balstās uz potenciālu noteicošajos procesos iesaistīto vielu īpašībām.
1. Pirmā veida elektrodi.
Pirmās klases elektrodi Vai metāla elektrodi ir atgriezeniski attiecībā pret katjoniem (tostarp amalgamas) ( 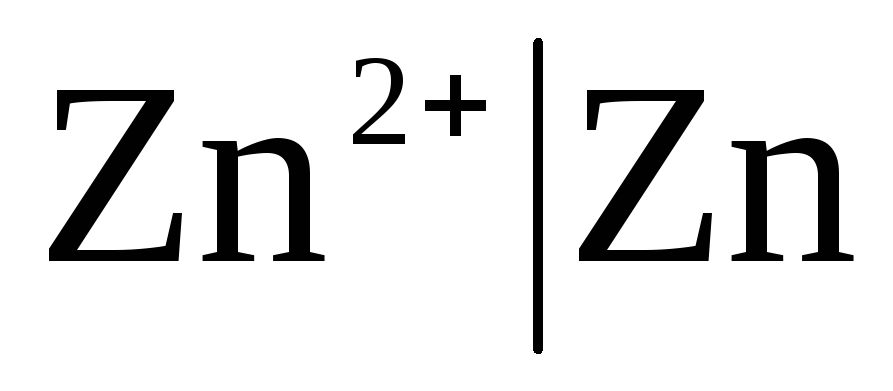 ) un metaloīdu, elektrodi ir atgriezeniski attiecībā pret anjoniem (
) un metaloīdu, elektrodi ir atgriezeniski attiecībā pret anjoniem ( 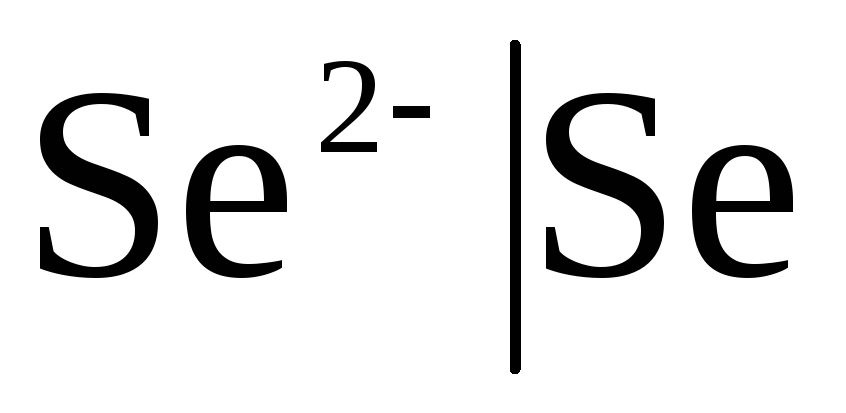 ).
).
Ja elektrods ir atgriezenisks attiecībā pret Zn 2+ / Zn katjonu, tad par to var rakstīt:
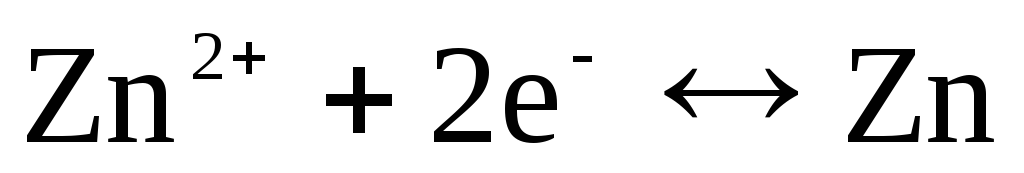 ,
,
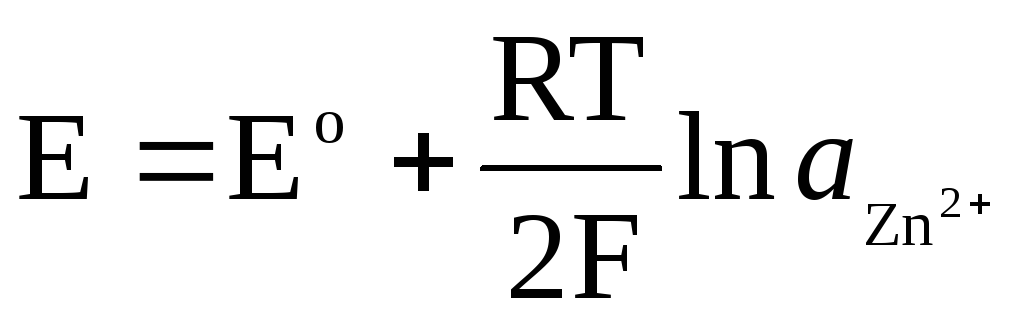
Zn 2+ / Zn (Hg) amalgamas elektrodam:
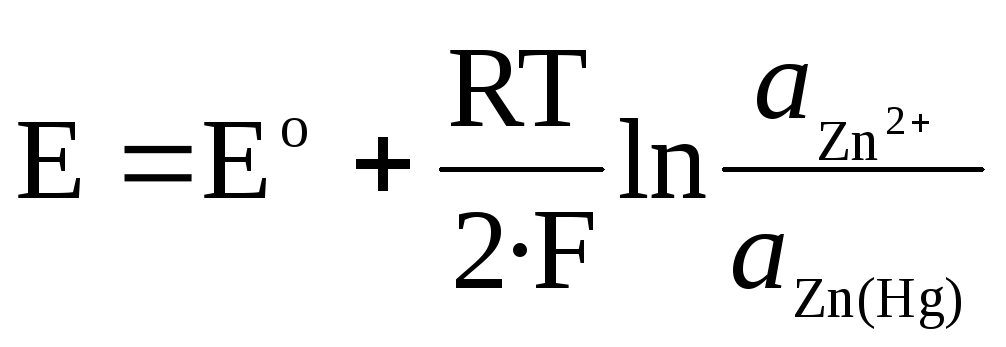 .
.
Ja elektrods ir atgriezenisks attiecībā pret anjonu, tad
![]() ,
,
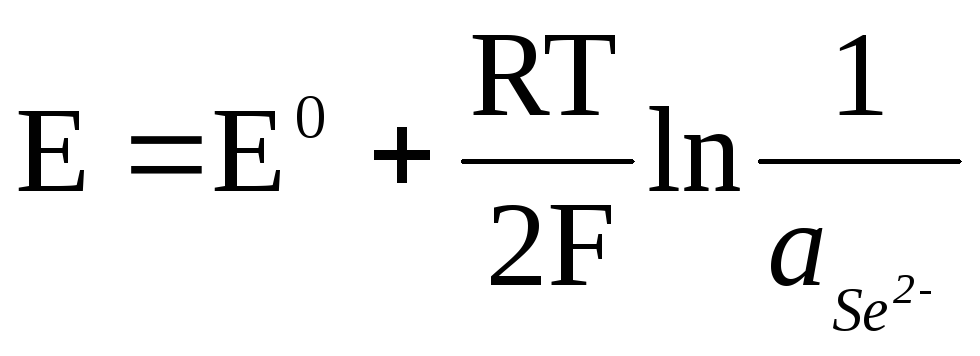 .
.
Pirmā veida elektrodos ietilpst arī gāze elektrodi (ūdeņradis 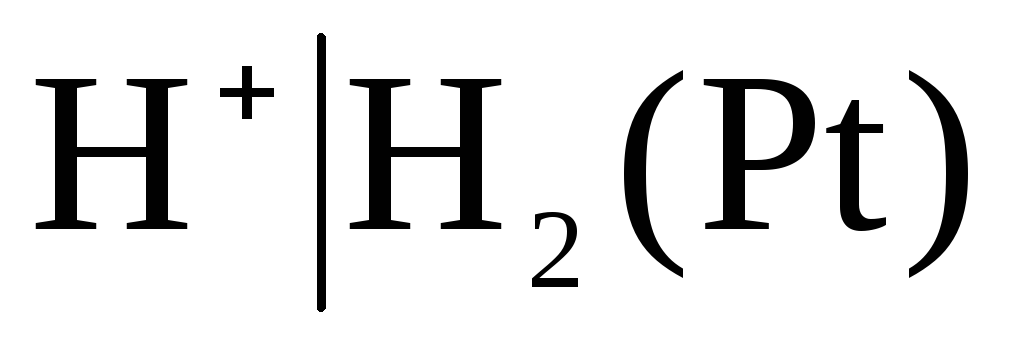 , hlors
, hlors 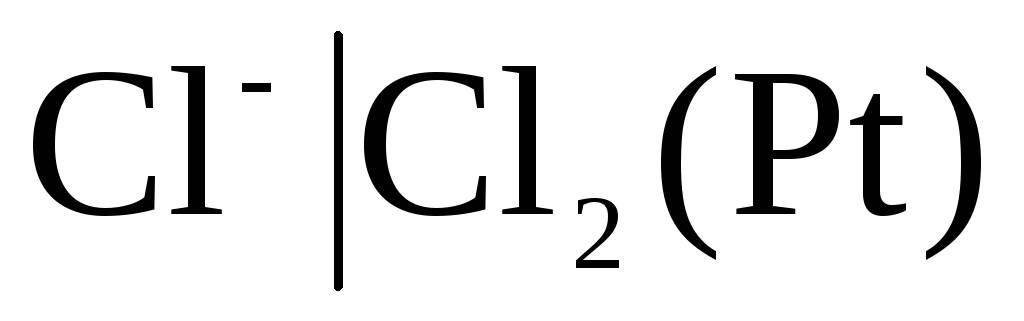 un utt.). Tie var būt atgriezeniski attiecībā pret katjonu (H +) vai anjonu (Cl -). Piemēram, ūdeņraža elektrods ir atgriezenisks attiecībā pret katjonu. Elektrodu procesa vienādojumu tam var uzrakstīt šādā formā:
un utt.). Tie var būt atgriezeniski attiecībā pret katjonu (H +) vai anjonu (Cl -). Piemēram, ūdeņraža elektrods ir atgriezenisks attiecībā pret katjonu. Elektrodu procesa vienādojumu tam var uzrakstīt šādā formā:
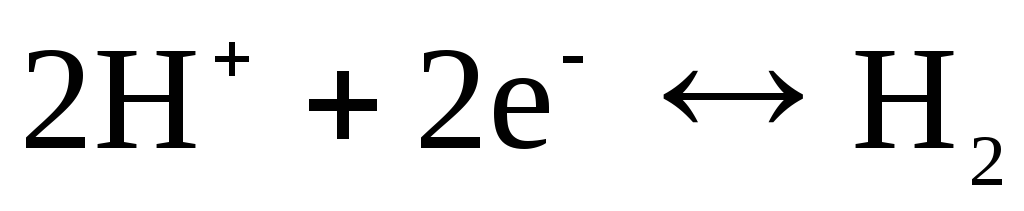 .
.
Ūdeņraža elektroda potenciālu nosaka izteiksme
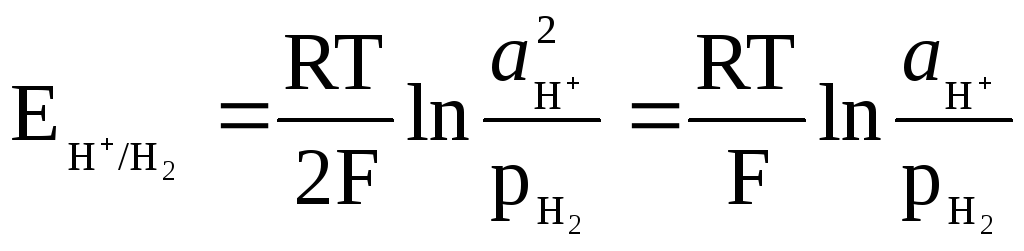 ,
,
un to var saistīt ar šķīduma pH.
Hlora elektrodam 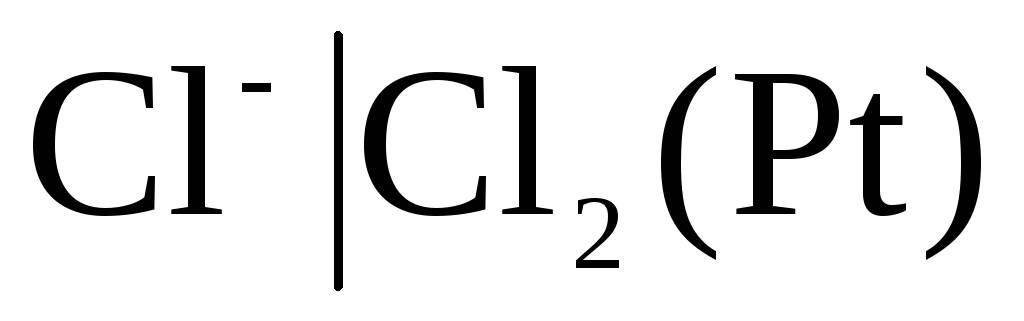 ar potenciālu noteicošu reakciju
ar potenciālu noteicošu reakciju
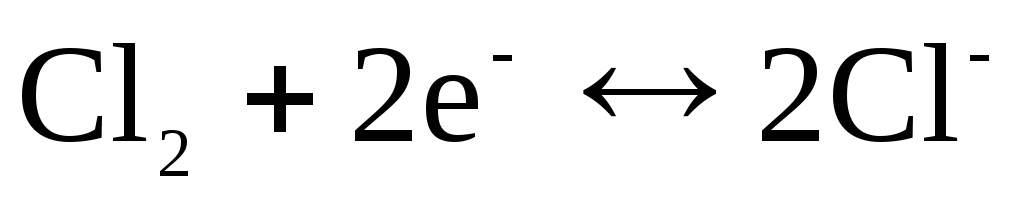 .
.
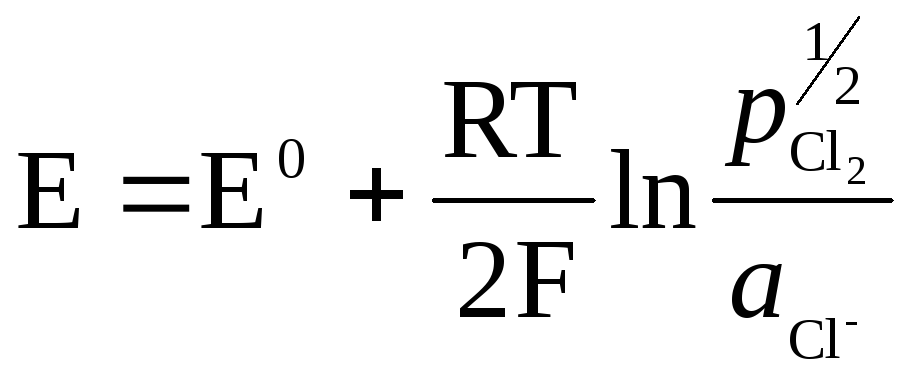
Metāls (Pt) gāzes elektrodos ir nepieciešams, lai izveidotu kontaktu starp gāzi un šķīdumu, tam jābūt inertam attiecībā pret šķīdumā esošajām vielām, un tas var katalizēt tikai vienu potenciālu noteicošu procesu.







