4. Temperatūras ietekme uz ķīmisko reakciju ātrumu
No kvalitatīviem apsvērumiem ir skaidrs, ka reakcijas ātrumam vajadzētu palielināties, palielinoties temperatūrai, jo tas palielina sadursmes daļiņu enerģiju un palielina iespējamību, ka sadursmes rezultātā notiks ķīmiska transformācija. Temperatūras ietekmes kvantitatīvajam aprakstam ķīmiskajā kinētikā tiek izmantotas divas pamata sakarības – Van Hofa noteikums un Arrēnija vienādojums.
Vant Hofa likums slēpjas faktā, ka, uzkarsējot līdz aptuveni 10 C, vairumam ķīmisko reakciju ātrums palielinās 2 līdz 4 reizes. Matemātiski tas nozīmē, ka reakcijas ātrums ir atkarīgs no temperatūras pēc spēka likuma:
![]() , (4.1)
, (4.1)
kur ir ātruma temperatūras koeficients (= 24). Van't Hoff noteikums ir ļoti aptuvens un attiecas tikai uz ļoti ierobežotu temperatūras diapazonu.
Daudz precīzāk ir Arrēnija vienādojums aprakstot ātruma konstantes atkarību no temperatūras:
![]() , (4.2)
, (4.2)
kur R- universāla gāzes konstante; A- preeksponenciālais faktors, kas nav atkarīgs no temperatūras, bet tiek noteikts tikai pēc reakcijas veida; E A - aktivizācijas enerģija, ko var raksturot kā noteiktu sliekšņa enerģiju: rupji runājot, ja sadursmes daļiņu enerģija ir mazāka E A, tad sadursmē reakcija nenotiks, ja enerģija pārsniedz E A, reakcija notiks. Aktivizācijas enerģija nav atkarīga no temperatūras.
Grafiskā atkarība k(T) sekojoši:
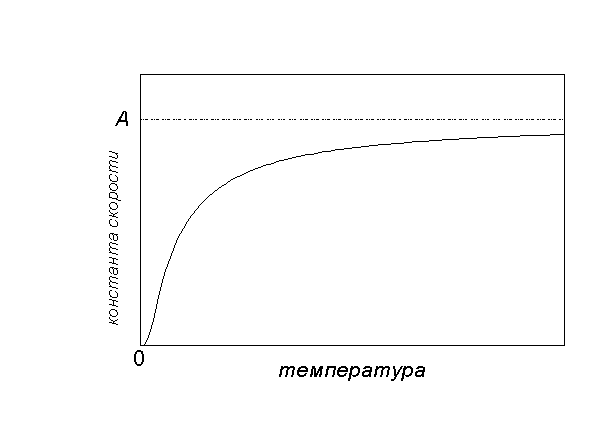
Zemā temperatūrā ķīmiskās reakcijas gandrīz nenotiek: k(T) 0. Ļoti augstā temperatūrā ātruma konstantei ir tendence sasniegt robežvērtību: k(T)A... Tas atbilst faktam, ka visas molekulas ir reaktīvas un katra sadursme izraisa reakciju.
Aktivizācijas enerģiju var noteikt, izmērot ātruma konstanti divās temperatūrās. Vienādojums (4.2) nozīmē:
![]() . (4.3)
. (4.3)
Precīzāk, aktivizācijas enerģiju nosaka no ātruma konstantes vērtībām vairākās temperatūrās. Šim nolūkam Arrēnija vienādojums (4.2) ir uzrakstīts logaritmiskā formā
![]()
un ierakstiet eksperimentālos datus koordinātēs ln k - 1/T... Iegūtās taisnes slīpuma leņķa tangensa ir - E A / R.
Dažām reakcijām preeksponenciālais faktors ir vāji atkarīgs no temperatūras. Šajā gadījumā ts eksperimentālās aktivizācijas enerģija:
![]() . (4.4)
. (4.4)
Ja preeksponenciālais koeficients ir nemainīgs, tad eksperimentālā aktivācijas enerģija ir vienāda ar Arrēnija aktivācijas enerģiju: E op = E A.
Piemērs 4-1. Izmantojot Arrēnija vienādojumu, novērtējiet, pie kādām temperatūrām un aktivizācijas enerģijām ir spēkā Van Hofa noteikums.
Risinājums. Mēs attēlojam Van Hofa likumu (4.1) kā ātruma konstantes atkarību no jaudas likuma:
![]() ,
,
kur B- nemainīga vērtība. Salīdzināsim šo izteiksmi ar Arrēnija vienādojumu (4.2), ņemot ~ vērtību e = 2.718:
![]() .
.
Ņemiet šīs aptuvenās vienādības abu pušu naturālo logaritmu:
![]() .
.
Diferencējot iegūto attiecību pret temperatūru, mēs atrodam vēlamo attiecību starp aktivācijas enerģiju un temperatūru:
Ja aktivācijas enerģija un temperatūra aptuveni atbilst šai attiecībai, tad Van't Hoff likumu var izmantot, lai novērtētu temperatūras ietekmi uz reakcijas ātrumu.
Piemērs 4-2. Pirmās kārtas reakcija 70 ° C temperatūrā tiek pabeigta par 40% 60 minūtēs. Kādā temperatūrā reakcija ir par 80% pabeigta 120 minūtēs, ja aktivācijas enerģija ir 60 kJ/mol?
Risinājums. Pirmās kārtas reakcijai ātruma konstante tiek izteikta konversijas izteiksmē šādi:
![]() ,
,
kur a = x/a- konversijas pakāpe. Mēs rakstām šo vienādojumu divās temperatūrās, ņemot vērā Arrēnija vienādojumu:
kur E A= 60 kJ/mol, T 1 = 343 K, t 1 = 60 min, a 1 = 0,4, t 2 = 120 min, a 2 = 0,8. Mēs sadalām vienu vienādojumu ar otru un logaritmu:
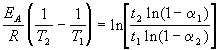
Aizvietojot iepriekš minētās vērtības šajā izteiksmē, mēs atrodam T 2 = 333 K = 60 o C.
Piemērs 4-3. Zivju muskuļu baktēriju hidrolīzes ātrums dubultojas, pārejot no -1,1 o C temperatūras līdz +2,2 o C. Novērtējiet šīs reakcijas aktivācijas enerģiju.
Risinājums. Divkāršs hidrolīzes ātruma pieaugums ir saistīts ar ātruma konstantes palielināšanos: k 2 = 2k viens . Aktivizācijas enerģiju attiecībā pret ātruma konstantu attiecību divās temperatūrās var noteikt no (4.3) vienādojuma ar T 1 = t 1 + 273,15 = 272,05 K, T 2 = t 2 + 273,15 = 275,35 K:
![]() 130800 J / mol = 130,8 kJ / mol.
130800 J / mol = 130,8 kJ / mol.
4-1. Izmantojot Van't Hoff likumu, aprēķiniet, pie kādas temperatūras reakcija beigsies pēc 15 minūtēm, ja pie 20 ° C tas aizņem 2 stundas. Ātruma temperatūras koeficients ir 3. (atbilde)
4-2. Vielas pussabrukšanas periods pie 323 K ir 100 min, bet pie 353 K tas ir 15 min. Nosakiet temperatūras ātruma koeficientu. (Atbilde)
4-3. Kādai jābūt aktivācijas enerģijai, lai reakcijas ātrums palielinātos 3 reizes, temperatūrai paaugstinoties par 10 0 С a) pie 300 K; b) pie 1000 K? (atbilde)
4-4. Pirmās kārtas reakcijas aktivācijas enerģija ir 25 kcal / mol un preeksponenciālais koeficients 5. 10 13 sek -1. Kādā temperatūrā šīs reakcijas pussabrukšanas periods būs: a) 1 min; b) 30 dienas? (atbilde)
4-5. Kurā no diviem gadījumiem reakcijas ātruma konstante palielinās vairāk reižu: karsējot no 0 o C līdz 10 o C vai karsējot no 10 o C līdz 20 o C? Pamato atbildi, izmantojot Arrēnija vienādojumu. (Atbilde)
4-6. Noteiktas reakcijas aktivācijas enerģija ir 1,5 reizes lielāka nekā citas reakcijas aktivācijas enerģija. Sildot no T 1 līdz T 2 otrās reakcijas ātruma konstante palielinājās par a vienreiz. Cik reizes palielinājās pirmās reakcijas ātruma konstante, karsējot no T 1 līdz T 2? (Atbilde)
4-7. Sarežģītas reakcijas ātruma konstante tiek izteikta ar elementārpakāpju ātruma konstantēm šādi:
Sarežģītas reakcijas aktivācijas enerģiju un preeksponenciālo koeficientu izsakiet ar atbilstošiem lielumiem, kas saistīti ar elementārajiem posmiem. (Atbilde)
4-8. Neatgriezeniskā pirmās kārtas reakcijā 20 minūtēs 125 ° C temperatūrā izejmateriāla konversija bija 60%, un 145 ° C temperatūrā tāda pati konversija tika sasniegta 5,5 minūtēs. Atrodiet šīs reakcijas ātruma konstantes un aktivācijas enerģiju. (Atbilde)
4-9. Pirmās kārtas reakcija 25 ° C temperatūrā tiek pabeigta par 30% 30 minūtēs. Kādā temperatūrā reakcija tiks pabeigta par 60% 40 minūtēs, ja aktivācijas enerģija ir 30 kJ / mol? (Atbilde)
4-10. Pirmās kārtas reakcija 25 ° C temperatūrā tiek pabeigta par 70% 15 minūtēs. Kādā temperatūrā reakcija tiks pabeigta par 50% 15 minūtēs, ja aktivācijas enerģija ir 50 kJ / mol? (Atbilde)
4-11. Pirmās kārtas reakcijas ātruma konstante ir 4,02. 10 -4 s -1 pie 393 K un 1,98. 10 -3 s -1 pie 413 K. Aprēķiniet šīs reakcijas preeksponenciālo koeficientu. (Atbilde)
4-12. Reakcijas H 2 + I 2 2HI ātruma konstante 683 K temperatūrā ir 0,0659 L / (mol min), bet temperatūrā 716 K - 0,375 L / (mol min). Atrodiet šīs reakcijas aktivācijas enerģiju un ātruma konstanti 700 K temperatūrā. (atbilde)
4-13. Reakcijas 2N 2 O 2N 2 + O 2 ātruma konstante 986 K temperatūrā ir 6,72 L / (mol min), bet temperatūrā 1165 K - 977,0 L / (mol min). Atrodiet šīs reakcijas aktivācijas enerģiju un ātruma konstanti 1053,0 K temperatūrā. (atbilde)
4-14. Trihloracetāta jons jonizējošos šķīdinātājos, kas satur H +, sadalās saskaņā ar vienādojumu
H + + CCl 3 COO - CO 2 + CHCl 3
Posms, kas nosaka reakcijas ātrumu, ir C-C saites monomolekulārā šķelšanās trihloracetāta jonos. Reakcija notiek saskaņā ar pirmo secību, un ātruma konstantēm ir šādas nozīmes: k= 3.11. 10 -4 s -1 pie 90 о С, k= 7,62. 10 -5 s -1 pie 80 o C. Aprēķināt a) aktivācijas enerģiju, b) ātruma konstanti pie 60 o C. (atbilde)
4-15. Reakcijai CH 3 COOC 2 H 5 + NaOH * CH 3 COONa + C 2 H 5 OH ātruma konstante pie 282,6 K ir 2,307 L / (mol min), bet pie 318,1 K - 21,65 L / (mol min). Atrodiet šīs reakcijas aktivācijas enerģiju un ātruma konstanti 343 K temperatūrā. (atbilde)
4-16. Reakcijas C 12 H 22 O 11 + H 2 OC 6 H 12 O 6 + C 6 H 12 O 6 ātruma konstante 298,2 K temperatūrā ir 0,765 L / (mol.min) un temperatūrā 328,2 K - 35,5 L / (mol min). Atrodiet šīs reakcijas aktivācijas enerģiju un ātruma konstanti 313,2 K temperatūrā. (atbilde)
4-17. Viela sadalās divos paralēlos ceļos ar ātruma konstantēm k 1 un k 2. Kāda ir atšķirība starp šo divu reakciju aktivācijas enerģijām, ja 10 o C temperatūrā k 1 /k 2 = 10 un 40 o C temperatūrā k 1 /k 2 = 0,1? (Atbilde)
4-18. Divās vienādas secības reakcijās aktivācijas enerģiju atšķirība ir E 2 - E 1 = 40 kJ / mol. 293 K temperatūrā ātruma konstantu attiecība ir k 1 /k 2 = 2. Kādā temperatūrā ātruma konstantes kļūs vienādas? (Atbilde)
4-19. Acetona dikarbonskābes sadalīšanās ūdens šķīdumā ir pirmās kārtas reakcija. Šīs reakcijas ātruma konstantes tika mērītas dažādās temperatūrās:
Aprēķiniet aktivizācijas enerģiju un pirmseksponenciālo koeficientu. Kāds ir pusperiods 25 ° C temperatūrā?







