3.2. Daļēji spiedieni gāzes maisījumā. Daltona likums
Gāzu maisījums ir līdzsvara stāvoklī, ja komponentu koncentrācijai un tā stāvokļa parametriem visā tilpumā ir vienādas vērtības. Šajā gadījumā visu gāzu temperatūra, kas nonāk maisījumā, ir vienāda un vienāda ar maisījuma temperatūru T cm.
Līdzsvara stāvoklī katras gāzes molekulas ir vienmērīgi izkliedētas visā maisījuma tilpumā, tas ir, tām ir sava specifiskā koncentrācija un līdz ar to arī savs spiediens. R i, Pa, ko sauc daļēja ... Tas ir definēts šādi.
Parciālais spiediens ir vienāds ar dotā komponenta spiedienu, ja tas viens pats aizņem visu maisījumam paredzēto tilpumu maisījuma temperatūrā T cm .
Saskaņā ar angļu ķīmiķa un fiziķa Daltona likumu, kas formulēts 1801. gadā, ideālo gāzu maisījuma spiediens p. cm ir vienāds ar tā sastāvdaļu parciālo spiedienu summu p i :
kur n- sastāvdaļu skaits.
Izteiksme (2) tiek saukta arī daļēju spiedienu likums.
3.3. Samazināts gāzes maisījuma sastāvdaļas tilpums. Amaga likums
Pēc definīcijas samazināts apjoms i gāzu maisījuma sastāvdaļa V i, m 3, ir tilpums, ko šī viena sastāvdaļa varētu aizņemt, ja tās spiediens un temperatūra ir vienādi ar visa gāzes maisījuma spiedienu un temperatūru.
Franču fiziķa Amaga likums, kas formulēts ap 1870. gadu, nosaka: visu maisījuma sastāvdaļu samazināto tilpumu summa ir vienāda ar maisījuma tilpumu.V cm :
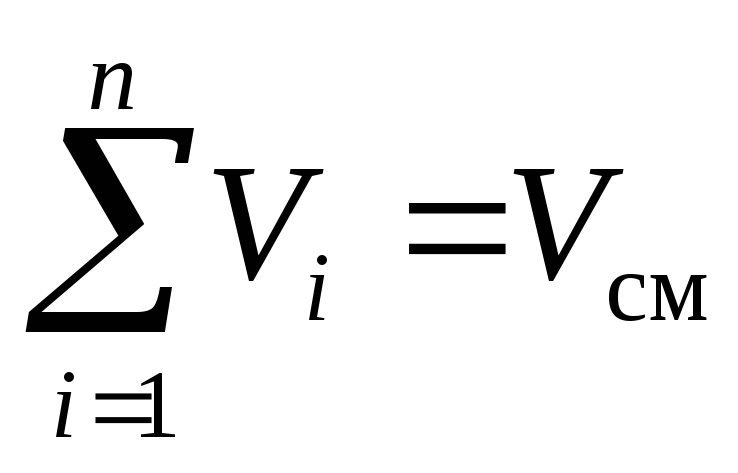 , m 3. (3)
, m 3. (3)
3.4. Gāzu maisījuma ķīmiskais sastāvs
Gāzu maisījuma ķīmisko sastāvu var iestatīt trīs dažādi veidus.
Apsveriet gāzu maisījumu, kas sastāv no n komponentiem. Maisījums aizņem tilpumu V cm, m 3, ir masa M cm, kg, spiediens R cm, Pa un temperatūra T cm, K. Arī maisījuma molu skaits ir N cm, mols. Turklāt viena masa i th sastāvdaļa m i, kg un šī komponenta molu skaits ν i, kurmis.
Ir skaidrs, ka:
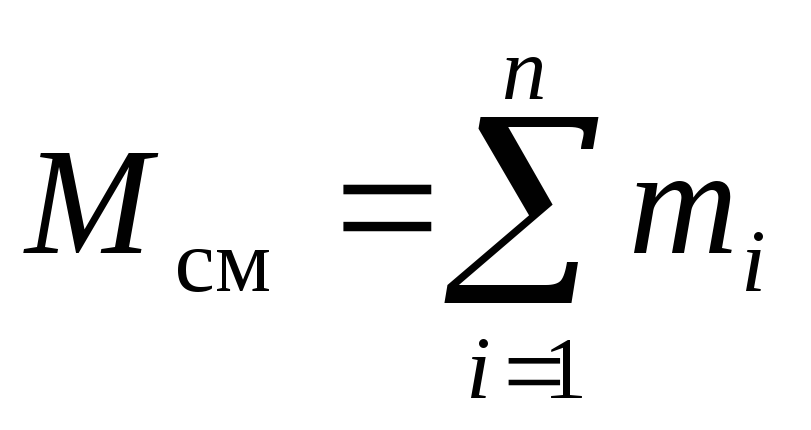 , (4)
, (4)
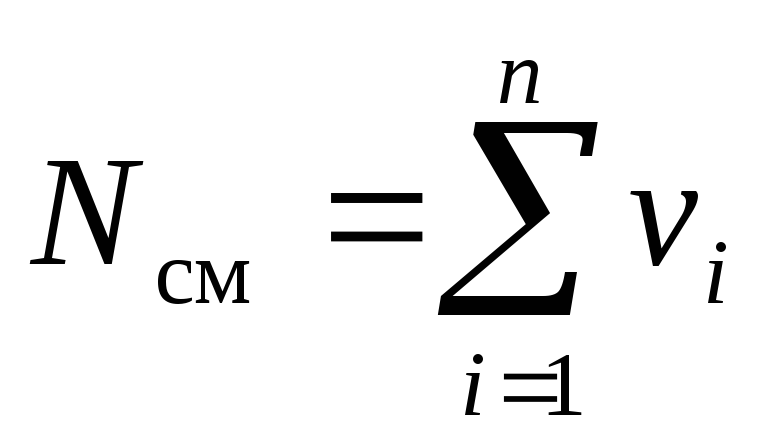 . (5)
. (5)
Izmantojot Daltona likumu (2) un Amaga likumu (3) aplūkojamajam maisījumam, mēs varam rakstīt:
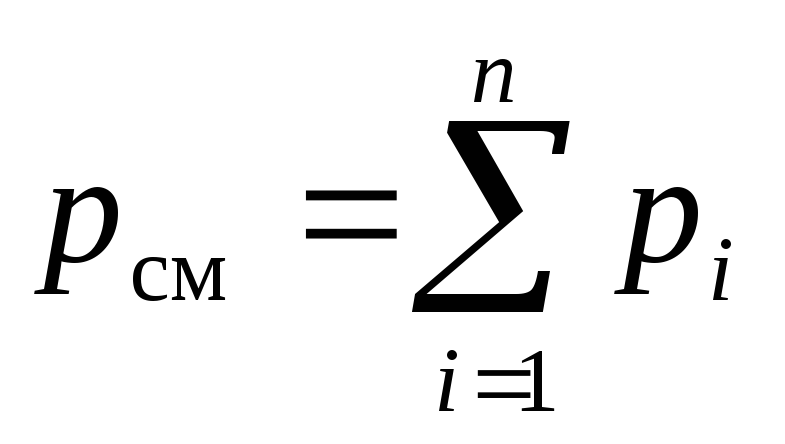 , (6)
, (6)
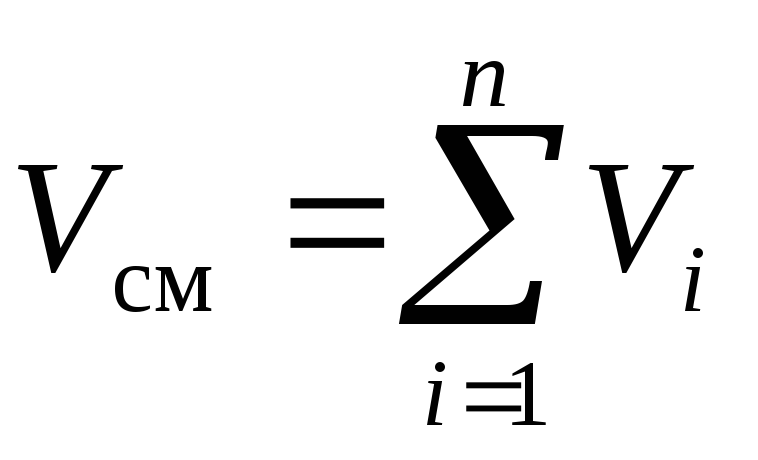 , (7)
, (7)
kur R i- daļējs spiediens i th komponents, Pa; V i- samazināts skaļums i komponents, m 3.
Gāzu maisījuma ķīmisko sastāvu var nepārprotami noteikt pēc tā sastāvdaļu masas, molārām vai tilpuma daļām:
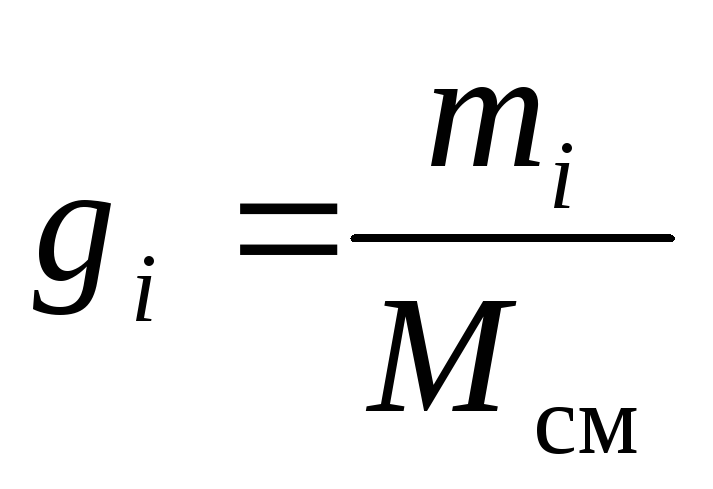 , (8)
, (8)
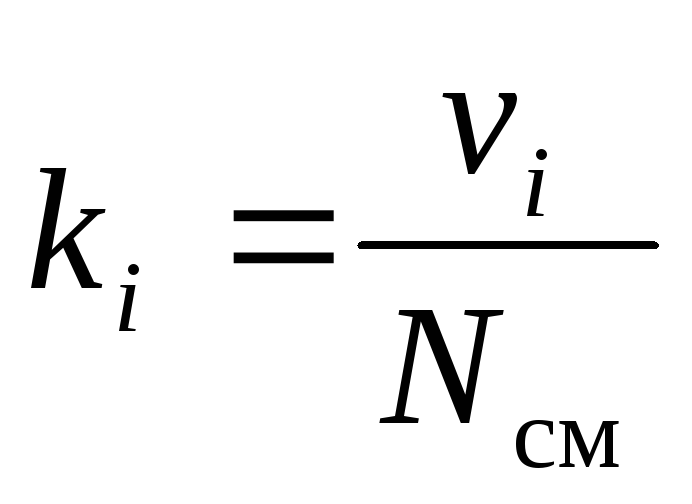 , (9)
, (9)
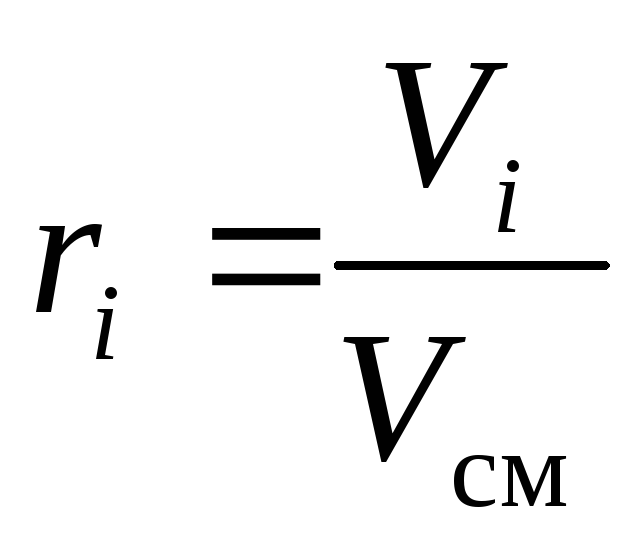 , (10)
, (10)
kur g i , k i un r i- masa, molārā un tilpuma daļa i attiecīgi maisījuma komponents (bezizmēra daudzumi).
Ir skaidrs, ka:
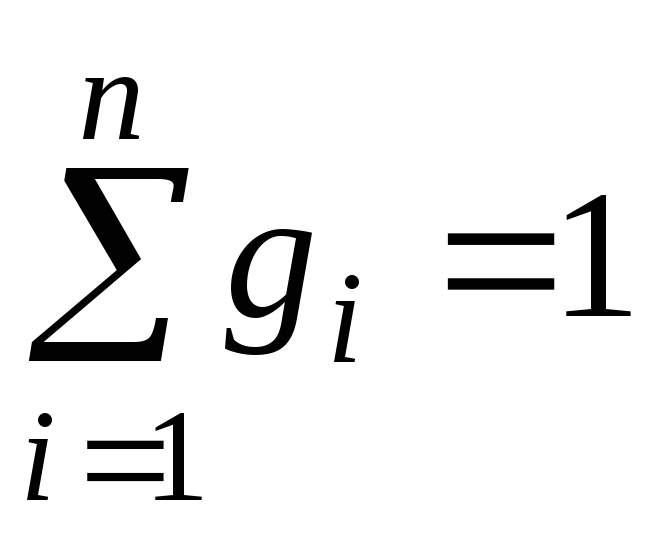 ,
,
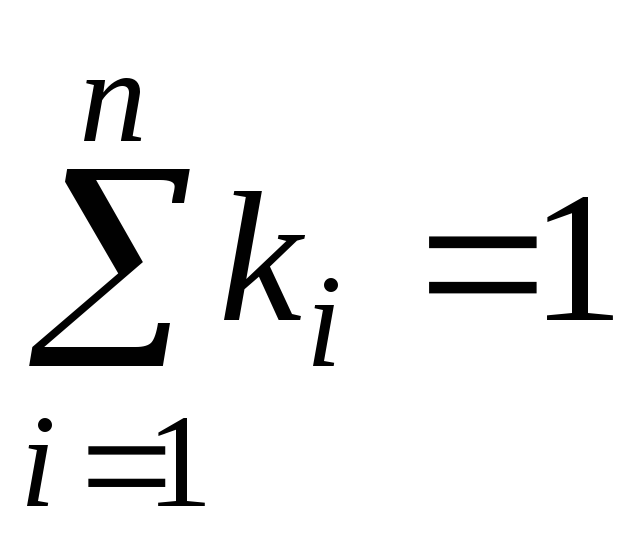 ,
,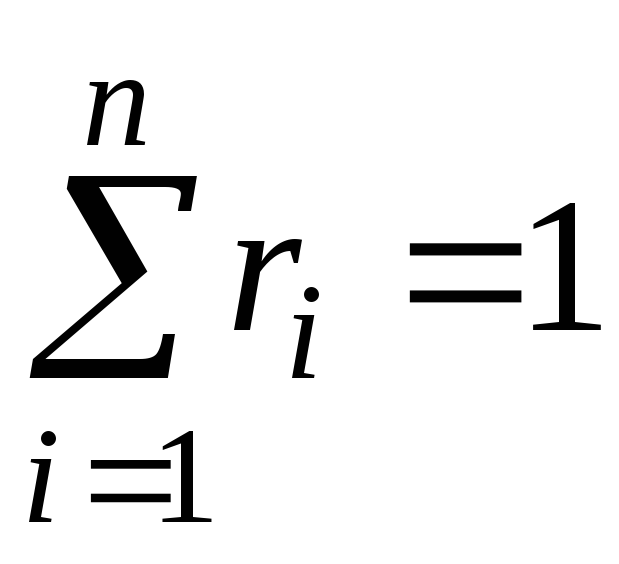 . (11)
. (11)
Bieži praksē maisījuma ķīmiskais sastāvs nav noteikts frakcijās i th komponents, un tā procenti.
Piemēram, siltumtehnikā tiek aptuveni pieņemts, ka sausais gaiss sastāv no 79 tilpuma procentiem slāpekļa un 21 tilpuma procenta skābekļa.
Procenti i Maisījuma th komponentu aprēķina, reizinot tā daļu ar 100.
Piemēram, ar sausu gaisu mums būs:
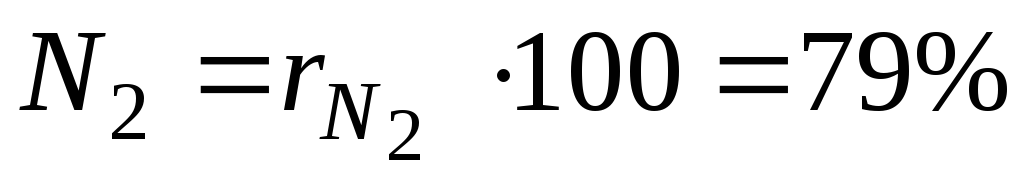 ,
,
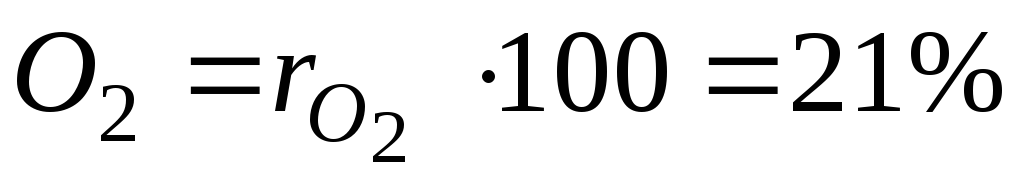 . (12)
. (12)
kur 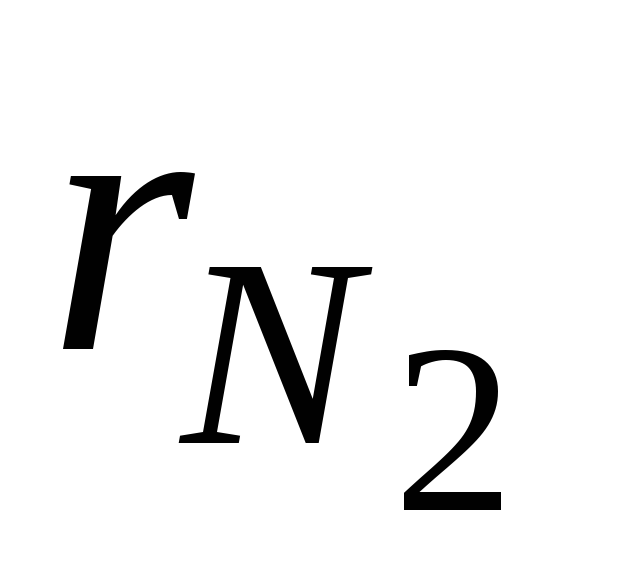 un
un 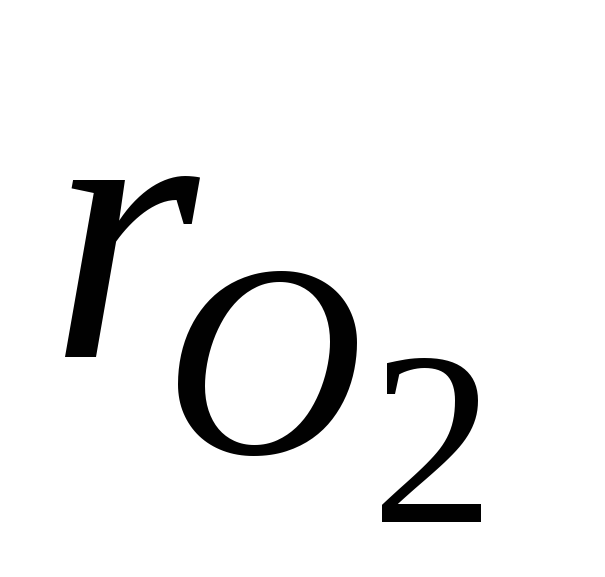 - slāpekļa un skābekļa tilpuma daļas sausā gaisā; N 2 un O 2 - attiecīgi slāpekļa un skābekļa tilpuma procentu apzīmējums,% (tilp.).
- slāpekļa un skābekļa tilpuma daļas sausā gaisā; N 2 un O 2 - attiecīgi slāpekļa un skābekļa tilpuma procentu apzīmējums,% (tilp.).
Piezīme:
1)Ideāla maisījuma molārās daļas ir skaitliski vienādas ar tilpuma daļām:k i = r i ... Pierādīsim to.
Izmantojot tilpuma daļas definīciju(10)un Amaga likumu (3) mēs varam rakstīt:
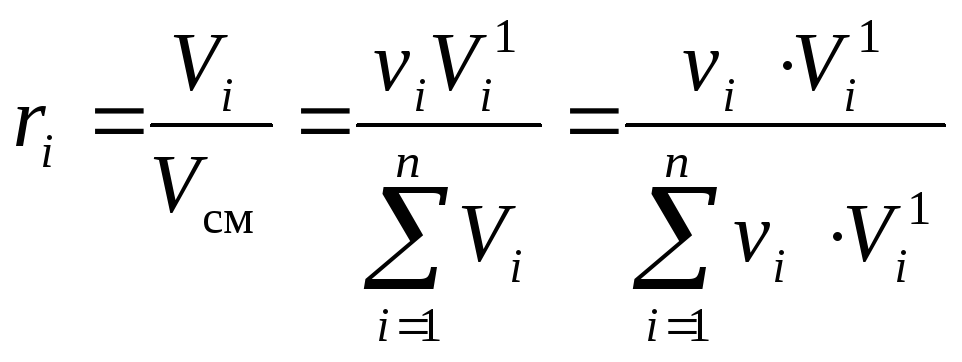 ,
(13)
,
(13)
kurV i - samazināts skaļumsith komponents, m 3
;
ν
i - molu skaitsith komponents, mol;
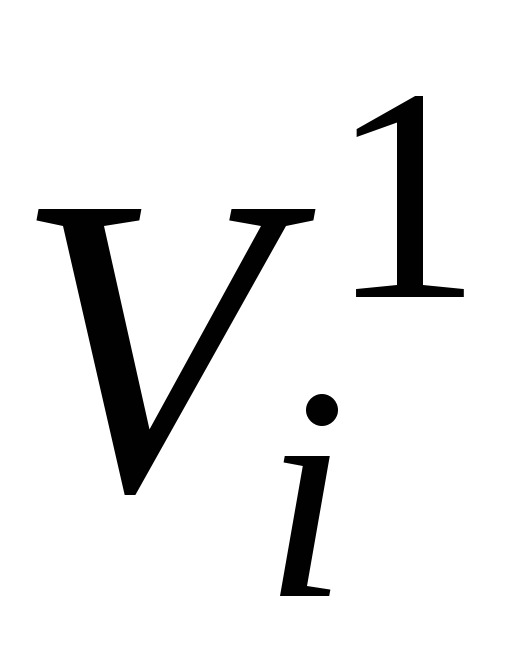 - viena mola tilpumsi-th komponents pie maisījuma spiediena p cm un maisījuma temperatūra T cm , m 3
/ mol.
- viena mola tilpumsi-th komponents pie maisījuma spiediena p cm un maisījuma temperatūra T cm , m 3
/ mol.
No Avogadro likuma (sk. šī pielikuma 2.3. lpp.) izriet, ka vienā un tajā pašā temperatūrā un spiedienā viens mols jebkuras gāzes (maisījuma sastāvdaļas) aizņem tādu pašu tilpumu. Jo īpaši pie T cm un lpp cm tas būs kāds apjomsV 1 , m 3 .
Iepriekš minētais ļauj mums uzrakstīt vienlīdzību:
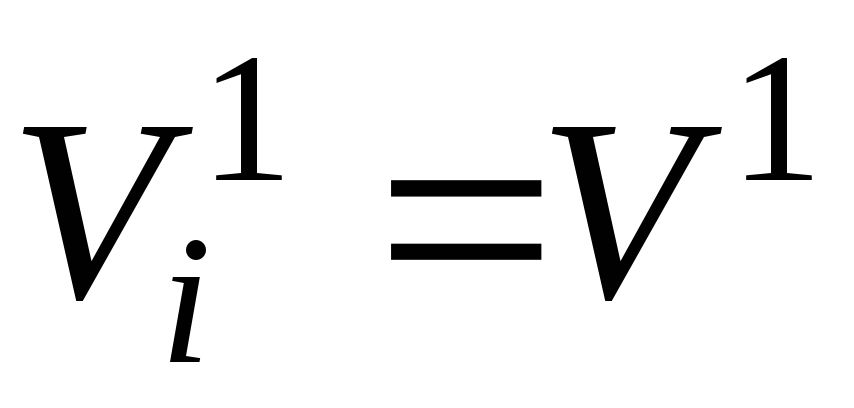 .
(14)
.
(14)
Aizstāšana(14)v(13)mēs saņemam nepieciešamo:
![]() .
(15)
.
(15)
2)Gāzu maisījuma sastāvdaļu tilpuma daļas var aprēķināt, zinot to daļējo spiedienu. Parādīsim to.
Apsverieti-ideāla gāzu maisījuma sastāvdaļa divos dažādos stāvokļos: kad tas ir pie tā daļējā spiediena p i ; kad tas aizņem samazināto tilpumuV i .
Ideālas gāzes stāvokļa vienādojums ir derīgs jebkuram no tās stāvokļiem, jo īpaši diviem iepriekš minētajiem stāvokļiem.
Saskaņā ar to un ņemot vērā konkrētā apjoma definīciju, mēs varam pierakstīt:
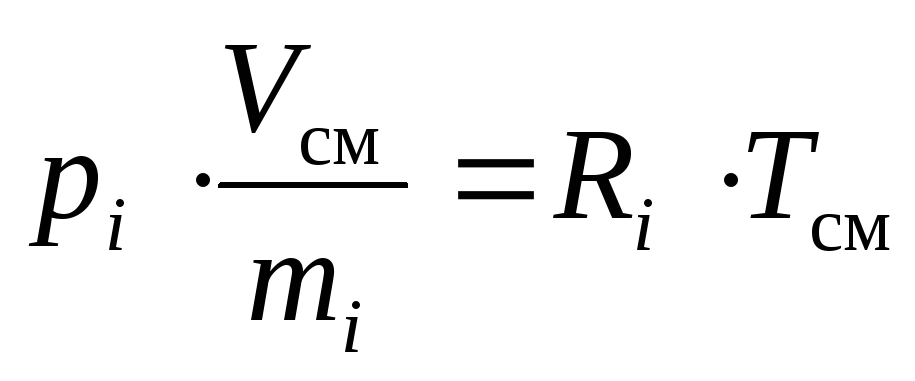 ,
(16)
,
(16)
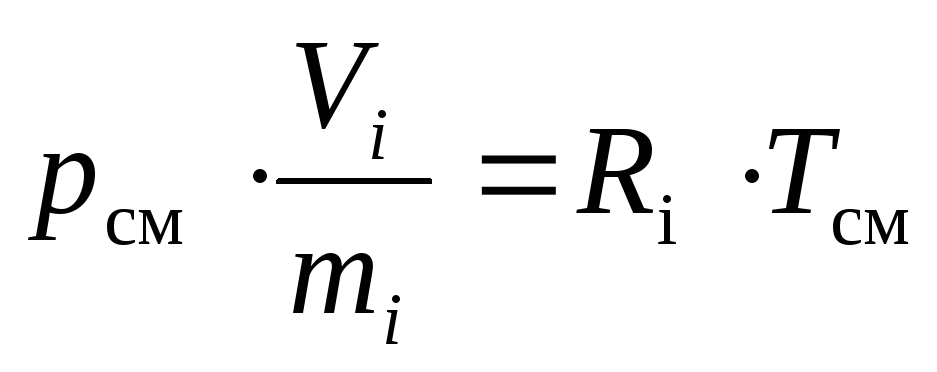 ,
(17)
,
(17)
kurR i - gāzes konstantei-maisījuma komponents, J / (kg · K).
Pēc abu daļu sadalīšanas(16)un(17)viens virs otra mēs iegūstam nepieciešamo:
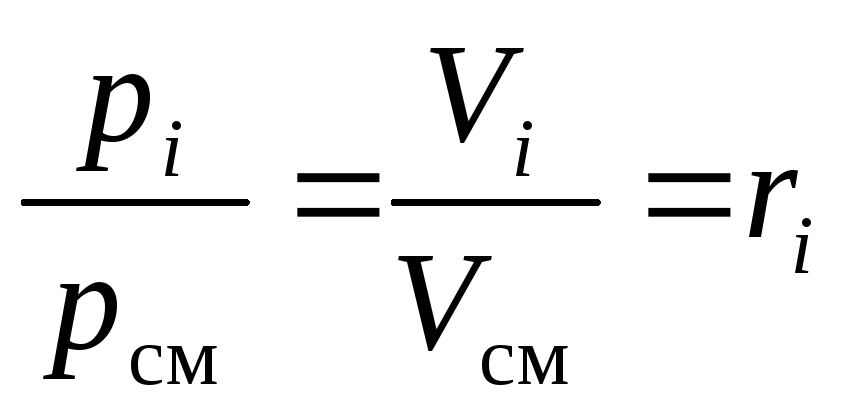 .
(18)
.
(18)
No(18)redzams, ka maisījuma sastāvdaļu daļējos spiedienus var aprēķināt pēc tā ķīmiskā sastāva pie zināma maisījuma kopējā spiediena p cm :
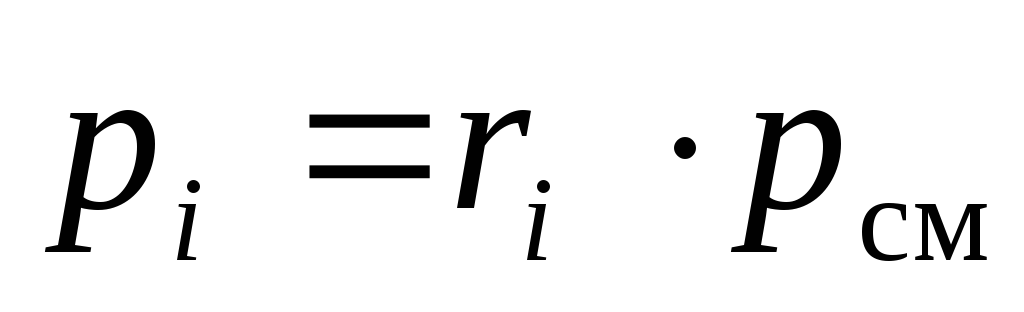 .
(19)
.
(19)







