10. Ķīmiskā līdzsvara apstākļi.
Ķīmiskais stāvoklis līdzsvars- tas ir stāvoklis, kurā produktu un sākotnējo vielu ķīmiskais potenciāls ir vienāds viens ar otru, ņemot vērā procesa stehiometriju.
Par ķīmisko līdzsvaru var runāt, ja ir izpildīti divi nosacījumi:
Reakcijas ātrums uz priekšu un atpakaļ ir vienāds.
Līdzsvars pastāv, ja, iedarbojoties uz ārēju ietekmi, un pēc tam, kad tas tiek noņemts, sistēma atgriežas sākotnējā stāvoklī.
11. Masu darbības likums.
Pastāvīgā temperatūrā ķīmiskās reakcijas ātrums ir tieši proporcionāls reaģentu koncentrāciju reizinājumam, kas ir vienāds ar stehiometriskajiem koeficientiem reakcijas vienādojumā.
Piemēram, amonjaka sintēzes reakcijai:
N2 + 3H2 = 2NH3
Masu darbības likumam ir šāda forma:
K c = 2 / 3
12.Līdzsvara konstante viendabīgā sistēmā. Līdzsvara konstantes izteikšanas veidi.
līdzsvara konstante ir nemainīga vērtība, kas vienāda ar reakcijas beigu un sākotnējo dalībnieku līdzsvara koncentrāciju produktu attiecību, kas ņemta pakāpēs, kas atbilst stehiometriskajiem koeficientiem
Homogēns sauc par reakcijām, kas notiek vienā fāzē: gāzu maisījumā, šķidrumā vai dažreiz cietā šķīdumā.
Līdzsvara konstantu izteikšanas veidi
Ja reakcijā iesaistīto vielu koncentrācijas ir izteiktas molārās molaritātes vienībās, t.i. mol / l, tad to parasti apzīmē ar Ks
Viendabīgai gāzes reakcijai ir ērtāk izteikt līdzsvara konstanti vielu parciālo spiedienu izteiksmē:
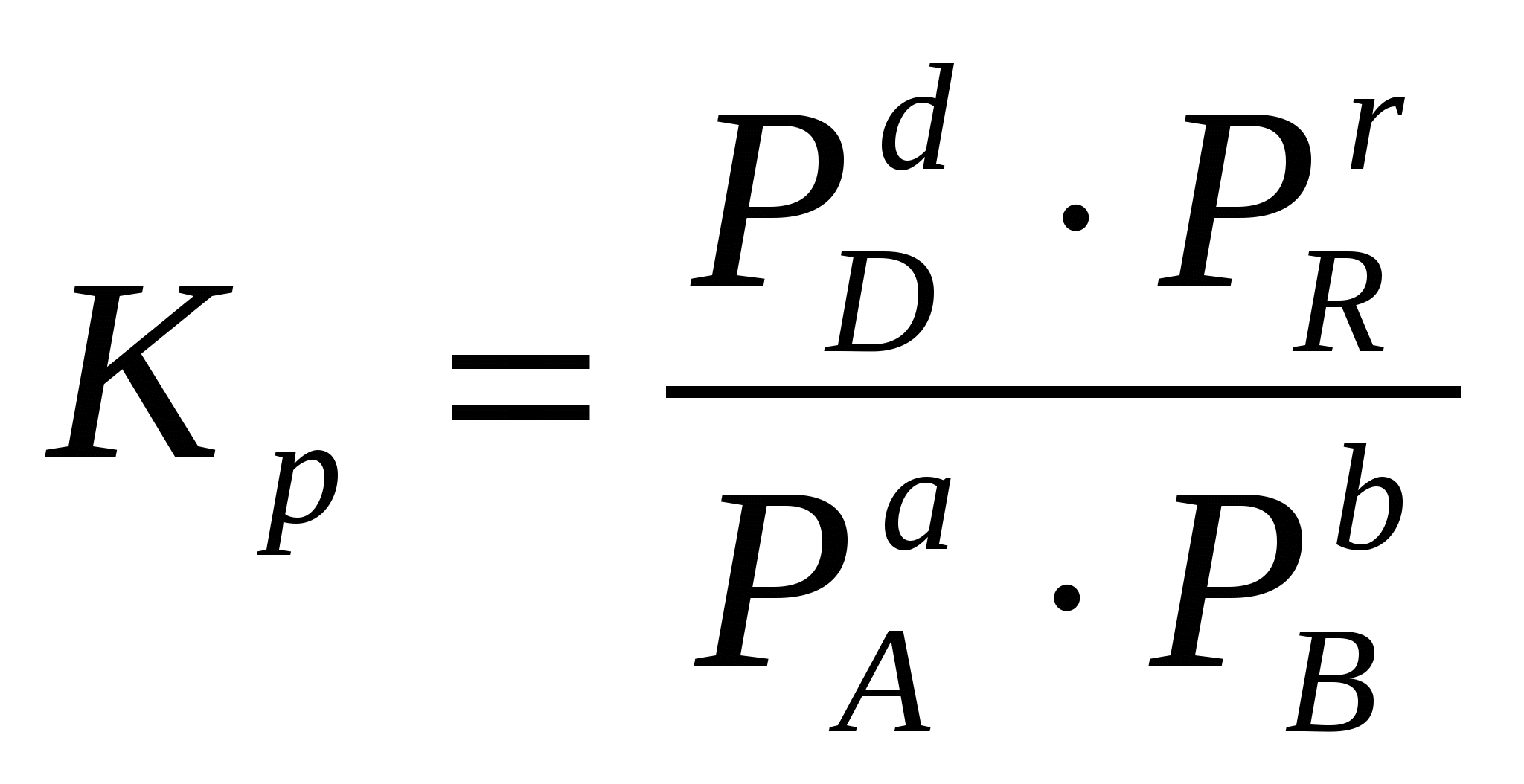
Dažreiz ir ērti izteikt līdzsvara konstanti nevis parciālo spiedienu un koncentrāciju izteiksmē, bet gan vielu daudzuma izteiksmē: 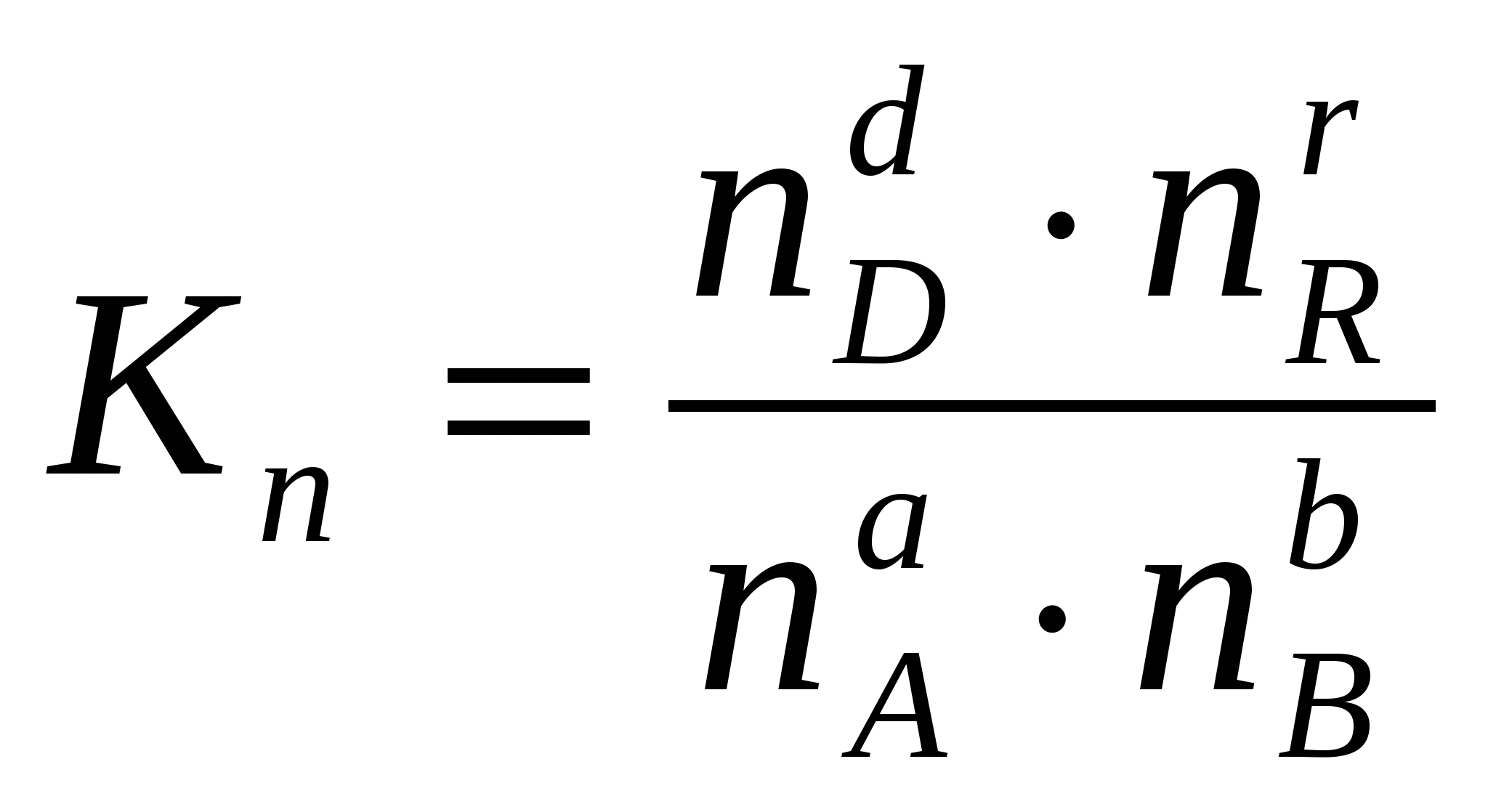 vai caur atbilstošajām molu daļām:
vai caur atbilstošajām molu daļām: 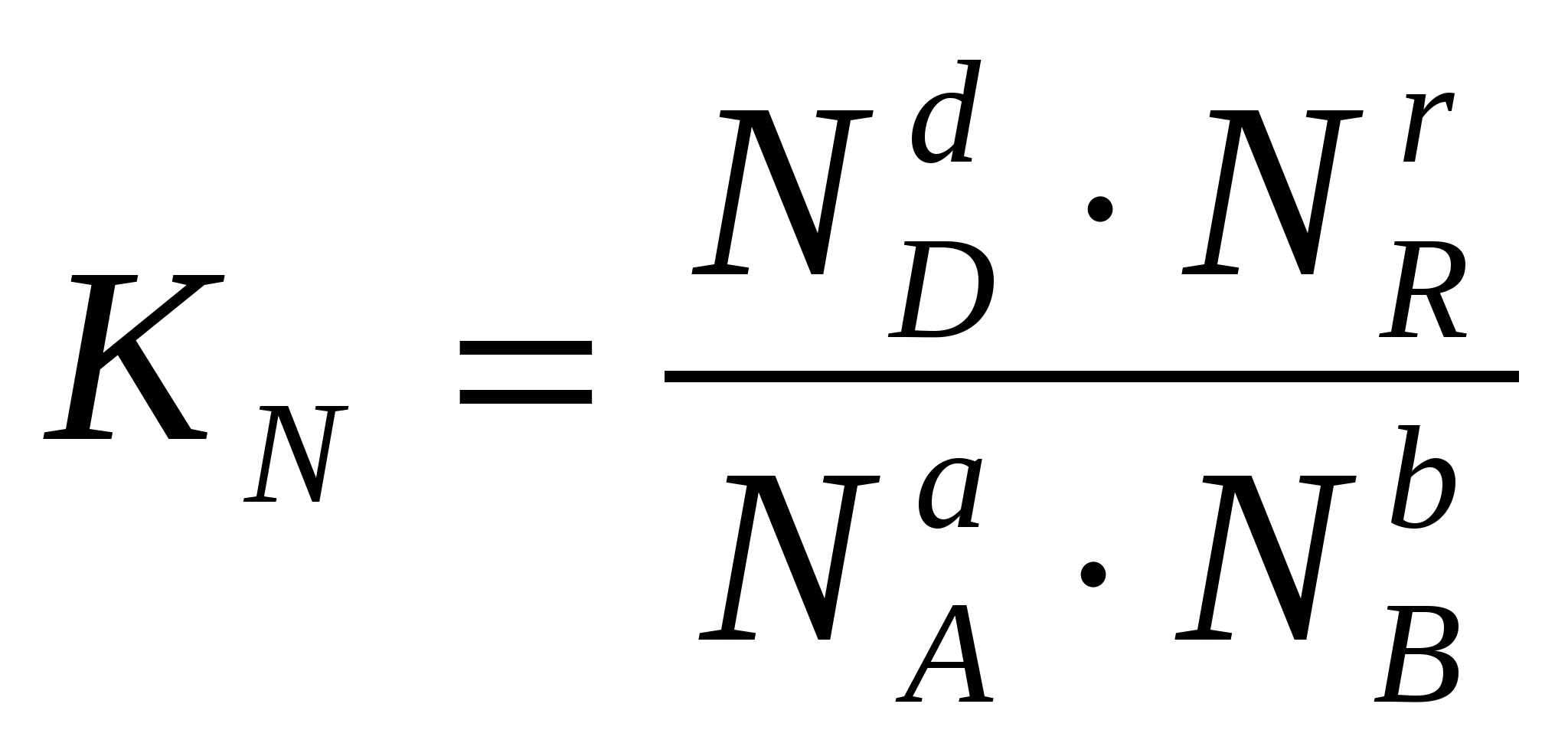
Vispārīgā gadījumā līdzsvara konstantes Kc, Kp, Kn un K N ir atšķirīgas.
13 Le Šateljē-Brauna princips .
ja uz līdzsvarotu sistēmu iedarbojas ārēja ietekme, tad līdzsvars tiek nobīdīts virzienā, kas vājina ārējo ietekmi.
14. Vant Hoff izobāra vienādojums.
šī izteiksme ļauj kvalitatīvi novērtēt T ietekmi uz līdzsvaru un līdzsvara konstanti.
15.Fāze.
Fāze tiek saukta - neviendabīgas sistēmas viendabīga daļa, kurai ir reāls interfeiss, kurā visas īpašības var nepārtraukti mainīties, un, izejot caur kuru, lēcienā.
16. Sastāvdaļas un sastāvdaļas.
Komponentu sauc- minimālais iebūvēto komponentu skaits, kas ir pietiekams, lai aprakstītu sistēmu stāvokli.
Sastāvā esošās vielassauca - vielas, kas veido sistēmu, kuras var izolēt ar tradicionālajām narkotiku metodēm un kuras var eksistēt ārpus sistēmas tik daudz, cik nepieciešams.
17 Gibsa fāzes noteikums .
Līdzsvara termodinamiskās sistēmas brīvības pakāpju skaits, kuru no ārējiem faktoriem ietekmē tikai temperatūra un spiediens, ir vienāds ar neatkarīgo komponentu skaitu. C = K-F +n(ārējo parametru skaits)
Fāzes noteikums parāda, ka brīvības pakāpju skaits palielinās, palielinoties komponentu skaitam, un samazinās, palielinoties fāžu skaitam sistēmā.
18. Fāzu līdzsvara nosacījumi sistēmā.
Neviendabīgā sistēmā pastāv fāzu līdzsvars, ja starp fāzēm pastāv šādi līdzsvara veidi:
Termiskā (temperatūras vienlīdzība)
Mehānisks (spiediena vienlīdzība)
Ķīmiskā katrai sastāvdaļai
19.Kliperona-Klausiusa vienādojums
Kur, - Δ V- vielas tilpuma izmaiņas tās pārejas laikā no pirmās fāzes uz otro, T - pārejas temperatūra, Δ H- vielas entropijas un entalpijas izmaiņas, pārejot 1 molam vielas no vienas fāzes uz otru
Tas ļauj novērtēt, kā mainās temperatūra vai spiediens fāzes pārejas laikā, mainoties 2 parametriem.
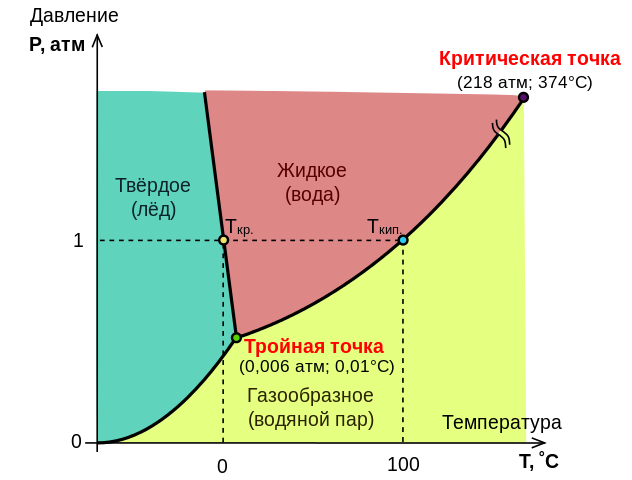
20.Ūdens stāvokļa diagramma
Sakarība starp sistēmas stāvokli raksturojošiem lielumiem un fāzu pārvērtībām sistēmā, pāreju no cieta stāvokļa uz šķidrumu, no šķidruma uz gāzveida stāvokli
21. Patiesi risinājumi. Šķīduma koncentrācijas izteikšanas metodes. Vielas molārās un masas daļas un vielas molārās koncentrācijas aprēķins šķīdumā.
Patiess risinājums ir šķīduma veids, kurā izšķīdušās vielas daļiņu izmērs ir ārkārtīgi mazs un salīdzināms ar šķīdinātāja daļiņu izmēru.
Risinājumi ir gāzveida(gāzu maisījumi), šķidrums un ciets... Gāzveida šķīdums ir gaiss. Jūras ūdens - sāļu maisījums ūdenī - šķidrs šķīdums. Cietie šķīdumi - metālu sakausējumi. Šķīdumi sastāv no šķīdinātāja un izšķīdušās vielas (-ām).
Risinājumu sauc cieta vai šķidra viendabīga sistēma, kas sastāv no divām vai vairākām sastāvdaļām.
Tiek ņemts vērā šķīdinātājs- in-in, kas nosaka šķīduma agregācijas stāvokli vai in-in, kas ir lielāks pēc tilpuma vai masas.
Šķīdumu koncentrācijas izteikšanas metodes.
Šķīduma koncentrācija Ir izšķīdušās vielas masa vai daudzums noteiktā šķīduma vai šķīdinātāja daudzumā, masā vai tilpumā.
1) Masas daļa ( wi ) Vai izšķīdušās vielas masa ir 100 gramos šķīduma.
2) Molārā daļa (molārā) - X i - komponenta molu skaits, kas atrodas 1 molā šķīduma.
3) Molārā koncentrācija (molalitāte) mi - izšķīdušās vielas molu skaits 1 kg šķīdinātāja [mol / kg].
4) Molārā koncentrācija AR i - izšķīdušās vielas molu skaits, kas atrodas 1 litrā vai 1 dm3 šķīduma [mol / l].







