Kas ir fermenti? Fermentu loma cilvēka organismā. Fermenti un to loma cilvēka organismā Fermentu struktūra un darbības mehānisms
Bez fermentiem cilvēks nebūs dzīvotspējīgs, jo organismam ir nepieciešamas olbaltumvielu molekulas visiem svarīgajiem vielmaiņas procesiem un veselīgai gremošanai.
Cilvēka organismā esošajiem fermentiem ir olbaltumvielu struktūra. Jūs varat iedomāties tos kā cilvēka ķermeņa katalizatorus, kas nodrošina visu vielmaiņas procesu darbību. Tie stimulē daudzas bioķīmiskas reakcijas un nodrošina, ka organisms ar pārtiku saņem nepieciešamās uzturvielas.
Darbības mehānisms
Fermenti sadala barības vielas, lai organisms tās varētu izmantot. Rezultātā barības vielas no pārtikas tiek ievadītas organismā.
Patiesībā fermenti ir ļoti gudri! Katram no šķietamajiem 10 000 dažādajiem fermentu veidiem organismā ir noteikta funkcija: tas iedarbojas uz noteiktu substrātu. Tādējādi proteīnu sagremojošie enzīmi sagremo tikai olbaltumvielas un nešķīdina taukus.
Lai mainītu savu funkciju, ferments var īslaicīgi apvienoties ar citu substrātu, kā rezultātā veidojas enzīma-substrāta komplekss. Pēc tam tas atgriežas sākotnējā struktūrā.
Galvenās enzīmu grupas organismā
Fermenti iedalās trīs kategorijās: gremošanas, uztura un vielmaiņas enzīmi. Kamēr gremošanas un vielmaiņas enzīmus ražo pats ķermenis, organisms saņem pārtikas fermentus no neapstrādātas pārtikas.
1. Gremošanas līdzeklis. Šīs olbaltumvielas tiek ražotas aizkuņģa dziedzerī, kuņģī, tievajās zarnās un siekalu dziedzeros mutē. Tur viņi sadala pārtikas molekulas savos pamatelementos un tādējādi nodrošina to pieejamību vielmaiņas procesam.
Īpaši svarīgs orgāns daudzu gremošanas enzīmu ražošanai ir aizkuņģa dziedzeris. Tas ražo amilāzi, kas pārvērš ogļhidrātus vienkāršos cukuros, lipāzi, kas no taukiem veido glicerīnu un vienkāršās taukskābes, un proteāzi, kas veido aminoskābes no olbaltumvielām.
2. Ēdiens. Šī enzīmu grupa ir atrodama neapstrādātā svaigā pārtikā. Pārtikas fermenti darbojas kā gremošanas enzīmi. Ieguvums: tie tieši palīdz pārtikas sagremošanai.
Lietojot svaigus augļus un neapstrādātus dārzeņus, pārtikas fermenti organismā sagremo līdz pat 70% pārtikas. Siltums tos iznīcina, tāpēc ir svarīgi ēst neapstrādātu pārtiku. Tam jābūt pēc iespējas daudzveidīgam, lai nodrošinātu dažādu fermentu piegādi.
Īpaši bagāti ar tiem ir banāni, ananāsi, vīģes, bumbieri, papaija un kivi. No dārzeņiem izceļas brokoļi, tomāti, gurķi un cukini.
3. Vielmaiņa. Šo enzīmu grupu ražo šūnās, orgānos, kaulos un asinīs. Tikai to klātbūtnes dēļ var strādāt sirds, nieres un plaušas. Metaboliskie fermenti nodrošina efektīvu barības vielu piegādi no pārtikas.
Tādējādi tie piegādā ķermenim vitamīnus, minerālvielas, fitoelementus un hormonus.
Ietekme uz ādu
Cītīgi enzīmu biokatalizatori organismā palīdz ne tikai ķermeņa iekšienē, bet arī ārpusē. Cilvēki, kuri cieš no pinnēm vai kuriem ir jutīga āda, ar viņu palīdzību var uzlabot savu izskatu. Lai paātrinātu procesu, tiek izmantoti speciāli enzīmu pīlingi. Tos parasti veido augļu fermenti.
Šādas procedūras noņem atmirušās ādas šūnas un noņem lieko sebumu. Enzīmu pīlingi tiek brīvi pārdoti un ir ļoti maigi pret ādu. Tomēr tos nevajadzētu lietot biežāk kā reizi nedēļā.
Fermenti (Enzīmi) ir specifiski proteīni, bioloģiski aktīvas organiskas vielas, kas paātrina ķīmiskās reakcijas šūnā. Fermentu milzīgā loma organismā. Tie var palielināt reakcijas ātrumu vairāk nekā desmit reizes. Tas ir vienkārši nepieciešams normālai šūnas darbībai. Un fermenti ir iesaistīti katrā reakcijā.
Visu dzīvo būtņu organismā, arī visprimitīvāko mikroorganismu organismā, ir atrasti fermenti. Fermenti to katalītiskās aktivitātes dēļ ir ļoti svarīgi mūsu ķermeņa sistēmu normālai darbībai.
Galvenie enzīmi organismā
Cilvēka ķermeņa dzīves pamatā ir tūkstošiem ķīmisko reakciju, kas notiek šūnās. Katrs no tiem tiek veikts, piedaloties īpašiem paātrinātājiem - biokatalizatoriem vai fermentiem.
Fermenti darbojas kā katalizatori gandrīz visās bioķīmiskajās reakcijās, kas notiek dzīvos organismos. Līdz 2013. gadam bija aprakstīti vairāk nekā 5000 dažādu fermentu.
Mūsdienu zinātne zina apmēram divus tūkstošus biokatalizatoru. Pievērsīsimies t.s galvenie fermenti . Tie ietver organisma dzīvībai svarīgākos biokatalizatorus, kuru “salūšana” parasti noved pie slimību rašanās. Mēs cenšamies atbildēt uz jautājumu: kā šis enzīms darbojas veselā organismā un kas ar to notiek cilvēka saslimšanas procesā?
Ir zināms, ka svarīgākie biopolimēri, kas veido visu dzīvo būtņu pamatu (no tiem ir uzbūvētas visas mūsu ķermeņa šūnu sastāvdaļas un visi fermenti), ir proteīna raksturs. Savukārt olbaltumvielas sastāv no vienkāršiem slāpekļa savienojumiem – aminoskābēm, kas savienotas ar ķīmiskām saitēm – peptīdu saitēm. Organismā ir īpaši fermenti, kas sadala šīs saites, piesaistot ūdens molekulas (hidrolīzes reakcija). Šādus enzīmus sauc par peptīdu hidrolāzēm. To ietekmē olbaltumvielu molekulās tiek sarautas ķīmiskās saites starp aminoskābēm un veidojas olbaltumvielu molekulu fragmenti - peptīdi, kas sastāv no dažāda skaita aminoskābēm. Peptīdi, kuriem ir augsta bioloģiskā aktivitāte, var pat izraisīt ķermeņa saindēšanos. Galu galā, pakļaujoties peptīdu hidrolāzēm, peptīdi vai nu zaudē vai ievērojami samazina savu bioloģisko aktivitāti.
1979. gadā profesoram VN Orekhovičam un viņa studentiem izdevās atklāt, izolēt tīrā veidā un detalizēti izpētīt vienas no peptīdu hidrolāzes fizikālās, ķīmiskās un katalītiskās īpašības, kas iepriekš bioķīmiķiem nebija zināmas. Tagad tas ir iekļauts starptautiskajā sarakstā ar enzīma karboksikatepsīna nosaukumu. Pētījumi ļāvuši tuvāk atbildēt uz jautājumu: kāpēc veselam organismam nepieciešams karboksikatepsīns un kas var notikt noteiktu tā struktūras izmaiņu rezultātā.
Izrādījās, ka karboksikatepsīns ir iesaistīts gan angiotenzīna B peptīda veidošanā, kas paaugstina asinsspiedienu, gan cita peptīda – bradikinīna – iznīcināšanā, kuram, gluži pretēji, ir asinsspiedienu pazeminājoša īpašība.
Tādējādi karboksikatepsīns izrādījās galvenais katalizators, kas iesaistīts vienas no svarīgākajām ķermeņa bioķīmisko sistēmu - asinsspiediena regulēšanas sistēmas - darbībā. Jo lielāka ir karboksikatepsīna aktivitāte, jo augstāka ir angiotenzīna II koncentrācija un zemāka bradikinīna koncentrācija, un tas, savukārt, izraisa asinsspiediena paaugstināšanos. Nav pārsteidzoši, ka cilvēkiem, kuri cieš no hipertensijas, palielinās karboksi-katepsīna aktivitāte asinīs. Šī rādītāja definīcija palīdz ārstiem novērtēt terapeitisko pasākumu efektivitāti, prognozēt slimības gaitu.
Vai ir iespējams inhibēt karboksitepsīna darbību tieši cilvēka organismā un tādējādi panākt asinsspiediena pazemināšanos? Mūsu institūtā veiktie pētījumi ir parādījuši, ka dabā ir peptīdi, kas spēj saistīties ar karboksikatepsīnu bez hidrolizēšanas un tādējādi atņem tam spēju pildīt tai raksturīgo funkciju.
Pašlaik notiek darbs pie mākslīgo karboksikatepsīna blokatoru (inhibitoru) sintēzes, kurus paredzēts izmantot kā jaunus terapeitiskus līdzekļus hipertensijas apkarošanai.
Citi svarīgi galvenie enzīmi, kas iesaistīti slāpekļa vielu bioķīmiskajās transformācijās cilvēka organismā, ir amīnoksidāzes. Bez tiem nevar iztikt tā saukto biogēno amīnu, pie kuriem pieder daudzi ķīmiskie nervu impulsu raidītāji - neirotransmiteri, oksidācijas reakcijas. Amīnoksidāžu sadalīšanās izraisa centrālās un perifērās nervu sistēmas darbības traucējumus; amīnoksidāžu ķīmiskie blokatori jau tiek izmantoti klīniskajā praksē kā terapeitiski līdzekļi, piemēram, depresīvos stāvokļos.
Amīnoksidāžu bioloģisko funkciju izpētes procesā izdevās atklāt to iepriekš nezināmo īpašību. Izrādījās, ka noteiktas ķīmiskās izmaiņas šo enzīmu molekulās pavada kvalitatīvas to katalītisko īpašību izmaiņas. Tādējādi monoamīnoksidāzes, kas oksidē biogēnos monoamīnus (piemēram, labi zināmie neirotransmiteri noradrenalīns, serotonīns un dopamīns), pēc apstrādes ar oksidētājiem daļēji zaudē savas īpašības. Bet, no otras puses, viņi atklāj kvalitatīvi jaunu spēju iznīcināt diamīnus, dažas aminoskābes un aminocukurus, nukleotīdus un citus šūnas dzīvībai nepieciešamos slāpekļa savienojumus. Turklāt monoamīnoksidāzes iespējams pārveidot ne tikai mēģenē (tas ir, gadījumos, kad pētnieki eksperimentē ar attīrītiem enzīmu preparātiem), bet arī dzīvnieka organismā, kurā sākotnēji tiek modelēti dažādi patoloģiski procesi.
Cilvēka ķermeņa šūnās monoamīnoksidāzes ir iekļautas bioloģisko membrānu sastāvā - daļēji caurlaidīgās starpsienas, kas kalpo kā šūnu membrānas un sadala katru no tām atsevišķos nodalījumos, kur notiek noteiktas reakcijas. Biomembrānas ir īpaši bagātas ar viegli oksidējamiem taukiem, kas atrodas pusšķidrā stāvoklī. Daudzas slimības pavada pārmērīga tauku oksidācijas produktu uzkrāšanās biomembrānās. Pārmērīgi oksidēti (peroksidēti), tie traucē gan normālu membrānu caurlaidību, gan normālu fermentu darbību, kas veido to sastāvu. Šie fermenti ietver monoamīnoksidāzes.
Jo īpaši radiācijas traumas laikā tauki tiek pāroksidēti kaulu smadzeņu, zarnu, aknu un citu orgānu šūnu biomembrānās, un monoamīnoksidāzes ne tikai daļēji zaudē savu lietderīgo aktivitāti, bet arī iegūst kvalitatīvi jaunu īpašību, kas ir kaitīga ķermenis. Viņi sāk iznīcināt šūnai vitāli svarīgas slāpekļa vielas. Monoamīnoksidāžu spēja pārveidot savu bioloģisko aktivitāti izpaužas gan eksperimentos ar attīrītiem enzīmu preparātiem, gan dzīvā organismā. Turklāt izrādījās, ka ārstniecības līdzekļi, kas tiek izmantoti cīņā pret radiācijas traumām, novērš arī kvalitatīvu enzīmu izmaiņu attīstību.
Šī ļoti svarīgā īpašība - monoamīnoksidāžu transformācijas atgriezeniskums - tika konstatēta eksperimentos, kuru laikā pētnieki iemācījās ne tikai novērst enzīmu transformāciju, bet arī novērst pārkāpumus, atgriežot katalizatoru funkcijas normālā stāvoklī un panākot noteiktu terapeitisko efektu. efekts.
Kamēr mēs runājam par eksperimentiem ar dzīvniekiem. Taču mūsdienās ir pilns pamats uzskatīt, ka amīnoksidāžu aktivitāte mainās arī cilvēka organismā, jo īpaši aterosklerozes gadījumā. Tāpēc pašlaik īpaši neatlaidīgi turpinās amīnoksidāžu īpašību izpēte, kā arī ķīmiskās vielas, ar kurām var ietekmēt to darbību cilvēka organismā terapeitiskos nolūkos.
Un pēdējais piemērs. Ir labi zināms, cik svarīga loma mūsu ķermeņa dzīvē ir ogļhidrātiem un līdz ar to arī galvenajiem fermentiem, kas paātrina to bioķīmiskās pārvērtības. Šie katalizatori ietver mūsu institūtā atklāto enzīmu gamma-amilāzi; viņš piedalās ķīmisko saišu sadalīšanā starp glikozes molekulām (no tām tiek veidotas sarežģītas glikogēna molekulas). Iedzimta gamma-amilāzes trūkums vai nepietiekamība izraisa normālu glikogēna bioķīmisko transformāciju traucējumus. Tā saturs bērna dzīvībai svarīgo orgānu šūnās palielinās, viņi zaudē spēju veikt savas funkcijas. Visas šīs izmaiņas raksturo vissmagāko slimību - glikogenozi.
Glikogēna bioķīmiskajās transformācijās ir iesaistīti arī citi fermenti.
To iedzimtais trūkums izraisa arī glikogenozes. Lai savlaicīgi un precīzi atpazītu, ar kāda veida glikogenozi slimo bērns (un tas ir svarīgi ārstēšanas metodes izvēlei un slimības gaitas prognozēšanai), ir jāizpēta vairāku enzīmu darbība, tai skaitā gamma. -amilāze. Pagājušā gadsimta 70. gados PSRS Medicīnas zinātņu akadēmijas Bioloģiskās un medicīniskās ķīmijas institūtā izstrādātās glikogenozes diferenciāllaboratoriskās un ķīmiskās diagnostikas metodes joprojām tiek izmantotas klīniskajā praksē.
Saskaņā ar profesora V.Z. GORKINA
Saglabāt sociālajos tīklos:Jebkura dzīva organisma šūnā notiek miljoniem ķīmisku reakciju. Katram no tiem ir liela nozīme, tāpēc ir svarīgi uzturēt bioloģisko procesu ātrumu augstā līmenī. Gandrīz katru reakciju katalizē savs enzīms. Kas ir fermenti? Kāda ir viņu loma šūnā?
Fermenti. Definīcija
Termins "enzīms" cēlies no latīņu vārda fermentum - raugs. Tos var saukt arī par fermentiem, no grieķu valodas en zyme, "raugā".
Fermenti ir bioloģiski aktīvas vielas, tāpēc jebkura reakcija, kas notiek šūnā, nevar iztikt bez to līdzdalības. Šīs vielas darbojas kā katalizatori. Attiecīgi jebkuram fermentam ir divas galvenās īpašības:
1) Enzīms paātrina bioķīmisko reakciju, bet netiek patērēts.
2) Līdzsvara konstantes vērtība nemainās, bet tikai paātrina šīs vērtības sasniegšanu.
Fermenti paātrina bioķīmiskās reakcijas tūkstoš un dažos gadījumos miljonu reižu. Tas nozīmē, ka, ja nav fermentatīvā aparāta, visi intracelulārie procesi praktiski apstāsies, un pati šūna mirs. Tāpēc enzīmu kā bioloģiski aktīvo vielu loma ir liela.
Dažādi fermenti ļauj dažādot šūnu metabolisma regulēšanu. Jebkurā reakciju kaskādē piedalās daudzi dažādu klašu fermenti. Bioloģiskie katalizatori ir ļoti selektīvi molekulas īpašās konformācijas dēļ. Tā kā fermentiem vairumā gadījumu ir proteīna raksturs, tie ir terciārā vai kvartārā struktūrā. Tas atkal ir izskaidrojams ar molekulas specifiku.
Fermentu funkcijas šūnā
Fermenta galvenais uzdevums ir paātrināt atbilstošo reakciju. Jebkurai procesu kaskādei, sākot no ūdeņraža peroksīda sadalīšanās līdz glikolīzei, ir nepieciešams bioloģiskais katalizators.
Pareiza fermentu darbība tiek panākta ar augstu specifiskumu konkrētam substrātam. Tas nozīmē, ka katalizators var tikai paātrināt noteiktu reakciju un nevienu citu, pat ļoti līdzīgu. Pēc specifiskuma pakāpes izšķir šādas fermentu grupas:
1) Fermenti ar absolūtu specifiskumu, kad tiek katalizēta tikai viena reakcija. Piemēram, kolagenāze sadala kolagēnu, bet maltāze - maltozi.
2) Fermenti ar relatīvu specifiskumu. Tas ietver vielas, kas var katalizēt noteiktas klases reakcijas, piemēram, hidrolītisko šķelšanos.
Biokatalizatora darbs sākas no brīža, kad tā aktīvā vieta tiek piestiprināta pie substrāta. Šajā gadījumā tiek runāts par papildinošu mijiedarbību, piemēram, slēdzeni un atslēgu. Šeit mēs domājam aktīvā centra formas pilnīgu sakritību ar substrātu, kas ļauj paātrināt reakciju.
Nākamais solis ir pati reakcija. Tā ātrums palielinās fermentatīvā kompleksa darbības dēļ. Galu galā mēs iegūstam fermentu, kas ir saistīts ar reakcijas produktiem.
Pēdējais posms ir reakcijas produktu atdalīšana no fermenta, pēc kura aktīvais centrs atkal kļūst brīvs nākamajam darbam.
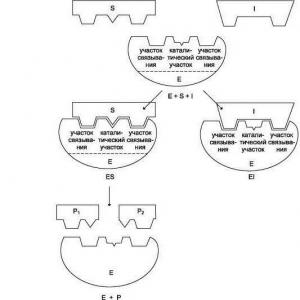
Shematiski fermenta darbu katrā posmā var uzrakstīt šādi:
1) S + E ——> SE
2) SE ——> SP
3) SP ——> S + P, kur S ir substrāts, E ir ferments un P ir produkts.

Enzīmu klasifikācija
Cilvēka ķermenī var atrast milzīgu skaitu fermentu. Visas zināšanas par to funkcijām un darbu tika sistematizētas, un rezultātā parādījās vienota klasifikācija, pateicoties kurai ir viegli noteikt, kam tas vai cits katalizators ir paredzēts. Šeit ir 6 galvenās fermentu klases, kā arī dažu apakšgrupu piemēri.
- Oksidoreduktāzes.
Šīs klases enzīmi katalizē redoksreakcijas. Kopumā ir 17 apakšgrupas. Oksidoreduktāzēm parasti ir daļa, kas nav proteīna, ko attēlo vitamīns vai hems.
Starp oksidoreduktāzēm bieži sastopamas šādas apakšgrupas:
a) Dehidrogenāzes. Dehidrogenāzes enzīmu bioķīmija sastāv no ūdeņraža atomu likvidēšanas un to pārnešanas uz citu substrātu. Šī apakšgrupa visbiežāk sastopama elpošanas, fotosintēzes reakcijās. Dehidrogenāžu sastāvs obligāti satur koenzīmu NAD / NADP vai flavoproteīnu FAD / FMN formā. Bieži vien ir metāla joni. Piemēri ir enzīmi, piemēram, citohroma reduktāze, piruvāta dehidrogenāze, izocitrāta dehidrogenāze un daudzi aknu enzīmi (laktāta dehidrogenāze, glutamāta dehidrogenāze utt.).
b) Oksidāzes. Vairāki fermenti katalizē skābekļa pievienošanu ūdeņradim, kā rezultātā reakcijas produkti var būt ūdens vai ūdeņraža peroksīds (H 2 0, H 2 0 2). Fermentu piemēri: citohroma oksidāze, tirozināze.
c) Peroksidāzes un katalāzes ir fermenti, kas katalizē H 2 O 2 sadalīšanos skābeklī un ūdenī.
d) oksigenāzes. Šie biokatalizatori paātrina skābekļa pievienošanu substrātam. Dopamīna hidroksilāze ir viens no šādu enzīmu piemēriem.
2. Transferāzes.
Šīs grupas enzīmu uzdevums ir pārnest radikāļus no donorvielas uz recipientu.
a) metiltransferāze. DNS metiltransferāzēm, galvenajiem enzīmiem, kas kontrolē nukleotīdu replikācijas procesu, ir svarīga loma nukleīnskābes regulēšanā.
b) Aciltransferāzes. Šīs apakšgrupas enzīmi transportē acilgrupu no vienas molekulas uz otru. Aciltransferāžu piemēri: lecitinholesterīna aciltransferāze (pārvieto funkcionālo grupu no taukskābes uz holesterīnu), lizofosfatidilholīna aciltransferāze (acilgrupa tiek pārnesta uz lizofosfatidilholīnu).
c) Aminotransferāzes - fermenti, kas ir iesaistīti aminoskābju pārvēršanā. Fermentu piemēri: alanīna aminotransferāze, kas katalizē alanīna sintēzi no piruvāta un glutamāta, pārnesot aminogrupas.
d) Fosfotransferāzes. Šīs apakšgrupas enzīmi katalizē fosfātu grupas pievienošanu. Cits fosfotransferāžu nosaukums, kināzes, ir daudz izplatītāks. Piemēri ir fermenti, piemēram, heksokināzes un aspartātkināzes, kas attiecīgi pievieno fosfora atlikumus heksozēm (visbiežāk glikozei) un asparagīnskābei.
3. Hidrolāzes - enzīmu klase, kas katalizē saišu šķelšanos molekulā, kam seko ūdens pievienošana. Vielas, kas pieder šai grupai, ir galvenie gremošanas enzīmi.
a) Esterāzes - sarauj esteru saites. Piemērs ir lipāzes, kas sadala taukus.
b) glikozidāzes. Šīs sērijas fermentu bioķīmija sastāv no polimēru (polisaharīdu un oligosaharīdu) glikozīdu saišu iznīcināšanas. Piemēri: amilāze, saharāze, maltāze.
c) Peptidāzes ir fermenti, kas katalizē olbaltumvielu sadalīšanos aminoskābēs. Peptidāzes ietver tādus fermentus kā pepsīni, tripsīns, himotripsīns, karboksipeptidāze.
d) Amidāzes - sašķeļ amīda saites. Piemēri: argināze, ureāze, glutamināze utt. Daudzi amidāzes enzīmi ir atrodami
4. Liāzes - enzīmi, kas pēc darbības ir līdzīgi hidrolāzēm, tomēr, sadalot saites molekulās, ūdens netiek patērēts. Šīs klases enzīmi vienmēr satur neolbaltumvielu daļu, piemēram, vitamīnu B1 vai B6 veidā.
a) Dekarboksilāzes. Šie fermenti iedarbojas uz C-C saiti. Piemēri ir glutamāta dekarboksilāze vai piruvāta dekarboksilāze.
b) Hidratāzes un dehidratāzes - fermenti, kas katalizē C-O saišu sadalīšanas reakciju.
c) Amidīn-liāzes - iznīcina C-N saites. Piemērs: arginīna sukcināta liāze.
d) P-O liāze. Šādi fermenti, kā likums, atdala fosfātu grupu no substrāta vielas. Piemērs: adenilāta ciklāze.

Fermentu bioķīmija balstās uz to struktūru
Katra fermenta spējas nosaka tā individuālā, unikālā struktūra. Jebkurš enzīms, pirmkārt, ir proteīns, un tā struktūrai un locīšanas pakāpei ir izšķiroša nozīme tā funkcijas noteikšanā.
Katram biokatalizatoram ir raksturīgs aktīvā centra klātbūtne, kas, savukārt, ir sadalīta vairākās neatkarīgās funkcionālās zonās:
1) Katalītiskais centrs ir īpašs proteīna apgabals, pa kuru enzīms tiek pievienots substrātam. Atkarībā no proteīna molekulas uzbūves katalītiskais centrs var izpausties dažādās formās, kam ir jāatbilst substrātam tāpat kā atslēgas slēdzenei. Šāda sarežģīta struktūra izskaidro to, kas atrodas terciārajā vai ceturtajā stāvoklī.
2) Adsorbcijas centrs - darbojas kā "turētājs". Šeit, pirmkārt, ir saikne starp fermenta molekulu un substrāta molekulu. Tomēr adsorbcijas centra izveidotās saites ir ļoti vājas, kas nozīmē, ka katalītiskā reakcija šajā posmā ir atgriezeniska.
3) Allosteriskie centri var atrasties gan aktīvajā centrā, gan pa visu fermenta virsmu kopumā. To funkcija ir regulēt fermenta darbību. Regulēšana notiek ar inhibitoru molekulu un aktivatora molekulu palīdzību.

Aktivatora proteīni, saistoties ar enzīma molekulu, paātrina tās darbu. Inhibitori, gluži pretēji, kavē katalītisko aktivitāti, un tas var notikt divos veidos: vai nu molekula saistās ar allosterisko vietu fermenta aktīvās vietas reģionā (konkurējošā inhibīcija), vai arī tā piesaistās citam proteīna reģionam. (nekonkurējoša inhibīcija). uzskatīts par efektīvāku. Galu galā tas aizver vietu substrāta saistīšanai ar fermentu, un šis process ir iespējams tikai gandrīz pilnīgas inhibitora molekulas un aktīvā centra formas sakritības gadījumā.
Fermentu bieži veido ne tikai aminoskābes, bet arī citas organiskas un neorganiskas vielas. Attiecīgi tiek izolēts apoenzīms - olbaltumvielu daļa, koenzīms - organiskā daļa un kofaktors - neorganiskā daļa. Koenzīmu var attēlot ogļhidrāti, tauki, nukleīnskābes, vitamīni. Savukārt kofaktors visbiežāk ir palīgmetālu joni. Fermentu aktivitāti nosaka tā struktūra: papildu vielas, kas veido sastāvu, maina katalītiskās īpašības. Dažādu veidu fermenti ir visu uzskaitīto kompleksa veidošanās faktoru kombinācijas rezultāts.

Enzīmu regulēšana
Fermenti kā bioloģiski aktīvas vielas ne vienmēr organismam ir nepieciešami. Fermentu bioķīmija ir tāda, ka pārmērīgas katalīzes gadījumā tie var kaitēt dzīvai šūnai. Lai novērstu fermentu kaitīgo ietekmi uz ķermeni, ir nepieciešams kaut kā regulēt to darbu.
Tā kā fermentiem ir proteīna raksturs, tie ir viegli iznīcināmi augstā temperatūrā. Denaturācijas process ir atgriezenisks, taču tas var būtiski ietekmēt vielu darbību.
PH arī spēlē lielu lomu regulēšanā. Vislielākā fermentu aktivitāte, kā likums, tiek novērota pie neitrālām pH vērtībām (7,0-7,2). Ir arī fermenti, kas darbojas tikai skābā vidē vai tikai sārmainā vidē. Tātad šūnu lizosomās tiek uzturēts zems pH līmenis, pie kura hidrolītisko enzīmu aktivitāte ir maksimāla. Ja tie nejauši nokļūst citoplazmā, kur vide jau ir tuvāk neitrālai, to aktivitāte samazināsies. Šāda aizsardzība pret "pašēdu" balstās uz hidrolāžu darba iezīmēm.
Ir vērts pieminēt koenzīma un kofaktora nozīmi enzīmu sastāvā. Vitamīnu vai metālu jonu klātbūtne būtiski ietekmē dažu specifisku enzīmu darbību.

Enzīmu nomenklatūra
Visi ķermeņa fermenti parasti tiek nosaukti atkarībā no to piederības kādai no klasēm, kā arī no substrāta, ar kuru tie reaģē. Dažreiz nosaukumā tiek izmantots nevis viens, bet divi substrāti.
Dažu fermentu nosaukumu piemēri:
- Aknu enzīmi: laktāta dehidrogenāze, glutamāta dehidrogenāze.
- Fermenta pilns sistemātiskais nosaukums: laktāts-NAD+-oksidoreduktāze.
Ir arī triviāli nosaukumi, kas neatbilst nomenklatūras noteikumiem. Piemēri ir gremošanas enzīmi: tripsīns, himotripsīns, pepsīns.
Enzīmu sintēzes process
Fermentu funkcijas tiek noteiktas ģenētiskā līmenī. Tā kā molekula kopumā ir proteīns, tās sintēze precīzi atkārto transkripcijas un translācijas procesus.
Fermentu sintēze notiek saskaņā ar šādu shēmu. Vispirms no DNS tiek nolasīta informācija par vēlamo fermentu, kā rezultātā veidojas mRNS. Messenger RNS kodē visas aminoskābes, kas veido fermentu. Fermentu regulēšana var notikt arī DNS līmenī: ja pietiek ar katalizētās reakcijas produktu, gēnu transkripcija apstājas un otrādi, ja ir nepieciešams produkts, tiek aktivizēts transkripcijas process.
Pēc mRNS nonākšanas šūnas citoplazmā sākas nākamais posms – translācija. Endoplazmatiskā retikuluma ribosomās tiek sintezēta primārā ķēde, kas sastāv no aminoskābēm, kas savienotas ar peptīdu saitēm. Tomēr proteīna molekula primārajā struktūrā vēl nevar veikt savas fermentatīvās funkcijas.
Fermentu aktivitāte ir atkarīga no proteīna struktūras. Tajā pašā ER notiek olbaltumvielu savīšana, kā rezultātā vispirms veidojas sekundārās un pēc tam terciārās struktūras. Dažu enzīmu sintēze apstājas jau šajā posmā, tomēr, lai aktivizētu katalītisko aktivitāti, bieži vien ir nepieciešams pievienot koenzīmu un kofaktoru.
Atsevišķos endoplazmatiskā tīkla apgabalos ir piesaistīti enzīma organiskie komponenti: monosaharīdi, nukleīnskābes, tauki, vitamīni. Daži fermenti nevar darboties bez koenzīma klātbūtnes.
Kofaktoram ir izšķiroša loma veidošanā Dažas no enzīmu funkcijām ir pieejamas tikai tad, kad proteīns sasniedz domēna organizāciju. Tāpēc viņiem ļoti svarīga ir kvartāra struktūras klātbūtne, kurā savienojošā saite starp vairākām proteīna globulām ir metāla jons.

Vairākas enzīmu formas
Ir situācijas, kad ir nepieciešami vairāki fermenti, kas katalizē vienu un to pašu reakciju, bet atšķiras viens no otra ar dažiem parametriem. Piemēram, ferments var strādāt pie 20 grādiem, bet pie 0 grādiem tas vairs nespēs pildīt savas funkcijas. Kas dzīvam organismam būtu jādara šādā situācijā zemā apkārtējās vides temperatūrā?
Šo problēmu var viegli atrisināt, vienlaikus klātesot vairākiem fermentiem, kas katalizē vienu un to pašu reakciju, bet darbojas dažādos apstākļos. Ir divu veidu vairākas fermentu formas:
- Izoenzīmi. Šādus proteīnus kodē dažādi gēni, tie sastāv no dažādām aminoskābēm, bet katalizē vienu un to pašu reakciju.
- Īstas daudzskaitļa formas. Šīs olbaltumvielas tiek transkribētas no viena un tā paša gēna, bet peptīdi tiek modificēti uz ribosomām. Rezultātā tiek iegūtas vairākas viena un tā paša enzīma formas.
Rezultātā pirmais vairāku formu veids veidojas ģenētiskajā līmenī, bet otrais – pēctranslācijas līmenī.
Fermentu nozīme
Medicīnā runa ir par jaunu zāļu izlaišanu, kurās vielas jau ir vajadzīgajā daudzumā. Zinātnieki vēl nav atraduši veidu, kā stimulēt organismā trūkstošo enzīmu sintēzi, taču mūsdienās plaši pieejamas zāles, kas var īslaicīgi kompensēt to trūkumu.
Dažādi šūnā esošie fermenti katalizē dažādas dzīvību uzturošas reakcijas. Viens no šiem enismiem ir nukleāžu grupas pārstāvji: endonukleāzes un eksonukleāzes. Viņu uzdevums ir uzturēt nemainīgu nukleīnskābju līmeni šūnā, noņemot bojāto DNS un RNS.
Neaizmirstiet par tādu parādību kā asins recēšanu. Tā kā šis process ir efektīvs aizsardzības līdzeklis, to kontrolē vairāki fermenti. Galvenais no tiem ir trombīns, kas pārvērš neaktīvo proteīna fibrinogēnu par aktīvo fibrīnu. Tās pavedieni veido sava veida tīklu, kas aizsprosto kuģa bojājuma vietu, tādējādi novēršot pārmērīgu asins zudumu.
Fermentus izmanto vīna darīšanā, alus darīšanā, daudzu raudzētu piena produktu iegūšanā. Raugu var izmantot spirta ražošanai no glikozes, taču šī procesa veiksmīgai norisei pietiek ar ekstraktu no tiem.

Interesanti fakti, kurus tu nezināji
Visiem ķermeņa enzīmiem ir milzīga masa - no 5000 līdz 1 000 000 Da. Tas ir saistīts ar olbaltumvielu klātbūtni molekulā. Salīdzinājumam: glikozes molekulmasa ir 180 Da, bet oglekļa dioksīdam ir tikai 44 Da.
Līdz šim ir atklāti vairāk nekā 2000 enzīmu, kas ir atrasti dažādu organismu šūnās. Tomēr lielākā daļa šo vielu vēl nav pilnībā izprastas.
Enzīmu aktivitāti izmanto, lai ražotu efektīvus veļas mazgāšanas līdzekļus. Šeit fermenti veic tādu pašu lomu kā organismā: tie sadala organiskās vielas, un šī īpašība palīdz cīņā pret traipiem. Ieteicams lietot līdzīgu veļas pulveri temperatūrā, kas nepārsniedz 50 grādus, pretējā gadījumā var notikt denaturācijas process.
Saskaņā ar statistiku, 20% cilvēku visā pasaulē cieš no kāda no fermentiem trūkuma.
Fermentu īpašības ir zināmas jau ļoti sen, taču tikai 1897. gadā cilvēki saprata, ka cukura raudzēšanai spirtā var izmantot nevis pašu raugu, bet gan ekstraktu no viņu šūnām.
Bioloģiskā ķīmija Leļevičs Vladimirs Valerjanovičs
Fermentu darbības mehānisms
Fermentu darbības mehānisms
Jebkurā fermentatīvā reakcijā izšķir šādus posmus:
E+S? ?E+P
kur E ir ferments, S ir substrāts, ir enzīma-substrāta komplekss, P ir produkts.
Fermentu darbības mehānismu var aplūkot no divām pozīcijām: no ķīmisko reakciju enerģijas izmaiņu viedokļa un no notikumu viedokļa aktīvajā centrā.
Enerģijas izmaiņas ķīmiskajās reakcijās
Jebkuras ķīmiskās reakcijas notiek, ievērojot divus termodinamikas pamatlikumus: enerģijas nezūdamības likumu un entropijas likumu. Saskaņā ar šiem likumiem ķīmiskās sistēmas un tās vides kopējā enerģija paliek nemainīga, savukārt ķīmiskajai sistēmai ir tendence samazināt kārtību (palielināt entropiju). Lai izprastu ķīmiskās reakcijas enerģiju, nepietiek tikai zināt reakcijā ienākošo un izejošo vielu enerģijas bilanci. Jāņem vērā enerģijas izmaiņas konkrētās ķīmiskās reakcijas procesā un enzīmu loma šī procesa dinamikā.
Jo vairāk molekulu ir enerģija, kas pārsniedz Ea līmeni (aktivācijas enerģija), jo lielāks ir ķīmiskās reakcijas ātrums. Ķīmiskās reakcijas ātrumu var palielināt karsējot. Tas palielina reaģējošo molekulu enerģiju. Tomēr augsta temperatūra ir kaitīga dzīviem organismiem, tāpēc šūnā tiek izmantoti fermenti, lai paātrinātu ķīmiskās reakcijas. Fermenti nodrošina augstu reakciju ātrumu optimālos apstākļos, kas pastāv šūnā, pazeminot Ea līmeni. Tādējādi fermenti pazemina enerģijas barjeras augstumu, kā rezultātā palielinās reaktīvo molekulu skaits un līdz ar to palielinās reakcijas ātrums.
Aktīvās vietas loma fermentatīvā katalīzē
Pētījumu rezultātā tika pierādīts, ka enzīma molekula, kā likums, ir daudzkārt lielāka nekā substrāta molekula, kas tiek ķīmiski pārveidota ar šo fermentu. Tikai neliela fermenta molekulas daļa nonāk saskarē ar substrātu, parasti no 5 līdz 10 aminoskābju atlikumiem, kas veido fermenta aktīvo vietu. Atlikušo aminoskābju atlikumu uzdevums ir nodrošināt pareizu fermenta molekulas konformāciju optimālai ķīmiskās reakcijas norisei.
Aktīvo vietu visos fermentatīvās katalīzes posmos nevar uzskatīt par pasīvu vietu substrāta saistīšanai. Tā ir sarežģīta molekulāra "mašīna", kas izmanto dažādus ķīmiskus mehānismus, kas veicina substrāta pārvēršanos produktā.
Fermenta aktīvajā centrā substrāti ir izkārtoti tā, lai substrātu funkcionālās grupas, kas piedalās reakcijā, atrodas tuvu viena otrai. Šo aktīvā centra īpašību sauc par reaģentu pieejas un orientācijas efektu. Šāds sakārtots substrātu izvietojums izraisa entropijas samazināšanos un līdz ar to aktivācijas enerģijas (Ea) samazināšanos, kas nosaka enzīmu katalītisko efektivitāti.
Fermenta aktīvais centrs veicina arī starpatomisko saišu destabilizāciju substrāta molekulā, kas atvieglo ķīmiskās reakcijas gaitu un produktu veidošanos. Šo aktīvā centra īpašību sauc par substrāta deformācijas efektu.
No grāmatas Jaunā dzīves zinātne autors Šeldreiks Rūperts2.2. Mehānisms Mūsdienu mehāniskā morfoģenēzes teorija DNS piešķir lielu lomu šādu četru iemeslu dēļ. Pirmkārt, ir konstatēts, ka daudzas iedzimtas atšķirības starp noteiktas sugas dzīvniekiem vai augiem ir atkarīgas no gēniem, kas
No grāmatas Cilvēku rase autors Bārnets EntonijsNervu sistēmas darbības mehānisms Tagad, iespējams, mums vajadzētu tuvāk apskatīt šīs sarežģītās struktūras darbības mehānismu, sākot ar vienkāršu piemēru. Ja acīs tiek vērsta spilgta gaisma, cilvēka zīlīte sašaurinās. Šī reakcija ir atkarīga no virknes notikumu, kas sākas
No grāmatas Stāsts par nelaimes gadījumu [vai Cilvēka nolaišanās] autors Višņatskis Leonīds Borisovičs No grāmatas Ceļojums uz mikrobu zemi autors Betina VladimirsMikrobi - fermentu ražotāji Mēs jau zinām, ka fermenti ir bioloģiski katalizatori, tas ir, vielas, kas veicina daudzu ķīmisku reakciju īstenošanu, kas notiek dzīvā šūnā un ir nepieciešamas barības vielu iegūšanai un tās veidošanai.
No grāmatas Embriji, gēni un evolūcija autors Rafs Rūdolfs AHeterohronija – klasiskais evolūcijas pārmaiņu mehānisms Mēģinājumi atrast evolūcijas mehānismus, kas sakņojas ontoģenēzē, galvenokārt ir vērsti uz heterohroniju – attīstības procesu relatīvā laika izmaiņām. Hekels uzsvēra atkarību
No grāmatas Bioloģisko sistēmu dabiskās tehnoloģijas autors Ugoļevs Aleksandrs Mihailovičs2.2. Gremošanas enzīmu vispārīgās īpašības Uzmanība tiek vērsta uz to enzīmu sistēmu fundamentālo līdzību un dažkārt pārsteidzošu sakritību, kas nodrošina gremošanu dažādos organismos. Tāpēc raksturlielumi, kas tiks parādīti turpmāk,
No grāmatas Dieva noslēpums un smadzeņu zinātne [Ticības un reliģiskās pieredzes neirobioloģija] autors Ņūbergs Endrjū2. Smadzeņu aparāts. Uztveres mehānisms
No Fenētikas grāmatas [Evolūcija, populācija, zīme] autors Jablokovs Aleksejs VladimirovičsI nodaļa. Evolūcijas mehānisms Bioloģijas kā zinātnes disciplīnas galvenais stratēģiskais uzdevums ir zināšanas par dzīvības attīstības modeļiem, lai tos pārvaldītu cilvēka interesēs. 20. gados N. I. Vavilovs zinātniekiem izvirzīja problēmu par pāreju uz kontrolētu evolūciju -
No grāmatas Ko darīt, ja Lamarkam ir taisnība? Imunoģenētika un evolūcija autors Stīls EdvardsEvolūcijas spēku mijiedarbība - evolūcijas mehānisms Evolūcijas sprūda mehānisms funkcionē evolūcijas faktoru kombinētas darbības rezultātā populācijā kā evolūcijas vienībā. Katra katras sugas populācija ir pakļauta tāda vai cita veida spiedienam.
No grāmatas Seksa noslēpumi [Vīrietis un sieviete evolūcijas spogulī] autors Butovskaja Marina Ļvovna No grāmatas Bioloģiskā ķīmija autors Leļēvičs Vladimirs ValerjanovičsDevas kompensācijas mehānisms Lielākajā daļā zīdītāju (bet ne marsupial) viena no X hromosomām ir inaktivēta mātīšu somatiskajās šūnās. Šāda izslēgšana ir viena no problēmas risināšanas iespējām sugās, kurām vienu dzimumu pārstāv divi
No autora grāmatas3. nodaļa. Fermenti. Fermentu darbības mehānisms Par fermentiem jeb fermentiem sauc specifiskus proteīnus, kas ietilpst visu dzīvo organismu šūnās un audos un darbojas kā bioloģiskie katalizatori.Enzīmu un neorganisko katalizatoru vispārīgās īpašības: 1. Nav
No autora grāmatasFermenta molekulas struktūra Pēc struktūras fermenti var būt vienkārši un sarežģīti proteīni. Fermentu, kas ir sarežģīts proteīns, sauc par holoenzīmu. Fermenta olbaltumvielu daļu sauc par apoenzīmu, bet neolbaltumvielu daļu sauc par kofaktoru. Ir divu veidu kofaktori: 1.
No autora grāmatasFermentu darbības specifika Fermentiem ir augstāka darbības specifika, salīdzinot ar neorganiskiem katalizatoriem. Ir specifiskums attiecībā uz ķīmiskās reakcijas veidu, ko katalizē ferments, un specifiskums attiecībā uz
No autora grāmatas4. nodaļa. Fermentu aktivitātes regulēšana. Medicīniskā enzimoloģija Enzīmu aktivitātes regulēšanas metodes: 1. Fermentu skaita izmaiņas.2. Fermenta katalītiskās efektivitātes izmaiņas.3. Reakcijas apstākļu maiņa Daudzuma regulēšana
No autora grāmatasFermentu izmantošana medicīnā Fermentu preparātus plaši izmanto medicīnā. Fermenti medicīnas praksē tiek izmantoti kā diagnostikas (enzimodiagnostikas) un terapeitiskie (enzīmu terapijas) līdzekļi. Turklāt fermentus izmanto kā
nodaļaIV.3.
Fermenti
Vielmaiņu organismā var definēt kā visu ķīmisko pārvērtību kopumu, ko veic savienojumi, kas nāk no ārpuses. Šīs transformācijas ietver visus zināmos ķīmisko reakciju veidus: funkcionālo grupu starpmolekulāro pārnesi, ķīmisko saišu hidrolītisko un nehidrolītisko šķelšanos, intramolekulāro pārkārtošanos, jaunu ķīmisko saišu veidošanos un redoksreakcijas. Šādas reakcijas organismā notiek ārkārtīgi lielā ātrumā tikai katalizatoru klātbūtnē. Visi bioloģiskie katalizatori ir olbaltumvielas, un tos sauc par fermentiem (turpmāk F) vai fermentiem (E).
Fermenti nav reakciju sastāvdaļas, bet tikai paātrina līdzsvara sasniegšanu, palielinot gan tiešo, gan reverso transformāciju ātrumu. Reakcijas paātrinājums notiek aktivācijas enerģijas samazināšanās dēļ - enerģijas barjera, kas atdala vienu sistēmas stāvokli (sākotnējais ķīmiskais savienojums) no cita (reakcijas produkts).
Fermenti paātrina dažādas ķermeņa reakcijas. Tātad, no tradicionālās ķīmijas viedokļa pavisam vienkārši, ūdens atdalīšanas reakcijai no ogļskābes ar CO 2 veidošanos ir nepieciešama fermenta līdzdalība, jo bez tā tas norit pārāk lēni, lai regulētu asins pH. Pateicoties enzīmu katalītiskajai darbībai organismā, kļūst iespējams veikt tādas reakcijas, kas bez katalizatora noritētu simtiem un tūkstošiem reižu lēnāk.
Enzīmu īpašības
1. Ietekme uz ķīmiskās reakcijas ātrumu: fermenti palielina ķīmiskās reakcijas ātrumu, bet paši netiek patērēti.
Reakcijas ātrums ir reakcijas komponentu koncentrācijas izmaiņas laika vienībā. Ja tas iet uz priekšu, tad tas ir proporcionāls reaģentu koncentrācijai, ja tas iet pretējā virzienā, tad tas ir proporcionāls reakcijas produktu koncentrācijai. Tiešo un apgriezto reakciju ātrumu attiecību sauc par līdzsvara konstanti. Fermenti nevar mainīt līdzsvara konstantes vērtības, bet līdzsvara stāvoklis fermentu klātbūtnē iestājas ātrāk.
2. Fermentu darbības specifika. Ķermeņa šūnās notiek 2-3 tūkstoši reakciju, katru no kurām katalizē noteikts enzīms. Fermenta darbības specifika ir spēja paātrināt vienas konkrētas reakcijas gaitu, neietekmējot citu, pat ļoti līdzīgu, ātrumu.
Atšķirt:
Absolūti– kad F katalizē tikai vienu konkrētu reakciju ( argināze- arginīna sadalīšanās)
Radinieks(īpaša grupa) - F katalizē noteiktu reakciju klasi (piemēram, hidrolītisko šķelšanos) vai reakcijas, kurās iesaistīta noteikta vielu klase.
Fermentu specifika ir saistīta ar to unikālo aminoskābju secību, kas nosaka aktīvā centra konformāciju, kas mijiedarbojas ar reakcijas komponentiem.
Vielu, kuras ķīmisko transformāciju katalizē ferments, sauc substrāts (
S ) .3. Fermentu aktivitāte ir spēja dažādās pakāpēs paātrināt reakcijas ātrumu. Aktivitāte ir izteikta:
1) Starptautiskās aktivitātes mērvienības - (IU) fermenta daudzums, kas katalizē 1 μM substrāta pārvēršanu 1 minūtē.
2) Katalakh (kaķis) - katalizatora (enzīma) daudzums, kas spēj pārvērst 1 molu substrāta 1 sekundē.
3) īpatnējā aktivitāte - aktivitātes vienību skaits (jebkura no iepriekš minētajām) testa paraugā pret kopējo olbaltumvielu masu šajā paraugā.
4) Retāk tiek izmantota molārā aktivitāte - substrāta molekulu skaits, ko pārvērš viena fermenta molekula minūtē.
aktivitāte ir atkarīga no temperatūra . Tas vai cits ferments uzrāda vislielāko aktivitāti optimālā temperatūrā. Dzīva organisma F šī vērtība ir robežās no +37,0 līdz +39,0
° C, atkarībā no dzīvnieka veida. Pazeminoties temperatūrai, Brauna kustība palēninās, difūzijas ātrums samazinās un līdz ar to kompleksu veidošanās process starp fermentu un reakcijas komponentiem (substrātiem) palēninās. Temperatūras paaugstināšanās gadījumā virs +40 - +50° Ar fermenta molekulu, kas ir proteīns, notiek denaturācijas process. Tajā pašā laikā ķīmiskās reakcijas ātrums ievērojami samazinās (4.3.1. att.).Fermentu aktivitāte ir atkarīga arī no vidējs pH līmenis . Lielākajai daļai no tiem ir noteikta optimālā pH vērtība, pie kuras to aktivitāte ir maksimāla. Tā kā šūnā ir simtiem enzīmu un katram no tiem ir savas izvēles pH robežas, pH izmaiņas ir viens no svarīgākajiem fermentu aktivitātes regulēšanas faktoriem. Tātad vienas ķīmiskas reakcijas rezultātā, piedaloties noteiktam enzīmam, kura pH izvēle ir robežās no 7,0 - 7,2, veidojas produkts, kas ir skābe. Šajā gadījumā pH vērtība mainās uz 5,5–6,0. Fermenta aktivitāte strauji samazinās, produkta veidošanās ātrums palēninās, bet tiek aktivizēts cits enzīms, kuram šīs pH vērtības ir optimālas, un pirmās reakcijas produkts tiek tālāk ķīmiski pārveidots. (Vēl viens piemērs par pepsīnu un tripsīnu).
Fermentu ķīmiskā būtība. Fermenta struktūra. Aktīvie un alosteriskie centri
Visi fermenti ir olbaltumvielas ar molekulmasu no 15 000 līdz vairākiem miljoniem Da. Pēc ķīmiskās struktūras tie ir vienkārši fermenti (sastāv tikai no AA) un komplekss enzīmi (tiem ir neolbaltumvielu daļa vai protēžu grupa). Olbaltumvielu daļu sauc apoenzīms, un neolbaltumvielas, ja tas ir kovalenti saistīts ar apoenzīmu, tad to sauc koenzīms, un ja saite ir nekovalenta (jonu, ūdeņraža) - kofaktors . Protēžu grupas funkcijas ir šādas: līdzdalība katalīzes aktā, kontakts starp fermentu un substrātu, fermenta molekulas stabilizācija telpā.
Kā kofaktors parasti darbojas neorganiskās vielas – cinka, vara, kālija, magnija, kalcija, dzelzs, molibdēna joni.
Koenzīmus var uzskatīt par enzīmu molekulas neatņemamu sastāvdaļu. Tās ir organiskas vielas, starp kurām ir: nukleotīdi ( ATP, UMF uc), vitamīni vai to atvasinājumi ( TDF- no tiamīna ( 1), FMN- no riboflavīna ( 2), koenzīms A- no pantotēnskābes ( 3. plkst), NAD u.c.) un tetrapirola koenzīmi - hemes.
Reakcijas katalīzes procesā ar substrātu saskaras nevis visa enzīma molekula, bet gan noteikta tā daļa, ko sauc. aktīvais centrs. Šī molekulas zona nesastāv no aminoskābju secības, bet veidojas, kad proteīna molekula ir savīti terciārā struktūrā. Atsevišķas aminoskābju sadaļas tuvojas viena otrai, veidojot noteiktu aktīvā centra konfigurāciju. Svarīga aktīvā centra struktūras iezīme ir tā, ka tā virsma papildina substrāta virsmu; Šīs fermenta zonas AA atliekas spēj nonākt ķīmiskā mijiedarbībā ar noteiktām substrāta grupām. To var iedomāties fermenta aktīvā vieta sakrīt ar substrāta struktūru kā atslēga un slēdzene.
V aktīvais centrs izšķir divas zonas: iesiešanas centrs, kas atbild par pamatnes piestiprināšanu, un katalītiskais centrs atbildīgs par substrāta ķīmisko pārveidošanu. Lielākajai daļai enzīmu katalītiskā centra sastāvā ietilpst tādi AA kā Ser, Cys, His, Tyr, Lys. Sarežģītajiem enzīmiem katalītiskajā centrā ir kofaktors vai koenzīms.
Papildus aktīvajam centram vairāki fermenti ir aprīkoti ar regulējošo (allosterisko) centru. Vielas, kas ietekmē tā katalītisko aktivitāti, mijiedarbojas ar šo fermenta zonu.
Fermentu darbības mehānisms
Katalīzes darbība sastāv no trim secīgiem posmiem.
1. Enzīma-substrāta kompleksa veidošanās mijiedarbības laikā caur aktīvo centru.
2. Substrāta saistīšanās notiek vairākos aktīvā centra punktos, kas noved pie substrāta struktūras izmaiņām, tā deformācijas sakarā ar saites enerģijas izmaiņām molekulā. Šis ir otrais posms, un to sauc par substrāta aktivizēšanu. Ja tas notiek, substrāta noteikta ķīmiska pārveidošana un tā pārveide par jaunu produktu vai produktiem.
3. Šādas transformācijas rezultātā jaunā viela (produkts) zaudē spēju noturēties enzīma aktīvajā centrā un enzīms-substrāts, pareizāk sakot, fermenta-produkta komplekss dissociē (sairst).
Katalītisko reakciju veidi:
A + E \u003d AE \u003d BE \u003d E + B
A + B + E \u003d AE + B \u003d ABE \u003d AB + E
AB + E \u003d ABE \u003d A + B + E, kur E ir enzīms, A un B ir substrāti vai reakcijas produkti.
Enzīmu efektori - vielas, kas maina fermentatīvās katalīzes ātrumu un tādējādi regulē vielmaiņu. Starp tiem izceļas inhibitori - reakcijas ātruma palēnināšanās un aktivatori - fermentatīvās reakcijas paātrināšana.
Atkarībā no reakcijas inhibīcijas mehānisma tiek izdalīti konkurējoši un nekonkurējoši inhibitori. Konkurētspējīgās inhibitora molekulas struktūra ir līdzīga substrāta struktūrai un sakrīt ar aktīvā centra virsmu kā atslēga ar slēdzeni (vai gandrīz sakrīt). Šīs līdzības pakāpe var būt pat augstāka nekā ar substrātu.
Ja A + E \u003d AE \u003d BE \u003d E + B, tad I + E \u003d IE
¹Katalīzē spējīgā fermenta koncentrācija samazinās un reakcijas produktu veidošanās ātrums strauji samazinās (4.3.2. att.).

Liela daļa endogēnas un eksogēnas izcelsmes ķīmisko vielu (t.i., kas veidojas organismā un nāk no ārpuses - attiecīgi ksenobiotikas) darbojas kā konkurējoši inhibitori. Endogēnās vielas ir vielmaiņas regulatori un tiek sauktas par antimetabolītiem. Daudzi no tiem tiek izmantoti onkoloģisko un mikrobu slimību ārstēšanā, varbūt. tie kavē mikroorganismu (sulfonamīdu) un audzēju šūnu galvenās vielmaiņas reakcijas. Bet ar substrāta pārpalikumu un zemu konkurējošā inhibitora koncentrāciju tā darbība tiek atcelta.
Otra veida inhibitori ir nekonkurējoši. Tie mijiedarbojas ar fermentu ārpus aktīvās vietas, un substrāta pārpalikums neietekmē to inhibējošo spēju, kā tas notiek ar konkurējošiem inhibitoriem. Šie inhibitori mijiedarbojas vai nu ar noteiktām enzīma grupām (smagie metāli saistās ar Cys tiola grupām), vai visbiežāk ar regulējošo centru, kas samazina aktīvā centra saistīšanās spēju. Faktiskais inhibēšanas process ir pilnīga vai daļēja enzīmu aktivitātes nomākšana, vienlaikus saglabājot tā primāro un telpisko struktūru.
Ir arī atgriezeniska un neatgriezeniska kavēšana. Neatgriezeniski inhibitori inaktivē fermentu, veidojot ķīmisku saiti ar tā AA vai citām strukturālām sastāvdaļām. Parasti tā ir kovalentā saite ar kādu no aktīvā centra vietām. Šāds komplekss fizioloģiskos apstākļos praktiski neizdalās. Citā gadījumā inhibitors izjauc fermenta molekulas konformācijas struktūru, izraisot tās denaturāciju.
Atgriezenisko inhibitoru darbību var novērst ar substrāta pārpalikumu vai tādu vielu iedarbību, kas maina inhibitora ķīmisko struktūru. Konkurētspējīgi un nekonkurējoši inhibitori vairumā gadījumu ir atgriezeniski.
Papildus inhibitoriem ir zināmi arī fermentatīvās katalīzes aktivatori. Viņi:
1) aizsargāt enzīma molekulu no inaktivācijas iedarbības,
2) veido kompleksu ar substrātu, kas aktīvāk saistās ar F aktīvo centru,
3) Mijiedarbojoties ar fermentu, kam ir kvartāra struktūra, tie atdala tā apakšvienības un tādējādi paver substrātam piekļuvi aktīvajam centram.
Fermentu sadalījums organismā
Enzīmi, kas piedalās olbaltumvielu, nukleīnskābju un enerģijas metabolisma enzīmu sintēzē, atrodas visās ķermeņa šūnās. Bet šūnas, kas veic īpašas funkcijas, satur arī īpašus fermentus. Tātad aizkuņģa dziedzera Langerhansa saliņu šūnās ir fermenti, kas katalizē hormonu insulīna un glikagona sintēzi. Fermentus, kas ir raksturīgi tikai noteiktu orgānu šūnām, sauc par orgānu specifiskiem: argināzi un urokināze- aknas, skābā fosfatāze- prostata. Mainot šādu enzīmu koncentrāciju asinīs, tiek spriests par patoloģiju klātbūtni šajos orgānos.
Šūnā atsevišķi enzīmi ir sadalīti visā citoplazmā, citi ir iestrādāti mitohondriju membrānās un endoplazmatiskajā retikulumā, veidojas šādi enzīmi. nodalījumi, kurā notiek noteiktas, cieši saistītas vielmaiņas stadijas.
Daudzi fermenti veidojas šūnās un izdalās anatomiskajos dobumos neaktīvā stāvoklī - tie ir proenzīmi. Bieži vien proenzīmu veidā veidojas proteolītiskie enzīmi (noārda olbaltumvielas). Tad pH vai citu enzīmu un substrātu ietekmē notiek to ķīmiskā modifikācija un aktīvais centrs kļūst pieejams substrātiem.
Tur ir arī izoenzīmi - fermenti, kas atšķiras pēc molekulārās struktūras, bet veic vienu un to pašu funkciju.
Fermentu nomenklatūra un klasifikācija
Fermenta nosaukums veidojas no šādām daļām:
1. substrāta nosaukums, ar kuru tas mijiedarbojas
2. katalizētās reakcijas raksturs
3. fermentu klases nosaukums (bet tas nav obligāti)
4. piedēklis -aza-
piruvāts - dekarboksil - aza, sukcināts - deūdeņradis - aza
Tā kā jau ir zināmi aptuveni 3 tūkstoši fermentu, tie ir jāklasificē. Pašlaik ir pieņemta starptautiskā fermentu klasifikācija, kuras pamatā ir katalizētās reakcijas veids. Ir 6 klases, kuras savukārt ir sadalītas vairākās apakšklasēs (šajā grāmatā tās ir parādītas tikai selektīvi):
1. Oksidoreduktāzes. Katalizējiet redoksreakcijas. Tie ir sadalīti 17 apakšklasēs. Visi fermenti satur neolbaltumvielu daļu hēma vai vitamīnu B 2, B 5 atvasinājumu veidā. Substrāts, kas tiek oksidēts, darbojas kā ūdeņraža donors.
1.1. Dehidrogenāzes atdala ūdeņradi no viena substrāta un pārnes uz citiem substrātiem. Koenzīmi NAD, NADP, FAD, FMN. Viņi pieņem fermenta atšķelto ūdeņradi, pārvēršoties reducētā formā (NADH, NADPH, FADH) un pārnes to uz citu enzīmu-substrāta kompleksu, kur tas tiek atdots.
1.2. Oksidāze - katalizē ūdeņraža pāreju uz skābekli, veidojot ūdeni vai H 2 O 2. F. Citohromoksisdāze elpošanas ķēde.
RH + NAD H + O 2 = ROH + NAD + H 2 O
1.3. Monoksidāzes - citohroms P450. Pēc struktūras gan hemo-, gan flavoproteīns. Tas hidroksilē lipofīlās ksenobiotikas (ar iepriekš aprakstīto mehānismu).
1.4. Peroksidāzesun katalāze- katalizēt ūdeņraža peroksīda sadalīšanos, kas veidojas vielmaiņas reakciju laikā.
1.5. Oksigenāzes - katalizē skābekļa pievienošanas reakcijas substrātam.
2. Transferāzes - katalizē dažādu radikāļu pārnešanu no donora molekulas uz akceptormolekulu.
A a+ E + B = E a+ A + B = E + B a+ A
2.1. Metiltransferāze (CH 3 -).
2.2. Karboksil- un karbamoiltransferāzes.
2.2. Aciltransferāzes — koenzīms A (acilgrupu pārnese — R-C=O).
Piemērs: neirotransmitera acetilholīna sintēze (skat. nodaļu "Olbaltumvielu metabolisms").
2.3. Heksoziltransferāzes katalizē glikozila atlikumu pārnesi.
Piemērs: glikozes molekulas sadalīšana no glikogēna, iedarbojoties fosforilāze.
2.4. Aminotransferāzes - aminogrupu pārnešana
R1-CO-R2+R1-CH- NH 3 - R 2 \u003d R 1 - CH - NH 3 - R2 + R1 - CO - R2
Viņiem ir svarīga loma AK pārveidē. Kopējais koenzīms ir piridoksāla fosfāts.
Piemērs: alanīna aminotransferāze(AlAT): piruvāts + glutamāts = alanīns + alfa-ketoglutarāts (skatīt nodaļu "Olbaltumvielu metabolisms").
2.5. Fosfotransferēze (kināze) - katalizē fosforskābes atlikuma pārnesi. Vairumā gadījumu ATP ir fosfātu donors. Šīs klases enzīmi galvenokārt ir iesaistīti glikozes sadalīšanās procesā.
Piemērs: Hekso (gliko) kināze.
3. Hidrolāzes - katalizēt hidrolīzes reakcijas, t.i. vielu sadalīšana ar pievienošanu ūdens saites pārraušanas vietā. Šajā klasē galvenokārt ietilpst gremošanas enzīmi, tie ir vienkomponenti (nesatur neolbaltumvielu daļu)
R1-R2 + H2O \u003d R1H + R2OH
3.1.
Esterāzes - nojauc būtiskās saites. Šī ir liela enzīmu apakšklase, kas katalizē tiola esteru, fosfoesteru hidrolīzi.
Piemērs: NH 2 ).
Piemērs: argināze(urīnvielas cikls).
4. Saistības - katalizēt molekulu šķelšanās reakcijas bez ūdens pievienošanas. Šiem fermentiem ir daļa, kas nav olbaltumviela, tiamīna pirofosfāta (B 1) un piridoksāla fosfāta (B 6) formā.
4.1. C-C saišu liāzes. Tos parasti sauc par dekarboksilāzēm.
Piemērs: piruvāta dekarboksilāze.
5.Izomerāzes - katalizēt izomerizācijas reakcijas.
Piemērs: fosfopentozes izomerāze, pentozes fosfāta izomerāze(pentozes fosfāta ceļa neoksidējošā atzara enzīmi).
6. Līgas katalizēt sarežģītāku vielu sintēzi no vienkāršām. Šādas reakcijas notiek, patērējot ATP enerģiju. Sintetāze tiek pievienota šādu enzīmu nosaukumam.
LITERATŪRA LĪDZ NODAĻAI
IV.3.1. Byshevsky A. Sh., Tersenovs O. A. Bioķīmija ārstam // Jekaterinburga: Urālu darbinieks, 1994, 384 lpp.;
2. Knorre D. G., Myzina S. D. Bioloģiskā ķīmija. - M .: Augstāk. skola 1998, 479 lpp.;
3. Filippovičs Ju. B., Egorova T. A., Sevastjanova G. A. Vispārējās bioķīmijas seminārs // M.: Prosveschenie, 1982, 311 lpp.;
4. Lēningers A. Bioķīmija. Šūnas uzbūves un funkciju molekulārās bāzes // M.: Mir, 1974, 956 lpp.;
5. Pustovalova L.M. Bioķīmijas seminārs // Rostova pie Donas: Phoenix, 1999, 540 lpp.