Umbes kõigi RNA-de kohta maailmas, nii suurtel kui ka väikestel. Väikesed RNA-d ja vähk Väikesed RNA-d
Teadlaste arvates on väikeste RNA-de vale ekspressioon paljude haiguste põhjustaja, mis mõjutab väga tõsiselt paljude inimeste tervist kogu maailmas. Selliste haiguste hulka kuuluvad kardiovaskulaarsed 23 ja onkoloogilised 24. Viimase osas pole see üllatav: vähk annab tunnistust rakkude arengu ja nende saatuse hälvetest ning väikestel RNA-del on vastavates protsessides oluline roll. Siin on üks kõige paljastavamaid näiteid tohutu mõju kohta, mida väikesed RNA-d avaldavad vähile kehale. Me räägime pahaloomulisest kasvajast, mida iseloomustab nende geenide vale ekspressioon, mis toimivad organismi esialgse arengu ajal, mitte postnataalsel perioodil. See on lapseea ajukasvaja tüüp, mis ilmneb tavaliselt enne kaheaastast vanust. Paraku on see väga agressiivne vähivorm ja isegi intensiivse ravi korral on prognoos kehv. Onkoloogiline protsess areneb ajurakkudes geneetilise materjali väära ümberjaotamise tagajärjel. Promootor, mis tavaliselt põhjustab ühe valke kodeeriva geeni tugevat ekspressiooni, rekombineeritakse spetsiifilise väikese RNA-klastriga. Siis võimendatakse kogu seda ümberkorraldatud piirkonda: teisisõnu luuakse sellest genoomis palju koopiaid. Järelikult ekspresseerunud promootorist “allavoolu” asuvad väikesed RNA-d ekspresseeritakse palju tugevamalt kui peaks. Aktiivsete väikeste RNA-de sisaldus on normaalsest umbes 150-1000 korda suurem.
Joon. 18,3. Alkoholi aktiveeritud väikesed RNA-d võivad seostuda Messenger RNA-dega, mis ei mõjuta keha vastupidavust alkoholile. Kuid need väikesed RNA-d ei seostu Messenger-RNA molekulidega, mis soodustavad seda resistentsust. See viib alkoholi resistentsusega seotud valgu variatsioone kodeerivate Messenger RNA molekulide osakaalu suhtelise ülekaalu saavutamiseni.
See klaster kodeerib üle 40 erineva väikese RNA. Tegelikult on see tavaliselt primaatide hulgas saadaolevatest klastritest suurim. Tavaliselt avaldub see ainult inimarengu varases staadiumis, embrüo esimese 8 nädala jooksul. Selle tugev aktiveerimine imiku ajus põhjustab katastroofilist mõju geneetilisele ekspressioonile. Üks tagajärgi on epigeneetilise valgu ekspressioon, mis lisab DNA-le modifikatsioone. See põhjustab ulatuslikke muutusi kogu DNA metüleerimise mustris ja seetõttu igasuguste geenide ebanormaalset ekspressiooni, millest paljud peavad ekspresseeruma alles siis, kui ebaküpsed ajurakud jagunevad keha arengu varases staadiumis. Nii algab vähkkasvajaprogramm 25 lapse rakkudes.
Niisugune suhtlus väikeste RNA-de ja raku epigeneetilise aparatuuri vahel võib märkimisväärselt mõjutada teisi olukordi, kui rakkudes areneb eelsoodumus vähi tekkeks. See mehhanism viib tõenäoliselt selleni, et väikeste RNA-de kahjustatud ekspressiooni mõju suurendab emigeneetiliste modifikatsioonide muutmine, mis edastatakse emalt tütarrakkudele. Nii saab moodustada geeniekspressiooni olemuse potentsiaalselt ohtlike muutuste skeemi.
Siiani pole teadlased välja mõelnud väikeste RNA-de integreerimise kõiki etappe epigeneetiliste protsessidega, kuid siiski õnnestub neil toimuva kohta saada mõned näpunäited. Näiteks selgus, et teatud rinnavähi agressiivsust suurendavate väikeste RNA-de klass on suunatud Messengeri RNA-de teatud ensüümidele, mis eemaldavad peamised epigeneetilised modifikatsioonid. See muudab vähiraku epigeneetiliste modifikatsioonide mustrit ja häirib veelgi geneetilist ekspressiooni 26.
Paljud vähivormid on patsiendil raskesti jälgitavad. Onkoloogilised protsessid võivad toimuda raskesti ligipääsetavates kohtades, mis raskendab proovivõtu protseduuri. Sellistel juhtudel on arstil keeruline jälgida vähiprotsessi arengut ja ravivastust. Sageli on arstid sunnitud lootma kaudsetele mõõtmistele - näiteks kasvaja tomograafilisele skaneerimisele. Mõned teadlased usuvad, et väikesed RNA molekulid võivad aidata luua uue meetodi kasvaja arengu jälgimiseks, mis võimaldaks uurida ka selle päritolu. Kui vähirakud surevad, lahkuvad väikesed RNA-d rakkudest, kui nad rebenevad. Need väikesed rämpsmolekulid moodustavad sageli rakuvalkudega komplekse või on mähitud rakumembraanide fragmentidesse. Selle tulemusel on nad kehavedelikes väga stabiilsed, mis tähendab, et sellist RNA-d saab eraldada ja analüüsida. Kuna nende arv on väike, peavad teadlased kasutama ülitundlikke analüütilisi meetodeid. Siin pole aga midagi võimatut: nukleiinhapete järjestamise tundlikkus suureneb pidevalt 27. Avaldatud on andmeid, mis kinnitavad sellise lähenemisviisi lubadusi seoses rinnavähi 28, munasarjavähi 29 ja paljude teiste vähivormidega. Kopsuvähiga patsientide väikeste ringlevate RNA-de analüüs näitas, et need RNA-d aitavad eristada patsiente, kellel on üks kopsusõlm (ravi ei vaja), ja patsiente, kellel tekivad pahaloomulised kasvaja sõlmed (vajavad ravi) 30.
Sihtmärk-mRNA hävitamine võib toimuda ka väikese segava RNA (siRNA) mõjul. RNA sekkumine on üks uusi revolutsioonilisi avastusi molekulaarbioloogias ja selle autorid said selle eest 2002. aastal Nobeli preemia. Häirivad RNA-d on erinevat tüüpi RNA-st erineva struktuuriga ja on kaks komplementaarset RNA molekuli, pikkusega umbes 21-28 lämmastiku alust, mis on üksteisega ühendatud nagu DNA molekuli ahelad. Sel juhul jäävad siRNA ahelate servadesse alati kaks paarita nukleotiidi. Mõju teostatakse järgmiselt. Kui siRNA molekul on raku sees, seob see kõigepealt kompleksi kahe rakusisese ensüümiga - helikaasi ja nukleaasiga. See kompleks sai nime RISC ( RNA- induced silencing complex; vaikus - eng. ole vait, ole vait; vaigistamine - vaikus, kuna inglise keeles ja erikirjanduses nimetatakse geeni "väljalülitamise" protsessi). Järgmisena keerab helikaas lahti ja eraldab siRNA ahelad ning üks ahelas (antisenss struktuuris) nukleaasiga kompleksis interakteerub spetsiifiliselt sihtmärgi mRNA komplementaarses (sellele rangelt vastavuses) piirkonnaga, mis võimaldab nukleaasil lõigata selle kaheks osaks. MRNA lõigatud lõigud puutuvad täiendavalt kokku teiste rakuliste RNA nukleaaside toimel, mis lõikavad need veelgi väiksemateks tükkideks.
Taimedes ja madalamates loomsetes organismides (putukates) leiduvad siRNA-d on oluline lüli omamoodi "rakusiseses immuunsuses", mis võimaldab võõrast RNA ära tunda ja kiiresti hävitada. Juhul, kui RNA-d sisaldav viirus tungib rakku, takistab selline kaitsesüsteem selle paljunemist. Kui viirus sisaldab DNA-d, takistab siRNA süsteem sellel viirusvalkude tootmist (kuna selleks vajalik mRNA tunneb ära ja lõigatakse ära) ning selle strateegia kasutamine aeglustab selle levikut kogu kehas. Leiti, et siRNA süsteem on äärmiselt loetav: iga siRNA tunneb ära ja hävitab ainult oma spetsiifilise mRNA. Ainult ühe nukleotiidi asendamine siRNA-s põhjustab häirete mõju dramaatilist vähenemist. Ühelgi seni teadaoleval geeniblokaatoril pole oma sihtgeeni suhtes seda erandlikku spetsiifilisust.
Praegu kasutatakse seda meetodit peamiselt teaduslikes uuringutes erinevate rakuvalkude funktsioonide tuvastamiseks. Kuid seda saab potentsiaalselt kasutada ka ravimite loomiseks.
RNA-häirete avastamine on andnud uut lootust võitluses AIDSi ja vähi vastu. Ehk kasutades siRNA-ravi koos traditsiooniliste viirusevastaste ja vähivastaste teraapiatega, on võimalik saavutada tugevdav efekt, kus need kaks toimet annavad teravama efekti, kui nende kummagi eraldi rakendatav lihtne summa.
SiRNA häiremehhanismi kasutamiseks imetajarakkudes terapeutilistel eesmärkidel tuleb rakkudesse viia valmis kaheahelalised siRNA molekulid. Siiski on mitmeid probleeme, mis praegu seda praktikas ei võimalda, ja veelgi enam, mingite ravimvormide loomiseks. Esiteks, veres mõjutab neid keha esimene kaitsekeha, ensüümid - nukleaasidmis lõikavad meie keha jaoks topelt-RNA ahelad potentsiaalselt ohtlikuks ja ebatavaliseks. Teiseks, hoolimata nende nimest, on väikesed RNA-d endiselt üsna pikad ja mis kõige tähtsam - nad kannavad negatiivset elektrostaatilist laengu, mis muudab nende passiivseks sisenemiseks raku sisse võimatuks. Ja kolmandaks, üks olulisemaid küsimusi on see, kuidas panna siRNA toimima (või tungima) ainult teatud ("haigetes") rakkudes, mõjutamata seejuures terveid? Ja lõpuks suuruse probleem. Selliste sünteetiliste siRNA-de optimaalne suurus on samad 21–28 nukleotiidi. Kui suurendate selle pikkust, reageerivad rakud interferooni tootmisega ja valkude sünteesi vähendamisega. Teisest küljest, kui proovida kasutada siRNA-sid, mis on väiksemad kui 21 nukleotiidi, väheneb järsult selle soovitud mRNA-ga seondumise spetsiifilisus ja võime moodustada RISC kompleksi. Tuleb märkida, et nende probleemide ületamine on kriitilise tähtsusega mitte ainult siRNA-ravi, vaid ka geeniteraapia jaoks üldiselt.
Nende lahendamisel on juba tehtud teatavaid edusamme. Näiteks üritavad teadlased siRNA molekule rohkem teha lipofiilsed, see tähendab, et nad võivad lahustuda rasvades, mis moodustavad rakumembraani, ja hõlbustada seeläbi siRNA tungimist rakku. Ja selleks, et tagada töö spetsiifilisus ainult teatud kudedes, lisavad geenitehnoloogid oma struktuuridesse spetsiaalsed regulatoorsed piirkonnad, mis on aktiveeritud ja käivitavad sarnases struktuuris sisalduva teabe (ja seetõttu siRNA, kui see sinna kuulub) lugemise, ainult teatud rakkudes kangad.
Näiteks on California ülikooli San Diego meditsiinikooli (California ülikool, San Diego meditsiinikool) teadlased välja töötanud uue efektiivse manustamissüsteemi väikeste segavate RNA-de (siRNA-de) jaoks, mis pärsivad teatud valkude tootmist, rakkudesse. Sellest süsteemist peaks saama tehnoloogia, mis võimaldab ravimit eri tüüpi vähktõbe spetsiifiliselt tarnida, alus. „Väikestel segavatel RNA-del, mis viivad läbi protsessi, mida nimetatakse RNA interferentsiks, on uskumatu potentsiaal vähiravis,“ selgitab uuringut juhtinud professor Steven Dowdy, „ja kuigi meil on veel palju teha, oleme välja töötanud tehnoloogia ravimite tarnimine rakupopulatsioonile - nii primaarne kasvaja kui ka metastaasid, kahjustamata terveid rakke ”.
Aastaid on Dowdy ja tema kolleegid uurinud väikeste segavate RNA-de vähivastast potentsiaali. Tavalised siRNA-d on siiski pisikesed, negatiivselt laetud molekulid, mida nende omaduste tõttu on rakusse äärmiselt raske toimetada. Selle saavutamiseks kasutasid teadlased lühikest signaalvalku PTD (peptiidi transduktsiooni domeen). Varem loodi selle kasutamisel üle 50 „liitvalgu”, milles PTD ühendati kasvaja supressorvalkudega.
SiRNA ja PTD lihtne kombinatsioon ei vii aga RNA kohaletoimetamiseni rakusse: siRNA-d on negatiivselt laetud, PTD-d on positiivselt laetud, mille tulemusel moodustub tihe RNA-valgu konglomeraat, mida ei transpordita läbi rakumembraani. Seetõttu ühendasid teadlased PTD esmalt valgu RNA-d siduva domeeniga, mis neutraliseeris siRNA negatiivse laengu (tulemuseks oli sulandvalk, mida nimetatakse PTD-DRBD). Selline RNA-valgu kompleks läbib juba hõlpsalt rakumembraani ja siseneb raku tsütoplasmasse, kus see pärsib spetsiifiliselt tuumori kasvu aktiveerivate valkude Messenger RNA-sid.
PTD-DRBD sulandvalgu võime määramiseks siRNA rakkudesse toimetada kasutasid teadlased inimese kopsuvähist tuletatud rakuliini. Pärast rakkude töötlemist PTD-DRBD-siRNA-ga leiti, et kasvajarakud on siRNA suhtes kõige vastuvõtlikumad, samas kui normaalsetes rakkudes (kontrollina kasutati T-rakke, endoteelirakke ja embrüonaalseid tüvirakke), kus ei suurenenud onkogeensete rakkude tootmine valke, toksilisi toimeid ei täheldatud.
Selle meetodi abil saab teha erinevaid modifikatsioone, kasutades erinevaid siRNA-sid erinevate kasvajavalkude - mitte ainult üleprodukteeritud, vaid ka mutantide - supresseerimiseks. Teraapiat on võimalik muuta ka korduvate kasvajate korral, mis muutuvad uute mutatsioonide tõttu tavaliselt keemiaravi ravimite suhtes resistentseks.
Onkoloogilised haigused on väga erinevad ja tuumorirakkude valkude molekulaarsed omadused on iga patsiendi jaoks individuaalsed. Töö autorid usuvad, et selles olukorras on ratsionaalseim lähenemisviis väikeste segavate RNA-de kasutamine.
Elusas rakus ei kuivata infovoog tuuma ja tsütoplasma vahel kunagi, kuid mõista kõiki selle “pööriseid” ja selles kodeeritud teabe dešifreerida on tõeliselt titaanne ülesanne. Möödunud sajandi bioloogia üheks olulisemaks läbimurdeks võib pidada informatiivsete (või maatriks) RNA (mRNA või mRNA) molekulide avastamist, mis toimivad vahendajatena, kes kannavad tuumast (kromosoomidest) informatiivseid "sõnumeid" tsütoplasmasse. RNA otsustavat rolli valkude sünteesis ennustati juba 1939. aastal Thorbjorn Kasperssoni ( Torbjörn Caspersson), Jean Brachet ( Jean sulg) ja Jack Schultz ( Jack schultz) ja 1971. aastal George Marbeis ( George marbaix) alustas hemoglobiini sünteesi konna munarakkudes, süstides selle isoleeritud küüliku Messenger RNA, mis kodeeris seda valku.
Aastatel 1956-1957 tõestasid A. N. Belozersky ja A. S. Spirin Nõukogude Liidus iseseisvalt mRNA olemasolu ja leidsid ka, et suurem osa RNA-st rakus ei ole mingil juhul maatriks, vaid ribosomaalne RNA (rRNA). Ribosomaalne RNA - rakulise RNA teine \u200b\u200b"peamine" tüüp - moodustab kõigis organismides ribosoomide "skeleti" ja funktsionaalse keskuse; valkude sünteesi põhietappe reguleerib rRNA (ja mitte valgud). Samal ajal kirjeldati ja uuriti kolmandat "peamist" RNA tüüpi - transport-RNA-d (tRNA), mis koos kahe teise - mRNA ja rRNA-ga moodustavad ühe valku sünteesiva kompleksi. "RNA-maailma" üsna populaarse hüpoteesi kohaselt oli just see nukleiinhape Maa elu alguspunktis.
Tulenevalt asjaolust, et RNA on palju hüdrofiilsem kui DNA (deoksüribioosi asendamise tõttu riboosiga), on see labiilsem ja suudab rakus suhteliselt vabalt liikuda ning seetõttu toimetada geneetilise teabe (mRNA) lühiajalised koopiad sinna, kus see algab valkude süntees. Siiski väärib märkimist sellega seotud "ebamugavusi" - RNA on väga ebastabiilne. See on palju hullem kui DNA, see säilitatakse (isegi raku sees) ja laguneb väikseima tingimuste (temperatuuri, pH) muutuse korral. Lisaks "sisemisele" ebastabiilsusele kuulub suur panus ribonukleaasidele (või RNaasidele) - RNA-d lõhustavate ensüümide klassile, mis on väga stabiilsed ja "üldlevinud" - isegi eksperimenteerija käte nahk sisaldab neid ensüüme piisavalt, et kogu katse negatiivseks muuta. Seetõttu on RNA-ga töötamine palju raskem kui valkude või DNA-ga - viimast saab üldiselt säilitada sadu tuhandeid aastaid vähese kahjustuseta või ilma selleta.
Fantastiline täpsus tööl, tridistilaat, steriilsed kindad, ühekordselt kasutatavad laboratoorsed klaasnõud - kõik see on vajalik RNA lagunemise vältimiseks, kuid vastavus sellistele standarditele ei olnud alati võimalik. Seetõttu pikka aega ignoreeriti RNA lühikesi "fragmente", mis vältimatult saastasid lahuseid. Aja jooksul sai aga selgeks, et hoolimata kõigist pingutustest tööpiirkonna steriilsuse säilitamiseks, jätkati "prahi" leidmist loomulikult ning siis selgus, et tsütoplasmas on alati tuhandeid lühikesi kaheahelalisi RNA-sid, mis täidavad üsna spetsiifilisi funktsioone ja on normaalseks arenguks hädavajalikud. rakud ja organism.
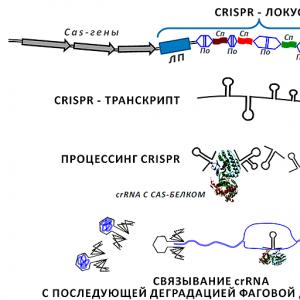
RNA häirete põhimõte
Apteekrid on huvi tundnud ka siRNA kasutamise võimaluse vastu, kuna üksikute geenide töö suunatud reguleerimise võime tõotab paljude haiguste ravis ennekuulmatuid väljavaateid. Toime väike suurus ja kõrge spetsiifilisus lubavad siRNA-põhiste ravimite suurt efektiivsust ja madalat toksilisust; lahendage siiski probleem kohaletoimetamine kehas haigete rakkude siRNA ei ole veel õnnestunud - see on tingitud nende molekulide haprusest ja haprusest. Ja kuigi nüüd üritavad kümned meeskonnad leida viisi, kuidas suunata need "võluväljad" otse sihtmärgile (haigete elundite sees), pole nad veel nähtavat edu saavutanud. Peale selle on ka muid raskusi. Näiteks võib viirusevastase ravi korral olla siRNA toime kõrge selektiivsusega "karuteene" - kuna viirused muteeruvad kiiresti, kaotab modifitseeritud tüvi teraapia alguses valitud siRNA suhtes väga kiiresti tundlikkuse: on teada, et siRNA-s ainult ühe nukleotiidi asendamine põhjustab märkimisväärset langust häirete efekt.
Siinkohal tasub taas meelde tuletada - avastati siRNA-d ainult taimedes, selgrootutes ja üherakulistel; kuigi kõrgematel loomadel esinevad ka RNA interferentsi valguhomoloogid (Dicer, RISC kompleks), ei tuvastatud siRNA-sid tavapäraste meetoditega. Milline oli üllatus, kui kunstlikult sisse viidud sünteetilised siRNA analoogid tekitasid imetaja rakukultuurides tugeva spetsiifilise annusest sõltuva toime! See tähendas, et selgroogsetes rakkudes ei asendanud RNA sekkumist keerukamate immuunsussüsteemidega, vaid arenes koos organismidega, muutudes millekski "arenenumaks". Järelikult oli imetajatel vaja otsida mitte siRNA täpseid analooge, vaid nende evolutsioonilisi järeltulijaid.
Mängija nr 2 - microRNA
Tõepoolest, arenenud organismidel on evolutsiooniliselt üsna iidse RNA interferentsi mehhanismi alusel kaks spetsiaalset süsteemi geenide töö kontrollimiseks, millest igaüks kasutab oma rühma väikesi RNA-sid - mikroRNA (mikroRNA) ja piRNA (piRNA, Piwiga interakteeruv RNA). Mõlemad süsteemid ilmusid käsnadesse ja koelelentidesse ning arenesid koos nendega, tõrjudes välja siRNA ja "palja" RNA interferentsi mehhanismi. Nende roll immuunsuse tagamisel on vähenenud, kuna selle funktsiooni võtsid üle raku immuunsuse arenenumad mehhanismid, eriti interferoonisüsteem. See süsteem on aga nii tundlik, et reageerib ka siRNA-le endale: väikeste kaheahelaliste RNA-de ilmumine imetajarakkudes käivitab “häire” (aktiveerib interferooni sekretsiooni ja põhjustab interferoonist sõltuvate geenide ekspressiooni, mis blokeerib täielikult kõik translatsiooniprotsessid). Sellega seoses vahendavad kõrgematel loomadel RNA sekkumise mehhanismi peamiselt mikroRNA ja piRNA - spetsiifilise struktuuriga üheahelalised molekulid, mida interferoonisüsteem ei tuvasta.
Genoomi keerukamaks muutudes osalesid mikroRNA-d ja piRNA-d üha enam transkriptsiooni ja translatsiooni regulatsioonis. Aja jooksul arenesid nad genoomi regulatsiooni täiendavaks, täpseks ja peeneks süsteemiks. Erinevalt siRNA-dest ei toodeta miRNA-sid ja piRNA-sid (avastatud 2001. aastal, vt 3. selgitus) võõrastest kaheahelalistest RNA molekulidest, vaid need kodeeritakse algselt peremeesgenoomis.
Kohtume: microRNA
MiRNA prekursor transkribeeritakse genoomse DNA mõlemast ahelast RNA polümeraas II abil, mille tulemusel ilmneb vahevorm - pri-miRNA -, millel on tavalise mRNA omadused - m 7 G-kork ja polüA-saba. Selles eellas on moodustatud silmus, mille keskel on kaks üheahelalist "saba" ja mitu paarimata nukleotiidi (joonis 3). Selline silmus läbib kaheastmelise töötlemise (joonis 4): esiteks lõikab Drosha endonukleaas juuksenõelast lahti üheahelalised RNA “sabad”, seejärel eksporditakse väljalõigatud juuksenõel (eel-mikroRNA) tsütoplasmasse, kus seda tunneb ära Dicer, kes teeb veel kaks jaotustükki (kaheahelaline piirkond lõigatakse välja). värvikoodiga joonisel 3). Sel kujul on küps miRNA, sarnaselt siRNA-ga, kaasatud RISC kompleksi.
Joonis 3. Kaheahelalise mikroRNA prekursormolekuli struktuur. Peamised omadused: juuksenõela moodustavate konservatiivsete järjestuste olemasolu; komplementaarse koopia (microRNA *) olemasolu, millel on 3 'otsas kaks "ekstra" nukleotiidi; spetsiifiline järjestus (2–8 bp), mis moodustab endonukleaaside äratundmiskoha. MikroRNA ise on punasega esile tõstetud - seda lõikab Dicer välja.
Paljude miRNA-de toimemehhanism on sarnane siRNA toimele: lühike (21–25 nukleotiidi) üheahelaline RNA RISC valgukompleksis seob kõrge spetsiifilisusega komplementaarset piirkonda sihtmärgi mRNA 3'-mittetransleeritavas piirkonnas. Seondumise tulemusel mRNA lõhustatakse Ago valgu poolt. Kuid mikroRNA aktiivsus (võrreldes siRNA-ga) on juba diferentseeritum - kui komplementaarsus pole absoluutne, ei pruugi sihtmärgi mRNA laguneda, vaid ainult pöörduvalt blokeerida (translatsiooni ei toimu). Sama RISC kompleksi saab ka kasutada kunstlikult sisse viidud siRNA. See seletab, miks algloomadega analoogia põhjal valmistatud siRNA-d on imetajatel aktiivsed.
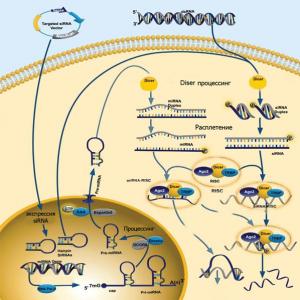
Seega saame RNA häirete toimemehhanismi illustratsiooni kõrgemates (kahepoolselt sümmeetrilistes) organismides täiendada, ühendades ühe joonisega mikroRNA ja biotehnoloogiliselt sisse viidud siRNAde skeemi (joonis 5).

Joonis 5. Kunstliku mikroRNA ja siRNA toimimise üldine skeem (kunstlikud siRNA-d sisestatakse rakku spetsiaalsete plasmiidide abil - siRNA vektori sihtimine).
MicroRNA funktsioonid
MikroRNA-de füsioloogilised funktsioonid on äärmiselt mitmekesised - tegelikult on nad ontogeneesi peamised mittevalguregulaatorid. miRNA-d ei tühista, vaid täiendavad geeniregulatsiooni "klassikalist" skeemi (indutseerijad, supressorid, kromatiini tihendamine jne). Lisaks reguleeritakse miRNA-de enda sünteesi komplekssel viisil (teatud miRNA-de kogumeid saavad sisse lülitada interferoonid, interleukiinid, tuumorinekroosifaktor α (TNF-α) ja paljud teised tsütokiinid). Selle tulemusel tekib hämmastavalt keeruline ja paindlik mitmetasandiline võrgustik tuhandete geenide "orkestri" häälestamiseks, kuid see ei lõpe ka sellega.
mikroRNA-d on „universaalsemad” kui siRNA-d: „eestkostetavad” geenid ei pea olema 100% komplementaarsed - regulatsioon toimub isegi osalise interaktsiooni korral. Täna on molekulaarbioloogia üks kuumimaid teemasid mikroRNA-de otsimine, mis toimiksid tuntud füsioloogiliste protsesside alternatiivsete regulaatoritena. Näiteks on juba kirjeldatud miRNA-sid, mis osalevad rakutsükli reguleerimises ja taimede apoptoosis, Drosophilas ja nematoodides; inimestel reguleerivad mikroRNA-d immuunsussüsteemi ja vereloome tüvirakkude arengut. Biokiipidel põhinevate tehnoloogiate kasutamine (mikrotiivrite skriinimine) on näidanud, et väikeste RNA-de terved kogumid lülitatakse sisse ja välja raku erinevatel etappidel. Bioloogiliste protsesside jaoks on tuvastatud kümneid spetsiifilisi mikroRNA-sid, mille ekspressioonitase muutub teatud tingimustel tuhandeid kordi, rõhutades nende protsesside erakordset juhitavust.
Kuni viimase ajani usuti, et mikroRNA-d pärsivad ainult või osaliselt geenide tööd. Hiljuti aga selgus, et mikroRNA mõju võib olenevalt raku olekust olla radikaalselt erinev! Aktiivselt jagunevas rakus pärsib mikroRNA mRNA 3'-piirkonnas komplementaarse järjestusega seondumisega valkude sünteesi (translatsiooni). Kuid puhke- või stressiseisundis (näiteks halvas keskkonnas kasvades) põhjustab sama sündmus täpselt vastupidise efekti - sihtvalgu sünteesi suurenemise!
MikroRNA evolutsioon
Kõrgemate organismide mikroRNA-sortide arv pole veel täielikult kindlaks tehtud - mõnedel andmetel ületab see valku kodeerivate geenide arvust 1% (näiteks inimestel räägivad nad 700 mikroRNA-st ja see arv kasvab pidevalt). mikroRNA-d reguleerivad umbes 30% kõigi geenide aktiivsust (paljude nende sihtmärgid pole veel teada) ning leidub nii üldlevinud kui ka koespetsiifilisi molekule - näiteks reguleerib üks selline oluline mikroRNA-de kogum vere tüvirakkude küpsemist.
Lai ekspressiooniprofiil erinevate organismide erinevates kudedes ja mikroRNA-de bioloogiline levimus viitavad muistsele evolutsioonilisele päritolule. Esmakordselt leiti miRNA-sid nematoodides ja pikka aega hiljem usuti, et need molekulid esinevad ainult käsnades ja koelenteraatides; hiljem avastati neid ka üherakulistest vetikatest. Huvitav on see, et organismide keerukamaks muutudes suureneb ka mikroRNA kogumi hulk ja heterogeensus. See näitab kaudselt, et nende organismide keerukuse tagab eelkõige mikroRNA toimimine. MikroRNA-de võimalik evolutsioon on näidatud joonisel 6.

Joonis 6. MikroRNA-de mitmekesisus erinevates organismides. Mida kõrgem on organismi organisatsioon, seda rohkem mikroRNA-d selles leidub (sulgudes olev arv). Liigid on esiletõstetud punasega, milles vallaline mikroRNA.
SiRNA ja mikroRNA vahel saab luua selge evolutsioonilise seose, mis põhineb järgmistel faktidel:
- mõlemat tüüpi toime on vahetatav ja seda vahendavad homoloogsed valgud;
- imetajarakkudesse sisestatud siRNA-d "lülitavad" soovitud geenid välja (hoolimata mõnest interferooni kaitse aktiveerimisest);
- mikroRNA-sid leidub üha enam iidsetes organismides.
Need ja muud andmed viitavad mõlema süsteemi päritolule ühiselt "esivanemalt". Huvitav on ka fakt, et "RNA" immuunsus kui valguantikehade sõltumatu eelkäija kinnitab teooria esimeste eluvormide päritolu kohta RNA, mitte valkude põhjal (tuletage meelde, et see on akadeemiku A. S. Spirini lemmikteooria).
Mida kaugemale, seda segasemaks. Mängija nr 3 - piRNA
Kui molekulaarbioloogia areenil oli ainult kaks "mängijat" - siRNA ja mikroRNA, tundus RNA häirete peamine "eesmärk" täiesti selge. Tõepoolest: homoloogiliste lühikeste RNA-de ja valkude komplekt erinevates organismides toimib sarnaselt; organismide keerukamaks muutudes muutub funktsionaalsus keerukamaks.
Loodus lõi aga evolutsiooniprotsessis uue, evolutsiooniliselt kõige uuema ja kõrgelt spetsialiseerunud süsteemi, mis põhineb samal RNA häirete edukal põhimõttel. Me räägime piRNAst (piRNA, alates Piwi-interaktsiooni RNA).
Mida keerukam genoom on korraldatud, seda organism on rohkem arenenud ja kohanenud (või vastupidi? ;-). Kuid genoomi keerukuse suurenemisel on ka varjukülg: keeruliseks geneetiliseks süsteemiks saab ebastabiilne... See tingib vajaduse genoomi terviklikkuse säilitamise eest vastutavate mehhanismide järele - vastasel juhul lülitab DNA iseeneslik "segunemine" selle lihtsalt välja. Liikuvad geneetilised elemendid ( IGE) - üks peamisi genoomi ebastabiilsuse tegureid - on lühikesed ebastabiilsed piirkonnad, mida saab kogu genoomis autonoomselt transkribeerida ja rännata. Selliste liikuvate elementide aktiveerimine põhjustab mitmekordseid DNA katkemisi kromosoomides, millel on surmavad tagajärjed.
SHE-de arv suureneb genoomi suurusega mittelineaarselt ja nende aktiivsus peab olema piiratud. Selleks kasutavad loomad, alustades kolenteraatidest, sama RNA häirete nähtust. Seda funktsiooni täidavad ka lühikesed RNA-d, kuid mitte ülalnimetatud, vaid nende kolmanda tüübi piRNA-d.
PiRNA "portree"
PiRNA funktsioonid
PiRNA põhifunktsioon on MGE aktiivsuse mahasurumine transkriptsiooni ja translatsiooni tasemel. Arvatakse, et piRNA-d on aktiivsed ainult embrüogeneesi ajal, kui genoomi ettearvamatu segunemine on eriti ohtlik ja võib põhjustada embrüo surma. See on loogiline - kui immuunsussüsteem pole veel tööle hakanud, vajavad embrüo rakud lihtsat, kuid tõhusat kaitset. Embrüo on platsenta (või munakoore) abil väliste patogeenide eest usaldusväärselt kaitstud. Kuid lisaks sellele on kaitset vaja ka endogeensete (sisemiste) viiruste, peamiselt MGE vastu.
Seda piRNA rolli on kinnitanud kogemus - geenide Ago3, Piwi või Aub geenide "knockout" või mutatsioonid põhjustavad tõsiseid arenguhäireid (ja sellise organismi genoomi mutatsioonide arvu järsku suurenemist) ning põhjustavad sugurakkude arengu halvenemise tõttu ka viljatust.
PiRNA levik ja areng
Esimesi piRNA-sid leidub juba anemoonides ja käsnades. Ilmselt kulgesid taimed teistsugust rada - Piwi valke neis ei leitud ning transposoonide “koonu” rolli mängivad endonukleaasid Ago4 ja siRNA.
Kõrgematel loomadel, sealhulgas inimestel, on piRNA süsteem väga hästi arenenud, kuid seda võib leida ainult embrüonaalsetes rakkudes ja amniootilises endoteelis. Miks piRNA-de jaotus kehas on nii piiratud, jääb üle vaadata. Võib eeldada, et nagu iga võimas relv, on ka piRNA-dest kasu ainult väga spetsiifilistes tingimustes (loote arengu ajal) ja täiskasvanu kehas teeb nende tegevus rohkem kahju kui kasu. Sellegipoolest on piRNA-de arv suurusjärgu võrra suurem kui teadaolevate valkude arv ja keeruline on ennustada piRNA-de mittespetsiifilisi toimeid küpsetes rakkudes.
| siRNA | mikroRNA | piRNA | |
|---|---|---|---|
| Levik | Taimed, Drosophila, C. elegans... Pole leitud selgroogsetest | Eukarüootid | Embrüonaalsed loomarakud (alustades kolenteraatidest). Algloomad ja taimed puuduvad |
| Pikkus | 21-22 nukleotiidi | 19-25 nukleotiidi | 24-30 nukleotiidi |
| Struktuur | Kaheahelalised, 19 komplementaarset nukleotiidi kummaski ja kaks paarita nukleotiidi 3'-otsas | Üheahelaline keeruline struktuur | Üheahelaline keeruline struktuur. U 5'-otsas, 2'- O-metüülitud 3'-ots |
| Töötlemine | Dikerisõltlased | Dikerisõltlased | Dicer-sõltumatu |
| Endonukleaas | Ago2 | Ago1, Ago2 | Ago3, Piwi, Aub |
| Aktiivsus | Komplementaarse mRNA lagunemine, genoomse DNA atsetüülimine | Sihtmärk-mRNA lagunemine või translatsiooni pärssimine | MGE kodeeriva mRNA lagunemine, MGE transkriptsiooni reguleerimine |
| Bioloogiline roll | Viirusevastane immuunkaitse, oma geenide aktiivsuse mahasurumine | Geenitegevuse reguleerimine | MGE aktiivsuse pärssimine embrüogeneesi ajal |
Järeldus
Kokkuvõtteks tahaksin esitada tabeli, mis illustreerib valgu aparatuuri arengut RNA interferentsi korral (joonis 9). On näha, et algloomadel on kõige enam arenenud siRNA süsteem (valguperekonnad Ago, Dicer) ja organismide keerukamaks muutudes nihutatakse rõhk spetsialiseeritumatele süsteemidele - mikroRNA (Drosha, Pasha) ja piRNA (Piwi, Hen1) valguisovormide arv suureneb. Sel juhul väheneb siRNA toimet vahendavate ensüümide mitmekesisus.

Joonis 9. RNA interferentsis osalevate valkude mitmekesisus (numbrid näitavad valkude kogust igas rühmas). Sinises rõhutatakse siRNA ja mikroRNA iseloomulikke elemente ja punane - valk jaseotud piRNA-ga.
RNA häirete nähtust on juba hakanud kasutama ka kõige lihtsamad organismid. Selle mehhanismi põhjal on loodus loonud immuunsussüsteemi prototüübi ja organismide keerukamaks muutudes muutub RNA-sekkumine genoomi aktiivsuse asendamatuks regulaatoriks. Kaks erinevat mehhanismi pluss kolme tüüpi lühikesed RNA-d ( cm. sakk. 1) - selle tulemusel näeme tuhandeid mitmesuguste metaboolsete ja geneetiliste radade peent regulaatorit. See silmatorkav pilt illustreerib molekulaarbioloogiliste süsteemide mitmekülgsust ja evolutsioonilist kohanemist. Lühikesed RNA-d tõestavad jälle, et raku sees pole mingeid "pisiasju" - on vaid väikesed molekulid, mille rolli olulisust me alles hakkame mõistma.
(Tõsi, selline fantastiline keerukus räägib pigem sellest, et evolutsioon on "pime" ja toimib ilma eelnevalt kinnitatud "üldplaanita";
), takistades ribosoomidel asuva mRNA translatsiooni selle kodeeritavaks valguks. Lõppkokkuvõttes on väikeste segavate RNA-de mõju identne sellega, kui geeniekspressioon lihtsalt väheneb.
Väikesed segavad RNA-d avastasid 1999. aastal Ühendkuningriigis David Baulcombe'i rühmad taimede transkriptsioonijärgse geenide summutamise süsteemi komponendina. PTGS, en: transkriptsioonijärgne geeni vaigistamine). Rühm avaldas leiud ajakirjas Science.
Kaheahelalised RNA-d võivad suurendada geeniekspressiooni mehhanismi abil, mida nimetatakse RNA-st sõltuvaks geeni aktiveerimiseks (eng. RNAa, väike RNA poolt indutseeritud geeni aktiveerimine). On näidatud, et kaheahelalised RNA-d, mis on komplementaarsed sihtgeenide promootoritega, põhjustavad vastavate geenide aktiveerimise. Inimese rakkudes on näidatud RNA-st sõltuvat aktiveerimist sünteetiliste kaheahelaliste RNA-de sisseviimisega. Pole teada, kas sarnane süsteem eksisteerib ka teiste organismide rakkudes.
Kui väikestel segavatel RNA-del põhinevad RNA-häiringud võimaldavad põhimõtteliselt ükskõik millise geeni välja lülitada, on see põhjustanud tohutut huvi põhi- ja rakendusbioloogia vastu. Biokeemiliste radade oluliste geenide tuvastamiseks tehtavate suuremahuliste RNA-häirete testide arv kasvab pidevalt. Kuna haiguse progresseerumist juhib ka geenitegevus, võib eeldada, et mõnel juhul võib geeni seiskamine väikese segava RNA-ga avaldada ravitoimet.
Väikestel segavatel RNA-del põhinevate RNA-häirete rakendamine loomadele ja eriti inimestele on aga silmitsi paljude raskustega. Katsed on näidanud, et väikeste segavate RNA-de efektiivsus on erinevat tüüpi rakkude puhul erinev: mõned rakud reageerivad väikeste segavate RNA-de mõjule kergesti ja näitavad geeni ekspressiooni langust, samas kui teistes seda hoolimata tõhusast transfektsioonist ei täheldata. Selle nähtuse põhjused on siiani halvasti mõistetavad.
Kahe esimese RNA interferentsi mehhanismi mõjutavate (makuladegeneratsiooni raviks mõeldud) terapeutiliste ravimite uuringute esimese etapi tulemused, mis avaldati 2005. aasta lõpus, näitavad, et patsiendid taluvad väikestel segavatel RNA-del põhinevaid ravimeid kergesti ja neil on vastuvõetavad farmakokineetilised omadused.
Ebola viirusele suunatud väikeste segavate RNA-de esialgsed kliinilised uuringud näitavad, et need võivad olla tõhusad haiguse kokkupuutejärgseks profülaktikaks. See ravim võimaldas tervel katselistel primaatidel, kes said surmavat annust Zaire'i Ebolaviirust, ellu jääda
SiRNA-d on pikkusega 21-25 aluspaari ja need on saadud dsRNA-delt. Selliste RNA-de allikaks võivad olla viirusnakkused, genoomi sisse viidud geneetilised konstruktid, transkriptide pikad juuksenõelad ja liikuvate elementide kahesuunaline transkriptsioon.
dsRNA-d lõikab Dicer RNase 21-25 aluspaari fragmentideks. 3 "otsaga, mis eenduvad 2 nukleotiidi võrra, mille järel üks ahel on osa RISC-st ja juhib homoloogsete RNA-de lõhustumist. RISC sisaldab siRNA-sid, mis vastavad nii dsRNA pluss- kui ka miinus ahelale. siRNA-del pole oma geene ja nad esindavad on pikemate RNA-de fragmendid.siRNA-d suunavad siht-RNA lõhustumist, kuna need täiendavad seda täielikult. Taimedes, seentes ja nematoodides osalevad geeniekspressiooni pärssimises RNA-sõltuvad RNA polümeraasid, mille jaoks siRNA-d toimivad ka praimeritena (seemned uue RNA sünteesiks) Saadud dsRNA lõigatakse Diceri abil, moodustuvad uued siRNA-d, mis on sekundaarsed, võimendades seega signaali. 
RNA sekkumine

1998. aastal avaldasid Craig C. Mello ja Andrew Fire ajakirjas Nature, milles väideti, et kaheahelaline RNA (dsRNA) võib geeniekspressiooni maha suruda. Hiljem selgus, et selle protsessi aktiivseks põhimõtteks on lühikesed üheahelalised RNA-d. Nimetatud on mehhanism geeniekspressiooni allasurumiseks nende RNA-de abil
RNA häiringud ja RNA vaigistamine. Seda mehhanismi on leitud kõigist suurtest eukarüootide taksonitest: selgroogsetest ja selgrootutest, taimedest ja seentest. Selle avastuse eest saadi 2006. aastal Nobeli preemia.
Ekspressiooni pärssimine võib toimuda transkriptsiooni või transkriptsiooni järgsel tasemel. Selgus, et kõigil juhtudel on vaja sarnast valkude komplekti ja lühikesi (21-32 aluspaari) RNA-sid.
siRNA-d reguleerivad geeni aktiivsust kahel viisil. Nagu eespool arutatud, suunavad nad sihtmärk-RNA lõhustamist. Seda nähtust nimetatakse "allasurumiseks" ( kisendamine) seentes " translatsioonijärgne geeni vaigistamine"taimedes ja" RNA sekkumine
"Loomades. Nendes protsessides osalevad 21-23 aluspaari pikkused siRNA-d. Teine toimimisviis on siRNA-d, mis on võimelised pärssima homoloogseid siRNA järjestusi sisaldavate geenide transkriptsiooni. Seda nähtust nimetati transkriptsiooni geeni vaigistamine
(TGS) ja seda leidub pärmides, taimedes ja loomades. siRNA-d suunavad ka DNA metüülimist, mille tulemuseks on heterokromatiini moodustumine ja transkriptsiooniline repressioon. TGS-i uuritakse kõige paremini pärmi S. pombis, kus on leitud, et siRNA-d on sisestatud RISC-sarnasesse valgukompleksi, mida nimetatakse RITSiks. Tema, nagu RISC puhul, interakteerub siRNA AGO perekonna valguga. On tõenäoline, et siRNA on võimeline selle kompleksi sihtima geeni, mis sisaldab homoloogset siRNA fragmenti. Pärast seda värbavad RITS-i valgud metüültransferaase, mille tulemusel moodustub siRNA sihtgeeni kodeerivas lookuses heterokromatiin ja aktiivse geeni ekspressioon lõpetatakse. 
Roll rakuprotsessides
 Milline on siRNA tähtsus rakus?
Milline on siRNA tähtsus rakus?
siRNA-d osalevad rakkude kaitsmises viiruste vastu, transgeenide represseerimises, mõnede geenide reguleerimises ja tsentromeerse heterokromatiini moodustamises. SiRNA oluline funktsioon on liikuvate geneetiliste elementide ekspressiooni allasurumine. Selline allasurumine võib toimuda nii transkriptsiooni kui ka transkriptsiooni ajal.
Mõnede viiruste genoom koosneb DNA-st, teised aga RNA-st ja viiruste RNA võib olla kas ühe- või kaheahelaline. Võõra (viirusliku) mRNA enda lõikamisprotsess toimub sel juhul samal viisil, nagu ülalpool kirjeldatud, st RISC ensüümikompleksi aktiveerimisega. Suurema efektiivsuse huvides on taimed ja putukad leiutanud ainulaadse viisi siRNA kaitsva toime tugevdamiseks. MRNA ahela külge kinnitades saab siRNA sait DICER ensüümikompleksi abil kõigepealt teise mRNA ahela lõpule viia ja seejärel erinevates kohtades lõigata, luues seeläbi mitmesuguseid "sekundaarseid" siRNA-sid. Nad moodustavad omakorda RISC ja juhivad mRNA-d kõigil ülalnimetatud etappidel kuni selle täieliku hävitamiseni. Sellised "sekundaarsed" molekulid on võimelised spetsiifiliselt seonduma mitte ainult selle viiruse mRNA piirkonnaga, kuhu "primaarne" molekul suunati, vaid ka teiste piirkondadega, mis suurendab järsult raku kaitse efektiivsust.
Nii on taimedes ja madalamates loomsetes organismides siRNA-d oluliseks lüliks omamoodi "rakusiseses immuunsuses", mis võimaldab võõrast RNA ära tunda ja kiiresti hävitada. Juhul, kui RNA-d sisaldav viirus tungib rakku, takistab selline kaitsesüsteem selle paljunemist. Kui viirus sisaldab DNA-d, takistab siRNA süsteem sellel viirusvalkude tootmist (kuna selleks vajalik mRNA tunneb ära ja lõigatakse ära) ning selle strateegia kasutamine aeglustab selle levikut kogu kehas.
Imetajates töötab erinevalt putukatest ja taimedest teine \u200b\u200bkaitsesüsteem. Kui võõras RNA siseneb "küpse" (diferentseeritud) imetajarakku, mille pikkus on üle 30 aluspaari, hakkab rakk sünteesima interferooni. Interferoon, seostudes raku pinnal olevate spetsiifiliste retseptoritega, on võimeline stimuleerima rakus tervet rühma geene. Selle tulemusel sünteesitakse rakus mitut tüüpi ensüüme, mis pärsivad valkude sünteesi ja lagundavad viiruse RNA-sid. Lisaks võib interferoon toimida naaberrakkudes, mis pole veel nakatunud, blokeerides sellega viiruse võimalikku levikut.
Nagu näete, on mõlemad süsteemid mitmes mõttes sarnased: neil on ühine eesmärk ja töö "meetodid". Isegi nimed "interferoon" ja "(RNA) interferents" on pärit ühistest juurtest. Kuid neil on ka üks väga oluline erinevus: kui interferoon sissetungi esimeste märkide korral "külmutab" raku töö, takistades (igaks juhuks) paljude, sealhulgas rakus "süütute" valkude tootmist, on siRNA süsteem äärmiselt loetav. : iga siRNA tunneb ära ja hävitab ainult oma spetsiifilise mRNA. Ainult ühe nukleotiidi asendamine siRNA-s põhjustab häirete mõju järsku vähenemist ... Ühelgi seni teadaoleval geeniblokaatoril pole oma sihtgeeni suhtes seda erandlikku spetsiifilisust.
RNA-häirete avastamine on andnud uut lootust võitluses AIDSi ja vähi vastu. On võimalik, et siRNA-ravi kasutamisel koos tavapärase viirusevastase teraapiaga on võimalik saavutada tugevdav efekt, kui need kaks efekti annavad teravama efekti, kui nende kummagi eraldi rakendatav lihtne summa.
SiRNA interferentsi mehhanismi kasutamiseks imetajate rakkudes tuleb rakkudesse viia valmis kaheahelalised siRNA molekulid. Selliste sünteetiliste siRNA-de optimaalne suurus on samad 21–28 nukleotiidi. Kui suurendate selle pikkust, reageerivad rakud interferooni tootmisega ja valkude sünteesi vähendamisega. Sünteetilised siRNA-d võivad siseneda nii nakatunud kui ka tervetesse rakkudesse ning valkude tootmise vähenemine nakatumata rakkudes on äärmiselt ebasoovitav. Teisest küljest, kui proovida kasutada siRNA-sid, mis on väiksemad kui 21 nukleotiidi, väheneb järsult selle soovitud mRNA-ga seondumise spetsiifilisus ja võime moodustada RISC kompleksi.
Kui siRNA saab kohale toimetada ühel või teisel viisil, millel on võime seonduda mõne HIV genoomi osaga (mis, nagu teada, koosneb RNA-st), võib proovida vältida selle integreerumist peremeesraku DNA-sse. Lisaks töötavad teadlased välja viise, kuidas mõjutada HIV-i paljunemise erinevaid etappe juba nakatunud rakus. Viimane lähenemisviis ei anna ravi, kuid see võib märkimisväärselt vähendada viiruse paljunemise kiirust ja anda nurgalisele immuunsüsteemile võimaluse "puhata" viiruse rünnakust ja proovida tegeleda haiguse enda jäänustega. Joonisel on kaks HIV paljunemise etappi rakus, mida teadlased loodavad siRNA abil blokeerida, tähistatud punaste ristidega (etapid 4-5 - viiruse sisestamine kromosoomi ja etapid 5-6 - viiruse kokkupanek ja rakust väljumine). 
Praeguseks kehtib kõik eelnev ainult teooria valdkonnas. Praktikas puutub siRNA-teraapia kokku raskustega, mida teadlased pole veel suutnud vältida. Näiteks viirusevastase teraapia puhul võib siRNA kõrge spetsiifilisus mängida julma nali: nagu teate, on viirustel võime kiiresti muteeruda, s.t. muuta nende nukleotiidide koostist. Eriti edukas on olnud HIV, mille muutuste sagedus on selline, et inimese, kes on mõne aasta pärast nakatunud viiruse alatüüpi, saab eristada täiesti erineva alatüübi järgi. Sel juhul muutub modifitseeritud HIV tüvi teraapia alguses valitud siRNA suhtes automaatselt tundmatuks.
Vananemine ja kantserogenees
 Nagu iga epigeneetiline tegur, mõjutavad siRNA-d vaigistavate geenide ekspressiooni. Nüüd on olemas töid, mis kirjeldavad katseid kasvajatega seotud geenide väljalülitamiseks. SiRNA mõjutas geene. Näiteks kasutasid Hiina teadlased siRNA-d geeni väljalülitamiseks transkriptsioonifaktor 4 (TCF4) jaoks, mille aktiivsus vastutab Pitt-Hopkinsi sündroomi (väga haruldane geneetiline haigus, mida iseloomustavad vaimne alaareng ning hüperventilatsiooni ja apnoe episoodid) ja muude vaimuhaiguste eest. Selles töös uurisime TCF4 rolli maovähirakkudes. TCF4 emakaväline ekspressioon vähendab rakkude kasvu maovähi rakuliinides ja TCF4 geeni siRNA desaktiveerimine suurendab rakkude migratsiooni. Seega võib järeldada, et TCF4 geeni epigeneetiline väljalülitamine (vaigistamine) mängib olulist rolli kasvaja moodustumisel ja arengul.
Nagu iga epigeneetiline tegur, mõjutavad siRNA-d vaigistavate geenide ekspressiooni. Nüüd on olemas töid, mis kirjeldavad katseid kasvajatega seotud geenide väljalülitamiseks. SiRNA mõjutas geene. Näiteks kasutasid Hiina teadlased siRNA-d geeni väljalülitamiseks transkriptsioonifaktor 4 (TCF4) jaoks, mille aktiivsus vastutab Pitt-Hopkinsi sündroomi (väga haruldane geneetiline haigus, mida iseloomustavad vaimne alaareng ning hüperventilatsiooni ja apnoe episoodid) ja muude vaimuhaiguste eest. Selles töös uurisime TCF4 rolli maovähirakkudes. TCF4 emakaväline ekspressioon vähendab rakkude kasvu maovähi rakuliinides ja TCF4 geeni siRNA desaktiveerimine suurendab rakkude migratsiooni. Seega võib järeldada, et TCF4 geeni epigeneetiline väljalülitamine (vaigistamine) mängib olulist rolli kasvaja moodustumisel ja arengul.
Onkoloogia osakonna uuringute kohaselt Albert Einsteini vähikeskuses, mida juhib Leonard H. Augenlicht, osaleb siRNA HDAC4 geeni väljalülitamises, mis põhjustab käärsoolevähi kasvu, apoptoosi ja p21 suurenenud transkriptsiooni pärssimist. HDAC4 on histooni deatsetülaas, mis on koespetsiifiline, pärsib rakkude diferentseerumist ja selle ekspressioon pärsitakse rakkude diferentseerimise käigus. Töö näitas, et HDAC4 on käärsoolerakkude proliferatsiooni oluline regulaator (mis on oluline vähiprotsessis) ja seda omakorda reguleerib siRNA.
Jaapani Nara Meditsiiniülikooli meditsiinikooli patoloogiaosakond viis läbi uuringuid eesnäärmevähi kohta. Replikatiivne rakkude vananemine on takistuseks kontrollimatule jagunemisele ja kantserogeneesile. Lühikese elueaga jagunevad rakud (TAC) on osa eesnäärme rakkude populatsioonist, millest kasvajad arenevad. Jaapani teadlased on uurinud põhjuseid, miks need rakud vananemisest üle saavad. JunB siRNA transfekteeriti kultuuris eesnäärmerakkudesse. Nendes rakkudes täheldatakse p53, p21, p16 ja pRb suurenenud ekspressioonitaset, mis tuvastatakse vananemise ajal. Järgmises etapis kasutati rakke kultuuris, mis näitasid vähenenud p16 taset. SiRNA uuesti transfekteerimine TAC-i võimaldas rakkudel vältida vananemist, kui p16 / pRb oli inaktiveeritud. Lisaks indutseerib junB protoonkogeeni vaigistamine junB siRNA poolt rakkude sissetungi. Selle põhjal järeldati, et junB on p16 element ja soodustab rakkude vananemist, mis hoiab ära TAC pahaloomulisuse. Seega on junB eesnäärme kartsinogeneesi regulaator ja võib olla terapeutilise sekkumise sihtmärk. Ja selle tegevust saab reguleerida siRNA abil.
Selliseid uuringuid on palju. Tänapäeval pole siRNA mitte ainult objekt, vaid ka instrument teadlase-arsti, bioloogi, onkoloogi, gerontoloogi käes. SiRNA seoste uurimine onkoloogiliste haigustega, vanusega seotud geenide ekspressiooniga on teaduse kõige olulisem ülesanne. SiRNA avastamisest on möödunud väga vähe aega ja kui palju on nendega seotud huvitavaid uurimusi ja trükiseid ilmunud. Pole kahtlust, et nende uuringust saab inimkonna üks samme vähktõve ja vananemise vastu võitlemiseks ...