Väikeste molekulide suured tehingud: kuidas väikesed RNA-d bakteri geene juhivad. Väikesed RNA-d ja vähk Väikesed segavad RNA-d ei hõlma
Artikkel võistlusele "bio / mol / tekst": Viimastel aastatel on RNA - ja eriti selle "mitteklassikalised" sordid - pälvinud bioloogide tähelepanu kogu maailmas. Selgus, et mittekodeerivate RNA-de abil on regulatsioon laialt levinud - alates viirustest ja bakteritest kuni inimesteni. Väikeste bakteriaalsete RNA-regulaatorite mitmekesisuse uuring näitas selgelt nende olulist rolli nii vahepealses metabolismis kui ka adaptiivsetes reaktsioonides. Selles artiklis kirjeldatakse bakterite väikeste RNA-de tüüpe ja nende abil teostatavaid regulatsioonimehhanisme. Erilist rõhku pannakse nende molekulide rollile eriti ohtlikke nakkusi põhjustavate bakteriaalsete ainete elulises tegevuses.
RNA: enamat kui lihtsalt DNA koopia
Alates koolist on enamik selle saidi lugejaid tuttavad elava raku põhimehhanismidega. Bioloogia käigus, alustades Mendeli seadustest ja lõpetades tipptasemel genoomide järjestamise projektidega, sündis idee organismi arengu peamiseks geneetiliseks programmiks, mis on professionaalsetele bioloogidele tuntud kui molekulaarbioloogia keskne dogma... Selles öeldakse, et DNA molekul toimib geneetilise teabe kandjana ja säilitajana, mis vahendaja kaudu - Messenger RNA (mRNA) ning ribosomaalse (rRNA) ja transport RNA (tRNA) osalusel - realiseeritakse valkude kujul. Viimased määravad liigi ja individuaalse fenotüübi.
Selline asjade seis ja RNA määramine molekulaarses vaatemängus alaealise osaleja rollile püsis teadusringkondades kuni eelmise sajandi 80ndateni. RNA-d lähemalt vaatas läbi T. Cheki töö, kes näitas, et RNA võib toimida keemiliste reaktsioonide katalüsaatorina. Varem usuti, et rakus leiduvate keemiliste protsesside kiirendamine on ensüümide eelisõigus, millel on eranditult valgu iseloom. Katalüütilise aktiivsuse avastamisel RNA-s olid kaugeleulatuvad tagajärjed - koos K. Woese varasemate teoreetiliste töödega ja see võimaldas joonistada võimaliku pildi prebiootikumi evolutsioonist meie planeedil. Fakt on see, et kuna DNA-s geneetilise teabe kandja funktsioon avastati, tundus dilemma evolutsiooni käigus varem ilmnenud - DNA või DNA reprodutseerimiseks vajaliku valgu kohta - peaaegu sama filosoofiline (st mõttetu) kui küsimus kana või muna välimuse ülimuslikkuse kohta. Pärast T. Cheki avastust võttis lahendus üsna reaalsed piirid - leiti molekul, millel on nii infokandja kui ka biokatalüsaatori omadused (ehkki embrüonaalsel kujul). Aja jooksul on need uuringud kasvanud bioloogias terveks suunaks, uurides elu tekkimist niinimetatud "RNA-maailma" prisma kaudu.
Nii sai ilmsiks, et RNA iidne maailm võis olla seotud esmase elu alguse ja õitsenguga. Sellest hoolimata ei järeldu sellest automaatselt, et RNA pole tänapäevastes organismides rakusiseste molekulaarsüsteemide vajadustele kohandatud arhaism, vaid raku molekulaarse ansambli tõeliselt oluline liige. Ainult molekulaarsete meetodite arendamine - eriti nukleiinhapete järjestamine - on näidanud, et RNA-d on rakus hädavajalikud, ja mitte ainult "mRNA, rRNA, tRNA" kanoonilise kolmainsuse vormis. Juba esimesed ulatuslikud andmed DNA sekveneerimise kohta osutasid tõsiasjale, mida alguses tundus olevat raske seletada - suurem osa sellest osutus mittekodeeriv see tähendab, et see ei sisalda teavet valgu molekulide või "standardse" RNA kohta. Muidugi võib seda osaliselt seostada "geneetilise prügi" - "välja lülitatud" või sellega, et nad on oma genoomi funktsioonifragmendid kaotanud. Kuid nii suure "kaasavara" säilitamine bioloogiliste süsteemide jaoks, mis üritavad energiat säästlikult kulutada, tundub ebaloogiline.
Tõepoolest, üksikasjalikumad ja peenemad uurimismeetodid on võimaldanud avastada terve klassi RNA regulaatorite geeniekspressiooni, mis osaliselt täidavad geenidevahelist ruumi. Enne ümarussis eukarüootide täielike genoomijärjestuste lugemist C. elegans eraldati mikroRNA-d - lühikese pikkusega (umbes 20 nukleotiidi) molekulid, mis vastavalt komplementaarsuse põhimõttele võivad spetsiifiliselt seostuda mRNA piirkondadega. Lihtne on arvata, et sellistel juhtudel ei ole enam võimalik kodeeritud valkude kohta mRNA-st teavet lugeda: ribosoom lihtsalt ei suuda “kulgeda” üle sellise piirkonna, mis on järsku kaheahelaliseks muutunud. See geeniekspressiooni allasurumise mehhanism, mida nimetatakse RNA sekkumine, on "biomolekul" juba piisavalt detailselt lahti võetud. Praeguseks on avastatud tuhandeid mikroRNA ja muid mittekodeerivaid RNA molekule (piRNA, snoRNA, nanoRNA jne). Eukarüootides (sealhulgas inimestel) asuvad nad geenidevahelistes piirkondades. On kindlaks tehtud nende oluline roll rakkude diferentseerumises, kantserogeneesis, immuunvastuses ning teistes protsessides ja patoloogiate korral.
Väikesed RNA-d - Trooja hobune bakteriaalsete valkude jaoks
Hoolimata asjaolust, et mittekodeerivad valgu RNA-d bakterites avastati palju varem kui esimesed analoogsed regulaatorid eukarüootides, on nende roll bakteriraku metabolismis teadlaste jaoks juba pikka aega looritatud. See on arusaadav - traditsiooniliselt peeti bakterirakku teadlase jaoks primitiivsemaks ja vähem salapäraseks struktuuriks, mille keerukust ei saa võrrelda struktuuride kuhjumisega eukarüootsesse rakku. Veelgi enam, mittekodeeriva teabe sisu bakteri genoomides on vaid mõni protsent kogu DNA pikkusest, ulatudes mõnes mükobakteris maksimaalselt 40% -ni. Kuid arvestades, et mikroRNA-sid leidub isegi viiruses, peaksid need bakterites mängima olulist regulatiivset rolli, veelgi enam.
Selgus, et prokarüootidel on üsna palju väikseid RNA regulaatoreid. Neid kõiki võib tinglikult jagada kahte rühma:
- RNA molekulid, mis peavad oma funktsiooni täitmiseks valkudega seonduma.
- RNA-d, mis seonduvad komplementaarselt teiste RNA-dega (moodustavad suurema osa teadaolevatest RNA regulaatormolekulidest).
Esimeses rühmas eraldatakse väikesed RNA-d, mille jaoks valkudega seondumine on võimalik, kuid mitte vajalik. Tuntud näide on RNaas P (RNAse P), mis toimib ribosüümina "küpseval" tRNA-l. Kui RNaas P saab toimida ka ilma valgukomponendita, on selle rühma teiste väikeste RNA-de puhul kohustuslik seostumine valguga (ja nad ise on tegelikult kofaktorid). Näiteks aktiveerib tmRNA keerulise valgukompleksi, toimides "kinni jäänud" ribosoomi valimisel - kui Messenger RNA, millest lugemine läbi viiakse, on lõppenud ja stoppkoodoni pole kohanud.
Samuti on teada veelgi intrigeerivam väikeste RNA-de otsese interaktsiooni mehhanism valkudega. Mis tahes rakus on "traditsiooniliste" nukleiinhapetega seonduvad valgud laialt levinud. Prokarüootne rakk pole erand. Näiteks aitavad selle histoonisarnased valgud DNA ahelat õigesti pakendada ja selle spetsiifilistel repressorvalkudel on afiinsus bakterigeenide operaatorpiirkonna suhtes. On tõestatud, et neid repressoreid võivad pärssida väikesed RNA-d, mis jäljendavad nende valkude "natiivseid" DNA sidumissaite. Näiteks on väikesel RNA CsrB-l (joonis 1) 18 "võlts" saiti, mis takistavad repressorvalgu CsrA jõudmist oma tõelise sihtmärgini, glükogeeni operonini. Muide, selliste väikeste RNA-de tõttu "kaotatud" repressorvalkude hulgas on globaalsete metaboolsete radade regulaatorid, mis võimaldab korrutada väikese RNA inhibeerivaid signaale. Näiteks teeb seda väike RNA 6S, mis “jäljendab” valgufaktorit σ 70. Okupeerides konfiguratsiooni "trikk" abil RNA polümeraasi sidumissaite sigmafaktoriga, pärsib see majapidamisgeenide ekspressiooni.
Joonis 1. Bioinformaatlikult ennustatud väikese RNA CsrB sekundaarstruktuur alates Vibrio koolerad M66-2. Väikesed RNA-d on üheahelalised molekulid, kuid sarnaselt teiste RNA-dega kaasneb stabiilseks ruumistruktuuriks voltimisega (voltimisega) ka piirkondade moodustumine, kus molekul hübridiseerub iseendaga. Kutsutakse arvukalt konstruktsiooni painutusi avatud rõngaste kujul juuksenõelad... Mõnel juhul võimaldab juuksenõelte kombinatsioon RNA-l toimida "käsna", sidudes teatud valke mittekovalentselt. Kuid sagedamini segavad seda tüüpi molekulid DNA või RNA; sel juhul on väikese RNA ruumiline struktuur häiritud ja juba moodustuvad sihtmolekuliga uued hübridisatsiooni piirkonnad. Soojuskaart peegeldab tõenäosust, et vastav nukleotiidipaar on tegelikult seotud molekulisisese vesiniksidemega; paarimata saitide korral vesiniksidemete moodustumise tõenäosus molekuli mis tahes saitidega. Pilt saadi programmi abil RNA korda.
Bakterite väikesed RNA-d segavad ... ja väga edukalt!
Mehhanism, mille abil teise rühma regulaatorid toimivad, on üldiselt sarnane eukarüootide regulatoorsete RNA-dega - see on sama RNA häire, hübridiseerumisel mRNA-ga, ainult väikesed RNA ahelad ise on sageli autentsemad - kuni mitusada nukleotiidi ( cm. joon. 1). Selle tulemusel ei saa ribosoomid väikese RNA tõttu mRNA-st teavet lugeda. Ehkki sageli ei paista see tulevat: moodustunud kompleksidest "väike RNA - mRNA" saab RNaaside (näiteks RNaas P) sihtmärk.
Prokarüootse genoomi kompaktsus ja tihedus annab endast tunda: kui eukarüootides registreeritakse suurem osa regulatiivsetest RNA-dest eraldi (enamasti ei kodeeri valku) lookustes, siis paljud allasurutud geeniga samasse DNA piirkonda võivad kodeerida paljud väikesed bakterite RNA-d, aga vastupidi ketid! Selliseid RNA-sid nimetatakse cis-kodeeritud (antisenss) ja väikesed RNA-d, mis asuvad inhibeeritud DNA piirkonnast mingil kaugusel - trans-kodeeritud... Ilmselt võib cis-RNA asukohta pidada ergonoomika võidukäiguks: neid saab lugeda lahti vastassuunaliselt DNA ahelalt selle lahtiütlemise hetkel samaaegselt sihtmärgistusega, mis võimaldab sünteesitud valgu koguse täielikku kontrolli.
Trans-positsioonis olevad väikesed RNA-d arenevad sõltumatult siht-mRNA-st ja regulaatori järjestus muutub mutatsioonide tagajärjel rohkem. Võimalik, et bakteriraku selline joondamine on ainult "käepärast", kuna väike RNA omandab aktiivsuse varem mitte iseloomulike sihtmärkide suhtes, mis vähendab teiste regulaatorite loomiseks kuluvat aega ja energiakulu. Teisest küljest takistab selektsioonisurve trans-väikese RNA liiga palju muteerumist, kuna see kaotab aktiivsuse. Messengeri RNA-ga hübridiseerimiseks vajavad enamik trans-väikeseid RNA-sid aga abistajat Hfq valku. Ilmselt võib väikese RNA ebatäielik komplementaarsus sihtmärkidega seondumisel probleeme tekitada.
Ilmselt aitab potentsiaalselt teostatav regulatsioonimehhanism põhimõttel „üks väike RNA - palju sihtmärke“ integreerida bakterite metaboolsed võrgud, mis on lühikese üherakulise eluea jooksul äärmiselt vajalik. Saame jätkata selle teema spekuleerimist ja eeldada, et transkoodeeritud väikeste RNA-de abil viiakse ekspressiooni "ettekirjutused" üle funktsionaalselt seotud, kuid füüsiliselt kaugetest lookustest. Vajadus sellist geneetilist nn rullkõnet selgitab loogiliselt patogeensetes bakterites leiduvate väikeste RNA-de arvukuses. Näiteks leiti selle indikaatori - Vibrio cholerae ( Vibrio koolerad). See on mikroorganism, mis võib ellu jääda ümbritsevas veekeskkonnas (nii värskes kui soolases), vesikarpides, kalades ja inimese soolestikus - siin ei saa te ilma reguleerivate molekulide abiga hakkama ilma keeruka kohanemiseta!
CRISPR kaitseb bakterite tervise eest
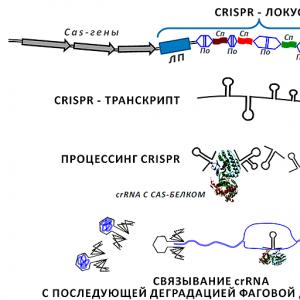
Väikest RNA-d kasutati ka bakteritele elutähtsa probleemi lahendamisel. Isegi kõige õelamad patogeensed koktsid ja batsillid võivad spetsiaalsete viiruste - bakteriofaagide - tekitatava ohu korral olla võimetud, väljudes bakteripopulatsiooni välkkiirega. Mitmerakulistel organismidel on spetsiaalne süsteem viiruste eest kaitsmiseks - immuunne, kaitstes keha sissetungijate (sealhulgas viirusliku iseloomuga) sissetungijate eest. Bakterirakk on küll üksik, kuid see pole nii haavatav, kui esmapilgul võib tunduda. Lokid toimivad bakterite viirusevastase immuunsuse säilitamise retseptide pidajatena CRISPR - klastri regulaarsed-katkendlikud lühikesed palindroomsed kordused ( rühmitatud regulaarselt vahemaa tagant paiknevate lühikeste palindroomsete kordustega) (Joonis 2;). Prokarüootide genoomides esindab iga CRISPR-kassetti mitmesaja nukleotiidi pikkune liiderjärjestus, millele järgneb 2–24 (mõnikord kuni 400) kordust, mis on eraldatud pikkusega sarnase pikkusega, kuid nukleotiidijärjestuses ainulaadsete vahepiirkondadega. Iga vaheliistu ja korramise pikkus ei ületa sada aluspaari.

Joonis 2. CRISPR lookus ja vastava väikese RNA töötlemine funktsionaalseks transkriptsiooniks. Genoomis CRISPR- kassetti tähistavad põimitud vahedetailid (joonisel näidatud kui Cn), osaliselt homoloogne faagi DNA piirkondadega ja kordub ( Kõrval) 24–48 aluspaari pikkune, näidates dünaamilist sümmeetriat. Vastupidiselt kordustele on ühe lookuse vahekaugused sama pikkusega (erinevates bakterites võib see olla 20–70 nukleotiidi), kuid erinevad nukleotiidijärjestuse poolest. Jaod "-Spacer-korrata-" võivad olla üsna pikad ja koosneda mitmest sajast lingist. Kogu struktuur on ühel küljel liiderjärjestusega ( LP, mitusada aluspaari). Cas geenid ( CRISPR-kuisotsialiseerunud), operoniks organiseeritud. Neilt loetud valgud täidavad mitmeid abifunktsioone, pakkudes alates loetud transkripti töötlemist CRISPR-lokus, selle edukas hübridiseerumine faagi sihtmärk-DNA-ga, uute elementide sisestamine lookusesse jne. Mitmeastmelise töötlemise tulemusel moodustunud CrRNA hübridiseerub DNA piirkonnaga (joonise alumine osa), mille faag süstis bakterisse. See vaigistab viiruse transkriptsioonimasina ja peatab selle paljunemise prokarüootses rakus.
Kõigi päritolu üksikasjalik mehhanism CRISPR-lokus jääb veel uurimata. Kuid praeguseks on välja pakutud vaheplaadide - selle koostise kõige olulisemate struktuuride - ilmumise skeem. Selgub, et "bakteriküttide" peksmiseks osutub nende endi relv - nukleiinhapped või pigem "trofee" geneetiline teave, mille bakterid on saanud faagidest eelmistes lahingutes! Asi on selles, et mitte kõik bakterirakku sisenevad faagid pole surmavad. Selliste faagide (võib olla seotud parasvöötmega) DNA lõigatakse spetsiaalsete Cas-valkude abil (nende geenid külgnevad CRISPR) väikesteks kildudeks. Mõned neist fragmentidest manustatakse CRISPR- peremehe genoomi loogikad. Ja kui faagi DNA siseneb uuesti bakterirakku, kohtub see väikese RNA-ga CRISPR-lokus, mida sel hetkel ekspresseerivad ja töötlevad Cas-valgud. Sellele järgneb viiruse geneetilise teabe inaktiveerimine juba ülalkirjeldatud RNA interferentsi mehhanismi abil.
Tühikute moodustumise hüpoteesist ei selgu, miks on vaja nende vahel kordusi, ühes lookuses, mille pikkus on pisut erinev, kuid järjestuses peaaegu identne? Siin on kujutlusvõimel lai ulatus. Võib-olla oleks ilma kordusteta problemaatiline jagada geneetilised andmed semantilisteks fragmentideks, sarnaselt sektoritele arvuti kõvakettal, ja seejärel transkriptsioonimasina juurdepääs rangelt määratletud aladele CRISPR-lokus muutuks piinlikuks? Või äkki lihtsustavad kordused rekombinatsiooniprotsesse, kui sisestatakse uued faagi DNA elemendid? Või on need "kirjavahemärgid", mis on CRISPRi töötlemisel hädavajalikud? Olgu nii või teisiti, leitakse õigel ajal bioloogiline põhjus, mis selgitab bakteriraku käitumist Gogoli Pljuškini viisil.
CRISPRolles bakterite ja faagide vaheliste suhete "kroonika", saab seda kasutada fülogeneetilistes uuringutes. Seega viis hiljuti läbi masinakirjutamine CRISPR võimaldas heita pilgu katkumikroobi üksikute tüvede arengule ( Yersinia pestis). Uurige nende CRISPR- "sugupuud" valgustasid sündmusi poole aastatuhande tagustest sündmustest, kui tüved sisenesid Mongooliasse nüüd Hiinale kuuluvalt territooriumilt. Kuid mitte kõigi bakterite ja eriti haigustekitajate puhul on see meetod rakendatav. Hoolimata hiljutisest teabest CRISPR-i töötlevate valkude kohta tularemia patogeenides ( Francisella tularensis) ja koolera, CRISPR-id ise, kui neid on oma genoomis, pole arvukad. Võib-olla, arvestades nende positiivset panust bakteririigi patogeensete liikmete virulentsuse omandamisse, ei ole faagid CRISPR-i abil nende kaitsmiseks nii kahjulikud ja ohtlikud? Või on neid baktereid ründavad viirused liiga mitmekesised ja nende vastu RNA immuunsuse "segamise" strateegia on steriilne?

Joonis 3. Mõned ribosilitri töömehhanismid. Riboslülitid (ribosilülitid) on sisse ehitatud Messenger RNA-sse, kuid erinevad sõltuvalt spetsiifilistest ligandidest suure konformatsioonikäitumise vabaduse poolest, mis annab aluse pidada riboskeeme väikeste RNA-de iseseisvateks üksusteks. Ekspressiooniplatvormi konformatsiooni muutus mõjutab mRNA ribosoomi sisenemise kohta ( RBS) ja määrab sellest tulenevalt kogu mRNA kättesaadavuse lugemiseks. Riboslülitid on teatud määral sarnased operaatori domeeniga klassikalises mudelis lak-operoon - kuid madala molekuliga ained reguleerivad tavaliselt ainult aptameerilisi piirkondi ja muudavad geeni tööd mRNA, mitte DNA tasemel. ja - Ligandite puudumisel ribolülitid btuB (kobalamiini transporter) ja thiM (tiamiinpürofosfaadist sõltuv)mis teostavad mRNA mittenukleolüütilist repressiooni, on "sisse lülitatud" ( PEAL) ja lase ribosoomil oma äri ajada. Ligandi sidumine ribosilitsaga ( VÄLJAS-positsioon) viib juuksenõela moodustumiseni, muutes selle koha ribosoomi jaoks kättesaamatuks. b - lüsiini ribolüliti lysC sisaldub ka ligandi puudumisel ( PEAL). Ribaüliti väljalülitamine blokeerib ribosoomi juurdepääsu mRNA-le. Kuid vastupidiselt ülalkirjeldatud ribosküüntele, lüsiinis välja lülitatuna "paljastatakse" piirkond spetsiaalse RNaasi kompleksi abil ( lagunev) ja kasutatakse kogu mRNA-d, lagunedes väikesteks fragmentideks. Sellisel juhul nimetatakse riboswitchi abil toimuvat repressiooni nukleolüütiliseks ( nukleolüütiline) ja on pöördumatu, kuna vastupidiselt näitele ( ja ), lülitage tagasi (uuesti sisse PEAL) pole enam võimalik. Oluline on märkida, et sel viisil saab kasutada "mittevajalike" mRNA-de rühma: ribosüliti sarnaneb lastekunstniku detailiga ja tervel rühmal funktsionaalselt seotud maatriksimolekulidel võivad olla sarnased lülitid.
Riboswitch - andur bakteritele
Niisiis, on olemas valkudega seotud väikesed RNA-d, on ka väikeseid RNA-sid, mis segavad bakterite enda mRNA-sid, samuti RNA-sid, mida bakterid on viirustest kinni püüdnud ja faagi DNA suruvad alla. Kas on võimalik väikeste RNA-de abil ette kujutada mõnda muud regulatsioonimehhanismi? Selgub, jah. Kui analüüsime ülaltoodut, leitakse, et kõigil antisenssregulatsiooni juhtudel on kahe RNRi hübridiseerumise tagajärjel häiritud väikese RNA ja sihtmärgi vahel. individuaalne molekulid. Miks mitte korraldada väike RNA osana ärakirjast ise? Siis, muutes sellise "saadetud kasaka" konformatsiooni mRNA-s, on võimalik muuta kogu matriitsi kättesaadavust tõlkimise ajal lugemiseks või, mis on energeetiliselt veelgi otstarbekam, reguleerida mRNA biosünteesi, s.o. transkriptsioon!
Sellised struktuurid on bakterirakkudes laialdaselt esindatud ja neid tuntakse riboslülititena ( riboswitch). Need asuvad enne geeni kodeeriva osa algust, mRNA 5'-otsas. Tavaliselt saab riboslülitite koostises eristada kahte struktuurimotiivi: aptameeri piirkond- vastutavad ligandiga seondumise eest (efektor) ja - väljendusplatvormgeeniekspressiooni reguleerimise võimaldamine mRNA üleminekul alternatiivsetele ruumilistele struktuuridele. Näiteks kasutatakse sellist lülitit ("off" tüüpi) tööks lüsiini operon: koos lüsiini liiaga eksisteerib see “takerdunud” ruumilise struktuuri kujul, mis blokeerib lugemist operonist, ja lüsiini puudumisel ribosüliti “lahti harutab” ja lüsiini biosünteesiks vajalikud valgud sünteesitakse (joonis 3).
Kirjeldatud riboslüliti seadme skeem ei ole kaanon, on võimalusi. Vibrio cholerae'st leiti huvitav "sisse lülitatud" tandem riboswitch: ekspressiooniplatvormile eelneb kaks korraga aptameerne sait. Ilmselt tagab see suurema tundlikkuse ja sujuvama reageerimise teise aminohappe, glütsiini, ilmnemisele rakus. Võib-olla on see kaudselt seotud bakteri kõrge ellujäämismääraga, mis on põhimõtteliselt sarnane, kuid "topelt" ribilüliti siberi katku põhjustaja genoomis ( Bacillus anthracis). See reageerib tiamiinpürofosfaadile, mis on ülioluline selle mikroobi jaoks, mis on osa minimaalsest keskkonnast.
Lisaks metaboolsete radade vahetamisele sõltuvalt bakterirakule pakutavast menüüst võivad ribosülitid olla ka bakteriaalse homöostaasi andurid. Nii on neid nähtud geeni loetavuse reguleerimisel, kui rakusisese translatsioonisüsteemi toimimine on häiritud (näiteks signaalid, näiteks "laadimata" tRNA ja "vigaste" (seiskunud) ribosoomide ilmumine) või kui keskkonnategurid muutuvad (näiteks temperatuuri tõus ).
Valku pole vaja, andke meile RNA!
Mida tähendab selliste väikeste RNA-regulaatorite olemasolu bakterites? Kas see viitab kontseptsiooni tagasilükkamisele, kui peamised "juhid" on oravad, või oleme tunnistajaks mõnele muule moetrendile? Ilmselt ei üht ega teist. Kindlasti on mõned väikesed RNA-d metaboolsete radade globaalsed regulaatorid, nagu näiteks ülalmainitud CsrB, mis osaleb koos CsrC-ga orgaanilise süsiniku säilitamise regulatsioonis. Kuid võttes arvesse bioloogiliste süsteemide funktsioonide dubleerimise põhimõtet, saab bakterite väikseid RNA-sid võrrelda rohkem "kriisijuhiga" kui tegevjuhiga. Niisiis, tingimustes, kus mikroorganismi ellujäämine on vajalik kiire rakusisese metabolismi ümberkonfigureerimine, võib nende regulatiivne roll olla otsustav ja tõhusam kui sarnaste funktsioonidega valkudel. Seega vastutavad RNA regulaatorid tõenäolisemalt ekspressioonivastuse eest, mis on vähem stabiilne ja usaldusväärne kui valkude puhul: ei tohiks unustada, et väike RNA säilitab oma 3D-struktuuri ja hoiab seda pärsitud maatriksil nõrkade vesiniksidemete abil.
Juba mainitud Vibrio cholerae väike RNA võib anda nendele teesidele kaudse kinnituse. Selle bakteri jaoks pole inimkehasse sisenemine soovitav eesmärk, vaid ilmselt hädaolukord. Toksiinide tootmine ja muude virulentsusega seotud radade aktiveerimine on sel juhul lihtsalt kaitsereaktsioon keskkonna ja keharakkude agressiivsele vastutegevusele "kõrvalistele". “Päästjad” on siin väikesed RNA-d - näiteks Qrr, mis aitavad vibrio stressiolukorras muuta oma ellujäämisstrateegiat, muutes kollektiivset käitumist. Seda hüpoteesi saab kaudselt kinnitada ka väikese RNA VrrA avastamisega, mida sünteesitakse aktiivselt, kui kehas leitakse vibriosid ja mis pärsib Omp-membraani valkude tootmist. Nakkuse algfaasis peidetud membraanvalgud võivad aidata vältida inimkeha tugevat immuunvastust (joonis 4).

Joonis 4. Väikesed RNA-d Vibrio cholerae patogeensete omaduste rakendamisel. ja - Vibrio cholerae tunneb end hästi ja taastub veekeskkonnas hästi. Inimkeha pole ilmselt selle mikroobi peamine ökoloogiline nišš. b - Vee või toidu kaudu nakatumise edasikandumine agressiivsesse keskkonda - inimese peensoole - hakkavad vibriod oma organiseeritud käitumises sarnanema pseudoorganismiga, mille põhiülesanne on immuunvastuse ohjeldamine ja koloniseerimiseks soodsa keskkonna loomine. Membraanvesiikulitel on suur tähtsus bakteripopulatsioonis toimuvate tegevuste koordineerimisel ja nende koostoimel kehaga. Kuni lõpuni on tundmatud keskkonnategurid soolestikus signaalid ekspressiooniks väikeste RNA-de (näiteks VrrA) vibratsioonides. Selle tulemusel käivitub vesiikulite moodustumise mehhanism, mis on mitteimmunogeensed, kui soolestikus on vähe vibriorakke. Lisaks kirjeldatud efektile aitavad väikesed RNA-d "peita" membraanivalgud Omp, mis võivad inimese immuunsussüsteemi provotseerida. Väikeste RNA-de Qrr1-4 kaudsel osalusel käivitub kooleratoksiini intensiivne tootmine (joonisel pole näidatud), mis täiendab vibrio-koolerade adaptiivsete reageeringute spektrit. sisse - Juba mõne tunni pärast suureneb bakterirakkude arv ja VrrA väikeste RNA-de kogum väheneb, mis tõenäoliselt põhjustab membraanivalkude kokkupuudet. Järk-järgult väheneb ka "tühjade" vesiikulite arv ja selles etapis asendatakse need enterootsüütidesse tarnitud immunogeensete vesiikulitega. Ilmselt on see osa keeruka signaali realiseerimise "kavast", mille eesmärk on provotseerida vibrode evakueerimine inimkehast. NB! Bakterirakkude ja enterotsüütide suuruse suhet ei täheldata.
Huvitav on jälgida, kuidas muutuvad meie ideed väikeste RNA-regulaatorite kohta, kui RNAseq-platvormidelt saadakse uusi andmeid, sealhulgas vabalt elavate ja kultuurita vormide kohta. Hiljutine "sügavat järjestamist" kasutav töö on juba andnud ootamatuid tulemusi, mis näitab mikroRNA-sarnaste molekulide olemasolu mutantsetes streptokokkides. Muidugi tuleb selliseid andmeid hoolikalt kontrollida, kuid olgu öeldud, võib kindlalt öelda, et bakterite väikeste RNA-de uurimine pakub palju üllatusi.
Tänusõnad
Algsed ideed ja kompositsiooniline kujundus nii pealkirjapildi kui ka pildi 4 loomisel kuuluvad SFedU Iarchi Instituudi lõpetanud E. A. Kopaevale. Joonise 2 olemasolu artiklis on osakonna dotsendi teene. Zooloogia SFedU G.B. Bakhtadze. Ta viis läbi ka pealkirja ja joonise 4 teadusliku korrektuuri ja revideerimise. Autor avaldab neile sügavat tänu nende kannatlikkuse ja loova lähenemise eest asjale. Eriline tänu minu kolleegile vanemteadurile lab. Rostovi katkuvastase instituudi mikroobide biokeemia V. M. Sorokin artikli teksti ja avaldatud väärtuslike kommentaaride arutamiseks.
Kirjandus
- Karl Woese (1928–2012) ;;; 80 , 1148-1154;
- R. R. Breaker. (2012). Riboslülitid ja RNA maailm. Külma kevade sadama perspektiivid bioloogias. 4 , a003566-a003566;
- J. Patrick Bardill, Brian K. Hammer. (2012). Mittekodeerivad sRNA-d reguleerivad bakteri patogeeni Vibrio cholerae virulentsust. RNA bioloogia. 9 , 392-401;
- Heon-Jin Lee, Su-Hyung Hong. (2012). Streptococcus mutans mikroRNA suurusega väikeste RNA-de analüüs sügava sekveneerimise abil. FEMS mikrobiol Lett. 326 , 131-136;
- M.-P. Caron, L. Bastet, A. Lussier, M. Simoneau-Roy, E. Masse, D. A. Lafontaine. (2012). Translatsiooni initsieerimise ja mRNA lagunemise kahepoolse toimega riboswitch-juhtimine. Riikliku Teaduste Akadeemia toimetised. 109 , E3444-E3453.
), takistades ribosoomidel asuva mRNA translatsiooni selle kodeeritavaks valguks. Lõppkokkuvõttes on väikeste segavate RNA-de mõju identne sellega, kui geeniekspressioon lihtsalt väheneb.
Väikesed segavad RNA-d avastasid 1999. aastal Ühendkuningriigis David Baulcombe'i rühmad taimede transkriptsioonijärgse geenide summutamise süsteemi komponendina. PTGS, en: transkriptsioonijärgne geeni vaigistamine). Rühm avaldas leiud ajakirjas Science.
Kaheahelalised RNA-d võivad suurendada geeniekspressiooni mehhanismi abil, mida nimetatakse RNA-st sõltuvaks geeni aktiveerimiseks (eng. RNAa, väike RNA poolt indutseeritud geeni aktiveerimine). On näidatud, et kaheahelalised RNA-d, mis on komplementaarsed sihtgeenide promootoritega, põhjustavad vastavate geenide aktiveerimise. Inimese rakkudes on näidatud RNA-st sõltuvat aktiveerimist sünteetiliste kaheahelaliste RNA-de sisseviimisega. Pole teada, kas sarnane süsteem eksisteerib ka teiste organismide rakkudes.
Kui väikestel segavatel RNA-del põhinevad RNA-häiringud võimaldavad põhimõtteliselt ükskõik millise geeni välja lülitada, on see põhjustanud tohutut huvi põhi- ja rakendusbioloogia vastu. Biokeemiliste radade oluliste geenide tuvastamiseks tehtavate suuremahuliste RNA-häirete testide arv kasvab pidevalt. Kuna haiguse progresseerumist juhib ka geenitegevus, võib eeldada, et mõnel juhul võib geeni seiskamine väikese segava RNA-ga avaldada ravitoimet.
Väikestel segavatel RNA-del põhinevate RNA-häirete rakendamine loomadele ja eriti inimestele on aga silmitsi paljude raskustega. Katsed on näidanud, et väikeste segavate RNA-de efektiivsus on erinevat tüüpi rakkude puhul erinev: mõned rakud reageerivad väikeste segavate RNA-de mõjule kergesti ja näitavad geeniekspressiooni langust, samas kui teistes seda hoolimata tõhusast transfektsioonist ei täheldata. Selle nähtuse põhjused on siiani halvasti mõistetavad.
Kahe esimese RNA interferentsi mehhanismi mõjutavate (makuladegeneratsiooni raviks mõeldud) terapeutiliste ravimite uuringute esimese etapi tulemused, mis avaldati 2005. aasta lõpus, näitavad, et patsiendid taluvad väikestel segavatel RNA-del põhinevaid ravimeid kergesti ja neil on vastuvõetavad farmakokineetilised omadused.
Ebola viirusele suunatud väikeste segavate RNA-de esialgsed kliinilised uuringud näitavad, et need võivad olla tõhusad haiguse kokkupuutejärgseks profülaktikaks. See ravim võimaldas tervel katselistel primaatidel, kes said surmavat annust Zaire'i Ebolaviirust, ellu jääda
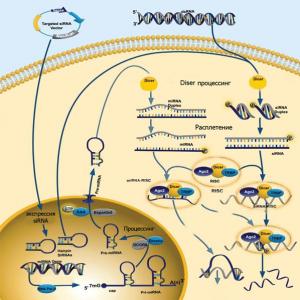
Sihtmärk-mRNA hävitamine võib toimuda ka väikese segava RNA (siRNA) mõjul. RNA sekkumine on üks uusi revolutsioonilisi avastusi molekulaarbioloogias ja selle autorid said selle eest 2002. aastal Nobeli preemia. Häirivad RNA-d on erinevat tüüpi RNA-st erineva struktuuriga ja on kaks komplementaarset RNA-molekuli, umbes 21–28 lämmastiku alust, mis on üksteisega ühendatud nagu DNA molekulis olevad ahelad. Sel juhul jäävad siRNA ahelate servadesse alati kaks paarita nukleotiidi. Mõju teostatakse järgmiselt. Kui siRNA molekul on raku sees, seob see kõigepealt kompleksi kahe rakusisese ensüümiga - helikaasi ja nukleaasiga. See kompleks sai nime RISC ( RNA- induced silencing complex; vaikus - eng. ole vait, ole vait; vaigistamine - vaikus, kuna inglise keeles ja erikirjanduses nimetatakse geeni "väljalülitamise" protsessi). Järgmisena keerab helikaas lahti ja eraldab siRNA ahelad ning üks nukleaasiga kompleksis olevatest ahelatest (struktuurilt antisenss) interakteerub spetsiifiliselt sihtmärgi mRNA komplementaarses (rangelt vastavas) piirkonnas, mis võimaldab nukleaasil lõigata selle kaheks osaks. MRNA lõigatud lõigud puutuvad täiendavalt kokku teiste rakuliste RNA nukleaaside toimel, mis lõikavad need veelgi väiksemateks tükkideks.
Taimedes ja madalamates loomsetes organismides (putukates) leiduvad siRNA-d on oluline lüli omamoodi "rakusiseses immuunsuses", mis võimaldab teil võõrast RNA-d ära tunda ja kiiresti hävitada. Juhul, kui RNA-d sisaldav viirus tungib rakku, takistab selline kaitsesüsteem selle paljunemist. Kui viirus sisaldab DNA-d, takistab siRNA süsteem sellel viirusvalkude tootmist (kuna selleks vajalik mRNA tunneb ära ja lõigatakse ära) ning selle strateegia kasutamine aeglustab selle levikut kogu kehas. Leiti, et siRNA süsteem on äärmiselt loetav: iga siRNA tunneb ära ja hävitab ainult oma spetsiifilise mRNA. Ainult ühe nukleotiidi asendamine siRNA-s põhjustab häirete mõju dramaatilist vähenemist. Ühelgi seni teadaoleval geeniblokaatoril pole oma sihtgeeni suhtes seda erandlikku spetsiifilisust.
Praegu kasutatakse seda meetodit peamiselt teaduslikes uuringutes erinevate rakuvalkude funktsioonide tuvastamiseks. Kuid seda saab potentsiaalselt kasutada ka ravimite loomiseks.
RNA-häirete avastamine on andnud uut lootust võitluses AIDSi ja vähi vastu. On võimalik, et siRNA-ravi kasutamisel koos tavapäraste viiruse- ja vähivastaste teraapiatega on võimalik saavutada tugevdav efekt, kui need kaks toimet annavad teravama efekti, kui nende kummagi eraldi rakendatav lihtne summa.
SiRNA häiremehhanismi kasutamiseks imetajarakkudes terapeutilistel eesmärkidel tuleb rakkudesse viia valmis kaheahelalised siRNA molekulid. Siiski on mitmeid probleeme, mis praegu seda praktikas ei võimalda, ja veelgi enam, mingite ravimvormide loomiseks. Esiteks mõjutab keha esimene kaitsekeha neil veres, ensüümides - nukleaasidmis lõikavad meie keha jaoks topelt-RNA ahelad potentsiaalselt ohtlikuks ja ebatavaliseks. Teiseks, hoolimata nende nimest, on väikesed RNA-d endiselt üsna pikad ja mis kõige tähtsam - nad kannavad negatiivset elektrostaatilist laengu, mis muudab nende passiivse tungimise raku võimatuks. Ja kolmandaks, üks olulisemaid küsimusi on see, kuidas panna siRNA toimima (või tungima) ainult teatud ("haigetes") rakkudes, mõjutamata seejuures terveid? Ja lõpuks suuruse probleem. Selliste sünteetiliste siRNA-de optimaalne suurus on samad 21–28 nukleotiidi. Kui suurendate selle pikkust, reageerivad rakud interferooni tootmisega ja valkude sünteesi vähendamisega. Teisest küljest, kui proovida kasutada siRNA-sid, mis on väiksemad kui 21 nukleotiidi, väheneb järsult selle soovitud mRNA-ga seondumise spetsiifilisus ja võime moodustada RISC kompleksi. Tuleb märkida, et nende probleemide ületamine on kriitilise tähtsusega mitte ainult siRNA-ravi, vaid ka geeniteraapia jaoks üldiselt.
Nende lahendamisel on juba tehtud teatavaid edusamme. Näiteks üritavad teadlased siRNA molekule rohkem teha lipofiilsed, see tähendab, et nad võivad lahustuda rasvades, mis moodustavad rakumembraani, ja hõlbustada seeläbi siRNA tungimist rakku. Ja selleks, et tagada töö spetsiifilisus ainult teatud kudedes, lisavad geenitehnoloogid oma struktuuridesse spetsiaalsed regulatoorsed piirkonnad, mis on aktiveeritud, ja hakkavad sellises struktuuris sisalduvat teavet (ja seetõttu siRNA-d, kui see sinna kuulub) lugema, ainult teatud rakkudes kangad.
Näiteks on California ülikooli San Diego meditsiinikooli (California ülikool, San Diego meditsiinikool) teadlased välja töötanud uue efektiivse manustamissüsteemi väikeste segavate RNA-de (siRNA-de) jaoks, mis pärsivad teatud valkude tootmist, rakkudesse. Sellest süsteemist peaks saama tehnoloogia, mis võimaldab ravimit eri tüüpi vähktõbe spetsiifiliselt tarnida, alus. “Väikestel segavatel RNA-del, mis viivad läbi niinimetatud RNA-häirete protsessi, on uskumatu potentsiaal vähi raviks,” selgitab uuringut juhtinud professor Steven Dowdy: “ja kuigi meil on veel palju teha, oleme välja töötanud tehnoloogia ravimite tarnimine rakupopulatsioonile - nii primaarne kasvaja kui ka metastaasid, kahjustamata terveid rakke ”.
Aastaid on Dowdy ja tema kolleegid uurinud väikeste segavate RNA-de vähivastast potentsiaali. Tavalised siRNA-d on siiski pisikesed, negatiivselt laetud molekulid, mida nende omaduste tõttu on rakusse äärmiselt raske toimetada. Selle saavutamiseks kasutasid teadlased lühikest signaalvalku PTD (peptiidi transduktsiooni domeen). Varem loodi selle kasutamisel üle 50 „liitvalgu”, milles PTD ühendati kasvaja supressorvalkudega.
SiRNA ja PTD lihtne kombinatsioon ei vii aga RNA kohaletoimetamiseni rakusse: siRNA-d on negatiivselt laetud, PTD-d on positiivselt laetud, mille tulemusel moodustub tihe RNA-valgu konglomeraat, mida ei transpordita läbi rakumembraani. Seetõttu ühendasid teadlased PTD esmalt valgu RNA-d siduva domeeniga, mis neutraliseeris siRNA negatiivse laengu (tulemuseks oli sulandvalk, mida nimetatakse PTD-DRBD). Selline RNA-valgu kompleks läbib juba hõlpsalt rakumembraani ja siseneb raku tsütoplasmasse, kus see pärsib spetsiifiliselt tuumori kasvu aktiveerivate valkude Messenger RNA-sid.
PTD-DRBD sulandvalgu võime määramiseks siRNA rakkudesse toimetada kasutasid teadlased inimese kopsuvähist tuletatud rakuliini. Pärast rakkude töötlemist PTD-DRBD-siRNA-ga leiti, et tuumorirakud on siRNA suhtes kõige vastuvõtlikumad, samas kui normaalsetes rakkudes (kontrollina kasutati T-rakke, endoteelirakke ja embrüonaalseid tüvirakke), kus ei suurenenud onkogeensete rakkude tootmine valke, toksilisi toimeid ei täheldatud.
Selle meetodi abil saab teha erinevaid modifikatsioone, kasutades erinevaid siRNA-sid erinevate kasvajavalkude - mitte ainult üleprodukteeritud, vaid ka mutantide - supresseerimiseks. Teraapiat on võimalik muuta ka korduvate kasvajate korral, mis muutuvad uute mutatsioonide tõttu tavaliselt keemiaravi ravimite suhtes resistentseks.
Onkoloogilised haigused on väga erinevad ja tuumorirakkude valkude molekulaarsed omadused on iga patsiendi jaoks individuaalsed. Töö autorid usuvad, et selles olukorras on ratsionaalseim lähenemisviis väikeste segavate RNA-de kasutamine.
Teadlaste arvates on väikeste RNA-de vale ekspressioon paljude haiguste põhjustaja, mis mõjutab väga tõsiselt paljude inimeste tervist kogu maailmas. Selliste haiguste hulka kuuluvad kardiovaskulaarsed 23 ja onkoloogilised 24. Viimase osas pole see üllatav: vähk annab tunnistust rakkude arengu ja nende saatuse hälvetest ning väikestel RNA-del on vastavates protsessides oluline roll. Siin on üks kõige paljastavamaid näiteid tohutu mõju kohta, mida väikesed RNA-d avaldavad vähile kehale. Me räägime pahaloomulisest kasvajast, mida iseloomustab nende geenide vale ekspressioon, mis toimivad organismi esialgse arengu ajal, mitte postnataalsel perioodil. See on lapseea ajukasvaja tüüp, mis ilmneb tavaliselt enne kaheaastast vanust. Paraku on see väga agressiivne vähivorm ja isegi intensiivse ravi korral on prognoos kehv. Onkoloogiline protsess areneb ajurakkudes geneetilise materjali väära ümberjaotamise tagajärjel. Promootor, mis tavaliselt põhjustab ühe valke kodeeriva geeni tugevat ekspressiooni, rekombineeritakse spetsiifilise väikese RNA-klastriga. Siis võimendatakse kogu seda ümberkorraldatud piirkonda: teisisõnu luuakse sellest genoomis palju koopiaid. Järelikult ekspresseerunud promootorist “allavoolu” asuvad väikesed RNA-d ekspresseeritakse palju tugevamalt kui peaks. Aktiivsete väikeste RNA-de sisaldus on normaalsest umbes 150-1000 korda suurem.
Joon. 18,3. Alkoholi aktiveeritud väikesed RNA-d võivad seostuda Messenger RNA-dega, mis ei mõjuta keha vastupidavust alkoholile. Kuid need väikesed RNA-d ei seostu Messenger-RNA molekulidega, mis soodustavad seda resistentsust. See viib alkoholi resistentsusega seotud valgu variatsioone kodeerivate Messenger RNA molekulide osakaalu suhtelise ülekaalu saavutamiseni.
See klaster kodeerib üle 40 erineva väikese RNA. Tegelikult on see tavaliselt primaatide hulgas saadaolevatest klastritest suurim. Tavaliselt avaldub see ainult inimarengu varases staadiumis, embrüo esimese 8 nädala jooksul. Selle tugev aktiveerimine imiku ajus põhjustab katastroofilist mõju geneetilisele ekspressioonile. Üks tagajärgi on epigeneetilise valgu ekspressioon, mis lisab DNA-le modifikatsioone. See toob kaasa ulatuslikud muutused kogu DNA metüleerimise mustris ja seega igasuguste geenide ebanormaalse ekspressiooni, millest paljud peavad ekspresseeruma alles siis, kui ebaküpsed ajurakud jagunevad keha arengu varases staadiumis. Nii algab vähkkasvajaprogramm 25 lapse rakkudes.
Niisugusel suhtlemisel väikeste RNA-de ja raku epigeneetilise aparatuuri vahel võib olla oluline mõju muudele olukordadele, kui rakkudes areneb eelsoodumus vähi tekkeks. See mehhanism viib tõenäoliselt selleni, et väikeste RNA-de häiritud ekspressiooni mõju suurendab emigeneetiliste modifikatsioonide muutmine, mis edastatakse emalt tütarrakkudele. Nii saab moodustada geeniekspressiooni olemuse potentsiaalselt ohtlike muutuste skeemi.
Siiani pole teadlased välja mõelnud väikeste RNA-de integreerimise kõiki etappe epigeneetiliste protsessidega, kuid siiski õnnestub neil toimuva kohta saada mõned näpunäited. Näiteks selgus, et teatud rinnavähi agressiivsust suurendav väikeste RNA-de klass on suunatud Messengeri RNA-de teatud ensüümidele, mis eemaldavad peamised epigeneetilised modifikatsioonid. See muudab vähiraku epigeneetiliste modifikatsioonide mustrit ja häirib veelgi geneetilist ekspressiooni 26.
Paljud vähivormid on patsiendil raskesti jälgitavad. Onkoloogilised protsessid võivad toimuda raskesti ligipääsetavates kohtades, mis raskendab proovivõtu protseduuri. Sellistel juhtudel on arstil keeruline jälgida vähiprotsessi arengut ja ravivastust. Sageli on arstid sunnitud lootma kaudsetele mõõtmistele - näiteks kasvaja tomograafilisele skaneerimisele. Mõned teadlased usuvad, et väikesed RNA molekulid võivad aidata luua uue meetodi kasvaja arengu jälgimiseks, mis võimaldab uurida ka selle päritolu. Kui vähirakud surevad, lahkuvad väikesed RNA-d rakkudest, kui nad rebenevad. Need väikesed rämpsmolekulid moodustavad sageli rakuvalkudega komplekse või on mähitud rakumembraanide fragmentidesse. Seetõttu on nad kehavedelikes väga stabiilsed, mis tähendab, et sellist RNA-d saab eraldada ja analüüsida. Kuna nende arv on väike, peavad teadlased kasutama ülitundlikke analüütilisi meetodeid. Siin pole aga midagi võimatut: nukleiinhapete järjestamise tundlikkus suureneb pidevalt 27. Avaldatud andmed, mis kinnitavad selle lähenemisviisi lubadusi seoses rinnavähi 28, munasarjavähi 29 ja paljude teiste vähivormidega. Kopsuvähiga patsientide väikeste ringlevate RNA-de analüüs näitas, et need RNA-d aitavad eristada patsiente, kellel on üks kopsusõlm (ravi ei vaja), ja patsiente, kellel tekivad pahaloomulised kasvaja sõlmed (vajavad ravi) 30.