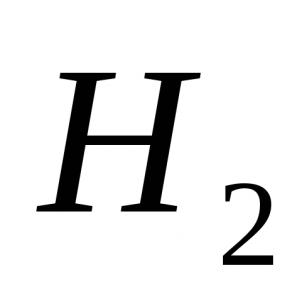Test »Dušik in njegove spojine. Tema: Dušik in njegove spojine (Testiranje) test iz kemije (9. razred) na temo Test na temo dušik in njegove spojine
Test "Dušik in njegove spojine"
1. možnost 1. Najmočnejša molekula a) H2; b) F 2 ; c) O2; d) N 2 . 2. Barva fenolftaleina v raztopini amoniaka: a) škrlatna; b) zelena; c) rumena; d) modra. 3. Oksidacijsko stanje je +3 pri atomu dušika v spojini: a) NH 4 NO 3; b) NaNO3; c) NO 2; d) KNO 2. 4. Med termično razgradnjo bakrovega (II) nitrata nastanejo:a) bakrov (II) nitrit in O 2 ;b) dušikov oksid(IV) in O 2 ;c) bakrov(II) oksid, rjavi plin ŠT 2 in O2; d) bakrov (II) hidroksid, N 2 in O 2. 5. Kateri ion nastane po mehanizmu darovalec-akceptor? a) NH4+; b) NO 3 - ; c) Cl-; d) SO 4 2–. 6. Določite močne elektrolite: a) dušikova kislina; b) dušikova kislina; c) vodna raztopina amoniaka; d) amonijev nitrat. 7. Med interakcijo se sprošča vodik: a) Zn + HNO 3 (razb.); b) Cu + HCl (raztopina); c) Al + NaOH + H 2 O; d) Zn + H 2 SO 4 (razb.); e) Fe + HNO 3 (konc.). 8. Napišite enačbo za reakcijo cinka z zelo razredčeno dušikovo kislino, če je eden od reakcijskih produktov amonijev nitrat. Določite koeficient pred oksidantom. 9.Poimenujte snovi A, B, C. 2. možnost 1. Z metodo izpodrivanja vode je nemogoče zbrati: a) dušik; b) vodik; c) kisik; d) amoniak. 2. Reagent za amonijev ion je raztopina: a) kalijevega sulfata; b) srebrov nitrat; c) natrijev hidroksid; d) barijev klorid. 3. Pri interakciji s HNO 3 (konc.) plin nastane z bakrenimi ostružki: a) N2O; b) NH3; c) NO 2 ; d) H 2 . 4. Toplotna razgradnja natrijevega nitrata povzroči: a) natrijev oksid, rjavi plin NO 2, O 2; b) natrijev nitrit in O 2; c) natrij, rjavi plin NO 2, O 2; d) natrijev hidroksid, N 2, O 2. 5. Stopnja oksidacije dušika v amonijevem sulfatu: a) -3; b) -1; c) +1; d) +3. 6. S katero od naslednjih snovi reagira koncentrirani HNO? 3 v normalnih pogojih? a) NaOH; b) AgCl; c) Al; d) Fe; e) Cu. 7. Navedite število ionov v skrajšani ionski enačbi za interakcijo natrijevega sulfata in srebrovega nitrata: a) 1; b) 2; v 3; d) 4. 8. Napišite enačbo za interakcijo magnezija z razredčeno dušikovo kislino, če je eden od produktov reakcije preprosta snov. Določite koeficient v enačbi pred oksidantom. 9. Napišite reakcijske enačbe za naslednje transformacije:
Poimenujte snovi A, B, C, D.
Odgovori
1. možnost 1 - G; 2 - a; 3 - G; 4 - v; 5 - a; 6 - a, d; 7 - c, d; 8 – 10,


2Ag + + SO 4 2– = Ag 2 SO 4;
8 – 12, 9. A - NE, B - NO 2, C - HNO 3, D - NH 4 NO 3,
1. možnost.
Kemični znak dušika: a) P b) N c) As d) Ne
Molekula dušika vsebuje: a) dvojno vez b) enojno vez c) trojno vez
Molekulska formula dušika: a) N b) N 2 c) N 3 d) Ne
O fizikalnih lastnostih dušika se ne uporablja : a) plin b) brez vonja c) slabo topen v vodi d) rjav.
Dušik v spojinah ne more pokazati oksidacijskega stanja a) +1 b) -3 c) +6 d) +5
Dušik ne reagira z a) kovinami b) fosforjem c) vodikom d) kisikom
Ko dušik reagira z vodikom, a) nastane fosfin b) dušikov oksid (II) c) metan d) amoniak
Ko dušik reagira s kisikom, a) nastane dušikov oksid (II) b) dušikov oksid (I) c) dušikov oksid (IV) d) dušikov oksid (V)
Spojine dušika s kovinami se imenujejo a) nitriti b) nitridi c) nitrati d) amonijati.
Oksidacijsko stanje dušika v amoniaku a) -3 b) +5 c) +3 d) +2
Katere od lastnosti se ne uporablja na amoniak: a) plin c) slabo topen v vodi c) ima oster vonj d) se pod pritiskom zlahka utekočini
Raztopina amoniaka ima medij: a) kislo b) alkalno c) nevtralno d) rahlo kislo
amoniak ne sodeluje a) s kislinami b) z alkalijami c) z vodo d) s kisikom
Ko zgoreva amoniak, a) nastane dušikov oksid (II) b) voda c) dušik d) dušikov oksid (IV)
Pri katalitski oksidaciji amoniaka poleg vode nastane a) dušikov oksid (II) b) dušikov oksid (IV) c) dušikov oksid (III) d) dušikov oksid (V)
Ko amoniak reagira s klorovodikovo kislino, nastane a) amonijev klorid b) amonijev klorid c) amonijev sulfat d) amonijev nitrat
Amoniak lahko pridobimo v laboratoriju z reakcijo a) amonijeve soli z alkalijo b) amonijeve soli s kislino c) vodika z dušikom d) amonijeve soli z drugimi solmi.
Amoniak se proizvaja v industriji a) amonijeve soli z alkalijo b) amonijeve soli s kislino c) vodik z dušikom d) amonijeve soli z drugimi solmi.
ne more tvorijo soli a) kisle b) srednje c) bazične
Amonijevih soli ni mogoče pridobiti a) z interakcijo amoniaka s kislinami b) z interakcijo raztopine amoniaka s kislinami c) z interakcijo amonijevih soli s kislinami d) z interakcijo amonijevih soli z alkalijo.
Katera reakcija je kvalitativna za amonijeve soli a) interakcija z alkalijo b) interakcija s kislinami c) interakcija z drugimi solmi d) interakcija z vodo.
Znak kvalitativne reakcije na amonijev ion je a) razvoj plina, ki povzroča motnost apnene vode b) razvoj plina z vonjem po amoniaku c) nastajanje bele oborine d) razvoj rjavega plina .
Pri segrevanju amonijevih soli se a) sprosti voda b) razpad s sproščanjem plinov c) izhlapevanje d) sprememba njihove barve.
Pri razgradnji amonijevega nitrata nastaneta: a) dušik in voda b) dušikov oksid (I) in voda c) dušikov oksid (II) in voda d) dušikov oksid (IV) in voda.
dušik ne tvori oksid s formulo a) NO 2 b) NO 3 c) NO d) N 2 O
Kisli oksid ni a) NO 2 b) N 2 O 3 c) N 2 O 5 d) NO
Oksidi, ki ne tvorijo soli, vključujejo a) NO 2 b) N 2 O 3 c) N 2 O 5 d) N 2 O
Dušikova kislina ne vključuje a) tekoče b) enobazične c) močnega oksidanta d) brez vonja
Oksidacijsko stanje dušika v dušikovi kislini a) +3 b) +5 c) +1 d) -3
ni oblikovana
Pri interakciji dušikove kisline s kovinami ne nastane a) voda b) vodik c) dušikov oksid d) sol
Ko koncentrirana dušikova kislina sodeluje s kovinami v napetostnem nizu po vodiku, poleg vode in soli,
Ko razredčena dušikova kislina poleg vode in soli reagira z bakrom,
a) dušikov oksid (II) b) dušikov oksid (I) c) dušikov oksid (IV) d) amoniak.
Dušikova kislina ne reagira z a) žveplovim oksidom (IV) b) natrijevim hidroksidom c) barijevim oksidom d) kalcijevim karbonatom.
Test na temo "Dušik in njegove spojine."
2. možnost.
Kemični znak dušika: a) N b) Nb c) Ar d) S
Molekula dušika vsebuje: a) vodikovo vez b) kovalentno polarno vez c) kovalentno nepolarno vez
Strukturna formula dušika: a) N=N b) N≡ N c) N- N d) :N::: N:
O fizikalnih lastnostih dušika se ne uporablja : a) plin b) ostrega vonja c) slabo topen v vodi d) težji od zraka.
Dušik v zraku po prostornini: a) 50 % b) 65 % c) 78 % d) 85 %
Dušik v spojinah ne more pokazati oksidacijskega stanja a) -1 b) +3 c) +4 d) +5
Dušik pri sobni temperaturi reagira z a) kisikom b) litijem c) vodikom d) natrijem
Ko dušik reagira z vodikom, a) nastane vodikov sulfid b) dušikov oksid (IV) c) amoniak d) dušikov oksid (II)
Med interakcijo dušika s kisikom nastane a) dušikov oksid (II) b) dušikov oksid (I) c) dušikov oksid (IV) d) dušikov oksid (III)
Spojine dušika s kovinami se imenujejo a) nitrati b) nitriti c) nitridi d) amonijeve soli.
Oksidacijsko stanje dušika v amoniaku a) +3 b) +4 c) -3 d) +2
Katere od lastnosti se ne uporablja na amoniak: a) plin c) zelo topen v vodi c) brez vonja d) lažji od zraka
Raztopina amoniaka ima medij: a) kislo b) nevtralno c) alkalno d) šibko alkalno
amoniak ne sodeluje a) s kisikom b) z vodikom c) z vodo d) s kislinami
Pri gorenju amoniaka oblikovana a) dušikov oksid (V) b) dušikov oksid (I) c) dušik d) voda
Pri katalitični oksidaciji amoniaka poleg vode nastane a) dušikov oksid (V) b) dušikov oksid (III) c) dušikov oksid (IV) d) dušikov oksid (II)
Ko amoniak reagira z žveplovo kislino, nastane a) amonijev klorid b) amonijev klorid c) amonijev sulfat d) amonijev nitrat
Amoniak lahko pridobimo v laboratoriju z reakcijo a) amonijevega klorida s kalijevim hidroksidom b) amonijevega sulfata s klorovodikovo kislino c) vodika z dušikom d) amonijevih soli z drugimi s kislinami.
Amoniak se v industriji proizvaja z interakcijo a) vodika z dušikom b) amonijevega klorida z alkalijo c) amonijeve soli s kislino d) amonijeve soli z drugimi solmi.
Pri interakciji s kislinami, amoniakom ne more tvorijo soli a) bazične
b) srednje c) kislo
amonijeve soli ne more dobiti a) interakcija amonijevih soli z alkalijo b) interakcija raztopine amoniaka z alkalijami c) interakcija raztopine amoniaka s kislinami d) interakcija amonijevih soli s kislinami.
Amonijeve soli lahko prepoznamo s pomočjo a) kisline b) alkalije c) druge soli d) vode.
Znak kvalitativne reakcije na amonijev ion je a) razvoj plina z vonjem po amoniaku; nastajanje plina; b) nastajanje plina, ki povzroča motnost apnene vode; c) nastajanje rjavega plina; d) nastajanje plina bela oborina.
Ko se amonijev karbonat segreje ne dogaja
a) sproščanje vode b) ogljikov dioksid c) sproščanje amoniaka d) sproščanje dušikovega oksida (I).
Pri razpadu amonijevega nitrita nastanejo:
a) dušik in voda b) dušikov oksid (I) in voda c) dušikov oksid (II) in voda d) dušikov oksid (IV) in voda.
dušik ne tvori oksid s formulo a) NO 2 b) N 2 O 5 c) NO d) N 2 O 7
Ni kislinski oksid a) NO 2 b) N 2 O 3 c) N 2 O d) N 2 O 5
Oksidi, ki ne tvorijo soli, vključujejo a) NO b) N 2 O 3 c) N 2 O 5 d) NO 2
Dušikova kislina ne vključuje a) tekoče b) dvobazične c) močnega oksidanta d) ki vsebuje kisik
Oksidacijsko stanje dušika v dušikovi kislini a) -3 b) +5 c) +4 d) +3
Ko dušikova kislina na svetlobi razpade oblikovana a) voda b) kisik c) amoniak d) dušikov oksid (IV).
Ko dušikova kislina reagira s kovinami, se ne tvori
a) dušikova spojina b) sol c) voda d) vodik
Pri interakciji koncentrirane dušikove kisline s srebrom poleg vode in soli nastane a) dušikov oksid (I) b) dušikov oksid (IV) c) dušikov oksid (II) d) amoniak.
Ko razredčena dušikova kislina poleg vode in soli reagira s srebrom,
a) dušikov oksid (II) b) dušikov oksid (I) c) dušikov oksid (IV) d) amoniak.
Dušikova kislina ne reagira z a) fosforjevim (V) oksidom b) natrijevim oksidom c) barijevim hidroksidom d) natrijevim karbonatom.
Možnost številka 1.
Naloga številka 1
1. Nima vonja.
2. Ima vonj.
3. Opekline v kisiku.
4. Vzajemno deluje s kislinami in tvori soli.
5. V molekuli med atomi je kovalentna nepolarna vez.
6. V molekuli med atomi je kovalentna polarna vez.
7. Ne gori na zraku.
8. Oksidacijsko stanje dušika -3.
9. Rahlo topen v vodi.
10. Vodna raztopina ima alkalno okolje.
Naloga številka 2
1. N 2 O 3 A) amonijev nitrat
2. NH 3 B) amonijev sulfat
3. NH 4 NO 3 B) dušikov oksid (III)
4. NH 4 HSO 4 D) amonijev hidrosulfat
5. NO 2 D) dušikov oksid (V)
E) dušikov oksid (IV)
G) amoniak
Naloga številka 3
N 2 NO NO 2 HNO 3 NO 2
Vaja№4
C + HNO 3 \u003d CO 2 + NO 2 + H 2 O
Naloga številka 5
NH 4 NE 2 = N 2 O + H 2 O
.
4) Trdni nitrati se vržejo v ogenj, in če ni svetlega utripa, je to nitrat.
Test na temo "DUŠIK IN NJEGOVE SPOJINE".
Možnost številka 2.
Naloga številka 1
Razdelite, katere lastnosti pripadajo dušiku in katere amoniaku? Zapišite podatke s številkami lastnosti v tabelo.
1. Ima oster vonj
2. Zelo topen v vodi.
3. Ne vpliva na zrak.
4. V molekuli med atomi je vez kovalentno polarna.
5. V molekuli med atomi je vez kovalentna nepolarna.
6. Plin brez barve in vonja.
7. Oksidacijsko stanje dušika -3.
8. Vodna raztopina ima alkalno okolje.
9. Daje reakcijo s kisikom med nevihto.
10. Uporablja se v tubah za shranjevanje starih slik.
Naloga številka 2
Ujemite formule in imena snovi.
1. N 2 O 5 A) amonijev sulfat
2. NE B) amonijev karbonat
3. (NH 4) 2 SO 4 B) dušikov oksid (II)
4. NH 4 H CO 3 D) amonijev bikarbonat
5.N 2 O D) dušikov oksid (V)
E) dušikov oksid (I)
G) amonijev hidrosulfat
Naloga številka 3
Napišite reakcijske enačbe za naslednje transformacije.
NO NO 2 HNO 3 NaNO 3 NaNO 2
Vaja№4
Koeficiente razporedite z metodo elektronskega ravnotežja, navedite oksidant in redukcijsko sredstvo.
S + HNO 3 \u003d H 2 SO 4 + NO 2 + H 2 O
Naloga številka 5
V tem besedilu poiščite 4 napake, napake zapišite. Nato ga pravilno zapišite zraven.
1) Pri segrevanju se nitrati razgradijo. Reakcija razgradnje nitratov različnih kovin poteka na enak način.
2) Samo proces toplotne razgradnje amonijevega nitrata poteka na svojstven način:
NH 4 NE 2 = N 2 O + H 2 O
3) Raztopine nitratov določimo z bakrom brez segrevanja.
4) Trdni nitrati se vržejo v ogenj, in če ni svetlega utripa, je to nitrat.