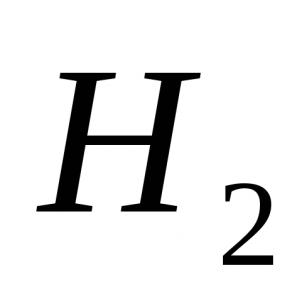Železove soli 3 barve. Kemijske lastnosti železa in njegovih spojin, njihova uporaba
Formula:
Železov(II) sulfat, železov sulfat, FeSO 4 - sol žveplove kisline in 2-valentnega železa. Trdota - 2.
V kemiji se železov sulfat imenuje kristalni hidrat železov(II) sulfat. Svetlo zeleni kristali. Uporablja se v tekstilni industriji, v kmetijstvu kot insekticid, za pripravo mineralnih barv.
Naravni analog - mineral melanterit; v naravi se pojavlja v kristalih monoklinoedričnega sistema, zeleno-rumene barve, v obliki razmazov ali prog.
Molarna masa: 151,91 g/mol
gostota: 1,8-1,9 g/cm³
Temperatura taljenja: 400°C
Topnost v vodi: 25,6 g/100 ml
Sulfat 2-valentnega železa se sprošča pri temperaturah od 1,82 °C do 56,8 °C iz vodnih raztopin v obliki svetlo zelenih kristalov FeSO 4 7H 2 O, v tehnologiji se imenuje železov sulfat (kristalni hidrat). V 100 g vode se raztopi: 26,6 g brezvodnega FeSO 4 pri 20 °C in 54,4 g pri 56 °C.
Raztopine sulfata 2-valentnega železa pod vplivom atmosferskega kisika sčasoma oksidirajo in se spremenijo v železov (III) sulfat:
12FeSO 4 + O 2 + 6H 2 O \u003d 4Fe 2 (SO 4) 3 + 4Fe (OH) 3 ↓
Ko se segreje nad 480 °C, se razgradi:
2FeSO 4 → Fe 2 O 3 + SO 2 + SO 3
Potrdilo o prejemu.
Železov vitriol lahko pripravimo z delovanjem razredčene žveplove kisline na odpadno železo, odrezke strešnega železa itd. V industriji ga dobimo kot stranski produkt, ko železo pločevino, žico ipd. jedkamo z razredčenim H 2 SO 4 na odstranite lestvico.
Fe + H 2 SO 4 \u003d FeSO 4 + H 2
Drug način je oksidativno praženje pirita:
2FeS 2 + 7O 2 + 2H 2 O \u003d 2FeSO 4 + 2H 2 SO 4
Kvalitativna analiza.
Analitične reakcije za železov kation (II).
1. S kalijevim heksacianoferatom (III) K 3 s tvorbo temno modre oborine kalijevega železovega(II) heksacianoferata(III) (»turnbull blue«), netopen v kislinah, ki se z alkalijami razgradi v Fe(OH) 3 (HF).
FeSO 4 + K 3 KFe + K 2 SO 4
Optimalna pH vrednost za reakcijo je 2-3. Reakcija je delna, zelo občutljiva. Motijo visoke koncentracije Fe 3+.
2. Z amonijevim sulfidom (NH 4 ) 2 S s tvorbo črne oborine, topne v močnih kislinah (HF).
FeSO 4
+ (NH 4) 2 S  FeS + (NH 4) 2 SO 4
FeS + (NH 4) 2 SO 4
3.2. Analitične reakcije za sulfatne ione.
1. S skupinskim reagentom BaCl 2 + CaCl 2 ali BaCl 2 (HF).
Frakcijsko odpiranje sulfatnega iona se izvede v kislem okolju, ki odpravi moteči učinek CO 3 2-, PO 4 3- itd., in s prevretjem preskusne raztopine s 6 mol / dm 3 HCl odstranimo S 2 -, SO 3 2 -, S 2 O 3 2- -ioni, ki lahko tvorijo elementarno žveplo, katerega oborino lahko vzamemo kot oborino BaSO 4 . Oborina BaSO 4 lahko tvori izomorfne kristale s KMnO 4 in postane rožnata (specifičnost reakcije se poveča).
Metodologija izvajanje reakcije v prisotnosti 0,002 mol/dm 3 KMnO 4 .
3-5 kapljicam preskusne raztopine dodamo enake količine raztopin kalijevega permanganata, barijevega klorida in klorovodikove kisline ter močno mešamo 2-3 minute. Pustimo, da se usede in, ne da bi ločili oborino od raztopine, dodamo 1-2 kapljici 3 % raztopine H 2 O 2 , premešamo in centrifugiramo. Oborina naj ostane rožnate barve, raztopina nad oboro pa naj postane brezbarvna.
2. S svinčevim acetatom.
TAKO 4
2-
+Pb2+  PbSO 4
PbSO 4
Metodologija : k 2 cm 3 raztopine sulfata dodamo 0,5 cm 3 razredčene klorovodikove kisline in 0,5 cm 3 raztopine svinčevega acetata; nastane bela oborina, topna v nasičeni raztopini amonijevega acetata ali natrijevega hidroksida.
PbSO 4 + 4 NaOH  Na 2 + Na 2 SO 4
Na 2 + Na 2 SO 4
S stroncijevimi solmi - tvorba bele oborine, netopne v kislinah (za razliko od sulfitov).
TAKO 4
2
-+Sr2+  SrSO 4
SrSO 4
Metodologija : K 4-5 kapljicam analizirane raztopine dodamo 4-5 kapljic koncentrirane raztopine stroncijevega klorida, nastane bela oborina.
S kalcijevimi solmi - tvorba igličastih kristalov mavca CaSO 4 2H 2 O.
SO 4 2- + Ca 2+ + 2H 2 O
 CaSO 4 2H 2 O
CaSO 4 2H 2 O
Metodologija: Kapljico analizirane raztopine in kalcijevih soli damo na stekelce, rahlo posušimo. Nastale kristale pregledamo pod mikroskopom.
Kvantitativna analiza.
Permanganatometrija.
Določanje masnega deleža železa v vzorcu Mohrove soli (NH 4) 2 Fe (SO 4) 2 6H 2 O s permanganometrično metodo
(možnost neposredne titracije)
Opredelitev temelji na oksidaciji železa(II) s kalijevim permanganatom v železo(III).
10 FeSO 4 + 2 KMnO 4 + 8H 2 TAKO 4 = 5 Fe 2 (TAKO 4 ) 3 + 2 MnSO 4 + K 2 TAKO 4 + 8H 2 O
M (Fe) = 55,85 g/mol
Metodologija: Natančna teža Mohrove soli, potrebna za pripravo 100 cm 3 0,1 M raztopine Mohrove soli, se kvantitativno prenese v merilno bučko s prostornino 100 cm 3, raztopljeno v majhni količini destilirane vode, po končanem raztapljanje, dovedeno do oznake z vodo, premešano. Alikvot dobljene raztopine (individualna naloga) damo v titracijsko bučko, dodamo enako količino razredčene žveplove kisline (1:5) in počasi titriramo z raztopino kalijevega permanganata, dokler se raztopina ne umiri rahlo rožnate barve. za 30 sekund.
Aplikacija.
Uporablja se v proizvodnji črnilo;
V poslovanju z barvili (za barvanje volna v črni barvi)
Za ohranjanje dreves.
Bibliografija.
- Zaporedna številka - 26.
- Obdobje je četrto veliko.
- Osma skupina, sekundarna podskupina.
- Atomska teža je 55,847.
- Strukturo zunanje elektronske lupine označujemo s formulo 3d 6 4s 2 .
- - Fe.
- Ime je železo, branje v formuli je "ferrum".
- V naravi obstajajo štirje stabilni izotopi obravnavanega elementa z masnimi številkami 54, 56, 57, 58.
- tališče - 1539 0 С;
- vrenje - 2862 0 С;
- aktivnost - povprečna;
- ognjevzdržnost - visoka;
- ima izrazite magnetne lastnosti.
- kisline;
- kisik (vključno z zrakom);
- siva;
- halogeni;
- pri segrevanju - z dušikom, fosforjem, ogljikom in silicijem;
- s solmi manj aktivnih kovin, ki jih reducirajo na preproste snovi;
- z ostro vodno paro;
- z železovimi solmi v oksidacijskem stanju +3.
- Jedra zemeljskih planetov - 90%.
- V zemeljski skorji - 5%.
- V Zemljinem plašču - 12%.
- V zemeljskem jedru - 86%.
- V rečni vodi - 2 mg/l.
- V morju in oceanu - 0,02 mg / l.
- magnetit;
- limonit ali rjava železova ruda;
- vivianit;
- pirotit;
- pirit;
- siderit;
- markazit;
- lellingit;
- mispikel;
- milanterit in drugi.
- lito železo;
- postati.
- oksid;
- hidroksid;
- binarne spojine;
- kompleksne soli;
- kompleksne spojine.
- železov(II) oksid.Črni prah, netopen v vodi. Narava povezave je osnovna. Lahko hitro oksidira, lahko pa ga tudi enostavno reduciramo v preprosto snov. Raztaplja se v kislinah in tvori ustrezne soli. Formula - FeO.
- železov(II) hidroksid. Je bela amorfna oborina. Nastane z reakcijo soli z bazami (alkalijami). Pokaže šibke osnovne lastnosti, lahko hitro oksidira na zraku v železove spojine +3. Formula - Fe (OH) 2.
- Soli elementa v določenem oksidacijskem stanju. Praviloma imajo bledo zeleno barvo raztopine, dobro oksidirajo tudi na zraku, pridobivajo in se spreminjajo v železove soli 3. V vodi se raztopijo. Primeri spojin: FeCL 2 , FeSO 4 , Fe(NO 3) 2 .

Med označenimi snovmi je več spojin praktičnega pomena. Prvič, (II). To je glavni dobavitelj ionov za človeško telo z anemijo. Ko se pri bolniku diagnosticira takšna bolezen, se mu predpišejo kompleksni pripravki, ki temeljijo na zadevni spojini. Tako se napolni pomanjkanje železa v telesu.
Drugič, železov (II) sulfat se skupaj z bakrom uporablja za uničenje kmetijskih škodljivcev v pridelkih. Metoda dokazuje svojo učinkovitost že več kot ducat let, zato jo vrtnarji in vrtnarji zelo cenijo.
Mora sol
To je spojina, ki je kristalinični hidrat železa in amonijevega sulfata. Njegova formula je zapisana kot FeSO 4 * (NH 4) 2 SO 4 * 6H 2 O. Ena izmed železovih (II) spojin, ki se v praksi pogosto uporablja. Glavna področja človeške uporabe so naslednja.
- Farmacevtika.
- Znanstvene raziskave in laboratorijske titrimetrične analize (za določitev vsebnosti kroma, kalijevega permanganata, vanadija).
- Zdravilo - kot dodatek k hrani s pomanjkanjem železa v telesu bolnika.
- Za impregnacijo lesenih izdelkov, saj Mora sol ščiti pred procesi gnilobe.
Obstajajo tudi druga področja, na katerih se ta snov uporablja. Ime je dobil po nemškem kemiku, ki je prvi odkril manifestirane lastnosti.
Snovi z oksidacijskim stanjem železa (III)
Lastnosti železovih spojin, v katerih ima oksidacijsko stanje +3, so nekoliko drugačne od zgoraj obravnavanih. Tako narava ustreznega oksida in hidroksida ni več bazična, ampak izrazito amfoterna. Podajamo opis glavnih snovi.

Med navedenimi primeri je s praktičnega vidika pomemben kristalni hidrat, kot je FeCL 3 * 6H 2 O, ali železov (III) klorid heksahidrat. V medicini se uporablja za zaustavitev krvavitev in napolnitev železovih ionov v telesu z anemijo.
Železov(III) sulfat pentahidrat se uporablja za čiščenje pitne vode, saj deluje kot koagulant.
Železove(VI) spojine
Formule kemičnih spojin železa, kjer ima posebno oksidacijsko stanje +6, lahko zapišemo takole:
- K 2 FeO 4 ;
- Na2FeO4;
- MgFeO 4 in drugi.
Vsi imajo skupno ime - ferati - in imajo podobne lastnosti (močna redukcijska sredstva). Prav tako so sposobni razkužiti in imajo baktericidni učinek. To jim omogoča uporabo za čiščenje pitne vode v industrijskem obsegu.
Kompleksne spojine
Posebne snovi so zelo pomembne v analitični kemiji in ne samo. Tisti, ki nastanejo v vodnih raztopinah soli. To so kompleksne spojine železa. Najbolj priljubljeni in dobro raziskani med njimi so naslednji.
- Kalijev heksacianoferat (II) K 4 . Drugo ime za spojino je rumena krvna sol. Uporablja se za kvalitativno določanje železovega iona Fe 3+ v raztopini. Zaradi izpostavljenosti raztopina pridobi lepo svetlo modro barvo, saj nastane še en kompleks - prusko modra KFe 3+. Že od antičnih časov se uporablja kot
- Kalijev heksacianoferat (III) K 3 . Drugo ime je rdeča krvna sol. Uporablja se kot kvalitativni reagent za določanje železovih ionov Fe 2+. Posledično nastane modra oborina, ki se imenuje Turnbull blue. Uporablja se tudi kot barvilo za tkanine.

Železo v organskih snoveh
Železo in njegove spojine so, kot smo že videli, velikega praktičnega pomena v gospodarskem življenju človeka. Vendar poleg tega njegova biološka vloga v telesu ni nič manj velika, nasprotno.
Obstaja ena zelo pomembna beljakovina, ki vključuje ta element. To je hemoglobin. Zahvaljujoč njemu se prenaša kisik in poteka enakomerna in pravočasna izmenjava plinov. Zato je vloga železa v vitalnem procesu - dihanju - preprosto ogromna.

Skupno človeško telo vsebuje približno 4 grame železa, ki ga je treba nenehno dopolnjevati z zaužito hrano.
- Kemične formule je treba vnesti z razlikovanjem med velikimi in malimi črkami
- Indeksi se vnesejo kot običajne številke
- Pika na srednji črti (znak množenja), ki se uporablja na primer v formulah kristalnih hidratov, se nadomesti z običajno piko.
- Primer: namesto CuSO₄ 5H₂O pretvornik za lažji vnos uporablja črkovanje CuSO4.5H2O.
- sol (natrijev klorid) NaCl
- sladkor (saharoza) C₁₂H₂₂O₁₁
- kis (raztopina ocetne kisline) CH₃COOH
- določiti atomske mase elementov po periodnem sistemu;
- določi število atomov vsakega elementa v formuli spojine;
- določite molsko maso tako, da seštejete atomske mase elementov, vključenih v spojino, pomnožene z njihovim številom.
- dva ogljikova atoma
- štirje atomi vodika
- dva atoma kisika
- ogljik C = 2 × 12,0107 g/mol = 24,0214 g/mol
- vodik H = 4 × 1,00794 g/mol = 4,03176 g/mol
- kisik O = 2 × 15,9994 g/mol = 31,9988 g/mol
- molska masa = 24,0214 + 4,03176 + 31,9988 = 60,05196 g/mol
Lurie Yu.Yu. Priročnik za analitično kemijo. Moskva, 1972;
Smernica "Instrumentalne metode analize", Perm, 2004;
Smernica "Kvalitativna kemijska analiza", Perm, 2003;
Smernica "Kvantitativna kemična analiza", Perm, 2004;
Rabinovich V.A., Khavin Z.Ya. Kratka kemijska referenca, Leningrad, 1991;
"Velika sovjetska enciklopedija";
DEFINICIJA
železo- element osme skupine četrtega obdobja periodnega sistema kemičnih elementov D. I. Mendelejeva.
In ohlapna številka je 26. Simbol je Fe (lat. »ferrum«). Ena najpogostejših kovin v zemeljski skorji (drugo mesto za aluminijem).
Fizikalne lastnosti železa
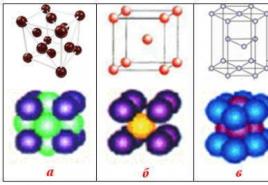
Železo je siva kovina. V svoji čisti obliki je precej mehka, voljna in duktilna. Elektronska konfiguracija zunanjega energijskega nivoja je 3d 6 4s 2 . V svojih spojinah ima železo oksidacijski stanji "+2" in "+3". Tališče železa je 1539C. Železo tvori dve kristalni modifikacije: α- in γ-železo. Prvi od njih ima kubično telesno osredotočeno mrežo, drugi pa kubično, obrazno osredotočen. α-železo je termodinamično stabilno v dveh temperaturnih območjih: pod 912 in od 1394C do tališča. Med 912 in 1394C je γ-železo stabilno.
Mehanske lastnosti železa so odvisne od njegove čistosti - vsebnosti v njem celo zelo majhnih količin drugih elementov. Trdno železo ima sposobnost, da v sebi raztopi številne elemente.
Kemične lastnosti železa
V vlažnem zraku železo hitro zarjavi, t.j. prekrita z rjavo prevleko iz hidratiranega železovega oksida, ki zaradi svoje drobljivosti ne ščiti železa pred nadaljnjo oksidacijo. V vodi železo intenzivno korodira; z obilnim dostopom kisika nastanejo hidratizirane oblike železovega oksida (III):
2Fe + 3/2O 2 + nH 2 O = Fe 2 O 3 × H 2 O.
Ob pomanjkanju kisika ali težkem dostopu nastane mešani oksid (II, III) Fe 3 O 4:
3Fe + 4H 2 O (v) ↔ Fe 3 O 4 + 4H 2.
Železo se raztopi v klorovodikovi kislini katere koli koncentracije:
Fe + 2HCl \u003d FeCl 2 + H 2.
Podobno pride do raztapljanja v razredčeni žveplovi kislini:
Fe + H 2 SO 4 \u003d FeSO 4 + H 2.
V koncentriranih raztopinah žveplove kisline se železo oksidira v železo (III):
2Fe + 6H 2 SO 4 \u003d Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O.
Vendar pa v žveplovi kislini, katere koncentracija je blizu 100%, postane železo pasivno in interakcije praktično ni. V razredčenih in zmerno koncentriranih raztopinah dušikove kisline se železo raztopi:
Fe + 4HNO 3 \u003d Fe (NO 3) 3 + NO + 2H 2 O.
Pri visokih koncentracijah dušikove kisline se raztapljanje upočasni in železo postane pasivno.
Tako kot druge kovine tudi železo reagira s preprostimi snovmi. Reakcije interakcije železa s halogeni (ne glede na vrsto halogena) potekajo pri segrevanju. Interakcija železa z bromom poteka pri povečanem parnem tlaku slednjega:
2Fe + 3Cl 2 \u003d 2FeCl 3;
3Fe + 4I 2 = Fe 3 I 8.
Medsebojno delovanje železa z žveplom (prah), dušikom in fosforjem se pojavi tudi pri segrevanju:
6Fe + N 2 = 2Fe 3 N;
2Fe + P = Fe 2 P;
3Fe + P = Fe 3 P.
Železo lahko reagira z nekovinami, kot sta ogljik in silicij:
3Fe + C = Fe 3 C;
Med reakcijami interakcije železa s kompleksnimi snovmi imajo posebno vlogo naslednje reakcije - železo je sposobno reducirati kovine, ki so v nizu aktivnosti desno od njega, iz raztopin soli (1), do redukcije železa (III) spojine (2):
Fe + CuSO 4 \u003d FeSO 4 + Cu (1);
Fe + 2FeCl 3 = 3FeCl 2 (2).
Železo pri povišanem tlaku reagira z oksidom, ki ne tvori soli – CO in tvori snovi kompleksne sestave – karbonile – Fe (CO) 5, Fe 2 (CO) 9 in Fe 3 (CO) 12.
Železo je v odsotnosti nečistoč stabilno v vodi in v razredčenih alkalijskih raztopinah.
Pridobivanje železa
Glavni način pridobivanja železa je iz železove rude (hematit, magnetit) ali elektroliza raztopin njegovih soli (v tem primeru dobimo "čisto" železo, torej železo brez nečistoč).
Primeri reševanja problemov
PRIMER 1
| Vaja | Železovo tehtnico Fe 3 O 4, ki tehta 10 g, smo najprej obdelali s 150 ml raztopine klorovodikove kisline (gostota 1,1 g/ml) z masnim deležem klorovodika 20 %, nato pa smo dobljeni raztopini dodali presežek železa. Določite sestavo raztopine (v masnih %). |
| Odločitev | Reakcijske enačbe zapišemo glede na pogoj problema: 8HCl + Fe 3 O 4 \u003d FeCl 2 + 2FeCl 3 + 4H 2 O (1); 2FeCl 3 + Fe = 3FeCl 2 (2). Če poznate gostoto in prostornino raztopine klorovodikove kisline, lahko najdete njeno maso: m sol (HCl) = V(HCl) × ρ (HCl); m sol (HCl) \u003d 150 × 1,1 \u003d 165 g. Izračunajte maso vodikovega klorida: m(HCl)=msol(HCl)×ω(HCl)/100 %; m(HCl) = 165 x 20 %/100 % = 33 g. Molarna masa (masa enega mola) klorovodikove kisline, izračunana s pomočjo tabele kemičnih elementov D.I. Mendelejev - 36,5 g / mol. Poiščite količino vodikovega klorida: v(HCl) = m(HCl)/M(HCl); v (HCl) \u003d 33 / 36,5 \u003d 0,904 mol. Molska masa (masa enega mola) lestvice, izračunana s pomočjo tabele kemičnih elementov D.I. Mendelejev - 232 g / mol. Poiščite količino snovi na lestvici: v (Fe 3 O 4) \u003d 10/232 \u003d 0,043 mol. Po enačbi 1 je v(HCl): v(Fe 3 O 4) = 1: 8, torej v (HCl) \u003d 8 v (Fe 3 O 4) = 0,344 mol. Potem bo količina snovi vodikovega klorida, izračunana po enačbi (0,344 mol), manjša od tiste, ki je navedena v pogoju problema (0,904 mol). Zato je klorovodikova kislina v presežku in bo potekala druga reakcija: Fe + 2HCl = FeCl 2 + H 2 (3). Določimo količino snovi železovega klorida, ki nastane kot posledica prve reakcije (indeksi označujejo določeno reakcijo): v 1 (FeCl 2): v (Fe 2 O 3) = 1:1 = 0,043 mola; v 1 (FeCl 3): v (Fe 2 O 3) = 2:1; v 1 (FeCl 3) = 2 × v (Fe 2 O 3) = 0,086 mol. Določimo količino vodikovega klorida, ki ni reagiral v reakciji 1, in količino snovi železovega (II) klorida, ki nastane med reakcijo 3: v rem (HCl) \u003d v (HCl) - v 1 (HCl) \u003d 0,904 - 0,344 = 0,56 mola; v 3 (FeCl 2): v rem (HCl) = 1:2; v 3 (FeCl 2) \u003d 1/2 × v rem (HCl) \u003d 0,28 mol. Določimo količino snovi FeCl 2, ki nastane med reakcijo 2, skupno količino snovi FeCl 2 in njeno maso: v2 (FeCl3) = v1 (FeCl3) = 0,086 mola; v 2 (FeCl 2): v 2 (FeCl 3) = 3:2; v 2 (FeCl 2) = 3/2× v 2 (FeCl 3) = 0,129 mola; v vsota (FeCl 2) \u003d v 1 (FeCl 2) + v 2 (FeCl 2) + v 3 (FeCl 2) \u003d 0,043 + 0,129 + 0,28 = 0,452 mola; m (FeCl 2) \u003d v vsota (FeCl 2) × M (FeCl 2) = 0,452 × 127 = 57,404 g. Določimo količino snovi in maso železa, ki je vstopila v reakcije 2 in 3: v 2 (Fe): v 2 (FeCl 3) = 1:2; v 2 (Fe) \u003d 1/2 × v 2 (FeCl 3) \u003d 0,043 mol; v3 (Fe): v rem (HCl) = 1:2; v3 (Fe) = 1/2×v rem (HCl) = 0,28 mol; v vsota (Fe) \u003d v 2 (Fe) + v 3 (Fe) \u003d 0,043 + 0,28 = 0,323 mol; m(Fe) = v vsota (Fe) × M(Fe) = 0,323 × 56 = 18,088 g. Izračunajmo količino snovi in maso vodika, ki se sprosti v reakciji 3: v (H 2) \u003d 1/2 × v rem (HCl) = 0,28 mola; m (H 2) \u003d v (H 2) × M (H 2) = 0,28 × 2 = 0,56 g. Določimo maso nastale raztopine m 'sol in masni delež FeCl 2 v njej: m’ sol \u003d m sol (HCl) + m (Fe 3 O 4) + m (Fe) - m (H 2); |
Človeško telo vsebuje približno 5 g železa, večina (70%) je del hemoglobina v krvi.
Fizične lastnosti
V prostem stanju je železo srebrno bela kovina s sivkastim odtenkom. Čisto železo je duktilno in ima feromagnetne lastnosti. V praksi se pogosto uporabljajo železove zlitine - lito železo in jekla.
Fe je najpomembnejši in najpogostejši element devetih d-kovinov sekundarne podskupine skupine VIII. Skupaj s kobaltom in nikljem tvori "železo družino".
Pri tvorbi spojin z drugimi elementi pogosto uporablja 2 ali 3 elektrone (B \u003d II, III).
Železo, tako kot skoraj vsi d-elementi skupine VIII, ne kaže višje valence, ki bi bila enaka številu skupine. Njegova največja valenca doseže VI in je izjemno redka.
Najbolj tipične spojine so tiste, v katerih so atomi Fe v +2 in +3 oksidacijskih stanjih.
Metode pridobivanja železa
1. Komercialno železo (v zlitini z ogljikom in drugimi nečistočami) se pridobiva s karbotermično redukcijo njegovih naravnih spojin po shemi:

Okrevanje poteka postopoma, v 3 fazah:
1) 3Fe 2 O 3 + CO = 2Fe 3 O 4 + CO 2
2) Fe 3 O 4 + CO = 3FeO + CO 2
3) FeO + CO \u003d Fe + CO 2
Lito železo, ki nastane s tem postopkom, vsebuje več kot 2 % ogljika. V prihodnosti se jekla pridobivajo iz litega železa - železove zlitine, ki vsebujejo manj kot 1,5% ogljika.
2. Zelo čisto železo se pridobi na enega od naslednjih načinov:
a) razgradnja pentakarbonila Fe
Fe(CO) 5 = Fe + 5CO
b) redukcija vodika čistega FeO
FeO + H 2 \u003d Fe + H 2 O
c) elektroliza vodnih raztopin Fe +2 soli
FeC 2 O 4 \u003d Fe + 2СO 2
železov(II) oksalat
Kemijske lastnosti
Fe - kovina srednje aktivnosti, ima splošne lastnosti, značilne za kovine.
Edinstvena lastnost je sposobnost "rjavenja" v vlažnem zraku:
V odsotnosti vlage s suhim zrakom začne železo opazno reagirati šele pri T > 150°C; pri žganju nastane "železov kamen" Fe 3 O 4:
3Fe + 2O 2 = Fe 3 O 4
Železo se v odsotnosti kisika ne raztopi v vodi. Pri zelo visokih temperaturah Fe reagira z vodno paro in izpodriva vodik iz vodnih molekul:
3 Fe + 4H 2 O (g) \u003d 4H 2
Proces rjavenja v svojem mehanizmu je elektrokemična korozija. Izdelek iz rje je predstavljen v poenostavljeni obliki. Pravzaprav nastane ohlapna plast mešanice oksidov in hidroksidov spremenljive sestave. Za razliko od filma Al 2 O 3 ta plast ne ščiti železa pred nadaljnjim uničenjem.
Vrste korozije

Zaščita železa proti koroziji

1. Interakcija s halogeni in žveplom pri visoki temperaturi.
2Fe + 3Cl 2 = 2FeCl 3
2Fe + 3F 2 = 2FeF 3
Fe + I 2 \u003d FeI 2
Nastanejo spojine, v katerih prevladuje ionski tip vezi.
2. Interakcija s fosforjem, ogljikom, silicijem (železo se ne povezuje neposredno z N 2 in H 2, ampak ju raztopi).
Fe + P = Fe x P y
Fe + C = Fe x C y
Fe + Si = FexSiy
Nastanejo snovi spremenljive sestave, saj bertolidi (v spojinah prevladuje kovalentna narava vezi)
3. Interakcija z "neoksidacijskimi" kislinami (HCl, H 2 SO 4 dil.)
Fe 0 + 2H + → Fe 2+ + H 2
Ker se Fe nahaja v nizu aktivnosti levo od vodika (E ° Fe / Fe 2+ \u003d -0,44V), lahko izpodriva H 2 iz navadnih kislin.
Fe + 2HCl \u003d FeCl 2 + H 2
Fe + H 2 SO 4 \u003d FeSO 4 + H 2
4. Interakcija z "oksidacijskimi" kislinami (HNO 3 , H 2 SO 4 konc.)
Fe 0 - 3e - → Fe 3+
Koncentrirana HNO 3 in H 2 SO 4 "pasivirata" železo, zato se pri običajnih temperaturah kovina v njih ne raztopi. Pri močnem segrevanju pride do počasnega raztapljanja (brez sproščanja H 2).
V razb. HNO 3 železo se raztopi, preide v raztopino v obliki Fe 3+ kationov, kislinski anion pa se reducira v NO *:
Fe + 4HNO 3 \u003d Fe (NO 3) 3 + NO + 2H 2 O
Zelo dobro se raztopi v mešanici HCl in HNO 3
5. Odnos do alkalij
Fe se ne raztopi v vodnih raztopinah alkalij. S staljenimi alkalijami reagira le pri zelo visokih temperaturah.
6. Interakcija s solmi manj aktivnih kovin
Fe + CuSO 4 \u003d FeSO 4 + Cu
Fe 0 + Cu 2+ = Fe 2+ + Cu 0
7. Interakcija s plinastim ogljikovim monoksidom (t = 200°C, P)
Fe (prah) + 5CO (g) \u003d Fe 0 (CO) 5 železov pentakarbonil
Fe(III) spojine
Fe 2 O 3 - železov oksid (III).
Rdeče-rjav prah, n. R. v H 2 O. V naravi - "rdeča železova ruda".
Načini za pridobitev:
1) razpad železovega hidroksida (III)
2Fe(OH) 3 = Fe 2 O 3 + 3H 2 O
2) praženje pirita
4FeS 2 + 11O 2 \u003d 8SO 2 + 2Fe 2 O 3
3) razgradnja nitrata
Kemijske lastnosti
Fe 2 O 3 je bazični oksid z znaki amfoterizma.
I. Glavne lastnosti se kažejo v sposobnosti reagiranja s kislinami:
Fe 2 O 3 + 6H + = 2Fe 3+ + ZN 2 O
Fe 2 O 3 + 6HCI \u003d 2FeCI 3 + 3H 2 O
Fe 2 O 3 + 6HNO 3 \u003d 2Fe (NO 3) 3 + 3H 2 O
II. Slabe kislinske lastnosti. Fe 2 O 3 se ne raztopi v vodnih raztopinah alkalij, vendar pri zlitju s trdnimi oksidi, alkalijami in karbonati nastanejo ferit:
Fe 2 O 3 + CaO \u003d Ca (FeO 2) 2
Fe 2 O 3 + 2NaOH \u003d 2NaFeO 2 + H 2 O
Fe 2 O 3 + MgCO 3 \u003d Mg (FeO 2) 2 + CO 2
III. Fe 2 O 3 - surovina za proizvodnjo železa v metalurgiji:
Fe 2 O 3 + ZS = 2Fe + ZSO ali Fe 2 O 3 + ZSO \u003d 2Fe + ZSO 2
Fe (OH) 3 - železov (III) hidroksid
Načini za pridobitev:
Pridobljeno z delovanjem alkalij na topne soli Fe 3+:
FeCl 3 + 3NaOH \u003d Fe (OH) 3 + 3NaCl
V času prejema Fe(OH) 3 - rdeče-rjava sluznična oborina.
Fe (III) hidroksid nastane tudi pri oksidaciji Fe in Fe (OH) 2 v vlažnem zraku:
4Fe + 6H 2 O + 3O 2 \u003d 4Fe (OH) 3
4Fe(OH) 2 + 2Н 2 O + O 2 = 4Fe(OH) 3
Fe(III) hidroksid je končni produkt hidrolize Fe 3+ soli.
Kemijske lastnosti
Fe(OH) 3 je zelo šibka baza (veliko šibkejša od Fe(OH) 2). Kaže opazne kislinske lastnosti. Tako ima Fe (OH) 3 amfoterni značaj:
1) reakcije s kislinami potekajo enostavno:
2) sveža oborina Fe(OH) 3 se raztopi v vročem konc. raztopine KOH ali NaOH s tvorbo hidrokso kompleksov:
Fe (OH) 3 + 3KOH \u003d K 3
V alkalni raztopini lahko Fe (OH) 3 oksidiramo v ferate (soli železove kisline H 2 FeO 4 niso izolirane v prostem stanju):
2Fe(OH) 3 + 10KOH + 3Br 2 = 2K 2 FeO 4 + 6KBr + 8H 2 O
Fe 3+ soli
Praktično najpomembnejši so: Fe 2 (SO 4) 3, FeCl 3, Fe (NO 3) 3, Fe (SCN) 3, K 3 4 - rumena krvna sol \u003d Fe 4 3 pruska modra (temno modra oborina)
b) Fe 3+ + 3SCN - \u003d Fe (SCN) 3 Fe (III) tiocianat (krvavo rdeča raztopina)
Prvi izdelki iz železa in njegovih zlitin so bili najdeni med izkopavanji in segajo v približno 4. tisočletje pred našim štetjem. To pomeni, da so že stari Egipčani in Sumerci uporabljali meteoritske usedline te snovi za izdelavo nakita in gospodinjskih predmetov ter orožja.
Danes so različne vrste železovih spojin, pa tudi čista kovina, najpogostejše in uporabljene snovi. Ni čudno, da je 20. stoletje veljalo za železo. Navsezadnje je bila pred pojavom in široko uporabo plastike in sorodnih materialov prav ta spojina odločilnega pomena za ljudi. Kaj je ta element in katere snovi tvori, bomo obravnavali v tem članku.
Kemični element železo
Če upoštevamo strukturo atoma, potem moramo najprej navesti njegovo lokacijo v periodnem sistemu.
Kemični element železo ima tudi približno 20 različnih izotopov, ki niso stabilni. Možna stanja oksidacije, ki jih lahko pokaže dani atom, so:
Pomemben ni samo element sam, temveč tudi njegove različne spojine in zlitine.
Fizične lastnosti
Kot preprosta snov ima železo izrazito kovinskost. To pomeni, da je srebrno bela kovina s sivim odtenkom, ki ima visoko stopnjo duktilnosti in duktilnosti ter visoko tališče in vrelišče. Če podrobneje razmislimo o značilnostih, potem:
Glede na pogoje in različne temperature obstaja več modifikacij, ki jih tvori železo. Njihove fizikalne lastnosti se razlikujejo od dejstva, da se kristalne mreže razlikujejo.

Vse modifikacije imajo različne vrste strukture kristalnih rešetk in se razlikujejo tudi po magnetnih lastnostih.
Kemijske lastnosti
Kot je navedeno zgoraj, ima enostavna snov železo srednjo kemično aktivnost. Vendar pa je v fino razpršenem stanju sposoben samovžiga na zraku, sama kovina pa izgori v čistem kisiku.
Korozijska sposobnost je visoka, zato so zlitine te snovi prevlečene z legirnimi spojinami. Železo lahko komunicira z:
Očitno je, da je kovina s takšno aktivnostjo sposobna tvoriti različne spojine, raznolike in polarne lastnosti. In tako se zgodi. Železo in njegove spojine so izjemno raznolike in se uporabljajo v različnih vejah znanosti, tehnologije in industrijske dejavnosti človeka.
Razširjenost v naravi
Naravne železove spojine so precej pogoste, saj je za aluminijem drugi najpogostejši element na našem planetu. Hkrati je v svoji čisti obliki kovina izjemno redka, kot del meteoritov, kar kaže na njene velike akumulacije v vesolju. Glavna masa je v sestavi rud, kamnin in mineralov.

Če govorimo o odstotku zadevnega elementa v naravi, potem lahko navedemo naslednje številke.
Najpogostejše železove spojine tvorijo naslednje minerale:
To je še dolg seznam, saj jih je res veliko. Poleg tega so razširjene različne zlitine, ki jih ustvari človek. To so tudi takšne železove spojine, brez katerih si je težko predstavljati sodobno življenje ljudi. Ti vključujejo dve glavni vrsti:
Železo je tudi dragocen dodatek številnim nikljevim zlitinam.
Spojine železa(II).
Ti vključujejo tiste, pri katerih je oksidacijsko stanje tvornega elementa +2. Precej jih je veliko, saj vključujejo:
Formule kemičnih spojin, v katerih ima železo navedeno stopnjo oksidacije, so za vsak razred individualne. Razmislite o najpomembnejših in najpogostejših od njih.
Pretvornik dolžine in razdalje Pretvornik mase Pretvornik prostornine hrane in hrane Pretvornik površin Pretvornik prostornine in enot receptov Pretvornik Temperaturni pretvornik Pretvornik tlaka, stresa, Youngovega modula Pretvornik energije in dela Pretvornik moči Pretvornik moči Pretvornik časa Linearni pretvornik hitrosti Pretvornik ravne kotne učinkovitosti Pretvornik toplotne učinkovitosti in učinkovitosti goriva števil v različnih številskih sistemih Pretvornik merskih enot količine informacij Tečaji Mere ženskih oblačil in čevljev Mere moških oblačil in čevljev Pretvornik kotne hitrosti in rotacijske frekvence Pretvornik pospeškov Pretvornik kotnih pospeškov Pretvornik gostote Pretvornik specifične prostornine Pretvornik vztrajnostnega momenta Mo pretvornika sile Pretvornik navora Pretvornik specifične kurilne vrednosti (po masi) Pretvornik energijske gostote in specifične kalorične vrednosti (po prostornini) Pretvornik temperaturne razlike Pretvornik koeficientov Koeficient toplotnega raztezanja Pretvornik toplotne upornosti Pretvornik toplotne prevodnosti Pretvornik specifične toplotne zmogljivosti Pretvornik specifične toplotne zmogljivosti Pretvornik energije izpostavljenosti in sevalne moči Pretvornik gostote toplotnega pretoka Pretvornik koeficienta prenosa toplote Pretvornik prostorninskega pretoka Pretvornik pretvornika masnega pretoka Molarni pretvornik pretoka Pretvornik molarnega pretoka Pretvornik pretvornika masnega pretoka Molarni pretvornik pretvornika pretoka Mo Pretvornik kinematične viskoznosti Pretvornik površinske napetosti Pretvornik prepustnosti pare Pretvornik gostote pretoka vodne pare Pretvornik gostote zvoka Pretvornik ravni zvoka Pretvornik občutljivosti mikrofona Pretvornik ravni zvočnega tlaka (SPL) Pretvornik Pretvornik ravni zvočnega tlaka z izbirnim pretvornikom referenčnega tlaka Pretvornik svetlosti Referenčni tlak Pretvornik svetlobne jakosti in pretvornik pretvornika volumna Frekvenca Pretvornik svetlobne intenzivnosti I pretvornik pretvornika I Moč v dioptrijah in goriščni razdalji Moč razdalje v dioptrijah in povečava leče (×) Električni pretvornik gostote naboja Linearni pretvornik gostote naboja Pretvornik površinske gostote naboja Volumetrični pretvornik gostote naboja Pretvornik električnega toka Pretvornik linearne gostote toka Pretvornik gostote površinskega toka Pretvornik električnega polja Električni pretvornik moči električnega polja Električni pretvornik napetosti električni pretvornik napetosti Po Pretvornik upornosti in električne prevodnosti Pretvornik električne prevodnosti Pretvornik kapacitivnosti Pretvornik induktivnosti Pretvornik merilnika ameriške žice Ravni v dBm (dBm ali dBm), dBV (dBV), vatih itd. enot Pretvornik magnetnomotorne sile Pretvornik jakosti magnetnega polja Pretvornik magnetnega toka Pretvornik magnetne indukcije Sevanje. Radioaktivnost pretvornika absorbirane doze ionizirajočega sevanja. Pretvornik radioaktivnega razpada Sevanje. Izpostavljenost sevanju s pretvornikom doze. Pretvornik absorpcije doze Pretvornik decimalnih predpon Prenos podatkov Tipografija in enota za obdelavo slik Pretvornik enote za obdelavo lesa Pretvornik prostornine lesa Izračun periodnega sistema kemičnih elementov molske mase D. I. Mendelejeva
Kemična formula
Molska masa Fe 2 (SO 4) 3 , železov (III) sulfat 399.8778 g/mol
55,845 2+(32,065+15,9994 4) 3
Masni deleži elementov v spojini
Uporaba kalkulatorja molske mase
Kalkulator molske mase
Krt
Vse snovi so sestavljene iz atomov in molekul. V kemiji je pomembno natančno izmeriti maso snovi, ki vstopajo v reakcijo in iz nje izhajajo. Po definiciji je mol enota SI za količino snovi. En mol vsebuje natančno 6,02214076×10²³ elementarnih delcev. Ta vrednost je številčno enaka Avogadrovi konstanti N A, izražena v enotah molov⁻¹, in se imenuje Avogadrovo število. Količina snovi (simbol n) sistema je merilo števila strukturnih elementov. Strukturni element je lahko atom, molekula, ion, elektron ali kateri koli delec ali skupina delcev.
Avogadrova konstanta N A = 6,02214076×10²³ mol⁻¹. Avogadrovo število je 6,02214076×10²³.
Z drugimi besedami, mol je količina snovi, ki je po masi enaka vsoti atomskih mas atomov in molekul snovi, pomnoženi z Avogadrovim številom. Krt je ena od sedmih osnovnih enot sistema SI in ga označujemo z molom. Ker sta ime enote in njen simbol enaka, je treba opozoriti, da se simbol ne spreminja, za razliko od imena enote, ki se lahko zavrne po običajnih pravilih ruskega jezika. En mol čistega ogljika-12 je enak natanko 12 gramov.
Molarna masa
Molska masa je fizikalna lastnost snovi, opredeljena kot razmerje med maso te snovi in količino snovi v molih. Z drugimi besedami, to je masa enega mola snovi. V sistemu SI je enota molske mase kilogram/mol (kg/mol). Vendar pa so kemiki navajeni uporabljati bolj priročno enoto g/mol.
molska masa = g/mol

Molska masa elementov in spojin
Spojine so snovi, sestavljene iz različnih atomov, ki so med seboj kemično vezani. Na primer, naslednje snovi, ki jih lahko najdemo v kuhinji katere koli gospodinje, so kemične spojine:
Molarna masa kemičnih elementov v gramih na mol je številčno enaka masi atomov elementa, izražena v enotah atomske mase (ali daltonih). Molarna masa spojin je enaka vsoti molskih mas elementov, ki sestavljajo spojino, ob upoštevanju števila atomov v spojini. Na primer, molska masa vode (H₂O) je približno 1 × 2 + 16 = 18 g/mol.
Molekularna masa

Molekulska masa (staro ime je molekulska masa) je masa molekule, izračunana kot vsota mas vsakega atoma, ki sestavlja molekulo, pomnožena s številom atomov v tej molekuli. Molekulska teža je brez dimenzij fizikalna količina, številčno enaka molski masi. To pomeni, da se molekulska masa razlikuje od molske mase po dimenziji. Čeprav je molekulska masa brezdimenzionalna količina, ima še vedno vrednost, imenovano enota atomske mase (amu) ali dalton (Da), in je približno enaka masi enega protona ali nevtrona. Enota atomske mase je tudi številčno enaka 1 g/mol.
Izračun molske mase
Molarna masa se izračuna na naslednji način:
Na primer, izračunajmo molsko maso ocetne kisline
Sestavljen je iz:
Naš kalkulator naredi prav to. Vanj lahko vnesete formulo ocetne kisline in preverite, kaj se zgodi.
Ali težko prevajate merske enote iz enega jezika v drugega? Kolegi so vam pripravljeni pomagati. Objavite vprašanje v TCTerms in v nekaj minutah boste prejeli odgovor.