Pridobivanje ogljika. Kemijske lastnosti nasičenih enobaznih karboksilnih kislin
Karboksilne kisline so derivati ogljikovodikov, ki vsebujejo eno ali več karboksilnih skupin.
Število karboksilnih skupin označuje bazičnost kisline.
Glede na število karboksilnih skupin karboksilne kisline delimo na enobazične karboksilne kisline (vsebuje eno karboksilno skupino), dvobazične (vsebuje dve karboksilni skupini) in polibazične kisline.
Glede na vrsto radikala, povezanega s karboksilno skupino, delimo karboksilne kisline na nasičene, nenasičene in aromatske. Omejevalne in nenasičene kisline so združene pod splošnim imenom alifatske ali maščobne kisline.
Enobazične karboksilne kisline
1.1 Homologne serije in nomenklatura
Homologna serija enobazičnih nasičenih karboksilnih kislin (včasih imenovanih maščobne kisline) se začne z mravljinčno kislino
Formula homologne serije
Nomenklatura IUPAC dovoljuje ohranjanje številnih kislin z njihovimi trivialnimi imeni, ki običajno označujejo naravni vir, iz katerega je bila ta ali druga kislina izolirana, na primer mravljinčna, ocetna, maslena, baldrijanska itd.
Za bolj zapletene primere so imena kislin izpeljana iz imena ogljikovodikov z enakim številom ogljikovih atomov kot v molekuli kisline, z dodatkom končnice -ovaya in besede kisline. Mravljinčna kislina H-COOH se imenuje metanojska kislina, ocetna kislina CH 3 -COOH se imenuje etanojska kislina itd.
Tako se kisline obravnavajo kot derivati ogljikovodikov, katerih ena povezava se pretvori v karboksil:

Pri poimenovanju kislin z razvejano verigo po racionalni nomenklaturi se štejejo za derivate ocetne kisline, v molekuli katere so atomi vodika nadomeščeni z radikali, na primer trimetilocetna kislina (CH 3) 3 C - COOH.
1.2 Fizikalne lastnosti karboksilnih kislin
Samo iz čisto formalnih položajev lahko karboksilno skupino obravnavamo kot kombinacijo karbonilnih in hidroksilnih funkcij. Pravzaprav je njihov medsebojni vpliv drug na drugega tak, da popolnoma spremeni njihove lastnosti.
Polarizacija dvojne vezi C=0, ki je običajna za karbonil, se močno poveča zaradi dodatne kontrakcije prostega elektronskega para iz sosednjega atoma kisika hidroksilne skupine:

Posledica tega je znatno oslabitev vezi O-H v hidroksilu in enostavnost odcepitve atoma vodika od njega v obliki protona (H +). Pojav zmanjšane elektronske gostote (δ+) na osrednjem ogljikovem atomu karboksila vodi tudi do krčenja σ-elektronov sosednje C-C vezi na karboksilno skupino in do pojava (kot pri aldehidih in ketonih) zmanjšana elektronska gostota (δ +) na α-ogljikovem atomu kisline.
Vse karboksilne kisline so kisle (zaznane z indikatorji) in tvorijo soli s hidroksidi, oksidi in karbonati kovin ter z aktivnimi kovinami:
Karboksilne kisline se v večini primerov v vodni raztopini disociirajo le v majhni meri in so šibke kisline, bistveno slabše od klorovodikovih, dušikovih in žveplovih kislin. Torej, pri raztapljanju enega mola v 16 litrih vode je stopnja disociacije mravljinčne kisline 0,06, ocetne kisline - 0,0167, medtem ko je klorovodikova kislina s to redčenjem skoraj popolnoma disociirana.
Za večino enobaznih karboksilnih kislin RK a \u003d 4,8, ima samo mravljinča kislina nižjo vrednost pKa (približno 3,7), kar je razloženo z odsotnostjo učinka darovanja elektronov alkilnih skupin.
V brezvodnih mineralnih kislinah se karboksilne kisline protonirajo pri kisiku in tvorijo karbokacije:

Zgoraj omenjen premik elektronske gostote v molekuli nedisociirane karboksilne kisline zmanjša elektronsko gostoto na hidroksilnem kisikovem atomu in jo poveča na karbonilnem. Ta premik se še poveča v anionu kisline:

Rezultat premika je popolna izenačitev nabojev v anionu, ki dejansko obstaja v obliki A - resonanca karboksilatnega aniona.
Prvi štirje predstavniki serije karboksilnih kislin so mobilne tekočine, ki se v vseh pogledih mešajo z vodo. Kisline, katerih molekula vsebuje od pet do devet atomov ogljika (pa tudi izomaslena kislina), so oljne tekočine, njihova topnost v vodi je nizka.
Višje kisline (iz C 10) so trdne snovi, praktično netopne v vodi, med destilacijo v normalnih pogojih se razgradijo.
Mravljinčna, ocetna in propionska kislina imajo oster vonj; srednji člani serije imajo neprijeten vonj, višje kisline nimajo vonja.

Na fizikalne lastnosti karboksilnih kislin vpliva pomembna stopnja povezanosti zaradi tvorbe vodikovih vezi. Kisline tvorijo močne vodikove vezi, saj so O-H vezi v njih močno polarizirane. Poleg tega so karboksilne kisline sposobne tvoriti vodikove vezi s sodelovanjem atoma kisika karbonilnega dipola, ki ima pomembno elektronegativnost. Dejansko karboksilne kisline v trdnem in tekočem stanju obstajajo predvsem v obliki cikličnih dimerov:
Takšne dimerne strukture do neke mere vztrajajo tudi v plinastem stanju in v razredčenih raztopinah v nepolarnih topilih.
13.1.1. Oksidacija ogljikovodikov. Obstajata dva načina: oksidacija nižjih alkanov C 4 -C 8 predvsem v ocetno kislino in oksidacija trdnega parafina s tvorbo sintetičnih maščobnih kislin (FFA) z ravno verigo ogljikovih atomov C 10 -C 20, ki so surovine za sintezo površinsko aktivnih snovi (površinsko aktivnih snovi) .
Postopek poteka v tekoči fazi pri segrevanju ali v prisotnosti katalizatorjev. Med oksidacijo alkanov pride do uničenja vzdolž vezi med sekundarnimi atomi ogljika, zato ocetna kislina v glavnem nastane iz n-butana, kot stranska produkta pa nastaneta metil etil keton in etil acetat.
13.1.2 Sinteze na osnovi ogljikovega monoksida (II). Karboksilne kisline dobimo iz ogljikovega monoksida z reakcijo karbonilacije:
Dodajanje dvojne vezi pri kislinski katalizi vedno poteka po Markovnikovem pravilu, zaradi česar se ravno verižna kislina pridobi samo iz etilena, α-metil-substituirane kisline pa iz njenih homologov. Ta metoda je še posebej zanimiva za sintezo kislin s terciarnim radikalom (nekisline) iz razvejanih olefinov. (Kochova reakcija):

Reakcijski mehanizem je sestavljen iz predhodnega protoniranja alkena s kislino, da nastane karbenijev ion, njegova interakcija s CO, da dobimo acil - kation in reakcije slednjega z vodo, da nastane karboksilna kislina:
Neokisline in njihove soli imajo zelo visoko topnost in viskoznost, njihovi estri pa odpornost na hidrolizo, kar jim omogoča široko uporabo v številnih panogah.
Karbonilacijo alkoholov katalizirajo kovinski kompleksi (Ni, Co, Fe, Pd). Postopek je bil implementiran v industriji za sintezo ocetne kisline iz metanola in je značilna visoka ekonomična učinkovitost.
Kisline se pridobivajo tudi z oksidacijo aldehidov (produkt oksosinteze).
Laboratorijske metode za pridobivanje karboksilnih kislin
Oksidacija alkanov.
Oksidacija alkenov.
13.2.3. Oksidacija primarnih alkoholov.
13.2.4. Oksidacija aldehidov in ketonov. Aldehidi se oksidirajo veliko lažje kot ketoni. Poleg tega oksidacija aldehidov vodi do tvorbe kislin z enakim številom ogljikovih atomov, medtem ko oksidacija ketonov poteka s lomljenjem vezi ogljik-ogljik (nastaneta dve kislini ali kislina in keton):

Oksidanti so kalijev permanganat ali dikromat. Za oksidacijo ketonov so potrebni strožji pogoji kot pri aldehidih.
13.2.5. Hidroliza nitrilov. Nitrile dobimo z interakcijo haloalkanov s kalijevim cianidom, hidrolizo izvajamo z vodnimi raztopinami kislin ali alkalij. V kislem okolju se dušik sprošča v obliki amonijeve soli:

v alkalnem - v obliki amonijevega hidroksida, ki se razgradi s sproščanjem amoniaka, dobimo kislino v obliki soli:

13.2.6. Grignardova sinteza. Ko organomagnezijeve spojine medsebojno delujejo z ogljikovim dioksidom, nastanejo soli karboksilnih kislin:
Močna kislina (običajno HCl) pretvori sol v kislino:
Hidroliza maščob
Maščobe so estri karboksilnih kislin in glicerola (trigliceridi). Karboksilne kisline, ki sestavljajo maščobe, imajo ogljikovo verigo od 3 do 18 ogljikovih atomov.
Pri vrenju maščob ali olj z vodnimi raztopinami alkalij (NaOH, KOH) nastanejo soli karboksilnih kislin in glicerola.
Ta postopek se imenuje umiljenje, saj se za izdelavo mila uporabljajo soli karboksilnih kislin.
Hidroliza derivatov karboksilnih kislin.
Fizične lastnosti
Nižje kisline z do 3 ogljikovimi atomi so hlapne, brezbarvne tekočine z značilnim ostrim vonjem, ki se mešajo z vodo v katerem koli razmerju. Večina kislin C 4 - C 9 so oljne tekočine z neprijetnim vonjem. Topnost v vodi se močno zmanjša s povečanjem molske mase. Kisline od C 10 in višje so trdne snovi, ki so netopne v vodi. Gostote mravljinčne in ocetne kisline so večje od ena, ostale manjše od ena. Vrelišče narašča z naraščajočo molsko maso, pri enakem številu ogljikovih atomov kisline normalne strukture vrejo višje kot kisline z razvejanim ogljikovim skeletom. Primerjava vrelišč kislin in alkoholov z enakim številom ogljikovih atomov je pokazala, da kisline vrejo pri veliko višjih temperaturah kot alkoholi. To kaže na večjo povezanost kislinskih molekul v primerjavi z alkoholi zaradi tvorbe vodikovih vezi.
Karboksilne kisline, tako kot alkoholi, so sposobne tvoriti vodikove vezi. Če je akceptor dovolj močna baza, je tvorba vodikove vezi pred popolnim prenosom protona na bazo. Po Bronstedu se spojina, ki je darovalec vodika, šteje za "kislino". Ali bo določena spojina "donor vodika" ("kislina"), je odvisno od narave "akceptorja vodika" ("baze"). Močnejša kot je baza, večja je verjetnost, da se bo spojina do nje obnašala kot kislina:

Medmolekularne vodikove vezi, ki nastanejo med molekulami karboksilnih kislin, so tako močne, da tudi v plinastem stanju obstaja pomemben del molekul v obliki dimerov:

Ko ogljikovodikova veriga raste, se sposobnost kislin, da tvorijo vodikove vezi, zmanjša.
DEFINICIJA
Organske snovi, katerih molekule vsebujejo eno ali več karboksilnih skupin, povezanih z ogljikovodikovim radikalom, se imenujejo karboksilne kisline.
Prvi trije člani homologne serije karboksilnih kislin, vključno s propionsko kislino, so tekočine, ki imajo oster vonj in so zelo topne v vodi. Naslednji homologi, začenši z masleno kislino, so tudi tekočine, ki imajo oster neprijeten vonj, vendar so slabo topne v vodi. Višje kisline s številom ogljikovih atomov 10 ali več so trdne snovi, brez vonja, netopne v vodi. Na splošno se v nizu homologov z naraščajočo molekulsko maso topnost v vodi zmanjša, gostota se zmanjša in vrelišče se poveča (tabela 1).
Tabela 1. Homologne serije karboksilnih kislin.
Pridobivanje karboksilnih kislin
Karboksilne kisline pridobivamo z oksidacijo nasičenih ogljikovodikov, alkoholov, aldehidov. Na primer, ocetna kislina - z oksidacijo etanola z raztopino kalijevega permanganata v kislem mediju pri segrevanju:
Kemijske lastnosti karboksilnih kislin
Kemične lastnosti karboksilnih kislin so predvsem posledica posebnosti njihove strukture. Torej so v vodi topne kisline sposobne disociirati v ione:
R-COOH↔R-COO - + H + .
Zaradi prisotnosti iona H + v vodi imajo kisel okus, lahko spremenijo barvo indikatorjev in prevajajo elektriko. V vodni raztopini so te kisline šibki elektroliti.
Karboksilne kisline imajo kemijske lastnosti, značilne za raztopine anorganskih kislin, t.j. medsebojno delujejo s kovinami (1), njihovimi oksidi (2), hidroksidi (3) in šibkimi solmi (4):
2CH 3 -COOh + Zn → (CH 3 COO) 2 Zn + H 2 (1);
2CH 3 -COOH + CuO→ (CH 3 COO) 2 Cu + H 2 O (2);
R-COOH + KOH → R-KUHANJE + H2O (3);
2CH 3 -COOH + NaHCO 3 → CH 3 COONa + H 2 O + CO 2 (4).
Posebna lastnost omejevanja, pa tudi nenasičenih karboksilnih kislin, ki se kaže zaradi funkcionalne skupine, je interakcija z alkoholi.
Karboksilne kisline reagirajo z alkoholi pri segrevanju in v prisotnosti koncentrirane žveplove kisline. Na primer, če ocetni kislini dodamo etilni alkohol in malo žveplove kisline, se pri segrevanju pojavi vonj etil estra ocetne kisline (etil acetata):
CH 3 -COOH + C 2 H 5 OH ↔CH 3 -C (O) -O-C 2 H 5 + H 2 O.
Posebna lastnost nasičenih karboksilnih kislin, ki se kaže zaradi radikala, je reakcija halogeniranja (kloriranja).

Uporaba karboksilnih kislin
Karboksilne kisline služijo kot surovina za proizvodnjo ketonov, kislinskih halogenidov, vinilnih estrov in drugih pomembnih razredov organskih spojin.
Mravljinčna kislina se pogosto uporablja za pridobivanje estrov, ki se uporabljajo v parfumeriji, usnjarstvu (strojenje), tekstilni industriji (kot jedkalo pri barvanju), kot topilo in konzervans.
Vodna raztopina (70-80%) ocetne kisline se imenuje kisova esenca, 3-9% vodna raztopina pa namizni kis. Esenca se pogosto uporablja za pripravo kisa doma z redčenjem.
Primeri reševanja problemov
PRIMER 1
| Vaja | Katere kemične reakcije se lahko uporabijo za izvedbo naslednjih transformacij: a) CH 4 → CH 3 Cl → CH 3 OH → HCHO → HCOOH → HCOOK. Napišite reakcijske enačbe, navedite pogoje za njihovo pojavljanje. |
| Odgovori | a) Kloriranje metana v prisotnosti svetlobe vodi do proizvodnje klorometana: CH 4 + Cl 2 → CH 3 Cl + HCl. Halogeni derivati alkanov so podvrženi hidrolizi v vodnem ali alkalnem mediju s tvorbo alkoholov: CH3Cl + NaOH→CH3OH + NaCl. Kot posledica oksidacije primarnih alkoholov, na primer s kalijevim dikromatom v kislem mediju v prisotnosti katalizatorja (Cu, CuO, Pt, Ag), nastanejo aldehidi: CH 3 OH+ [O] → HCHO. Aldehidi se zlahka oksidirajo v ustrezne karboksilne kisline, na primer s kalijevim permanganatom: HCHO + [O]→HCOOH. Karboksilne kisline imajo vse lastnosti, ki so lastne šibkim mineralnim kislinam, t.j. sposoben interakcije z aktivnimi kovinami v tvorbo soli: 2HCOOH+ 2K→2HCOOK + H2. |
PRIMER 2
| Vaja | Napišite reakcijske enačbe med naslednjima snovma: a) 2-metilpropanojsko kislino in klorom; b) ocetna kislina in propanol-2; c) akrilna kislina in bromova voda; d) 2-metilbutanojska kislina in fosforjev (V) klorid. Določite reakcijske pogoje. |
| Odgovori | a) kot posledica reakcije med 2-metilpropanojsko kislino in klorom se atom vodika nadomesti v ogljikovodikovem radikalu, ki se nahaja v a-položaju; Nastane 2-metil-2-kloropropanojska kislina H 3 C-C (CH 3) H-COOH + Cl 2 → H 3 C-C (CH 3) Cl-COOH + HCl (kat \u003d P). b) kot posledica interakcijske reakcije med ocetno kislino in propanolom-2 nastane ester - izopropil ester ocetne kisline. CH 3 -COOH + CH 3 -C (OH) H-CH 3 → CH 3 -C (O) -O-C (CH 3) -CH 3. c) kot posledica interakcijske reakcije med akrilno kislino in bromovo vodo dodatek halogena na mestu dvojne vezi v skladu z Markovnikovim pravilom; Nastane 2,3-dibromopropanojska kislina CH 2 \u003d CH-COOH + Br 2 → CH 2 Br-CHBr-COOH d) kot posledica interakcijske reakcije med 2-metilbutanojsko kislino in fosforjevim (V) kloridom nastane ustrezen kislinski klorid CH 3 -CH 2 -C (CH 3) H-COOH + PCl 5 →CH 3 -CH 2 -C (CH 3) H-COOCl + POCl 3 + HCl. |
Razvrstitev
a) Po bazičnosti (tj. številu karboksilnih skupin v molekuli):
monobazični (monokarboksilni) RCOOH; Na primer:
CH3CH2CH2COOH;
HOOS-CH 2-COOH propandiojska (malonska) kislina

Tribazični (trikarboksilni) R (COOH) 3 itd.
b) Glede na strukturo ogljikovodikovega radikala:
Alifatski
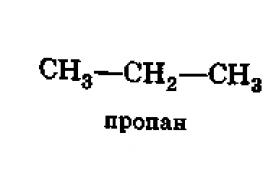
omejitev; na primer: CH3CH2COOH;
nenasičen; na primer: CH 2 \u003d CHCOOH propenojska (akrilna) kislina

Aliciklični, na primer:

Aromatično, na primer:

Omejite monokarboksilne kisline
(monobazične nasičene karboksilne kisline) - karboksilne kisline, v katerih je nasičen ogljikovodikov radikal povezan z eno karboksilno skupino -COOH. Vsi imajo splošno formulo C n H 2n+1 COOH (n ≥ 0); ali CnH 2n O 2 (n≥1)
Nomenklatura
Sistematična imena enobazičnih nasičenih karboksilnih kislin so podana z imenom ustreznega alkana z dodatkom končnice -ovaya in besedo kislina.
1. HCOOH metan (mravljična) kislina
2. CH 3 COOH etanojska (ocetna) kislina
3. CH 3 CH 2 COOH propanojska (propionska) kislina
izomerija
Izomerizem skeleta v ogljikovodikovem radikalu se kaže, začenši z butanojsko kislino, ki ima dva izomera:

Medrazredna izomerija se kaže, začenši z ocetno kislino:
CH3-COOH ocetna kislina;
H-COO-CH3 metil format (metil ester mravljinčne kisline);
HO-CH2-COH hidroksietanal (hidroksiocetni aldehid);
HO-CHO-CH 2 hidroksietilen oksid.
homologna serija
Trivialno ime |
Ime IUPAC |
|
Mravljinčna kislina |
metanojska kislina |
|
Ocetna kislina |
Etanojska kislina |
|
propionska kislina |
propanojska kislina |
|
Maslena kislina |
Butanojska kislina |
|
Valerinska kislina |
Pentanojska kislina |
|
Kaprojska kislina |
Heksanojska kislina |
|
Enantična kislina |
Heptanojska kislina |
|
Kaprilna kislina |
Oktanojska kislina |
|
Pelargonska kislina |
Nonanojska kislina |
|
kaprinska kislina |
Dekanojska kislina |
|
Undecilna kislina |
undekanojska kislina |
|
Palmitinska kislina |
Heksadekanska kislina |
|
Stearinska kislina |
Oktadekanska kislina |
Kislinski ostanki in kislinski radikali
kislinski ostanek |
Kislinski radikal (acil) |
|
UNSD |
NSOO- |
|
CH 3 COOH |
CH 3 SOO- |
|
CH 3 CH 2 COOH |
CH 3 CH 2 COO- |
|
CH 3 (CH 2) 2 COOH |
CH 3 (CH 2) 2 COO- |
|
CH 3 (CH 2) 3 COOH |
CH 3 (CH 2) 3 COO- |
|
CH 3 (CH 2) 4 COOH |
CH 3 (CH 2) 4 COO- |
Elektronska struktura molekul karboksilne kisline

Premik elektronske gostote, ki je prikazan v formuli proti karbonilnemu kisikovemu atomu, povzroči močno polarizacijo vezi O-H, zaradi česar je olajšan ločitev vodikovega atoma v obliki protona - v vodnih raztopinah poteka proces pride do kislinske disociacije:
RCOOH ↔ RCOO - + H +
V karboksilatnem ionu (RCOO -) poteka p, π-konjugacija osamljenega para elektronov kisikovega atoma hidroksilne skupine s p-oblaki, ki tvorijo π-vez, posledično je π-vez delokalizirana in negativni naboj je enakomerno porazdeljen med dvema atomoma kisika:

V zvezi s tem za karboksilne kisline v nasprotju z aldehidi adicijske reakcije niso značilne.
Fizične lastnosti

Vrelišče kislin je veliko višje od vrelišča alkoholov in aldehidov z enakim številom ogljikovih atomov, kar je razloženo s tvorbo cikličnih in linearnih asociatov med molekulami kisline zaradi vodikovih vezi:
Kemijske lastnosti
I. Lastnosti kislin
Moč kislin se zmanjša v nizu:
HCOOH → CH 3 COOH → C 2 H 6 COOH → ...
1. Nevtralizacijske reakcije
CH 3 COOH + KOH → CH 3 COOK + n 2 O
2. Reakcije z bazičnimi oksidi
2HCOOH + CaO → (HCOO) 2 Ca + H 2 O
3. Reakcije s kovinami
2CH 3 CH 2 COOH + 2Na → 2CH 3 CH 2 COONa + H 2
4. Reakcije s solmi šibkejših kislin (vključno s karbonati in bikarbonati)
2CH 3 COOH + Na 2 CO 3 → 2CH 3 COONa + CO 2 + H 2 O
2HCOOH + Mg(HCO 3) 2 → (HCOO) 2 Mg + 2CO 2 + 2H 2 O
(HCOOH + HCO 3 - → HCOO - + CO2 + H2O)
5. Reakcije z amoniakom
CH 3 COOH + NH 3 → CH 3 COONH 4
II. substitucija -OH skupine
1. Interakcija z alkoholi (reakcije esterifikacije)

2. Interakcija z NH 3 pri segrevanju (nastanejo amidi kislin)

Amidi kislin  hidrolizirajo v kisline:
hidrolizirajo v kisline:

ali njihove soli:

3. Tvorba kislinskih halogenidov
Največji pomen imajo kislinski kloridi. Klorirajoči reagenti - PCl 3 , PCl 5 , tionil klorid SOCl 2 .

4. Tvorba anhidridov kislin (medmolekulska dehidracija)

Anhidridi kislin nastanejo tudi pri interakciji kislinskih kloridov z brezvodnimi solmi karboksilnih kislin; v tem primeru lahko dobimo mešane anhidride različnih kislin; Na primer:

III. Substitucijske reakcije vodikovih atomov pri α-ogljikovem atomu

Značilnosti strukture in lastnosti mravljinčne kisline
Struktura molekule

Molekula mravljinčne kisline za razliko od drugih karboksilnih kislin v svoji strukturi vsebuje aldehidno skupino.
Kemijske lastnosti
Mravljinčna kislina vstopa v reakcije, značilne tako za kisline kot za aldehide. Ker kaže lastnosti aldehida, se zlahka oksidira v ogljikovo kislino:
Zlasti se HCOOH oksidira z raztopino amoniaka Ag 2 O in bakrovega (II) hidroksida Сu (OH) 2, kar pomeni, da aldehidni skupini daje kvalitativne reakcije:

Pri segrevanju s koncentrirano H 2 SO 4 mravljinčna kislina razpade na ogljikov monoksid (II) in vodo:

Mravljinčna kislina je opazno močnejša od drugih alifatskih kislin, saj je karboksilna skupina v njej vezana na atom vodika in ne na alkilni radikal, ki daruje elektrone.
Metode za pridobivanje nasičenih monokarboksilnih kislin
1. Oksidacija alkoholov in aldehidov
Splošna shema za oksidacijo alkoholov in aldehidov:
Kot oksidanti se uporabljajo KMnO 4 , K 2 Cr 2 O 7 , HNO 3 in drugi reagenti.
Na primer:
5C 2 H 5 OH + 4KMnO 4 + 6H 2 S0 4 → 5CH 3 COOH + 2K 2 SO 4 + 4MnSO 4 + 11H 2 O
2. Hidroliza estrov

3. Oksidativno cepitev dvojnih in trojnih vezi v alkenih in alkinih

Metode za pridobivanje HCOOH (specifične)
1. Interakcija ogljikovega monoksida (II) z natrijevim hidroksidom
CO + NaOH → HCOONa natrijev format
2HCOONa + H 2 SO 4 → 2 HCOOH + Na 2 SO 4
2. Dekarboksilacija oksalne kisline

Metode za pridobivanje CH 3 COOH (specifične)
1. Katalitična oksidacija butana

2. Sinteza iz acetilena

3. Katalitična karbonilacija metanola

4. Ocetno kislinska fermentacija etanola
Tako dobimo ocetno kislino za živila.
Pridobivanje višjih karboksilnih kislin
Hidroliza naravnih maščob

Nenasičene monokarboksilne kisline
Ključni predstavniki
Splošna formula alkenojskih kislin: C n H 2n-1 COOH (n ≥ 2)
CH 2 \u003d CH-COOH propenojska (akrilna) kislina

Višje nenasičene kisline
Radikali teh kislin so del rastlinskih olj.
C 17 H 33 COOH - oleinska kislina, oz cis-oktadien-9-ojska kislina

Trance-izomer oleinske kisline se imenuje elaidna kislina.
C 17 H 31 COOH - linolna kislina, oz cis, cis-oktadien-9,12-ojska kislina

C 17 H 29 COOH - linolenska kislina, oz cis, cis, cis-oktadekatrien-9,12,15-ojska kislina
Poleg splošnih lastnosti karboksilnih kislin so za nenasičene kisline značilne adicijske reakcije na več vezi v ogljikovodikovem radikalu. Torej se nenasičene kisline, kot so alkeni, hidrogenirajo in razbarvajo bromovo vodo, na primer:

Posamezni predstavniki dikarboksilnih kislin
Omejevanje dikarboksilnih kislin HOOC-R-COOH
HOOC-CH 2 -COOH propanediojska (malonska) kislina (soli in estri - malonati)
HOOC-(CH2)2-COOH butadinska (jantarna) kislina, (soli in estri - sukcinati)
HOOC-(CH2)3-COOH pentadijska (glutarna) kislina, (soli in estri - glutorati)
HOOC-(CH 2) 4 -COOH heksadiojska (adipinska) kislina, (soli in estri - adipinati)
Značilnosti kemičnih lastnosti
Dikarboksilne kisline so v marsičem podobne monokarboksilnim kislinam, vendar so močnejše. Na primer, oksalna kislina je skoraj 200-krat močnejša od ocetne kisline.
Dikarboksilne kisline se obnašajo kot dvobazične kisline in tvorijo dve vrsti soli - kisle in srednje:
HOOC-COOH + NaOH → HOOC-COONa + H 2 O
HOOC-COOH + 2NaOH → NaOOC-COONa + 2H 2 O
Pri segrevanju se oksalna in malonska kislina zlahka dekarboksilira: