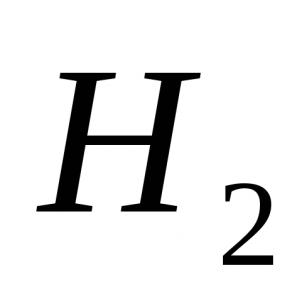Co2 v trdnem stanju je sestavljen iz molekul. Atomsko-molekularna doktrina
Atomsko-molekularno teorijo je razvil in prvič uporabil v kemiji veliki ruski znanstvenik M. V. Lomonosov. Glavne določbe te doktrine so predstavljene v delu "Elementi matematične kemije" (1741) in številnih drugih. Bistvo Lomonosovljevega učenja je mogoče zmanjšati na naslednje določbe.
1. Vse snovi so sestavljene iz "telec" (kot je Lomonosov imenoval molekule).
2. Molekule so sestavljene iz »elementov« (kot je Lomonosov imenoval atome).
3. Delci – molekule in atomi – so v neprekinjenem gibanju. Toplotno stanje teles je posledica gibanja njihovih delcev.
4. Molekule preprostih snovi so sestavljene iz enakih atomov, molekule kompleksnih snovi so sestavljene iz različnih atomov.
67 let po Lomonosovu je angleški znanstvenik John Dalton uporabil atomistično doktrino v kemiji. Glavne določbe atomizma je orisal v knjigi "Novi sistem kemijske filozofije" (1808). Daltonov nauk v svojem bistvu ponavlja nauk Lomonosova. Vendar je Dalton zanikal obstoj molekul v preprostih snoveh, kar je v primerjavi z naukom Lomonosova korak nazaj. Po Daltonu so preproste snovi sestavljene samo iz atomov, samo kompleksne pa iz "kompleksnih atomov" (v sodobnem pomenu - molekul). Atomsko-molekularna doktrina v kemiji se je dokončno uveljavila šele sredi 19. stoletja. Na mednarodnem kongresu kemikov v Karlsruheju leta 1860 so bile sprejete definicije pojmov molekula in atom.
Molekula je najmanjši delec določene snovi, ki ima svoje kemične lastnosti. Kemične lastnosti molekule določata njena sestava in kemična struktura.
Atom je najmanjši delec kemičnega elementa, ki je del molekul preprostih in zapletenih snovi. Kemične lastnosti elementa določa zgradba njegovega atoma. Iz tega sledi definicija atoma, ki ustreza sodobnim idejam:
Atom je električno nevtralen delec, sestavljen iz pozitivno nabitega atomskega jedra in negativno nabitih elektronov.
Po sodobnih zamislih so snovi v plinastem in parnem stanju sestavljene iz molekul. V trdnem stanju so molekule sestavljene samo iz snovi, katerih kristalna mreža ima molekularno strukturo. Večina trdnih anorganskih snovi nima molekularne strukture: njihova mreža ni sestavljena iz molekul, temveč iz drugih delcev (ionov, atomov); obstajajo v obliki makroteles (kristal natrijevega klorida, kos bakra itd.). Soli, kovinski oksidi, diamant, silicij, kovine nimajo molekularne strukture.
Kemični elementi
Atomska in molekularna teorija je omogočila razlago osnovnih konceptov in zakonov kemije. Z vidika atomske in molekularne znanosti se vsaka ločena vrsta atoma imenuje kemični element. Najpomembnejša lastnost atoma je pozitiven naboj njegovega jedra, številčno enak redni številki elementa. Vrednost naboja jedra služi kot razlikovalna značilnost za različne vrste atomov, kar nam omogoča popolnejšo opredelitev pojma elementa:
Kemični element Določena vrsta atoma z enakim pozitivnim jedrskim nabojem.
Znanih je 107 elementov. Trenutno se nadaljuje delo na umetni proizvodnji kemičnih elementov z višjimi serijskimi številkami.
Vse elemente običajno delimo na kovine in nekovine. Vendar je ta delitev pogojna. Pomembna značilnost elementov je njihova številčnost v zemeljski skorji, t.j. v zgornji trdni lupini Zemlje, katere debelina se običajno domneva, da je 16 km. Porazdelitev elementov v zemeljski skorji preučuje geokemija, znanost o kemiji zemlje. Geokemik A. P. Vinogradov je sestavil tabelo povprečne kemične sestave zemeljske skorje. Po teh podatkih je najpogostejši element kisik - 47,2% mase zemeljske skorje, sledijo silicij - 27,6, aluminij - 8,80, železo -5,10, kalcij - 3,6, natrij - 2,64, kalij - 2,6, magnezij - 2,10, vodik - 0,15%.
Kovalentna kemična vez, njene sorte in mehanizmi tvorbe. Značilnosti kovalentne vezi (polarnost in energija vezi). Ionska vez. Kovinska povezava. vodikova vez
Nauk o kemični vezi je osnova vse teoretične kemije.
Kemična vez je takšna interakcija atomov, ki jih veže v molekule, ione, radikale, kristale.
Obstajajo štiri vrste kemičnih vezi: ionske, kovalentne, kovinske in vodikove.
Razdelitev kemičnih vezi na vrste je pogojna, saj je za vse značilna določena enotnost.
Ionsko vez lahko obravnavamo kot omejevalni primer kovalentne polarne vezi.
Kovinska vez združuje kovalentno interakcijo atomov s pomočjo skupnih elektronov in elektrostatično privlačnost med temi elektroni in kovinskimi ioni.
Pri snoveh pogosto ni omejevalnih primerov kemične vezi (ali čistih kemičnih vezi).
Na primer, litijev fluorid $LiF$ je razvrščen kot ionska spojina. Dejansko je vez v njej 80%$ ionska in 20%$ kovalentna. Zato je očitno pravilneje govoriti o stopnji polarnosti (ioničnosti) kemične vezi.
V seriji vodikovih halogenidov $HF—HCl—HBr—HI—HAt$ se stopnja polarnosti vezi zmanjša, ker se zmanjša razlika v vrednostih elektronegativnosti atomov halogena in vodika, v astatinu pa vez postane skoraj nepolarni $(EO(H) = 2,1; EO(At) = 2,2)$.
V istih snoveh so lahko različne vrste vezi, na primer:
- pri bazah: med atomi kisika in vodika v hidrokso skupinah je vez polarna kovalentna, med kovino in hidrokso skupino pa ionska;
- v soli kislin, ki vsebujejo kisik: med nekovinskim atomom in kisikom kislinskega ostanka - kovalentno polarno, in med kovino in kislinskim ostankom - ionsko;
- v amonijevih, metilamonijevih solih itd.: med atomi dušika in vodika - kovalentno polarni, med amonijevimi ali metilamonijevimi ioni in kislinskim ostankom - ionski;
- pri kovinskih peroksidih (na primer $Na_2O_2$) je vez med atomi kisika kovalentna nepolarna, med kovino in kisikom pa ionska itd.
Različne vrste povezav lahko prehajajo ena v drugo:
- pri elektrolitski disociaciji v vodi kovalentnih spojin kovalentna polarna vez preide v ionsko;
- pri izhlapevanju kovin se kovinska vez spremeni v kovalentno nepolarno itd.
Razlog za enotnost vseh vrst in vrst kemičnih vezi je njihova enaka kemična narava - elektronsko-jedrska interakcija. Nastanek kemične vezi je v vsakem primeru posledica elektronsko-jedrne interakcije atomov, ki jo spremlja sproščanje energije.
Metode za tvorbo kovalentne vezi. Značilnosti kovalentne vezi: dolžina in energija
Kovalentna kemična vez je vez, ki nastane med atomi zaradi tvorbe skupnih elektronskih parov.
Mehanizem nastanka takšne vezi je lahko menjalni in darovalec-akceptor.
JAZ. menjalni mehanizem deluje, ko atomi tvorijo skupne elektronske pare z združevanjem neparnih elektronov.
1) $H_2$ - vodik:
Vez nastane zaradi tvorbe skupnega elektronskega para z $s$-elektroni atomov vodika (prekrivajoče se $s$-orbitale):

2) $HCl$ - vodikov klorid:
Vez nastane zaradi tvorbe skupnega elektronskega para $s-$ in $p-$elektronov (prekrivajoče se $s-p-$orbitale):
3) $Cl_2$: v molekuli klora nastane kovalentna vez zaradi neparnih $p-$elektronov (prekrivajoče se $p-p-$orbitale):

4) $N_2$: med atomi v molekuli dušika nastanejo trije skupni elektronski pari:
II. Mehanizem darovalec-sprejemnik Razmislimo o tvorbi kovalentne vezi na primeru amonijevega iona $NH_4^+$.

Donor ima elektronski par, akceptor ima prazno orbitalo, ki jo ta par lahko zasede. V amonijevem ionu so vse štiri vezi z vodikovimi atomi kovalentne: tri so nastale zaradi ustvarjanja skupnih elektronskih parov z atomom dušika in atomov vodika z izmenjevalnim mehanizmom, ena - z mehanizmom darovalec-akceptor.
Kovalentne vezi lahko razvrstimo po načinu prekrivanja elektronskih orbital, pa tudi po njihovem premikanju proti enemu od vezanih atomov.
Kemične vezi, ki nastanejo kot posledica prekrivanja elektronskih orbital vzdolž vezne črte, se imenujejo $σ$ -veze (sigma-veze). Sigma vez je zelo močna.

$p-$orbitale se lahko prekrivajo v dveh regijah in tvorijo kovalentno vez s stranskim prekrivanjem:

Kemične vezi, ki nastanejo kot posledica "bočnega" prekrivanja elektronskih orbital izven komunikacijske linije, t.j. v dveh regijah se imenujejo $π$ -vezi (pi-vezi).
Avtor stopnja pristranskosti skupnih elektronskih parov na enega od atomov, ki jih vežejo, je lahko kovalentna vez polarno in nepolarni.
Imenuje se kovalentna kemična vez, ki nastane med atomi z enako elektronegativnostjo nepolarni. Elektronski pari se ne premaknejo na noben atom, ker atomi imajo enako ER - lastnost vlečenja valenčnih elektronov k sebi iz drugih atomov. Na primer:
tiste. skozi kovalentno nepolarno vez nastanejo molekule preprostih nekovinskih snovi. Imenuje se kovalentna kemična vez med atomi elementov, katerih elektronegativnost se razlikuje polarno.
Dolžina in energija kovalentne vezi.
značilnost lastnosti kovalentne vezi je njegova dolžina in energija. Dolžina povezave je razdalja med jedri atomov. Kemična vez je močnejša, čim krajša je njena dolžina. Vendar pa je merilo trdnosti vezi vezavna energija, ki je določena s količino energije, ki je potrebna za prekinitev vezi. Običajno se meri v kJ/mol. Tako so po eksperimentalnih podatkih dolžine vezi molekul $H_2, Cl_2$ in $N_2$ $0,074, 0,198$ in $0,109$ nm, energije vezave pa $436, 242$ in $946$ kJ/ mol oz.
Ioni. Ionska vez
Predstavljajte si, da se "srečata" dva atoma: kovinski atom skupine I in nekovinski atom skupine VII. Kovinski atom ima na svoji zunanji energijski ravni en sam elektron, medtem ko nekovinski atom za dokončanje zunanjega nivoja nima samo enega elektrona.
Prvi atom bo drugemu zlahka dal svoj elektron, ki je daleč od jedra in nanj šibko vezan, drugi pa mu bo dal prosto mesto na njegovi zunanji elektronski ravni.
Nato bo atom, ki mu je odvzet eden od negativnih nabojev, postal pozitivno nabit delec, drugi pa se bo zaradi prejetega elektrona spremenil v negativno nabit delec. Takšni delci se imenujejo ioni.
Kemična vez, ki nastane med ioni, se imenuje ionska.
Razmislite o tvorbi te vezi z uporabo dobro znane spojine natrijevega klorida (namizne soli) kot primer:
Proces pretvorbe atomov v ione je prikazan na diagramu:

Takšna preobrazba atomov v ione se vedno zgodi med interakcijo atomov tipičnih kovin in tipičnih nekovin.
Upoštevajte algoritem (zaporedje) sklepanja pri snemanju tvorbe ionske vezi, na primer med atomi kalcija in klora:

Številke, ki prikazujejo število atomov ali molekul, se imenujejo koeficienti, in številke, ki kažejo število atomov ali ionov v molekuli, se imenujejo indeksi.
kovinska povezava
Spoznajmo, kako atomi kovinskih elementov medsebojno delujejo. Kovine običajno ne obstajajo v obliki izoliranih atomov, temveč v obliki kosa, ingota ali kovinskega izdelka. Kaj drži kovinske atome skupaj?
Atomi večine kovin na zunanji ravni vsebujejo majhno število elektronov - $1, 2, 3$. Ti elektroni se zlahka ločijo, atomi pa se pretvorijo v pozitivne ione. Ločeni elektroni se premikajo od enega iona do drugega in jih vežejo v eno celoto. Ko se povežejo z ioni, ti elektroni začasno tvorijo atome, nato se ponovno odcepijo in se združijo z drugim ionom itd. Posledično se v volumnu kovine atomi nenehno pretvarjajo v ione in obratno.
Vez v kovinah med ioni s pomočjo socializiranih elektronov se imenuje kovinska.
Slika shematično prikazuje strukturo fragmenta natrijeve kovine.

V tem primeru majhno število socializiranih elektronov veže veliko število ionov in atomov.

Kovinska vez je podobna kovalentni vezi, saj temelji na delitvi zunanjih elektronov. Pri kovalentni vezi pa so zunanji neparni elektroni le dveh sosednjih atomov socializirani, v kovinski vezi pa vsi atomi sodelujejo pri socializaciji teh elektronov. Zato so kristali s kovalentno vezjo krhki, tisti s kovinsko vezjo pa so praviloma duktilni, električno prevodni in imajo kovinski lesk.
Kovinska vez je značilna tako za čiste kovine kot za mešanice različnih kovin – zlitin, ki so v trdnem in tekočem stanju.
vodikova vez
Kemična vez med pozitivno polariziranimi atomi vodika ene molekule (ali njenega dela) in negativno polariziranimi atomi močno elektronegativnih elementov, ki imajo nedeljene elektronske pare ($F, O, N$ in manj pogosto $S$ in $Cl$), drugo molekula (ali njeni deli) se imenuje vodik.
Mehanizem nastanka vodikove vezi je deloma elektrostatični, deloma donorsko-akceptorski.
Primeri medmolekularne vodikove vezi:
V prisotnosti takšne vezi so lahko tudi snovi z nizko molekulsko maso v normalnih pogojih tekočine (alkohol, voda) ali lahko utekočinjeni plini (amoniak, vodikov fluorid).
Snovi z vodikovo vezjo imajo molekularne kristalne mreže.
Snovi molekularne in nemolekularne strukture. Vrsta kristalne mreže. Odvisnost lastnosti snovi od njihove sestave in strukture
Molekularna in nemolekularna zgradba snovi
V kemične interakcije ne vstopajo posamezni atomi ali molekule, temveč snovi. Snov je pod danimi pogoji lahko v enem od treh agregacijskih stanj: trdnem, tekočem ali plinastem. Lastnosti snovi so odvisne tudi od narave kemične vezi med delci, ki jo tvorijo – molekulami, atomi ali ioni. Glede na vrsto vezi ločimo snovi molekularne in nemolekularne strukture.
Snovi, sestavljene iz molekul, se imenujejo molekularne snovi. Vezi med molekulami v takih snoveh so zelo šibke, veliko šibkejše kot med atomi znotraj molekule in se že pri razmeroma nizkih temperaturah porušijo – snov se spremeni v tekočino in nato v plin (sublimacija joda). Tališče in vrelišče snovi, sestavljenih iz molekul, se povečujeta z naraščajočo molekulsko maso.
Med molekularne snovi sodijo snovi z atomsko strukturo ($C, Si, Li, Na, K, Cu, Fe, W$), med njimi so kovine in nekovine.
Razmislite o fizikalnih lastnostih alkalijskih kovin. Relativno nizka trdnost vezi med atomi povzroča nizko mehansko trdnost: alkalijske kovine so mehke in jih je mogoče enostavno rezati z nožem.
Velike velikosti atomov vodijo v nizko gostoto alkalijskih kovin: litij, natrij in kalij so celo lažji od vode. V skupini alkalijskih kovin se vrelišče in tališče zmanjšujeta s povečanjem redne številke elementa, ker. velikost atomov se poveča in vezi oslabijo.
Na snovi nemolekularni strukture vključujejo ionske spojine. Večina spojin kovin z nekovinami ima to strukturo: vse soli ($NaCl, K_2SO_4$), nekateri hidridi ($LiH$) in oksidi ($CaO, MgO, FeO$), baze ($NaOH, KOH$). Ionske (nemolekularne) snovi imajo visoko tališče in vrelišče.
Kristalne rešetke
Snov, kot je znano, lahko obstaja v treh agregacijskih stanjih: plinastem, tekočem in trdnem.
Trdne snovi: amorfne in kristalne.
Razmislite, kako značilnosti kemičnih vezi vplivajo na lastnosti trdnih snovi. Trdne snovi se delijo na kristalno in amorfna.
Amorfne snovi nimajo jasnega tališča - pri segrevanju se postopoma zmehčajo in postanejo tekoče. V amorfnem stanju so na primer plastelin in različne smole.
Za kristalne snovi je značilna pravilna razporeditev delcev, iz katerih so sestavljene: atomov, molekul in ionov – na strogo določenih točkah v prostoru. Ko so te točke povezane z ravnimi črtami, nastane prostorski okvir, imenovan kristalna mreža. Točke, na katerih se nahajajo kristalni delci, se imenujejo mrežna vozlišča.
Glede na vrsto delcev, ki se nahajajo na vozliščih kristalne mreže, in naravo povezave med njimi ločimo štiri vrste kristalnih rešetk: ionski, atomski, molekularni in kovinski.
Ionske kristalne rešetke.
ionski imenovane kristalne mreže, v vozliščih katerih so ioni. Tvorijo jih snovi z ionsko vezjo, ki lahko vežejo tako enostavne ione $Na^(+), Cl^(-)$ kot kompleksne $SO_4^(2−), OH^-$. Posledično imajo soli, nekateri oksidi in hidroksidi kovin ionske kristalne mreže. Na primer, kristal natrijevega klorida je sestavljen iz izmeničnih $Na^+$ pozitivnih ionov in $Cl^-$ negativnih ionov, ki tvorijo mrežo v obliki kocke. Vezi med ioni v takem kristalu so zelo stabilne. Zato je za snovi z ionsko rešetko značilna razmeroma visoka trdota in trdnost, so ognjevzdržne in nehlapne.

Atomske kristalne mreže.
jedrski imenovane kristalne mreže, v vozliščih katerih so posamezni atomi. V takih mrežah so atomi med seboj povezani z zelo močnimi kovalentnimi vezmi. Primer snovi s to vrsto kristalne mreže je diamant, ena od alotropnih modifikacij ogljika.
Večina snovi z atomsko kristalno mrežo ima zelo visoko tališče (na primer za diamant je nad 3500°C$), so močne in trde, praktično netopne.

Molekularne kristalne mreže.
Molekularno imenovane kristalne mreže, na vozliščih katerih se nahajajo molekule. Kemične vezi v teh molekulah so lahko polarne ($HCl, H_2O$) ali nepolarne ($N_2, O_2$). Kljub temu, da so atomi znotraj molekul vezani z zelo močnimi kovalentnimi vezmi, obstajajo šibke sile medmolekularne privlačnosti med samimi molekulami. Zato imajo snovi z molekularno kristalno mrežo nizko trdoto, nizko tališče in so hlapne. Večina trdnih organskih spojin ima molekularne kristalne mreže (naftalen, glukoza, sladkor).

Kovinske kristalne rešetke.
Snovi s kovinsko vezjo imajo kovinske kristalne mreže. Na vozliščih takšnih rešetk so atomi in ioni (bodisi atomi ali ioni, v katere se kovinski atomi zlahka spremenijo in dajo svoje zunanje elektrone "za skupno uporabo"). Takšna notranja struktura kovin določa njihove značilne fizikalne lastnosti: kovnost, plastičnost, električno in toplotno prevodnost ter značilen kovinski lesk.
Molekularna in nemolekularna zgradba snovi. Struktura snovi

V kemične interakcije ne vstopajo posamezni atomi ali molekule, temveč snovi. Snovi se razlikujejo po vrsti vezi molekularno in nemolekularna struktura. Snovi, sestavljene iz molekul, se imenujejo molekularne snovi. Vezi med molekulami v takih snoveh so zelo šibke, veliko šibkejše kot med atomi znotraj molekule in se že pri razmeroma nizkih temperaturah porušijo – snov se spremeni v tekočino in nato v plin (sublimacija joda). Tališče in vrelišče snovi, sestavljenih iz molekul, se povečujeta z naraščajočo molekulsko maso. Za molekularne snovi vključujejo snovi z atomsko strukturo (C, Si, Li, Na, K, Cu, Fe, W), med njimi so kovine in nekovine. Na snovi nemolekularna struktura vključujejo ionske spojine. Večina spojin kovin z nekovinami ima to strukturo: vse soli (NaCl, K 2 SO 4), nekateri hidridi (LiH) in oksidi (CaO, MgO, FeO), baze (NaOH, KOH). Ionske (nemolekularne) snovi imajo visoko tališče in vrelišče.

Trdne snovi: amorfne in kristalne
Trdne snovi se delijo na kristalni in amorfni.
Amorfne snovi nimajo jasnega tališča - pri segrevanju se postopoma zmehčajo in postanejo tekoče. V amorfnem stanju so na primer plastelin in različne smole.
Kristalne snovi zanje je značilna pravilna razporeditev delcev, iz katerih so sestavljeni: atomov, molekul in ionov – na strogo določenih točkah v prostoru. Ko so te točke povezane z ravnimi črtami, nastane prostorski okvir, imenovan kristalna mreža. Točke, na katerih se nahajajo kristalni delci, se imenujejo mrežna vozlišča. Glede na vrsto delcev, ki se nahajajo na vozliščih kristalne mreže, in naravo povezave med njimi ločimo štiri vrste kristalnih rešetk: ionske, atomske, molekularne in kovinske.
Kristalne rešetke imenujemo ionske, na mestih katerih so ioni. Tvorijo jih snovi z ionsko vezjo, ki je lahko povezana tako s preprostimi ioni Na +, Cl - kot s kompleksnimi SO 4 2-, OH -. Posledično imajo soli, nekateri oksidi in hidroksidi kovin ionske kristalne mreže. Na primer, kristal natrijevega klorida je zgrajen iz izmenično pozitivnih Na + in negativnih Cl - ionov, ki tvorijo mrežo v obliki kocke. Vezi med ioni v takem kristalu so zelo stabilne. Zato je za snovi z ionsko rešetko značilna razmeroma visoka trdota in trdnost, so ognjevzdržne in nehlapne.
Kristalna mreža - a) in amorfna mreža - b).
 Kristalna mreža - a) in amorfna mreža - b).
Kristalna mreža - a) in amorfna mreža - b). Atomske kristalne mreže
jedrski imenovane kristalne mreže, v vozliščih katerih so posamezni atomi. V takih mrežah so atomi med seboj povezani zelo močne kovalentne vezi. Primer snovi s to vrsto kristalne mreže je diamant, ena od alotropnih modifikacij ogljika. Večina snovi z atomsko kristalno mrežo ima zelo visoke tališče (na primer v diamantu je nad 3500 ° C), so močne in trde, praktično netopne.


Molekularne kristalne mreže
Molekularno imenovane kristalne mreže, na vozliščih katerih se nahajajo molekule. Kemične vezi v teh molekulah so lahko polarne (HCl, H 2 O) in nepolarne (N 2 , O 2). Kljub temu, da so atomi znotraj molekul vezani z zelo močnimi kovalentnimi vezmi, med samimi molekulami delujejo šibke sile medmolekularne privlačnosti. Zato imajo snovi z molekularno kristalno mrežo nizko trdoto, nizko tališče in so hlapne. Večina trdnih organskih spojin ima molekularne kristalne mreže (naftalen, glukoza, sladkor).
 Molekularna kristalna mreža (ogljikov dioksid)
Molekularna kristalna mreža (ogljikov dioksid) Kovinske kristalne rešetke
Snovi z kovinska vez imajo kovinske kristalne rešetke. Na vozliščih takšnih rešetk so atomi in ioni(bodisi atomi ali ioni, v katere se kovinski atomi zlahka spremenijo in dajo svoje zunanje elektrone "za splošno uporabo"). Takšna notranja struktura kovin določa njihove značilne fizikalne lastnosti: kovnost, plastičnost, električno in toplotno prevodnost ter značilen kovinski lesk.

goljufije


Molekula, v kateri težišča pozitivno in negativno nabitih odsekov ne sovpadata, se imenuje dipol. Opredelimo pojem "dipol".
Dipol je skupek dveh enakih električnih nabojev nasprotne velikosti, ki sta na neki razdalji drug od drugega.
Molekula vodika H 2 ni dipol (slika 50 a), molekula vodikovega klorida pa je dipol (slika 50 b). Molekula vode je tudi dipol. Elektronski pari v H 2 O se v večji meri premaknejo z atomov vodika na atom kisika.
Težišče negativnega naboja se nahaja blizu atoma kisika, težišče pozitivnega naboja pa blizu atomov vodika.
V kristalni snovi so atomi, ioni ali molekule v strogem vrstnem redu.
Kraj, kjer se tak delec nahaja, se imenuje vozlišče kristalne mreže. Položaj atomov, ionov ali molekul v vozliščih kristalne mreže je prikazan na sl. 51.
v g
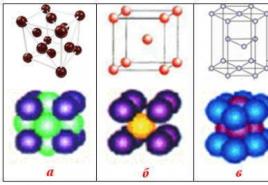
riž. 51. Modeli kristalnih rešetk (prikazana je ena ravnina velikega kristala): a) kovalentni ali atomski (diamant C, silicij Si, kremen SiO 2); b) ionski (NaCl); v) molekularni (led, I 2); G) kovinski (Li, Fe). V modelu kovinske mreže pike označujejo elektrone
Glede na vrsto kemične vezi med delci se kristalne mreže delijo na kovalentne (atomske), ionske in kovinske. Obstaja še ena vrsta kristalne mreže - molekularna. V takšni mreži se držijo posamezne molekule sile medmolekularne privlačnosti.
Ionski kristali(slika 51 b) vsebujejo pozitivno in negativno nabite ione na mestih kristalne mreže. Kristalna mreža je zgrajena tako, da so sile elektrostatičnega privlačenja nasprotno nabitih ionov in odbojne sile enako nabitih ionov uravnotežene. Takšne kristalne mreže so značilne za spojine, kot so LiF, NaCl in številne druge.
molekularni kristali(slika 51 v) vsebujejo dipolne molekule na mestih kristala, ki se med seboj držijo zaradi elektrostatičnih privlačnih sil, kot so ioni v ionski kristalni mreži. Na primer, led je molekularna kristalna mreža, ki jo tvorijo vodni dipoli. Na sl. 51 v simboli niso podani za naboje, da ne bi preobremenili številke.
kovinski kristal(slika 51 G) vsebuje pozitivno nabite ione na mestih mreže. Nekateri zunanji elektroni se prosto gibljejo med ioni. " e-plin"drži pozitivno nabite ione v vozliščih kristalne mreže.. Kovina se ob udarcu ne zbada kot led, kremen ali kristal soli, ampak le spremeni obliko. Elektroni imajo zaradi svoje mobilnosti čas, da se trenutno premikajo udarca in ohranjanje ionov v novem položaju.Zato se kovanje kovin in plastike upogne, ne da bi se zlomilo.
riž. 52. Struktura silicijevega oksida: a) kristalno; b) amorfna. Črne pike označujejo atome silicija, odprti krogi označujejo atome kisika. Upodobljena je ravnina kristala, tako da četrta vez pri atomu silicija ni označena. Črtkana črta označuje red kratkega dosega v neurejenosti amorfne snovi
V amorfni snovi je kršena tridimenzionalna periodičnost strukture, ki je značilna za kristalno stanje (slika 52 b).
Tekočine in plini se od kristalnih in amorfnih teles razlikujejo po naključnem gibanju atomov in
molekule. V tekočinah so privlačne sile sposobne zadržati mikrodelce drug glede drugega na bližnjih razdaljah, sorazmernih z razdaljami v trdnem telesu. V plinih je interakcija atomov in molekul praktično odsotna, zato plini za razliko od tekočin zasedajo celoten volumen, ki jim je na voljo. Mol tekoče vode pri 100 0 C zavzema prostornino 18,7 cm 3, mol nasičene vodne pare pa 30.000 cm 3 pri isti temperaturi. 
riž. 53. Različne vrste interakcij molekul v tekočinah in plinih: a) dipol–dipol; b) dipol–nedipol; v) nedipol–nedipol
Za razliko od trdnih snovi se molekule v tekočinah in plinih prosto gibljejo. Zaradi gibanja so na določen način usmerjeni. Na primer, na sl. 53 a, b. prikazano je, kako delujejo dipolne molekule, pa tudi nepolarne molekule z dipolnimi molekulami v tekočinah in plinih.
Ko se dipol približa dipolu, se molekule vrtijo zaradi privlačnosti in odbijanja. Pozitivno nabit del ene molekule se nahaja v bližini negativno nabitega dela druge. Tako delujejo dipoli v tekoči vodi.
Ko se dve nepolarni molekuli (nedipoli) približata druga drugi na dokaj bližnji razdalji, tudi medsebojno vplivata druga na drugo (slika 53 v). Molekule združujejo negativno nabite elektronske lupine, ki pokrivajo jedra. Elektronske lupine so deformirane tako, da se v obeh molekulah začasno pojavljajo pozitivni in negativni centri in se medsebojno privlačijo. Dovolj je, da se molekule razpršijo, saj začasni dipoli spet postanejo nepolarne molekule.
Primer je interakcija med molekulami plinastega vodika. (slika 53 v).
3.2. Razvrstitev anorganskih snovi. Enostavne in zapletene snovi
Na začetku 19. stoletja je švedski kemik Berzelius predlagal, da se snovi, pridobljene iz živih organizmov, imenujejo organski. Poimenovane so bile snovi, značilne za neživo naravo anorganski oz mineral(dobljeno iz mineralov).
Vse trdne, tekoče in plinaste snovi lahko razdelimo na enostavne in zapletene.
Snovi se imenujejo preproste, sestavljene iz atomov enega kemičnega elementa.
Na primer, vodik, brom in železo pri sobni temperaturi in atmosferskem tlaku so preproste snovi, ki so v plinastem, tekočem in trdnem stanju (slika 54 a B C).
Plinasti vodik H 2 (g) in tekoči brom Br 2 (l) sta sestavljena iz dvoatomskih molekul. Trdno železo Fe(t) obstaja v obliki kristala s kovinsko kristalno mrežo.
Enostavne snovi delimo v dve skupini: nekovine in kovine.
a) b) v)
riž. 54. Preproste snovi: a) plinast vodik. Je lažji od zraka, zato je epruveta zamašena in obrnjena na glavo; b) tekoči brom (običajno shranjen v zaprtih ampulah); v) železov prah
Nekovine so preproste snovi s kovalentno (atomsko) ali molekularno kristalno mrežo v trdnem stanju.
Pri sobni temperaturi je kovalentna (atomska) kristalna mreža značilna za nekovine, kot so bor B(t), ogljik C(t), silicij Si(t). V molekularni kristalni mreži so beli fosfor P (t), žveplo S (t), jod I 2 (t). Nekatere nekovine le pri zelo nizkih temperaturah preidejo v tekoče ali trdno agregacijsko stanje. V normalnih pogojih so plini. Takšne snovi vključujejo na primer vodik H 2 (g), dušik N 2 (g), kisik O 2 (g), fluor F 2 (g), klor Cl 2 (g), helij He (g), neon Ne (d), argon Ar(d). Pri sobni temperaturi obstaja molekularni brom Br 2 (l) v tekoči obliki.
Kovine so preproste snovi s kovinsko kristalno mrežo v trdnem stanju.
To so kovljive, duktilne snovi, ki imajo kovinski lesk in so sposobne prevajati toploto in elektriko.
Približno 80% elementov periodičnega sistema tvori preproste snovi-kovine. Pri sobni temperaturi so kovine trdne snovi. Na primer Li(t), Fe(t). Samo živo srebro, Hg (l) je tekočina, ki se strdi pri -38,89 0 С.
Spojine so snovi, ki so sestavljene iz atomov različnih kemičnih elementov.
Atomi elementov v kompleksni snovi so povezani s stalnimi in natančno določenimi odnosi.
Na primer, voda H 2 O je kompleksna snov. Njegova molekula vsebuje atome dveh elementov. Voda vedno in kjer koli na Zemlji vsebuje 11,1 % vodika in 88,9 % kisika po masi.
Glede na temperaturo in tlak je voda lahko v trdnem, tekočem ali plinastem stanju, kar je označeno desno od kemijske formule snovi - H 2 O (g), H 2 O (g), H 2 O (t).
V praksi se praviloma ne ukvarjamo s čistimi snovmi, temveč z njihovimi mešanicami.
Mešanica je zbirka kemičnih spojin različne sestave in strukture
Predstavljajmo preproste in zapletene snovi, pa tudi njihove zmesi v obliki diagrama:
Preprosto
nekovine
emulzije
Temelji
Kompleksne snovi v anorganski kemiji delimo na okside, baze, kisline in soli.
oksidi
Obstajajo oksidi kovin in nekovin. Kovinski oksidi so spojine z ionskimi vezmi. V trdnem stanju tvorijo ionske kristalne mreže.
Nekovinski oksidi- spojine s kovalentnimi kemičnimi vezmi.
Oksidi so kompleksne snovi, sestavljene iz atomov dveh kemičnih elementov, od katerih je eden kisik, katerega oksidacijsko stanje je -2.
Spodaj so molekularne in strukturne formule nekaterih oksidov nekovin in kovin.
Molekularna formula Strukturna formula
CO 2 - ogljikov monoksid (IV) O \u003d C \u003d O
 SO 2 - žveplov oksid (IV)
SO 2 - žveplov oksid (IV)
SO 3 - žveplov oksid (VI)
SiO 2 - silicijev oksid (IV)
Na 2 O - natrijev oksid
CaO - kalcijev oksid
K 2 O - kalijev oksid, Na 2 O - natrijev oksid, Al 2 O 3 - aluminijev oksid. Kalij, natrij in aluminij tvorijo vsak po en oksid.
Če ima element več oksidacijskih stanj, obstaja več njegovih oksidov. V tem primeru je za imenom oksida stopnja oksidacije elementa označena z rimsko številko v oklepaju. Na primer, FeO je železov (II) oksid, Fe 2 O 3 je železov (III) oksid.
Poleg imen, oblikovanih v skladu s pravili mednarodne nomenklature, se uporabljajo tradicionalna ruska imena za okside, na primer: CO 2 ogljikov monoksid (IV) - ogljikov dioksid, CO ogljikov monoksid (II) – ogljikov monoksid, CaO kalcijev oksid - živo apno, SiO 2 silicijev oksid – kremen, kremen, pesek.
Obstajajo tri skupine oksidov, ki se razlikujejo po kemičnih lastnostih, - bazična, kisla in amfoterično(drugo grško , - oba, dvojina).
Osnovni oksidi tvorijo elementi glavnih podskupin skupin I in II periodnega sistema (oksidacijsko stanje elementov je +1 in +2), pa tudi elementi sekundarnih podskupin, katerih oksidacijsko stanje je prav tako +1 ali + 2. Vsi ti elementi so kovine, torej osnovni oksidi so kovinski oksidi, Na primer:
Li 2 O - litijev oksid
MgO - magnezijev oksid
CuO - bakrov (II) oksid
Osnovni oksidi ustrezajo bazam.
Kislinski oksidi
tvorijo nekovine in kovine, katerih oksidacijsko stanje je večje od +4, na primer:
CO 2 - ogljikov monoksid (IV)
SO 2 - žveplov oksid (IV)
SO 3 - žveplov oksid (VI)
P 2 O 5 - fosforjev oksid (V)
Kislinski oksidi ustrezajo kislinam.
Amfoterni oksidi
tvorijo kovine, katerih oksidacijsko stanje je +2, +3, včasih +4, na primer:
ZnO - cinkov oksid
Al 2 O 3 - aluminijev oksid
Amfoterni oksidi ustrezajo amfoternim hidroksidom.
Poleg tega obstaja majhna skupina ti indiferentni oksidi:
N 2 O - dušikov oksid (I)
NO - dušikov oksid (II)
CO - ogljikov monoksid (II)
Treba je opozoriti, da je eden najpomembnejših oksidov na našem planetu vodikov oksid, ki vam ga poznamo kot voda H 2 O.
Temelji
V razdelku "Oksidi" je bilo omenjeno, da baze ustrezajo osnovnim oksidom:
Natrijev oksid Na 2 O - natrijev hidroksid NaOH.
Kalcijev oksid CaO - kalcijev hidroksid Ca (OH) 2.
Bakrov oksid CuO - bakrov hidroksid Cu (OH) 2
Baze so kompleksne snovi, sestavljene iz kovinskega atoma in ene ali več hidrokso skupin -OH.
Baze so trdne snovi z ionsko kristalno mrežo.
Ko se raztopijo v vodi, se kristali topnih baz ( alkalije) se uničijo zaradi delovanja polarnih molekul vode in nastanejo ioni:
NaOH(t) Na + (raztopina) + OH - (raztopina)
Podoben zapis ionov: Na + (raztopina) ali OH - (raztopina) pomeni, da so ioni v raztopini.
Ime fundacije vključuje besedo hidroksid in rusko ime kovine v rodilniku. Na primer, NaOH je natrijev hidroksid, Ca (OH) 2 je kalcijev hidroksid.
Če kovina tvori več baz, je oksidacijsko stanje kovine označeno v imenu z rimsko številko v oklepaju. Na primer: Fe (OH) 2 - železov (II) hidroksid, Fe (OH) 3 - železov (III) hidroksid.
Poleg tega obstajajo tradicionalna imena za nekatere razloge:
NaOH- kavstična soda, kavstična soda
KOH - kavstična pepelika
Ca (OH) 2 - gašeno apno, apnena voda
R
Vodotopne baze se imenujejo alkalije
Razlikovati topne in netopne baze v vodi.
To so kovinski hidroksidi glavnih podskupin skupin I in II, razen hidroksidov Be in Mg.
Amfoterni hidroksidi vključujejo:
HCl (g) H + (raztopina) + Cl - (raztopina)
Kisline imenujemo kompleksne snovi, ki vključujejo vodikove atome, ki jih je mogoče nadomestiti ali zamenjati za kovinske atome, in kislinske ostanke.
Glede na prisotnost ali odsotnost kisikovih atomov v molekuli, anoksična in ki vsebujejo kisik kisline.
Za poimenovanje kislin brez kisika se ruskemu imenu nekovine doda črka - o- in beseda vodik :
HF - fluorovodikova kislina
HCl - klorovodikova kislina
HBr - bromovodikova kislina
HI - jodovodikova kislina
H 2 S - hidrosulfidna kislina
Tradicionalna imena za nekatere kisline:
HCl- klorovodikova kislina; HF- fluorovodikova kislina
Za poimenovanje kislin, ki vsebujejo kisik, se korenu ruskega imena nekovine dodajo končnice - ne,
-ovayače je nekovina v najvišjem oksidacijskem stanju. Najvišje oksidacijsko stanje sovpada s številko skupine, v kateri se nahaja nekovinski element:
H 2 SO 4 - ser naya kisline
HNO 3 - dušik naya kisline
HClO 4 - klor naya kisline
HMnO 4 - mangan novo kisline
Če element tvori kisline v dveh oksidacijskih stanjih, se končnica uporablja za poimenovanje kisline, ki ustreza nižjemu oksidacijskemu stanju elementa - prav:
H 2 SO 3 - gams prav kisline
HNO 2 - dušik prav kisline
Glede na število vodikovih atomov v molekuli, enoosnovni(HCl, HNO 3), dvoosnovni(H 2 SO 4), triosnovni kisline (H 3 PO 4).
Številne kisline, ki vsebujejo kisik, nastanejo z interakcijo ustreznih kislih oksidov z vodo. Oksid, ki ustreza dani kislini, se imenuje njen anhidrid:
Žveplov dioksid SO 2 - žveplova kislina H 2 SO 3
Žveplov anhidrid SO 3 - žveplova kislina H 2 SO 4
Dušikov anhidrid N 2 O 3 - dušikova kislina HNO 2
Dušikov anhidrid N 2 O 5 - dušikova kislina HNO 3
Fosforjev anhidrid P 2 O 5 - fosforjeva kislina H 3 PO 4
Upoštevajte, da sta oksidacijska stanja elementa v oksidu in ustrezni kislini enaka.
Če element v istem oksidacijskem stanju tvori več kislin, ki vsebujejo kisik, se imenu kisline z nižjo vsebnostjo kisikovih atomov doda predpona "". meta", z visoko vsebnostjo kisika - predpona" orto". Na primer:
HPO 3 - metafosforna kislina
H 3 PO 4 - ortofosforna kislina, ki jo pogosto imenujemo preprosto fosforjeva kislina
H 2 SiO 3 - metasilicijeva kislina, običajno imenovana silicijeva kislina
H 4 SiO 4 - ortosilicijeva kislina.
Silicijeve kisline ne nastanejo z interakcijo SiO 2 z vodo, pridobivamo jih na drugačen način.
Z
Soli so kompleksne snovi, sestavljene iz kovinskih atomov in kislinskih ostankov.
oli
NaNO 3 - natrijev nitrat
CuSO 4 - bakrov sulfat (II)
CaCO 3 - kalcijev karbonat
Ko se raztopijo v vodi, se kristali soli uničijo, nastanejo ioni:
NaNO 3 (t) Na + (raztopina) + NO 3 - (raztopina).
Soli lahko obravnavamo kot produkte popolne ali delne zamenjave vodikovih atomov v molekuli kisline s kovinskimi atomi ali kot produkte popolne ali delne zamenjave baznih hidrokso skupin s kislimi ostanki.
S popolno zamenjavo vodikovih atomov, srednje soli: Na2SO4, MgCl2. . Z delno zamenjavo, kislinske soli (hidrosoli) NaHSO4 in bazične soli (hidroksosoli) MgOHCl.
V skladu s pravili mednarodne nomenklature so imena soli tvorjena iz imena kislinskega ostanka v imeniku in ruskega imena kovine v rodilniku (tabela 12):
NaNO 3 - natrijev nitrat
CuSO 4 - bakrov(II) sulfat
CaCO 3 - kalcijev karbonat
Ca 3 (RO 4) 2 - kalcijev ortofosfat
Na 2 SiO 3 - natrijev silikat
Ime kislinskega ostanka izhaja iz korena latinskega imena elementa, ki tvori kislino (na primer dušik - dušik, koren nitr-) in končnic:
-pri za najvišje oksidacijsko stanje, -to za nižje oksidacijsko stanje elementa, ki tvori kislino (tabela 12).
Tabela 12
Imena kislin in soli
| Ime kisline | Formula kisline | Ime soli | Primeri Soleil |
| Vodikov klorid (sol) | HCl | kloridi | AgCl srebrov klorid |
| Vodikov sulfid | H 2 S | Sulfidi | FeS Sulf idželezo (II) |
| žveplasti | H2SO3 | Sulfiti | Na 2 SO 3 sulf to natrij |
| žveplovo | H2SO4 | sulfati | K 2 SO 4 Sulf pri kalij |
| dušikov | HNO 2 | Nitriti | LiNO 2 Nitr to litij |
| dušik | HNO3 | Nitrati | Al(NO 3) 3 Nitr pri aluminij |
| ortofosforni | H3PO4 | Ortofosfati | Ca 3 (PO 4) 2 Kalcijev ortofosfat |
| Premog | H2CO3 | Karbonati | Na 2 CO 3 natrijev karbonat |
| silicij | H2SiO3 | silikati | Na 2 SiO 3 Natrijev silikat |
NaHSO 4 - natrijev hidrogen sulfat
NaHS - natrijev hidrosulfid
Imena osnovnih soli so sestavljena z dodajanjem predpone " hidrokso": MgOHCl - magnezijev hidroksoklorid.
Poleg tega imajo številne soli tradicionalna imena, kot so:
Na 2 CO 3 - soda;
NaHCO3 - soda za hrano (pitna);
CaCO 3 - kreda, marmor, apnenec.