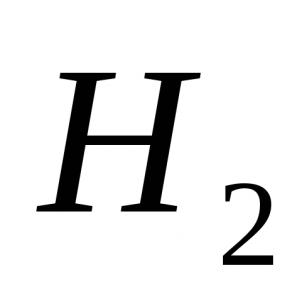Dihloretāna mijiedarbība ar skābekļa 9 gāzveida stāvokli. Ķīmiskās un fizikālās īpašības, skābekļa izmantošana un ražošana
Lekcija „Skābeklis – ķīmiskais elements un vienkārša viela »
Lekcijas plāns:
1. Skābeklis ir ķīmiskais elements:
c) ķīmiskā elementa izplatība dabā
2. Skābeklis ir vienkārša viela
a) skābekļa iegūšana
b) Skābekļa ķīmiskās īpašības
c) skābekļa cikls dabā
d) skābekļa izmantošana
"Dum spiro spero
"(Kamēr es elpoju, es ceru ...), - saka latīņu valoda
Elpošana ir dzīvības sinonīms, un dzīvības avots uz Zemes ir skābeklis.
Uzsverot skābekļa nozīmi zemes procesos, Jēkabs Berzēliuss teica: ”Skābeklis ir viela, ap kuru griežas zemes ķīmija.”Šīs lekcijas materiālā ir apkopotas iepriekš iegūtās zināšanas par tēmu "Skābeklis".
1. Skābeklis ir ķīmisks elements
a) Ķīmiskā elementa - skābekļa raksturojums pēc tā stāvokļa PSCE

Skābeklis - sestās grupas, D. I. Mendeļejeva ķīmisko elementu periodiskās sistēmas otrā perioda galvenās apakšgrupas elements ar atomu kārtas numuru 8. To apzīmē ar simbolu. O(lat.Oxygenium). Ķīmiskā elementa skābekļa relatīvā atommasa ir 16, t.i. Ar(O)=16.
b) Skābekļa atoma valences iespējas
Savienojumos skābeklis parasti ir divvērtīgs (oksīdos), valence VI Tas sastopams brīvā formā divu vienkāršu vielu veidā: O 2 (“parastais” skābeklis) un O 3 (ozons). Apmēram 2 - bezkrāsaina un bez smaržas gāze, ar relatīvo molekulmasu =32. O 3 - bezkrāsaina gāze ar asu smaku, ar relatīvo molekulmasu = 48.
Uzmanību! H 2 O 2 ( ūdeņraža peroksīds) - O (valence II)
CO (oglekļa monoksīds) - O (valence III)
c) ķīmiskā elementa skābekļa izplatība dabā
Skābeklis ir visizplatītākais elements uz Zemes, tā daļa (kā daļa no dažādiem savienojumiem, galvenokārt silikātiem) veido aptuveni 49% no cietās zemes garozas masas. Jūras un saldūdeņi satur milzīgu daudzumu saistītā skābekļa - 85,5% (pēc masas), atmosfērā brīvā skābekļa saturs ir 21% pēc tilpuma un 23% pēc masas. Vairāk nekā 1500 zemes garozas savienojumu satur skābekli savā sastāvā.
Skābeklis ir daudzu organisko vielu sastāvdaļa un atrodas visās dzīvās šūnās. Runājot par atomu skaitu dzīvās šūnās, tas ir aptuveni 20%, pēc masas daļas - aptuveni 65%.
2. Skābeklis ir vienkārša viela
a) skābekļa iegūšana
Iegūšana laboratorijā
1) Kālija permanganāta (kālija permanganāta) sadalīšanās:
2KMnO 4 t˚C \u003d K 2 MnO 4 +MnO 2 +O 2
2) Ūdeņraža peroksīda sadalīšanās:
2H 2 O 2 MnO2 \u003d 2H 2 O + O 2
3) Berthollet sāls sadalīšanās:
2KClO 3 t˚C, MnO2 \u003d 2KCl + 3O 2
Saņemšana rūpniecībā
1) Ūdens elektrolīze
2 H 2 O el. strāva \u003d 2 H 2 + O 2
2) No zila gaisa
GAISA spiediens, -183˚ C = O 2 (zils šķidrums)
Pašlaik rūpniecībā skābekli iegūst no gaisa. Laboratorijās nelielu daudzumu skābekļa var iegūt, karsējot kālija permanganātu (kālija permanganātu) KMnO 4 . Skābeklis nedaudz šķīst ūdenī un ir smagāks par gaisu, tāpēc to var iegūt divos veidos:
Plāns:
Atklājumu vēsture
Vārda izcelsme
Atrodoties dabā
Kvīts
Fizikālās īpašības
Ķīmiskās īpašības
Pieteikums
Skābekļa bioloģiskā loma
Toksiski skābekļa atvasinājumi
10. Izotopi
Skābeklis
Skābeklis- 16. grupas elements (pēc novecojušās klasifikācijas - VI grupas galvenā apakšgrupa), D. I. Mendeļejeva ķīmisko elementu periodiskās sistēmas otrais periods, ar atomskaitli 8. To apzīmē ar simbolu O (lat. . Oxygenium). Skābeklis ir reaktīvs nemetāls un ir vieglākais halkogēna grupas elements. vienkārša viela skābeklis(CAS numurs: 7782-44-7) normālos apstākļos - gāze bez krāsas, garšas un smaržas, kuras molekula sastāv no diviem skābekļa atomiem (formula O 2), un tāpēc to sauc arī par dioksīdu.Šķidrajam skābeklim ir gaiši zils, un cietā viela ir gaiši zili kristāli.
Ir arī citas skābekļa alotropās formas, piemēram, ozons (CAS numurs: 10028-15-6) - normālos apstākļos zila gāze ar specifisku smaržu, kuras molekula sastāv no trim skābekļa atomiem (formula O 3).
Atklājumu vēsture
Oficiāli tiek uzskatīts, ka skābekli 1774. gada 1. augustā atklāja angļu ķīmiķis Džozefs Prīstlijs, sadalot dzīvsudraba oksīdu hermētiski noslēgtā traukā (Prīstlijs, izmantojot spēcīgu lēcu, vērsa saules starus uz šo savienojumu).
Tomēr Prīstlijs sākotnēji neaptvēra, ka ir atklājis jaunu vienkāršu vielu, viņš uzskatīja, ka viņš izolēja vienu no gaisa sastāvdaļām (un sauca šo gāzi par "deflogisticated gaisu"). Prīstlijs par savu atklājumu ziņoja izcilajam franču ķīmiķim Antuānam Lavuazjē. 1775. gadā A. Lavuazjē konstatēja, ka skābeklis ir neatņemama gaisa, skābju sastāvdaļa un atrodams daudzās vielās.
Dažus gadus iepriekš (1771. gadā) zviedru ķīmiķis Karls Šēle bija ieguvis skābekli. Viņš kalcinēja salpetru ar sērskābi un pēc tam sadalīja iegūto slāpekļa oksīdu. Šēle šo gāzi nosauca par "ugunīgu gaisu" un savu atklājumu aprakstīja 1777. gadā izdotā grāmatā (tieši tāpēc, ka grāmata tika izdota vēlāk, nekā Prīstlijs paziņoja par savu atklājumu, pēdējais tiek uzskatīts par skābekļa atklājēju). Šēle par savu pieredzi ziņoja arī Lavuazjē.
Svarīgs posms, kas veicināja skābekļa atklāšanu, bija franču ķīmiķa Pjēra Baiena darbs, kurš publicēja darbu par dzīvsudraba oksidēšanu un sekojošo tā oksīda sadalīšanos.
Visbeidzot A. Lavuazjē beidzot saprata iegūtās gāzes būtību, izmantojot informāciju no Prīstlija un Šēla. Viņa darbam bija liela nozīme, jo, pateicoties tam, tika gāzta tolaik dominējošā flogistona teorija, kas kavēja ķīmijas attīstību. Lavuazjē veica eksperimentu par dažādu vielu sadegšanu un atspēkoja flogistona teoriju, publicējot rezultātus par sadegušo elementu svaru. Pelnu svars pārsniedza elementa sākotnējo svaru, kas deva Lavuāzjē tiesības apgalvot, ka degšanas laikā notiek vielas ķīmiska reakcija (oksidācija), saistībā ar to palielinās sākotnējās vielas masa, kas atspēko flogistona teorija.
Tādējādi patiesību par skābekļa atklāšanu dala Prīstlijs, Šēls un Lavuazjē.
vārda izcelsme
Vārds skābeklis (19. gs. sākumā to vēl sauca par "skābi"), tā parādīšanās krievu valodā zināmā mērā ir M. V. Lomonosova dēļ, kurš līdz ar citiem neoloģismiem ieviesa vārdu "skābe"; tātad vārds "skābeklis" savukārt bija pauspapīrs terminam "skābeklis" (franču oxygène), ko ierosināja A. Lavuazjē (no grieķu valodas ὀξύς — "skābs" un γεννάω — "es dzemdēju"), kas tulkojumā nozīmē “ģenerē skābi”, kas ir saistīta ar tās sākotnējo nozīmi – “skābe”, kas iepriekš apzīmēja vielas, ko saskaņā ar mūsdienu starptautisko nomenklatūru sauca par oksīdiem.
Atrodoties dabā
Skābeklis ir visizplatītākais elements uz Zemes, tā daļa (kā daļa no dažādiem savienojumiem, galvenokārt silikātiem) veido aptuveni 47,4% no cietās zemes garozas masas. Jūrā un saldūdeņos ir milzīgs daudzums saistītā skābekļa - 88,8% (masas), atmosfērā brīvā skābekļa saturs ir 20,95% pēc tilpuma un 23,12% pēc masas. Vairāk nekā 1500 zemes garozas savienojumu satur skābekli savā sastāvā.
Skābeklis ir daudzu organisko vielu sastāvdaļa un atrodas visās dzīvās šūnās. Runājot par atomu skaitu dzīvās šūnās, tas ir aptuveni 25%, pēc masas daļas - aptuveni 65%.
Skābeklis (lat. Oxygenium), O, Mendeļejeva periodiskās sistēmas VI grupas ķīmiskais elements; atomskaitlis 8, atommasa 15,9994. Normālos apstākļos skābeklis ir bezkrāsaina, bez smaržas un garšas gāze. Grūti nosaukt citu elementu, kam uz mūsu planētas būtu tik svarīga loma kā skābeklis.
Vēstures atsauce. Degšanas un elpošanas procesi jau sen ir piesaistījuši zinātnieku uzmanību. Pirmās norādes, ka ne viss gaiss, bet tikai tā "aktīvā" daļa atbalsta degšanu, tika atrastas 8. gadsimta ķīniešu manuskriptos. Daudz vēlāk Leonardo da Vinči (1452-1519) uzskatīja gaisu par divu gāzu maisījumu, no kurām tikai viena tiek patērēta degšanas un elpošanas laikā. Divu galveno gaisa sastāvdaļu - slāpekļa un skābekļa - galīgais atklājums, kas radīja laikmetu zinātnē, notika tikai 18. gadsimta beigās. Skābekli gandrīz vienlaikus ieguva K. Šēle (1769-70), kalcinējot salpetru (KNO3, NaNO3), mangāna dioksīdu MnO2 un citas vielas, un J. Prīstlijs (1774), karsējot sarkano svinu Pb3O4 un dzīvsudraba oksīdu HgO. 1772. gadā D. Rezerfords atklāja slāpekli. 1775. gadā A. Lavuazjē, veicot gaisa kvantitatīvo analīzi, atklāja, ka tas “sastāv no divām (gāzēm) ar atšķirīgu un, tā teikt, pretēju raksturu”, tas ir, no skābekļa un slāpekļa. Pamatojoties uz plašiem eksperimentāliem pētījumiem, Lavuazjē pareizi izskaidroja sadegšanu un elpošanu kā procesus vielu mijiedarbībai ar skābekli. Tā kā skābeklis ir skābju sastāvdaļa, Lavuazjē to sauca par skābekli, tas ir, "skābju veidotājs" (no grieķu oxys - skābs un gennao - es dzemdēju; no šejienes arī krievu nosaukums "skābeklis").
Skābekļa izplatība dabā. Skābeklis ir visizplatītākais ķīmiskais elements uz Zemes. Saistītais skābeklis veido aptuveni 6/7 no Zemes ūdens čaulas masas - hidrosfēras (85,82% pēc masas), gandrīz pusi no litosfēras (47% pēc masas) un tikai atmosfērā, kur skābeklis atrodas brīvā slānī. stāvoklī, vai tas ieņem otro vietu (23 ,15% no svara) aiz slāpekļa.
Skābeklis ieņem pirmo vietu arī veidojošo minerālu skaita ziņā (1364); No minerālvielām, kas satur skābekli, dominē silikāti (laukšpats, vizlas un citi), kvarcs, dzelzs oksīdi, karbonāti un sulfāti. Dzīvos organismos vidēji ap 70% skābekļa; tā ir daļa no vairuma svarīgāko organisko savienojumu (olbaltumvielas, tauki, ogļhidrāti utt.) un skeleta neorganisko savienojumu sastāvā. Brīvā skābekļa loma bioķīmiskajos un fizioloģiskos procesos, īpaši elpošanā, ir ārkārtīgi svarīga. Visi dzīvnieki un augi, izņemot dažus anaerobos mikroorganismus, savai dzīvībai nepieciešamo enerģiju iegūst dažādu vielu bioloģiskās oksidēšanās rezultātā ar skābekļa palīdzību.
Visa Zemes brīvā skābekļa masa radās un saglabājas, pateicoties zaļo augu dzīvībai svarīgai aktivitātei uz zemes un Pasaules okeānā, kas fotosintēzes procesā izdala skābekli. Uz zemes virsmas, kur notiek fotosintēze un dominē brīvais skābeklis, veidojas asi oksidējoši apstākļi. Gluži pretēji, magmā, kā arī dziļos pazemes ūdeņu apvāršņos, jūru un ezeru dūņās, purvos, kur nav brīva skābekļa, veidojas reducējoša vide. Oksidācijas-reducēšanās procesi, kuros ir iesaistīts skābeklis, nosaka daudzu elementu koncentrāciju un derīgo izrakteņu - akmeņogļu, naftas, sēra, dzelzsrūdas, vara u.c. Cilvēka ekonomiskā darbība ievieš izmaiņas arī skābekļa ciklā. Dažās rūpnieciski attīstītajās valstīs kurināmā sadegšana patērē vairāk skābekļa, nekā augi saražo fotosintēzes laikā. Kopumā pasaulē kurināmā sadedzināšanai gadā tiek patērētas aptuveni 9·109 tonnas skābekļa.
Skābekļa izotopi, atoms un molekula. Skābeklim ir trīs stabili izotopi: 16O, 17O un 18O, kuru vidējais saturs ir attiecīgi 99,759%, 0,037% un 0,204% no kopējā skābekļa atomu skaita uz Zemes. Vieglākā no tiem 16O krasais pārsvars izotopu maisījumā ir saistīts ar to, ka 16O atoma kodols sastāv no 8 protoniem un 8 neitroniem. Un šādiem kodoliem, kā izriet no atoma kodola teorijas, ir īpaša stabilitāte.
Saskaņā ar skābekļa stāvokli Mendeļejeva periodiskajā elementu sistēmā skābekļa atoma elektroni atrodas uz diviem apvalkiem: 2 - uz iekšējā un 6 - uz ārējo (konfigurācija 1s22s22p4). Tā kā skābekļa atoma ārējais apvalks nav piepildīts un jonizācijas potenciāls un elektronu afinitāte ir attiecīgi 13,61 un 1,46 eV, skābekļa atoms ķīmiskajos savienojumos parasti iegūst elektronus un tam ir negatīvs efektīvais lādiņš. Gluži pretēji, ir ārkārtīgi reti savienojumi, kuros elektroni tiek atdalīti (precīzāk, atvilkti) no skābekļa atoma (piemēram, F2O, F2O3). Iepriekš, pamatojoties tikai uz skābekļa stāvokli periodiskajā sistēmā, skābekļa atomam oksīdos un lielākajā daļā citu savienojumu tika piešķirts negatīvs lādiņš (-2). Taču, kā liecina eksperimentālie dati, O2 - jons neeksistē ne brīvā stāvoklī, ne savienojumos, un skābekļa atoma negatīvais efektīvais lādiņš gandrīz nekad būtiski nepārsniedz vienotību.
Normālos apstākļos skābekļa molekula ir diatomiska (O2); klusā elektriskā izlādē veidojas arī triatomiskā O3 molekula ozons; pie augsta spiediena O4 molekulas atrodamas nelielos daudzumos. O2 elektroniskā struktūra rada lielu teorētisku interesi. Pamatstāvoklī O2 molekulā ir divi nepāra elektroni; uz to nav attiecināma "parastā" klasiskā struktūrformula O=O ar divām divu elektronu saitēm. Izsmeļošs šī fakta skaidrojums ir sniegts molekulāro orbitāļu teorijas ietvaros. Skābekļa molekulas jonizācijas enerģija (O2 - e > O2+) ir 12,2 eV, un elektronu afinitāte (O2 + e > O2-) ir 0,94 eV. Molekulārā skābekļa disociācija atomos parastā temperatūrā ir niecīga, tā kļūst pamanāma tikai pie 1500°C; 5000°C temperatūrā skābekļa molekulas gandrīz pilnībā sadalās atomos.
Skābekļa fizikālās īpašības. Skābeklis ir bezkrāsaina gāze, kas -182,9°C un normālā spiedienā kondensējas līdz gaiši zilam šķidrumam, kas pie -218,7°C sacietē, veidojot zilus kristālus. Gāzveida skābekļa blīvums (pie 0°C un normālā spiedienā) ir 1,42897 g/l. Skābekļa kritiskā temperatūra ir diezgan zema (Tcrit = -118,84°C), tas ir, zemāka nekā Cl2, CO2, SO2 un dažām citām gāzēm; Tkrits = 4,97 MN/m2 (49,71 atm). Siltumvadītspēja (pie 0°C) 23,86 10-3 W/(m K). Molārā siltumietilpība (pie 0°C) j/(mol K) Cp = 28,9, Cv = 20,5, Cp/Cv = 1,403. Gāzveida skābekļa dielektriskā konstante ir 1,000547 (0°C), šķidruma 1,491. Viskozitāte 189 mpoise (0°C). Skābeklis nedaudz šķīst ūdenī: 20°C un 1 atm temperatūrā 1 m 3 ūdens izšķīst 0,031 m 3, bet 0° C temperatūrā - 0,049 m 3 skābekļa. Labi cietie skābekļa absorbētāji ir platīna melns un aktīvā ogle.
Skābekļa ķīmiskās īpašības. Skābeklis veido ķīmiskus savienojumus ar visiem elementiem, izņemot vieglās inertās gāzes. Būdams visaktīvākais (pēc fluora) nemetāls, skābeklis tieši mijiedarbojas ar lielāko daļu elementu; izņēmums ir smagās inertās gāzes, halogēni, zelts un platīns; to savienojumus ar skābekli iegūst netieši. Gandrīz visas skābekļa reakcijas ar citām vielām - oksidācijas reakcijas ir eksotermiskas, tas ir, tās pavada enerģijas izdalīšanās. Skābeklis ļoti lēni reaģē ar ūdeņradi parastā temperatūrā; virs 550°C šī reakcija norisinās ar sprādzienu 2H2 + O2 = 2H2O.
Skābeklis normālos apstākļos ļoti lēni reaģē ar sēru, oglekli, slāpekli un fosforu. Paaugstinoties temperatūrai, reakcijas ātrums palielinās un pie noteiktas aizdegšanās temperatūras, kas raksturīga katram elementam, sākas degšana. Slāpekļa reakcija ar skābekli N2 molekulas īpašās stiprības dēļ ir endotermiska un kļūst pamanāma tikai virs 1200°C vai elektriskās izlādes gadījumā: N2 + O2 = 2NO. Skābeklis aktīvi oksidē gandrīz visus metālus, īpaši sārmu un sārmzemju metālus. Metāla mijiedarbības ar skābekli aktivitāte ir atkarīga no daudziem faktoriem - metāla virsmas stāvokļa, slīpēšanas pakāpes, piemaisījumu klātbūtnes.
Vielas mijiedarbības procesā ar skābekli ūdens loma ir ārkārtīgi svarīga. Piemēram, pat tik aktīvs metāls kā kālijs nereaģē ar skābekli, kam nav pilnīgi mitruma, bet aizdegas skābeklī parastā temperatūrā pat nenozīmīga ūdens tvaiku daudzuma klātbūtnē. Tiek lēsts, ka korozijas rezultātā ik gadu tiek zaudēti līdz 10% no visa saražotā metāla.
Dažu metālu oksīdi, pievienojot skābekli, veido peroksīda savienojumus, kas satur 2 vai vairāk skābekļa atomus, kas saistīti viens ar otru. Tādējādi peroksīdi Na2O2 un BaO2 ietver peroksīda jonu O22-, superoksīdus NaO2 un KO2 - jonu O2- un ozonīdus NaO3, KO3, RbO3 un CsO3 - jonu O3- Skābeklis eksotermiski mijiedarbojas ar daudzām sarežģītām vielām. Tātad, amonjaks sadedzina skābeklī, ja nav katalizatoru, reakcija notiek saskaņā ar vienādojumu: 4NH3 + 3O2 = 2N2 + 6H2O. Amonjaka oksidēšana ar skābekli katalizatora klātbūtnē dod NO (šo procesu izmanto slāpekļskābes ražošanā). Īpaši svarīga ir ogļūdeņražu (dabasgāzes, benzīna, petrolejas) sadedzināšana - svarīgākais siltuma avots ikdienā un rūpniecībā, piemēram, CH4 + 2O2 = CO2 + 2H2O. Ogļūdeņražu mijiedarbība ar skābekli ir daudzu svarīgāko ražošanas procesu pamatā - piemēram, tā ir tā sauktā metāna pārvēršana ūdeņraža ražošanā: 2CH4 + O2 + 2H2O = 2CO2 + 6H2. Daudzi organiskie savienojumi (ogļūdeņraži ar dubultām vai trīskāršām saitēm, aldehīdi, fenoli, kā arī terpentīns, žāvēšanas eļļas un citi) aktīvi pievieno skābekli. Barības vielu oksidēšana šūnās ar skābekli kalpo kā enerģijas avots dzīviem organismiem.
Skābekļa iegūšana. Ir 3 galvenie skābekļa iegūšanas veidi: ķīmiskā, elektrolīze (ūdens elektrolīze) un fizikālā (gaisa atdalīšana).
Ķīmiskā metode tika izgudrota agrāk nekā citas. Skābekli var iegūt, piemēram, no Bertolet sāls KClOz, kas karsējot sadalās, izdalot O2 0,27 m 3 apjomā uz 1 kg sāls. Bārija oksīds BaO, sildot līdz 540°C, vispirms absorbē skābekli no gaisa, veidojot BaO2 peroksīdu, un pēc tam karsējot līdz 870°C, BaO2 sadalās, izdalot tīru skābekli. To var iegūt arī no KMnO4, Ca2PbO4, K2Cr2O7 un citām vielām, karsējot un pievienojot katalizatorus. Ķīmiskā skābekļa iegūšanas metode ir neefektīva un dārga, tai nav rūpnieciskas nozīmes un tiek izmantota tikai laboratorijas praksē.
Elektrolīzes metode sastāv no tiešas elektriskās strāvas izvadīšanas caur ūdeni, kam pievieno kaustiskās sodas NaOH šķīdumu, lai palielinātu tā elektrisko vadītspēju. Šajā gadījumā ūdens sadalās skābeklī un ūdeņradi. Skābeklis tiek savākts netālu no šūnas pozitīvā elektroda, bet ūdeņradis - netālu no negatīvā. Tādā veidā skābeklis tiek iegūts kā blakusprodukts ūdeņraža ražošanā. Lai iegūtu 2 m3 ūdeņraža un 1 m3 skābekļa, patērē 12-15 kWh elektroenerģijas.
Gaisa atdalīšana ir galvenais veids, kā iegūt skābekli mūsdienu tehnoloģijās. Ir ļoti grūti veikt gaisa atdalīšanu normālā gāzveida stāvoklī, tāpēc gaiss vispirms tiek sašķidrināts un tikai pēc tam sadalīts tā sastāvdaļās. Šo skābekļa iegūšanas metodi sauc par gaisa atdalīšanu ar dziļu dzesēšanu. Pirmkārt, gaiss tiek saspiests ar kompresoru, pēc tam, izejot cauri siltummaiņiem, tas izplešas paplašinātāja mašīnā vai droseļvārstā, kā rezultātā tas tiek atdzesēts līdz 93 K (-180 ° C) temperatūrai. un pārvēršas šķidrā gaisā. Šķidrā gaisa, kas galvenokārt sastāv no šķidrā slāpekļa un šķidrā skābekļa, tālākas atdalīšanas pamatā ir tā sastāvdaļu viršanas punktu atšķirības [Vāra O2 90.18 K (-182.9°C), N2 Vāra 77.36 K (-195.8° WITH) ]. Šķidrajam gaisam pakāpeniski iztvaicējot, vispirms tiek iztvaicēts slāpeklis, un atlikušais šķidrums arvien vairāk tiek bagātināts ar skābekli. Daudzkārt atkārtojot šo procesu uz gaisa atdalīšanas kolonnu destilācijas plāksnēm, tiek iegūts vajadzīgās tīrības (koncentrācijas) šķidrais skābeklis. PSRS ražo mazas (vairāki litri) un pasaulē lielākās skābekļa gaisa atdalīšanas iekārtas (35 000 m 3 /h skābekļa). Šīs vienības ražo tehnoloģisko skābekli ar koncentrāciju 95-98,5%, tehnisko skābekli ar koncentrāciju 99,2-99,9% un tīrāku, medicīnisko skābekli, izdalot produktus šķidrā un gāzveida formā. Elektroenerģijas patēriņš ir no 0,41 līdz 1,6 kWh/m3.
Skābekli var iegūt arī, atdalot gaisu ar selektīvās iespiešanās (difūzijas) metodi caur membrānas starpsienām. Augsta spiediena gaiss tiek izvadīts caur fluoroplasta, stikla vai plastmasas starpsienām, kuru strukturālais režģis spēj iziet cauri dažu komponentu molekulām un noturēt citas.
Gāzveida skābeklis tiek uzglabāts un transportēts tērauda balonos un uztvērējos ar spiedienu 15 un 42 MN/m2 (attiecīgi 150 un 420 bar, vai 150 un 420 atm), šķidrais skābeklis metāla Dewar traukos vai speciālās cisternās-cisternās. Šķidrā un gāzveida skābekļa transportēšanai tiek izmantoti arī speciāli cauruļvadi. Skābekļa baloni ir nokrāsoti zilā krāsā un uz tiem ir melns uzraksts "skābeklis".
Skābekļa izmantošana. Tehnisko skābekli izmanto metālu liesmas apstrādes procesos, metināšanā, skābekļa griešanā, virsmas rūdīšanā, metalizācijā un citos, kā arī aviācijā, zemūdenēs utt. Tehnoloģiskais skābeklis tiek izmantots ķīmiskajā rūpniecībā mākslīgās šķidrās degvielas, smēreļļu, slāpekļskābes un sērskābes, metanola, amonjaka un amonjaka mēslošanas līdzekļu, metālu peroksīdu un citu ķīmisko produktu ražošanā. Šķidru skābekli izmanto spridzināšanas darbos, reaktīvos dzinējos un laboratorijas praksē kā aukstumaģentu.
Tīrs skābeklis, kas ir ievietots cilindros, tiek izmantots elpošanai lielā augstumā, kosmosa lidojumu laikā, niršanas laikā utt. .P.
Skābekli plaši izmanto metalurģijā, lai intensificētu vairākus pirometalurģiskos procesus. Metalurģijas blokos ieplūstošā gaisa pilnīga vai daļēja aizvietošana ar skābekli ir mainījusi procesu ķīmiju, to termiskos parametrus un tehniskos un ekonomiskos rādītājus. Skābekļa strūkla ļāva samazināt siltuma zudumus ar izejošām gāzēm, no kurām ievērojama daļa gaisa spridzināšanas laikā bija slāpeklis. Nepiedaloties ķīmiskajos procesos, slāpeklis palēnināja reakciju gaitu, samazinot aktīvo reaģentu koncentrāciju redoksvidē. Attīrot ar skābekli, samazinās degvielas patēriņš, uzlabojas metāla kvalitāte, metalurģijas agregātos var iegūt jaunus izstrādājumu veidus (piemēram, šim procesam neparasta sastāva izdedžus un gāzes, kurām ir īpašs tehnisks pielietojums), utt.
Pirmie eksperimenti par ar skābekli bagātinātas strūklas izmantošanu domnu ražošanā čuguna un feromangāna kausēšanai tika veikti vienlaikus PSRS un Vācijā 1932.-33.gadā. Palielinātais skābekļa saturs domnā ir saistīts ar lielu pēdējās patēriņa samazinājumu, savukārt oglekļa monoksīda saturs domnas gāzē palielinās un tā sadegšanas siltums palielinās. Spridzināšanas bagātināšana ar skābekli ļauj palielināt domnas produktivitāti, un kombinācijā ar kurtuvi piegādāto gāzveida un šķidro kurināmo samazina koksa patēriņu. Šajā gadījumā par katru papildu skābekļa procentuālo daudzumu sprādzienā produktivitāte palielinās par aptuveni 2,5%, un koksa patēriņš samazinās par 1%.
Skābeklis PSRS martenu ražošanā pirmo reizi tika izmantots, lai pastiprinātu kurināmā sadedzināšanu (rūpnieciskā mērogā skābekli šim nolūkam pirmo reizi izmantoja Sirpjveida un āmura un Krasnoje Sormovo rūpnīcās 1932.-33.g.). 1933. gadā viņi sāka pūst skābekli tieši šķidruma vannā, lai apdares periodā oksidētu piemaisījumus. Palielinoties kausējuma pūšanas intensitātei par 1 m 3 /t 1 stundā, krāsns produktivitāte palielinās par 5-10%, degvielas patēriņš samazinās par 4-5%. Tomēr pūšana palielina metāla zudumus. Pie skābekļa patēriņa līdz 10 m 3 /t stundā, tērauda iznākums nedaudz samazinās (līdz 1%). Skābeklis kļūst arvien izplatītāks martena ražošanā. Tātad, ja 1965.gadā ar skābekļa izmantošanu martena krāsnīs tika izkausēts 52,1% tērauda, tad 1970.gadā jau 71%.
Eksperimenti par skābekļa izmantošanu elektriskajās tērauda kausēšanas krāsnīs PSRS sākās 1946. gadā Elektrostal rūpnīcā. Skābekļa strūklas ieviešana ļāva palielināt krāšņu produktivitāti par 25-30%, samazināt īpatnējo enerģijas patēriņu par 20-30%, uzlabot tērauda kvalitāti, samazināt elektrodu un dažu deficītu leģējošu piedevu patēriņu. Skābekļa padeve elektriskajām krāsnīm izrādījās īpaši efektīva nerūsējošā tērauda ar zemu oglekļa saturu ražošanā, kura kausēšana ir ļoti sarežģīta elektrodu karburizējošās iedarbības dēļ. PSRS, izmantojot skābekli, ražotā elektrotērauda īpatsvars nepārtraukti pieauga un 1970. gadā sastādīja 74,6% no kopējās tērauda produkcijas.
Kupolkausēšanā ar skābekli bagātinātu strūklu galvenokārt izmanto čuguna lielai pārkaršanai, kas nepieciešama augstas kvalitātes, jo īpaši augstleģētu lējumu (silīcija, hroma uc) ražošanā. Atkarībā no kupola spridzināšanas skābekļa bagātināšanas pakāpes degvielas patēriņš samazinās par 30-50%, sēra saturs metālā samazinās par 30-40%, kupola produktivitāte palielinās par 80-100%, un ievērojami palielinās no tā ražotā čuguna temperatūra (līdz 1500 ° C).
Skābeklis krāsainajā metalurģijā kļuva plaši izplatīts nedaudz vēlāk nekā melnajā metalurģijā. Ar skābekli bagātinātu strūklu izmanto matējuma pārveidošanā, izdedžu sublimācijas, valezēšanas, aglomerācijas procesos un vara koncentrātu atstarojošā kausēšanā. Svina, vara un niķeļa rūpniecībā skābekļa strūkla pastiprināja raktuvju kausēšanas procesus, ļāva samazināt koksa patēriņu par 10-20%, palielināt iespiešanos par 15-20% un dažos gadījumos samazināt plūsmu daudzumu par 2- 3 reizes. Cinka sulfīda koncentrātu apdedzināšanas laikā gaisa strūklas bagātināšana ar skābekli līdz 30% palielināja procesa produktivitāti par 70% un samazināja izplūdes gāzu daudzumu par 30%.
skābekļa elementa izotopu īpašība
Ārējā apvalka struktūra: 1 s 2 2s 2 2p 4, kas liek domāt, ka skābeklim ir vieglāk piestiprināt sev 2 elektronus pirms ārējā līmeņa piepildīšanas, nekā to atdot. Tāpēc skābeklis ir oksidētājs.
Skābekļa izotopi.
Ir 3 stabilas formas skābeklis: 16 Ak, 17 ak un 18 ak, kuru vidējais saturs ir attiecīgi 99,759%, 0,037% un 0,204% no kopējā atomu skaita.
Visbiežāk sastopamie 16 O, jo tas ir vieglākais (sastāv no 8 protoniem un 8 elektroniem), kas padara to ļoti stabilu.
Skābekļa fizikālās īpašības.
Skābekļa iegūšanas metodes.
Ir 4 veidi, kā iegūt skābeklis:
1. Ūdens elektrolīze.
2. Rūpnieciskā metode: gaisa maisījuma destilācija (skābeklis, kā smagāks elements, paliek maisījumā, un slāpeklis iztvaiko)
3. Laboratorijas metodes oksīdu, peroksīdu, sāļu sadalīšanai:
2KMnO 4 \u003d K 2 MnO 4 + MnO 2 + O 2,
2BaO 2 \u003d 2BaO + O 2,
2KNO 3 \u003d 2KNO 2 + O 2.
4. No peroksīdiem (izmanto kosmosā reģenerācijai O2 no oglekļa dioksīda)
2 K2O 2 + 2CO2 = 2K2CO3+O 2.
Skābekļa ķīmiskās īpašības.
Reaģē ar metāliem jau istabas temperatūrā:
2Ca + O 2 \u003d 2CaO,
2Mg + O 2 \u003d 2MgO,
Ar nemetāliem (karsējot):
S + O 2 \u003d SO 2 (T=250°C),
C + O 2 = CO 2 (T = 700°C),
O2 mijiedarbojas ar sarežģītiem savienojumiem:
2NO + O 2 \u003d 2NO 2,
2H 2S + O 2 \u003d 2S + 2H 2 O,
Skābekļa atrašana dabā.
Skābeklis ir visizplatītākais ķīmiskais elements. Saistītais skābeklis veido aptuveni 6/7 no Zemes ūdens čaulas masas - hidrosfēras (85,82% pēc masas), gandrīz pusi no litosfēras (47% pēc masas) un tikai atmosfērā, kur skābeklis atrodas brīvā slānī. stāvoklī, vai tas ieņem otro vietu (23 ,15% no svara) aiz slāpekļa.
Skābeklis veido lielu skaitu minerālvielu: silikātus, kvarcu, dzelzs oksīdus, karbonātus, sulfātus, nitrātus. Tas ir daļa no dzīvo organismu šūnām, piedalās elpošanas, difūzijas, asinsrites procesos, oksidācijas un reducēšanās reakcijās.
Skābeklis ir galvenā fotosintēzes sastāvdaļa.
Skābeklis atrodas periodiskās tabulas novecojušās īsās versijas VI galvenās grupas otrajā periodā. Pēc jaunajiem numerācijas standartiem šī ir 16. grupa. Attiecīgo lēmumu IUPAC pieņēma 1988. gadā. Skābekļa kā vienkāršas vielas formula ir O 2 . Apsveriet tās galvenās īpašības, lomu dabā un ekonomikā. Sāksim ar visas grupas, kuras vadībā ir skābeklis, īpašībām. Elements atšķiras no tā radniecīgajiem halkogēniem, un ūdens atšķiras no ūdeņraža selēna un telūra. Visu atšķirīgo pazīmju skaidrojumu var atrast, tikai uzzinot par atoma uzbūvi un īpašībām.
Halkogēni ir elementi, kas saistīti ar skābekli.
Atomi ar līdzīgām īpašībām periodiskajā sistēmā veido vienu grupu. Skābeklis ir halkogēnu saimes priekšgals, taču atšķiras no tiem vairāku īpašību dēļ.
Grupas priekšteča skābekļa atomu masa ir 16 amu. m.Halkogēni, veidojot savienojumus ar ūdeņradi un metāliem, uzrāda savu parasto oksidācijas pakāpi: -2. Piemēram, ūdens (H 2 O) sastāvā skābekļa oksidācijas skaitlis ir -2.
Tipisko halkogēnu ūdeņraža savienojumu sastāvs atbilst vispārīgajai formulai: H 2 R. Šīm vielām izšķīstot, veidojas skābes. Īpašas īpašības piemīt tikai skābekļa ūdeņraža savienojumam – ūdenim. Pēc zinātnieku domām, šī neparastā viela ir gan ļoti vāja skābe, gan ļoti vāja bāze.

Sēram, selēnam un telūram ir tipiski pozitīvi oksidācijas stāvokļi (+4, +6) savienojumos ar skābekli un citiem augstas elektronegativitātes (EO) nemetāliem. Halkogēna oksīdu sastāvs atspoguļo vispārīgās formulas: RO 2 , RO 3 . Attiecīgajām skābēm ir šāds sastāvs: H 2 RO 3 , H 2 RO 4 .
Elementi atbilst vienkāršām vielām: skābeklis, sērs, selēns, telūrs un polonijs. Pirmajiem trim pārstāvjiem ir nemetāliskas īpašības. Skābekļa formula ir O2. Tā paša elementa alotropā modifikācija ir ozons (O 3). Abas modifikācijas ir gāzes. Sērs un selēns ir cieti nemetāli. Telūrs ir metaloīda viela, elektriskās strāvas vadītājs, polonijs ir metāls.
Skābeklis ir visizplatītākais elements
Mēs jau zinām, ka pastāv cita veida tā paša ķīmiskā elementa pastāvēšana vienkāršas vielas veidā. Tas ir ozons, gāze, kas veido slāni aptuveni 30 km augstumā no zemes virsmas, ko bieži sauc par ozona ekrānu. Saistītais skābeklis ir iekļauts ūdens molekulās, daudzu iežu un minerālu, organisko savienojumu sastāvā.

Skābekļa atoma struktūra
Mendeļejeva periodiskā tabula satur pilnīgu informāciju par skābekli:
- Elementa kārtas numurs ir 8.
- Pamatlādiņš - +8.
- Kopējais elektronu skaits ir 8.
- Skābekļa elektroniskā formula ir 1s 2 2s 2 2p 4 .
Dabā ir trīs stabili izotopi, kuriem ir vienāds sērijas numurs periodiskajā tabulā, identisks protonu un elektronu sastāvs, bet atšķirīgs neitronu skaits. Izotopus apzīmē ar vienu un to pašu simbolu — O. Salīdzinājumam mēs piedāvājam diagrammu, kas atspoguļo trīs skābekļa izotopu sastāvu:

Skābekļa - ķīmiskā elementa īpašības
Atoma 2p apakšlīmenī atrodas divi nepāra elektroni, kas izskaidro oksidācijas stāvokļu -2 un +2 parādīšanos. Abus pārī savienotos elektronus nevar atdalīt, lai palielinātu oksidācijas pakāpi līdz +4, tāpat kā sēra un citu halkogēnu gadījumā. Iemesls ir bezmaksas apakšlīmeņa trūkums. Tāpēc savienojumos ķīmiskais elements skābeklis neuzrāda valenci un oksidācijas pakāpi, kas vienāda ar grupas numuru periodiskās sistēmas īsajā versijā (6). Tās parastais oksidācijas skaitlis ir -2.
Tikai savienojumos ar fluoru skābeklim ir pozitīvs oksidācijas stāvoklis +2, kas tam nav raksturīgs. Divu stipru nemetālu EO vērtība ir atšķirīga: EO(O) = 3,5; EO (F) = 4. Kā elektronnegatīvāks ķīmiskais elements fluors spēcīgāk notur savus elektronus un piesaista skābekļa atomiem valences daļiņas. Tāpēc reakcijā ar fluoru skābeklis ir reducētājs, tas ziedo elektronus.

Skābeklis ir vienkārša viela
Angļu pētnieks D. Prīstlijs 1774. gadā, veicot eksperimentus, dzīvsudraba oksīda sadalīšanās laikā atbrīvoja gāzi. Divus gadus iepriekš K. Šēle ieguva to pašu vielu tīrā veidā. Tikai dažus gadus vēlāk franču ķīmiķis A. Lavuazjē noskaidroja, kāda veida gāze ir daļa no gaisa, pētīja īpašības. Skābekļa ķīmiskā formula ir O 2 . Vielas sastāva ierakstā atspoguļosim elektronus, kas iesaistīti nepolārās kovalentās saites veidošanā - O::O. Aizstāsim katru savienojošo elektronu pāri ar vienu līniju: O=O. Šī skābekļa formula skaidri parāda, ka atomi molekulā ir savienoti starp diviem kopīgiem elektronu pāriem.

Veiksim vienkāršus aprēķinus un noteiksim, kāda ir skābekļa relatīvā molekulmasa: Mr (O 2) \u003d Ar (O) x 2 \u003d 16 x 2 \u003d 32. Salīdzinājumam: Mr (gaiss) \u003d 29. skābekļa formula atšķiras no viena skābekļa atoma. Tas nozīmē, ka Mr (O 3) \u003d Ar (O) x 3 \u003d 48. Ozons ir 1,5 reizes smagāks par skābekli.
Fizikālās īpašības
Skābeklis ir bezkrāsaina, bez garšas un smaržas gāze (normālā temperatūrā un atmosfēras spiedienā). Viela ir nedaudz smagāka par gaisu; šķīst ūdenī, bet nelielos daudzumos. Skābekļa kušanas temperatūra ir negatīva un ir -218,3 °C. Punkts, kurā šķidrais skābeklis pārvēršas atpakaļ gāzveida skābeklī, ir tā viršanas temperatūra. O 2 molekulām šī fiziskā daudzuma vērtība sasniedz -182,96 ° C. Šķidrā un cietā stāvoklī skābeklis iegūst gaiši zilu krāsu.
Skābekļa iegūšana laboratorijā
Sildot, skābekli saturošas vielas, piemēram, kālija permanganāts, izdalās bezkrāsaina gāze, kuru var savākt kolbā vai mēģenē. Ja iedegtu lāpu ienesat tīrā skābeklī, tas deg spožāk nekā gaisā. Divas citas laboratorijas metodes skābekļa iegūšanai ir ūdeņraža peroksīda un kālija hlorāta (bertoleta sāls) sadalīšana. Apsveriet ierīces shēmu, ko izmanto termiskai sadalīšanai.

Mēģenē vai apaļkolbā ieber nedaudz bertoleta sāls, aizver ar aizbāzni ar gāzes izplūdes cauruli. Tā pretējam galam jābūt vērstam (zem ūdens) uz otrādi apgriezto kolbu. Kakls jānolaiž plašā glāzē vai kristalizatorā, kas piepildīts ar ūdeni. Karsējot mēģeni ar Berthollet sāli, izdalās skābeklis. Caur gāzes izplūdes cauruli tas nonāk kolbā, izspiežot no tās ūdeni. Kad kolba ir piepildīta ar gāzi, to aizver zem ūdens ar korķi un apgriež. Šajā laboratorijas eksperimentā iegūto skābekli var izmantot vienkāršas vielas ķīmisko īpašību izpētei.
Degšana
Ja laboratorijā deg vielas skābeklī, tad jāzina un jāievēro ugunsdrošības noteikumi. Ūdeņradis gaisā sadeg acumirklī, un, sajaucoties ar skābekli attiecībā 2:1, tas ir sprādzienbīstams. Vielu sadegšana tīrā skābeklī ir daudz intensīvāka nekā gaisā. Šī parādība ir izskaidrojama ar gaisa sastāvu. Skābeklis atmosfērā ir nedaudz vairāk par 1/5 no daļas (21%). Degšana ir vielu reakcija ar skābekli, kā rezultātā veidojas dažādi produkti, galvenokārt metālu un nemetālu oksīdi. O 2 maisījumi ar degošām vielām ir viegli uzliesmojoši, turklāt iegūtie savienojumi var būt toksiski.
Parastas sveces (vai sērkociņa) degšanu pavada oglekļa dioksīda veidošanās. Mājās var veikt šādu pieredzi. Ja jūs sadedzinat vielu zem stikla burkas vai lielas glāzes, tad degšana apstāsies, tiklīdz viss skābeklis būs iztērēts. Slāpeklis neatbalsta elpošanu un degšanu. Oglekļa dioksīds, oksidācijas produkts, vairs nereaģē ar skābekli. Caurspīdīgs ļauj noteikt klātbūtni pēc sveces sadedzināšanas. Ja sadegšanas produkti tiek izvadīti caur kalcija hidroksīdu, šķīdums kļūst duļķains. Notiek ķīmiska reakcija starp kaļķa ūdeni un oglekļa dioksīdu, kā rezultātā veidojas nešķīstošs kalcija karbonāts.

Skābekļa ražošana rūpnieciskā mērogā
Lētākais process, kura rezultātā tiek iegūtas bezgaisa O 2 molekulas, neietver ķīmiskas reakcijas. Rūpniecībā, teiksim, metalurģijas rūpnīcās gaiss tiek sašķidrināts zemā temperatūrā un augstā spiedienā. Svarīgākās atmosfēras sastāvdaļas, piemēram, slāpeklis un skābeklis, vārās dažādās temperatūrās. Atdaliet gaisa maisījumu, pakāpeniski karsējot līdz normālai temperatūrai. Pirmkārt, tiek atbrīvotas slāpekļa molekulas, pēc tam skābeklis. Atdalīšanas metode ir balstīta uz dažādām vienkāršu vielu fizikālajām īpašībām. Vienkāršas skābekļa vielas formula ir tāda pati kā pirms gaisa dzesēšanas un sašķidrināšanas - O 2.
Dažu elektrolīzes reakciju rezultātā izdalās arī skābeklis, tas tiek savākts virs atbilstošā elektroda. Gāze lielos apjomos nepieciešama rūpniecības un būvniecības uzņēmumiem. Pieprasījums pēc skābekļa nepārtraukti pieaug, īpaši ķīmiskajā rūpniecībā. Iegūto gāzi rūpnieciskiem un medicīniskiem nolūkiem uzglabā tērauda balonos, kas ir aprīkoti ar marķējumu. Cisternas ar skābekli krāso zilā vai zilā krāsā, lai tās atšķirtu no citām sašķidrinātajām gāzēm – slāpekļa, metāna, amonjaka.

Ķīmiskie aprēķini pēc formulas un reakciju vienādojumiem, iesaistot O 2 molekulas
Skābekļa molārās masas skaitliskā vērtība sakrīt ar citu vērtību - relatīvo molekulmasu. Tikai pirmajā gadījumā ir mērvienības. Īsumā, skābekļa vielas un tās molārās masas formula jāraksta šādi: M (O 2) \u003d 32 g / mol. Normālos apstākļos jebkuras gāzes mols atbilst 22,4 litru tilpumam. Tas nozīmē, ka 1 mols O 2 ir 22,4 litri vielas, 2 moli O 2 ir 44,8 litri. Saskaņā ar reakcijas vienādojumu starp skābekli un ūdeņradi, var redzēt, ka mijiedarbojas 2 moli ūdeņraža un 1 mols skābekļa:

Ja reakcijā ir iesaistīts 1 mols ūdeņraža, tad skābekļa tilpums būs 0,5 mol. 22,4 l / mol \u003d 11,2 l.
O 2 molekulu loma dabā un cilvēka dzīvē
Skābekli patērē dzīvie organismi uz Zemes, un tas ir bijis iesaistīts matērijas ciklā vairāk nekā 3 miljardus gadu. Šī ir galvenā viela elpošanai un vielmaiņai, ar tās palīdzību notiek barības vielu molekulu sadalīšanās, tiek sintezēta organismiem nepieciešamā enerģija. Uz Zemes pastāvīgi tiek patērēts skābeklis, bet tā rezerves tiek papildinātas ar fotosintēzes palīdzību. Krievu zinātnieks K. Timirjazevs uzskatīja, ka, pateicoties šim procesam, uz mūsu planētas joprojām pastāv dzīvība.

Skābekļa loma dabā un ekonomikā ir liela:
- uzsūcas elpošanas procesā dzīvie organismi;
- piedalās augu fotosintēzes reakcijās;
- ir daļa no organiskajām molekulām;
- sabrukšanas, fermentācijas, rūsēšanas procesi notiek ar skābekļa līdzdalību, kas darbojas kā oksidētājs;
- izmanto, lai iegūtu vērtīgus organiskās sintēzes produktus.
Sašķidrināto skābekli balonos izmanto metālu griešanai un metināšanai augstā temperatūrā. Šie procesi tiek veikti mašīnbūves rūpnīcās, transporta un būvniecības uzņēmumos. Lai veiktu darbus zem ūdens, pazemē, lielā augstumā vakuumā, cilvēkiem ir nepieciešamas arī O 2 molekulas. izmanto medicīnā, lai bagātinātu slimu cilvēku ieelpotā gaisa sastāvu. Gāze medicīniskiem nolūkiem atšķiras no tehniskās gāzes ar gandrīz pilnīgu piemaisījumu un smakas neesamību.

Skābeklis ir ideāls oksidētājs
Skābekļa savienojumi ir zināmi ar visiem periodiskās tabulas ķīmiskajiem elementiem, izņemot pirmos cēlgāzu saimes pārstāvjus. Daudzas vielas tieši reaģē ar O atomiem, izņemot halogēnus, zeltu un platīnu. Liela nozīme ir parādībām, kas saistītas ar skābekli, ko pavada gaismas un siltuma izdalīšanās. Šādi procesi tiek plaši izmantoti ikdienas dzīvē un rūpniecībā. Metalurģijā rūdu mijiedarbību ar skābekli sauc par grauzdēšanu. Iepriekš sasmalcinātā rūda tiek sajaukta ar skābekli bagātinātu gaisu. Augstās temperatūrās metāli tiek reducēti no sulfīdiem līdz vienkāršām vielām. Tādā veidā iegūst dzelzi un dažus krāsainos metālus. Tīra skābekļa klātbūtne palielina tehnoloģisko procesu ātrumu dažādās ķīmijas, tehnoloģiju un metalurģijas nozarēs.
Lētas metodes parādīšanās skābekļa iegūšanai no gaisa, sadalot to komponentos zemā temperatūrā, stimulēja daudzu rūpnieciskās ražošanas jomu attīstību. Ķīmiķi uzskata O 2 molekulas un O atomus par ideāliem oksidētājiem. Tie ir dabīgi materiāli, dabā pastāvīgi atjaunojas, nepiesārņo vidi. Turklāt ķīmiskās reakcijas, kurās ir iesaistīts skābeklis, visbiežāk beidzas ar cita dabiska un droša produkta - ūdens - sintēzi. Liela ir O 2 loma toksisko rūpniecisko atkritumu neitralizēšanā, ūdens attīrīšanā no piesārņojuma. Papildus skābeklim dezinfekcijai izmanto tā alotropo modifikāciju ozonu. Šai vienkāršajai vielai ir augsta oksidējošā aktivitāte. Kad ūdens tiek ozonēts, piesārņotāji sadalās. Ozonam ir arī kaitīga ietekme uz patogēno mikrofloru.