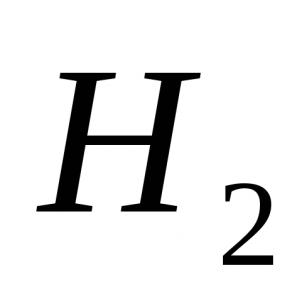Tests “Slāpeklis un tā savienojumi. Tēma: Slāpeklis un tā savienojumi.(Pārbaude) ieskaite ķīmijā (9. klase) par tēmu Ieskaite par tēmu slāpeklis un tā savienojumi
Tests "Slāpeklis un tā savienojumi"
1. iespēja 1. Spēcīgākā molekula a) H2; b) F2; c) O2; d) N 2 . 2. Fenolftaleīna krāsa amonjaka šķīdumā: a) sārtināta; b) zaļš; c) dzeltens; d) zils. 3. Oksidācijas pakāpe ir +3 pie slāpekļa atoma savienojumā: a) NH 4 NO 3; b) NaNO3; c) NO 2; d) KNO 2. 4. Vara (II) nitrāta termiskās sadalīšanās laikā veidojas:a) vara (II) nitrīts un O 2 b) slāpekļa oksīds (IV) un O 2 c) vara(II) oksīds, brūnā gāze NO 2 un O2; d) vara (II) hidroksīds, N 2 un O 2. 5. Kuru jonu veido donora-akceptora mehānisms? a) NH4+; b) NO3-; c) Cl-; d) SO 4 2–. 6. Norādiet spēcīgus elektrolītus: a) slāpekļskābe; b) slāpekļskābe; c) amonjaka ūdens šķīdums; d) amonija nitrāts. 7. Mijiedarbības laikā izdalās ūdeņradis: a) Zn + HNO 3 (razb.); b) Cu + HCl (šķīdums); c) Al + NaOH + H 2 O; d) Zn + H 2 SO 4 (razb.); e) Fe + HNO 3 (konc.). 8. Uzrakstiet vienādojumu cinka reakcijai ar ļoti atšķaidītu slāpekļskābi, ja viens no reakcijas produktiem ir amonija nitrāts. Norādiet koeficientu oksidētāja priekšā. 9.Nosauciet vielas A, B, C. 2. iespēja 1. Ar ūdens izspiešanas metodi nav iespējams savākt: a) slāpekli; b) ūdeņradis; c) skābeklis; d) amonjaks. 2. Amonija jonu reaģents ir: a) kālija sulfāta šķīdums; b) sudraba nitrāts; c) nātrija hidroksīds; d) bārija hlorīds. 3. Mijiedarbojoties ar HNO 3 (konc.) gāzi veido ar vara skaidām: a) N2O; b) NH3; c) NO2; d) H2. 4. Nātrija nitrāta termiskā sadalīšanās rada: a) nātrija oksīds, brūnā gāze NO 2, O 2; b) nātrija nitrīts un O 2; c) nātrijs, brūnā gāze NO 2, O 2; d) nātrija hidroksīds, N 2, O 2. 5. Slāpekļa oksidācijas pakāpe amonija sulfātā: a) -3; b) -1; c) +1; d) +3. 6. Ar kuru no šīm vielām reaģē koncentrēts HNO? 3 normālos apstākļos? a) NaOH; b) AgCl; c) Al; d) Fe; e) Cu. 7. Norādiet jonu skaitu saīsinātajā jonu vienādojumā nātrija sulfāta un sudraba nitrāta mijiedarbībai: a) 1; b) 2; in 3; d) 4. 8. Uzrakstiet vienādojumu magnija mijiedarbībai ar atšķaidītu slāpekļskābi, ja viens no reakcijas produktiem ir vienkārša viela. Norādiet koeficientu vienādojumā oksidētāja priekšā. 9. Uzrakstiet reakcijas vienādojumus šādiem pārveidojumiem:
Nosauciet vielas A, B, C, D.
Atbildes
1. iespēja 1 - G; 2 - a; 3 - G; 4 - iekšā; 5 - a; 6 - a, d; 7 - c, d; 8 – 10,


2Ag + + SO 4 2– = Ag 2 SO 4;
8 – 12, 9. A - NO, B - NO 2, C - HNO 3, D - NH 4 NO 3,
1. iespēja.
Slāpekļa ķīmiskā pazīme: a) P b) N c) Kā d) Ne
Slāpekļa molekula satur: a) dubultsaiti b) vienotu saiti c) trīskāršo saiti
Slāpekļa molekulārā formula: a) N b) N 2 c) N 3 d) Ne
Par slāpekļa fizikālajām īpašībām nav piemērojams : a) gāze b) bez smaržas c) slikti šķīst ūdenī d) brūns.
Slāpeklis savienojumos nevar uzrādīt oksidācijas pakāpi a) +1 b) -3 c) +6 d) +5
Slāpeklis nereaģē ar a) metāliem b) fosforu c) ūdeņradi d) skābekli
Slāpeklim reaģējot ar ūdeņradi, veidojas a) fosfīns b) slāpekļa oksīds (II) c) metāns d) amonjaks
Slāpeklim reaģējot ar skābekli, veidojas a) slāpekļa oksīds (II) b) slāpekļa oksīds (I) c) slāpekļa oksīds (IV) d) slāpekļa oksīds (V)
Slāpekļa savienojumus ar metāliem sauc par a) nitrītiem b) nitrīdiem c) par nitrātiem d) par amonātiem.
Slāpekļa oksidācijas pakāpe amonjakā a) -3 b) +5 c) +3 d) +2
Kurš no īpašumiem nav piemērojams uz amonjaku: a) gāze c) slikti šķīst ūdenī c) ir asa smaka d) viegli sašķidrinās zem spiediena
Amonjaka šķīdumam ir vide: a) skāba b) sārma c) neitrāla d) viegli skāba
Amonjaks nesadarbojas a) ar skābēm b) ar sārmiem c) ar ūdeni d) ar skābekli
Dedzinot amonjaku, veidojas a) slāpekļa oksīds (II) b) ūdens c) slāpeklis d) slāpekļa oksīds (IV)
Amonjaka katalītiskās oksidēšanas laikā papildus ūdenim veidojas a) slāpekļa oksīds (II) b) slāpekļa oksīds (IV) c) slāpekļa oksīds (III) d) slāpekļa oksīds (V)
Kad amonjaks reaģē ar sālsskābi, veidojas a) amonjaka hlorīds b) amonija hlorīds c) amonija sulfāts d) amonija nitrāts
Amonjaku var iegūt laboratorijā, reaģējot a) amonija sāli ar sārmu b) amonija sāli ar skābi c) ūdeņradi ar slāpekli d) amonija sāli ar citiem sāļiem.
Amonjaku ražo rūpniecībā a) amonija sāļi ar sārmu b) amonija sāļi ar skābi c) ūdeņradis ar slāpekli d) amonija sāļi ar citiem sāļiem.
nevar veido sāļus a) skābos b) vidējus c) bāziskos
Amonija sāļus nevar iegūt a) amonjaka mijiedarbībā ar skābēm b) amonjaka šķīdumam mijiedarbojoties ar skābēm c) amonija sāļiem mijiedarbojoties ar skābēm d) amonija sāļiem mijiedarbojoties ar sārmiem.
Kāda reakcija ir kvalitatīva amonija sāļiem a) mijiedarbība ar sārmiem b) mijiedarbība ar skābēm c) mijiedarbība ar citiem sāļiem d) mijiedarbība ar ūdeni.
Kvalitatīvas reakcijas uz amonija jonu pazīme ir a) gāzes izdalīšanās, kas izraisa kaļķa ūdens duļķainību b) gāzes izdalīšanās ar amonjaka smaku c) baltu nogulšņu evolūcija d) brūnās gāzes izdalīšanās. .
Karsējot amonija sāļus, a) izdalās ūdens b) sadalās ar gāzu izdalīšanos c) iztvaikošana d) mainās to krāsa.
Amonija nitrātam sadaloties rodas: a) slāpeklis un ūdens b) slāpekļa oksīds (I) un ūdens c) slāpekļa oksīds (II) un ūdens d) slāpekļa oksīds (IV) un ūdens.
Slāpeklis neveidojas oksīds ar formulu a) NO 2 b) NO 3 c) NO d) N 2 O
Skābais oksīds nav a) NO 2 b) N 2 O 3 c) N 2 O 5 d) NO
Pie sāli neveidojošiem oksīdiem pieder a) NO 2 b) N 2 O 3 c) N 2 O 5 d) N 2 O
Slāpekļskābe neietver a) šķidru b) vienbāzisku c) spēcīgu oksidētāju d) bez smaržas
Slāpekļa oksidācijas pakāpe slāpekļskābē a) +3 b) +5 c) +1 d) -3
nav izveidojies
Slāpekļskābes mijiedarbībā ar metāliem neveidojas a) ūdens b) ūdeņradis c) slāpekļa oksīds d) sāls
Kad koncentrēta slāpekļskābe mijiedarbojas ar metāliem sprieguma virknē pēc ūdeņraža, papildus ūdenim un sāli,
Ja atšķaidīta slāpekļskābe reaģē ar varu, papildus ūdenim un sāli,
a) slāpekļa oksīds (II) b) slāpekļa oksīds (I) c) slāpekļa oksīds (IV) d) amonjaks.
Slāpekļskābe nereaģē ar a) sēra oksīdu (IV) b) nātrija hidroksīdu c) bārija oksīdu d) kalcija karbonātu.
Tests par tēmu "Slāpeklis un tā savienojumi."
2. iespēja.
Slāpekļa ķīmiskā pazīme: a) N b) Nb c) Ar d) S
Slāpekļa molekula satur: a) ūdeņraža saiti b) kovalento polāro saiti c) kovalento nepolāro saiti
Slāpekļa strukturālā formula: a) N=N b) N≡ N c) N- N d) :N::: N:
Par slāpekļa fizikālajām īpašībām nav piemērojams : a) gāze b) ar asu smaku c) slikti šķīst ūdenī d) smagāka par gaisu.
Slāpeklis gaisā pēc tilpuma: a) 50% b) 65% c) 78% d) 85%
Slāpeklis savienojumos nevar uzrādīt oksidācijas pakāpi a) -1 b) +3 c) +4 d) +5
Slāpeklis istabas temperatūrā reaģē ar a) skābekli b) litiju c) ūdeņradi d) nātriju
Slāpeklim reaģējot ar ūdeņradi, veidojas a) sērūdeņradis b) slāpekļa oksīds (IV) c) amonjaks d) slāpekļa oksīds (II)
Slāpekļa mijiedarbība ar skābekli rada a) slāpekļa oksīdu (II) b) slāpekļa oksīdu (I) c) slāpekļa oksīdu (IV) d) slāpekļa oksīdu (III)
Slāpekļa savienojumus ar metāliem sauc par a) nitrātiem b) nitrītiem c) nitrīdiem d) par amonija sāļiem.
Slāpekļa oksidācijas pakāpe amonjakā a) +3 b) +4 c) -3 d) +2
Kurš no īpašumiem nav piemērojams uz amonjaku: a) gāze c) labi šķīst ūdenī c) bez smaržas d) vieglāks par gaisu
Amonjaka šķīdumam ir vide: a) skāba b) neitrāla c) sārmaina d) vāji sārmaina
Amonjaks nesadarbojas a) ar skābekli b) ar ūdeņradi c) ar ūdeni d) ar skābēm
Dedzinot amonjaku veidojas a) slāpekļa oksīds (V) b) slāpekļa oksīds (I) c) slāpeklis d) ūdens
Amonjaka katalītiskā oksidēšanā papildus ūdenim veidojas a) slāpekļa oksīds (V) b) slāpekļa oksīds (III) c) slāpekļa oksīds (IV) d) slāpekļa oksīds (II)
Kad amonjaks reaģē ar sērskābi, veidojas a) amonija hlorīds b) amonija hlorīds c) amonija sulfāts d) amonija nitrāts
Amonjaku var iegūt laboratorijā, reaģējot a) amonija hlorīdu ar kālija hidroksīdu b) amonija sulfātu ar sālsskābi c) ūdeņradi ar slāpekli d) amonija sāļus ar citiem reaģējot ar skābēm.
Amonjaks tiek ražots rūpniecībā, mijiedarbojoties a) ūdeņradim ar slāpekli b) amonija hlorīdu ar sārmu c) amonija sāli ar skābi d) amonija sāli ar citiem sāļiem.
Mijiedarbojoties ar skābēm, amonjaku nevar veido sāļus a) bāzes
b) vidēji c) skābs
amonija sāļi nevar dabūt a) amonija sāļu mijiedarbība ar sārmiem b) amonjaka šķīduma mijiedarbība ar sārmiem c) amonjaka šķīduma mijiedarbība ar skābēm d) amonija sāļu mijiedarbība ar skābēm.
Amonija sāļus var atpazīt ar a) skābes b) sārmu c) cita sāls d) ūdens palīdzību.
Kvalitatīvas reakcijas uz amonija jonu pazīme ir a) gāzes izdalīšanās ar amonjaka smaku; gāzes izdalīšanās; b) gāzes izdalīšanās, kas izraisa kaļķa ūdens duļķainību; c) brūnās gāzes evolūcija; d) baltas nogulsnes.
Kad amonija karbonāts tiek uzkarsēts nenotiek
a) ūdens izdalīšanās b) oglekļa dioksīds c) amonjaka izdalīšanās d) slāpekļa oksīda izdalīšanās (I).
Amonija nitrīta sadalīšanās rezultātā rodas:
a) slāpeklis un ūdens b) slāpekļa oksīds (I) un ūdens c) slāpekļa oksīds (II) un ūdens d) slāpekļa oksīds (IV) un ūdens.
Slāpeklis neveidojas oksīds ar formulu a) NO 2 b) N 2 O 5 c) NO d) N 2 O 7
Tas nav skābes oksīds a) NO 2 b) N 2 O 3 c) N 2 O d) N 2 O 5
Pie sāli neveidojošiem oksīdiem pieder a) NO b) N 2 O 3 c) N 2 O 5 d) NO 2
Slāpekļskābe neietver a) šķidru b) divbāzisku c) spēcīgu oksidētāju d) skābekli saturošu vielu
Slāpekļa oksidācijas pakāpe slāpekļskābē a) -3 b) +5 c) +4 d) +3
Kad slāpekļskābe sadalās gaismā veidojas a) ūdens b) skābeklis c) amonjaks d) slāpekļa oksīds (IV).
Slāpekļskābei reaģējot ar metāliem, tā neveidojas
a) slāpekļa savienojums b) sāls c) ūdens d) ūdeņradis
Koncentrētas slāpekļskābes mijiedarbībā ar sudrabu papildus ūdenim un sālim veidojas a) slāpekļa oksīds (I) b) slāpekļa oksīds (IV) c) slāpekļa oksīds (II) d) amonjaks.
Kad atšķaidīta slāpekļskābe reaģē ar sudrabu, papildus ūdenim un sāli,
a) slāpekļa oksīds (II) b) slāpekļa oksīds (I) c) slāpekļa oksīds (IV) d) amonjaks.
Slāpekļskābe nereaģē ar a) fosfora (V) oksīdu b) nātrija oksīdu c) bārija hidroksīdu d) nātrija karbonātu.
Iespējas numurs 1.
Uzdevums numurs 1
1. Nav smaržas.
2. Ir smarža.
3. Apdegumi skābeklī.
4. Mijiedarbojas ar skābēm, veidojot sāļus.
5. Molekulā starp atomiem ir kovalenta nepolāra saite.
6. Molekulā starp atomiem ir kovalentā polārā saite.
7. Nedeg gaisā.
8. Slāpekļa oksidācijas pakāpe -3.
9. Viegli šķīst ūdenī.
10. Ūdens šķīdumam ir sārmaina vide.
Uzdevums numurs 2
1. N 2 O 3 A) amonija nitrāts
2. NH 3 B) amonija sulfāts
3. NH 4 NO 3 B) slāpekļa oksīds (III)
4. NH 4 HSO 4 D) amonija hidrosulfāts
5. NO 2 D) slāpekļa oksīds (V)
E) slāpekļa oksīds (IV)
G) amonjaks
Uzdevums numurs 3
N 2 NO NO 2 HNO 3 NO 2
Exercise№4
C + HNO 3 \u003d CO 2 + NO 2 + H 2 O
Uzdevums numurs 5
NH 4 NĒ 2 = N 2 O + H 2 O
.
4) Ugunsgrēkā tiek mesti cietie nitrāti, un, ja nav spilgtas zibspuldzes, tas ir nitrāts.
Tests par tēmu "SLĀPEKLIS UN TĀ SAVIENOJUMI".
Opcijas numurs 2.
Uzdevums numurs 1
Sadaliet, kuras īpašības pieder slāpeklim un kuras amonjakam? Ierakstiet datus ar īpašumu numuriem tabulā.
1. Ir asa smaka
2. Labi šķīst ūdenī.
3. Nesadarbojas ar gaisu.
4. Molekulā starp atomiem saite ir kovalentā polārā.
5. Molekulā starp atomiem saite ir kovalenta nepolāra.
6. Bezkrāsaina un bez smaržas gāze.
7. Slāpekļa oksidācijas pakāpe -3.
8. Ūdens šķīdumam ir sārmaina vide.
9. Pērkona negaisa laikā dod reakciju ar skābekli.
10. Izmanto mēģenēs veco gleznu uzglabāšanai.
Uzdevums numurs 2
Saskaņojiet formulas un vielu nosaukumus.
1. N 2 O 5 A) amonija sulfāts
2. NAV B) amonija karbonāts
3. (NH 4) 2 SO 4 B) slāpekļa oksīds (II)
4. NH 4 H CO 3 D) amonija bikarbonāts
5.N 2 O D) slāpekļa oksīds (V)
E) slāpekļa oksīds (I)
G) amonija hidrosulfāts
Uzdevums numurs 3
Uzrakstiet reakcijas vienādojumus šādiem pārveidojumiem.
NO NO 2 HNO 3 NaNO 3 NaNO 2
Exercise№4
Sakārto koeficientus, izmantojot elektroniskā līdzsvara metodi, norāda oksidētāju un reducētāju.
S + HNO 3 \u003d H 2 SO 4 + NO 2 + H 2 O
Uzdevums numurs 5
Atrodiet šajā tekstā 4 kļūdas, pierakstiet kļūdas. Pēc tam pierakstiet to pareizi blakus.
1) Sildot, nitrāti sadalās. Dažādu metālu nitrātu sadalīšanās reakcija notiek vienādi.
2) Tikai amonija nitrāta termiskās sadalīšanās process notiek savdabīgā veidā:
NH 4 NĒ 2 = N 2 O + H 2 O
3) Nitrātu šķīdumus nosaka, izmantojot varu bez karsēšanas.
4) Ugunsgrēkā tiek mesti cietie nitrāti, un, ja nav spilgtas zibspuldzes, tas ir nitrāts.