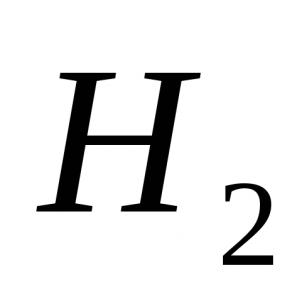Dzelzs sāļi 3 krāsa. Dzelzs un tās savienojumu ķīmiskās īpašības, to pielietojums
Formula:
Dzelzs(II) sulfāts, dzelzs sulfāts, FeSO 4 - sērskābes un 2-valentā dzelzs sāls. Cietība - 2.
Ķīmijā dzelzs sulfātu sauc par kristālisko hidrātu dzelzs (II) sulfāts. Gaiši zaļi kristāli. To izmanto tekstilrūpniecībā, lauksaimniecībā kā insekticīdu, minerālkrāsu pagatavošanai.
Dabisks analogs - minerāls melanterīts; dabā tas sastopams monoklinoedrālās sistēmas kristālos, zaļi dzeltenā krāsā, smērējumu vai svītru veidā.
Molārā masa: 151,91 g/mol
Blīvums: 1,8-1,9 g/cm³
Kušanas temperatūra: 400°C
Šķīdība ūdenī: 25,6 g/100 ml
Divvērtīgā dzelzs sulfāts tiek izdalīts temperatūrā no 1,82 ° C līdz 56,8 ° C no ūdens šķīdumiem gaiši zaļu FeSO 4 7H 2 O kristālu veidā, ko tehnoloģijā sauc par dzelzs sulfātu (kristālhidrātu). Izšķīst 100 g ūdens: 26,6 g bezūdens FeSO 4 20 ° C temperatūrā un 54,4 g 56 ° C temperatūrā.
Divvērtīgā dzelzs sulfāta šķīdumi atmosfēras skābekļa ietekmē laika gaitā oksidējas, pārvēršoties dzelzs (III) sulfātā:
12FeSO 4 + O 2 + 6H 2 O \u003d 4Fe 2 (SO 4) 3 + 4Fe (OH) 3 ↓
Sildot virs 480 °C, tas sadalās:
2FeSO 4 → Fe 2 O 3 + SO 2 + SO 3
Kvīts.
Dzelzs vitriolu var pagatavot, iedarbojoties ar atšķaidītu sērskābi uz metāllūžņiem, jumta dzelzs atgriezumiem utt. Rūpniecībā to iegūst kā blakusproduktu, kad dzelzs loksnes, stieples utt. tiek kodinātas ar atšķaidītu H 2 SO 4. noņemt skalu.
Fe + H 2 SO 4 \u003d FeSO 4 + H 2
Vēl viens veids ir pirīta oksidatīvā apdedzināšana:
2FeS 2 + 7O 2 + 2H 2 O \u003d 2FeSO 4 + 2H 2 SO 4
Kvalitatīva analīze.
Dzelzs katjona analītiskās reakcijas (II).
1. Ar kālija heksacianoferātu (III) K 3 veidojas tumši zilas kālija dzelzs(II) heksacianoferāta(III) nogulsnes (“turnbull blue”), kas nešķīst skābēs, sadaloties ar sārmiem, veidojot Fe(OH) 3 (HF).
FeSO 4 + K 3 KFe + K 2 SO 4
Reakcijas optimālā pH vērtība ir 2-3. Reakcija ir daļēja, ļoti jutīga. Augsta Fe 3+ koncentrācija traucē.
2. Ar amonija sulfīdu (NH 4 ) 2 S veidojas melnas nogulsnes, šķīst stiprās skābēs (HF).
FeSO 4
+ (NH 4) 2 S  FeS + (NH 4) 2 SO 4
FeS + (NH 4) 2 SO 4
3.2. Sulfātjonu analītiskās reakcijas.
1. Ar grupas reaģentu BaCl 2 + CaCl 2 vai BaCl 2 (GF).
Sulfātjona frakcionētu atvēršanu veic skābā vidē, kas novērš CO 3 2-, PO 4 3- utt. traucējošo iedarbību, un vārot testa šķīdumu ar 6 mol/dm 3 HCl, lai noņemtu S 2 -, SO 3 2 -, S 2 O 3 2- -joni, kas var veidot elementāru sēru, kura nogulsnes var ņemt kā BaSO 4 nogulsnes. BaSO 4 nogulsnes spēj ar KMnO 4 veidot izomorfus kristālus un kļūt sārtiem (palielinās reakcijas specifika).
Metodoloģija veicot reakciju 0,002 mol/dm klātbūtnē 3 KMnO 4 .
3–5 pilieniem testa šķīduma pievieno vienādos daudzumos kālija permanganāta, bārija hlorīda un sālsskābes šķīdumu un enerģiski maisa 2–3 minūtes. Ļauj nosēsties un, neatdalot nogulsnes no šķīduma, pievieno 1-2 pilienus 3% H 2 O 2 šķīduma, samaisa un centrifugē. Nogulsnēm jāpaliek rozā krāsā, un šķīdumam virs nogulsnēm jākļūst bezkrāsainam.
2. Ar svina acetātu.
SO 4
2-
+Pb2+  PbSO 4
PbSO 4
Metodoloģija : 2 cm 3 sulfāta šķīduma pievieno 0,5 cm 3 atšķaidītas sālsskābes un 0,5 cm 3 svina acetāta šķīduma; veidojas baltas nogulsnes, kas šķīst piesātinātā amonija acetāta vai nātrija hidroksīda šķīdumā.
PbSO 4 + 4 NaOH  Na 2 + Na 2 SO 4
Na 2 + Na 2 SO 4
Ar stroncija sāļiem - veidojas baltas nogulsnes, kas nešķīst skābēs (atšķirībā no sulfītiem).
SO 4
2
-+Sr2+  SrSO 4
SrSO 4
Metodoloģija : 4-5 pilieniem analizētā šķīduma pievieno 4-5 pilienus koncentrēta stroncija hlorīda šķīduma, veidojas baltas nogulsnes.
Ar kalcija sāļiem - ģipša CaSO 4 2H 2 O adatveida kristālu veidošanās.
SO42- + Ca2+ + 2H2O
 CaSO 4 2H 2 O
CaSO 4 2H 2 O
Metodoloģija: uzlieciet uz stikla priekšmetstikliņa, nedaudz nosusiniet pilienu analizētā šķīduma un kalcija sāļus. Izveidotos kristālus pārbauda mikroskopā.
Kvantitatīvā analīze.
Permanganatometrija.
Dzelzs masas daļas noteikšana Mora sāls (NH 4) 2 Fe (SO 4) 2 6H 2 O paraugā ar permanganometrisko metodi
(tiešās titrēšanas iespēja)
Definīcijas pamatā ir dzelzs(II) oksidēšana ar kālija permanganātu par dzelzi(III).
10 FeSO 4 + 2 KMnO 4 + 8H 2 SO 4 = 5 Fe 2 (TAD 4 ) 3 + 2 MnSO 4 + K 2 SO 4 + 8H 2 O
M (Fe) = 55,85 g/mol
Metodoloģija: Precīzu Mora sāls svaru, kas nepieciešams, lai pagatavotu 100 cm 3 0,1 M Mora sāls šķīduma, kvantitatīvi pārnes mērkolbā ar ietilpību 100 cm 3, izšķīdina nelielā daudzumā destilēta ūdens pēc pabeigšanas. izšķīdināšana, uzpildīta līdz atzīmei ar ūdeni, sajaukta. Iegūtā šķīduma alikvotu daļu (atsevišķs uzdevums) ievieto titrēšanas kolbā, pievieno vienādu tilpumu atšķaidītas sērskābes (1:5) un lēnām titrē ar kālija permanganāta šķīdumu, līdz šķīduma krāsa ir viegli rozā. uz 30 sekundēm.
Pieteikums.
Izmanto ražošanā tinte;
Krāsu biznesā (krāsošanai vilna melnā krāsā)
Koku saglabāšanai.
Bibliogrāfija.
- Kārtības skaitlis - 26.
- Periods ir ceturtais lielais.
- Astotā grupa, sekundārā apakšgrupa.
- Atomu svars ir 55,847.
- Ārējā elektronu apvalka uzbūvi apzīmē ar formulu 3d 6 4s 2 .
- - Fe.
- Nosaukums ir dzelzs, formulas rādījums ir "ferrum".
- Dabā ir četri stabili attiecīgā elementa izotopi ar masas skaitļiem 54, 56, 57, 58.
- kušanas temperatūra - 1539 0 С;
- vārīšanās - 2862 0 С;
- aktivitāte - vidēja;
- ugunsizturība - augsta;
- uzrāda izteiktas magnētiskās īpašības.
- skābes;
- skābeklis (ieskaitot gaisu);
- pelēks;
- halogēni;
- karsējot - ar slāpekli, fosforu, oglekli un silīciju;
- ar mazāk aktīvo metālu sāļiem, reducējot tos līdz vienkāršām vielām;
- ar asiem ūdens tvaikiem;
- ar dzelzs sāļiem oksidācijas stāvoklī +3.
- Sauszemes planētu kodoli - 90%.
- Zemes garozā - 5%.
- Zemes apvalkā - 12%.
- Zemes kodolā - 86%.
- Upes ūdenī - 2 mg/l.
- Jūrā un okeānā - 0,02 mg / l.
- magnetīts;
- limonīts vai brūnā dzelzsrūda;
- vivianīts;
- pirotīts;
- pirīts;
- siderīts;
- markazīts;
- lellingīts;
- mispikel;
- milanterīts un citi.
- čuguni;
- kļūt.
- oksīds;
- hidroksīds;
- binārie savienojumi;
- kompleksie sāļi;
- sarežģīti savienojumi.
- Dzelzs (II) oksīds. Melns pulveris, nešķīst ūdenī. Savienojuma būtība ir pamata. Tas spēj ātri oksidēties, tomēr to var arī viegli reducēt līdz vienkāršai vielai. Tas izšķīst skābēs, veidojot atbilstošus sāļus. Formula - FeO.
- Dzelzs (II) hidroksīds. Tās ir baltas amorfas nogulsnes. Veidojas sāļu reakcijā ar bāzēm (sārmiem). Uzrāda vājas pamata īpašības, spēj ātri oksidēties gaisā līdz dzelzs savienojumiem +3. Formula - Fe (OH) 2.
- Elementa sāļi norādītajā oksidācijas pakāpē. Parasti tiem ir gaiši zaļa šķīduma krāsa, tie labi oksidējas pat gaisā, iegūstot un pārvēršoties dzelzs sāļos 3. Tie izšķīst ūdenī. Savienojumu piemēri: FeCL 2 , FeSO 4 , Fe(NO 3) 2 .

Vairākiem savienojumiem ir praktiska nozīme starp norādītajām vielām. Pirmkārt, (II). Tas ir galvenais jonu piegādātājs cilvēka ķermenim ar anēmiju. Kad pacientam tiek diagnosticēta šāda kaite, viņam tiek nozīmēti kompleksi preparāti, kuru pamatā ir attiecīgais savienojums. Tādā veidā tiek atjaunots dzelzs deficīts organismā.
Otrkārt, tas ir, dzelzs (II) sulfātu kopā ar varu izmanto, lai iznīcinātu lauksaimniecības kaitēkļus uz kultūraugiem. Metode savu efektivitāti pierāda jau vairāk nekā duci gadu, tāpēc to ļoti novērtē dārznieki un dārznieki.
Mora Sāls
Šis ir savienojums, kas ir dzelzs un amonija sulfāta kristālisks hidrāts. Tā formula ir rakstīta kā FeSO 4 * (NH 4) 2 SO 4 * 6H 2 O. Viens no dzelzs (II) savienojumiem, kas ir plaši izmantots praksē. Galvenās cilvēku lietošanas jomas ir šādas.
- Farmācija.
- Zinātniskie pētījumi un laboratorijas titrimetriskās analīzes (hroma, kālija permanganāta, vanādija satura noteikšanai).
- Zāles - kā piedeva pārtikai ar dzelzs trūkumu pacienta organismā.
- Koka izstrādājumu impregnēšanai, jo Mora sāls aizsargā pret pūšanas procesiem.
Ir arī citas jomas, kurās šī viela tiek izmantota. Savu nosaukumu tas ieguva par godu vācu ķīmiķim, kurš pirmais atklāja izpaustās īpašības.
Vielas ar dzelzs oksidācijas pakāpi (III)
Dzelzs savienojumu īpašības, kurās tā oksidācijas pakāpe ir +3, nedaudz atšķiras no iepriekš apskatītajām. Tādējādi atbilstošā oksīda un hidroksīda daba vairs nav bāziska, bet gan izteikta amfotēriska. Mēs sniedzam galveno vielu aprakstu.

No sniegtajiem piemēriem no praktiskā viedokļa svarīgs ir tāds kristālisks hidrāts kā FeCL 3 * 6H 2 O vai dzelzs (III) hlorīda heksahidrāts. To lieto medicīnā, lai apturētu asiņošanu un papildinātu dzelzs jonus organismā ar anēmiju.
Dzelzs (III) sulfāta pentahidrātu izmanto dzeramā ūdens attīrīšanai, jo tas darbojas kā koagulants.
Dzelzs(VI) savienojumi
Dzelzs ķīmisko savienojumu formulas, kur tai ir īpašs oksidācijas pakāpe +6, var uzrakstīt šādi:
- K 2 FeO 4;
- Na2FeO4;
- MgFeO 4 un citi.
Visiem tiem ir kopīgs nosaukums - ferāti - un tiem ir līdzīgas īpašības (spēcīgi reducējoši līdzekļi). Tie spēj arī dezinficēt un tiem piemīt baktericīda iedarbība. Tas ļauj tos izmantot dzeramā ūdens attīrīšanai rūpnieciskā mērogā.
Kompleksie savienojumi
Īpašas vielas ir ļoti svarīgas analītiskajā ķīmijā un ne tikai. Tie, kas veidojas sāļu ūdens šķīdumos. Tie ir sarežģīti dzelzs savienojumi. Populārākie un labi izpētītie no tiem ir šādi.
- Kālija heksacianoferāts (II) K 4 . Vēl viens savienojuma nosaukums ir dzeltenais asins sāls. To izmanto dzelzs jonu Fe 3+ kvalitatīvai noteikšanai šķīdumā. Ekspozīcijas rezultātā šķīdums iegūst skaistu spilgti zilu krāsu, jo veidojas vēl viens komplekss - Prūsijas zilais KFe 3+. Kopš seniem laikiem to izmantoja kā
- Kālija heksacianoferāts (III) K 3 . Vēl viens nosaukums ir sarkanā asins sāls. To izmanto kā kvalitatīvu reaģentu dzelzs jonu Fe 2+ noteikšanai. Rezultātā veidojas zilas nogulsnes, ko sauc par Turnbull blue. Izmanto arī kā krāsvielu audumiem.

Dzelzs organiskajās vielās
Dzelzs un tās savienojumi, kā mēs jau redzējām, ir ļoti praktiska nozīme cilvēka saimnieciskajā dzīvē. Tomēr papildus tam tā bioloģiskā loma organismā ir ne mazāk liela, gluži pretēji.
Ir viens ļoti svarīgs proteīns, kas ietver šo elementu. Tas ir hemoglobīns. Pateicoties viņam, tiek transportēts skābeklis un tiek veikta vienmērīga un savlaicīga gāzes apmaiņa. Tāpēc dzelzs loma dzīvības procesā – elpošanā – ir vienkārši milzīga.

Kopumā cilvēka organismā ir aptuveni 4 grami dzelzs, kas pastāvīgi jāpapildina ar uzņemto pārtiku.
- Ķīmiskās formulas jāievada reģistrjutīgi
- Indeksi tiek ievadīti kā parastie skaitļi
- Punkts uz viduslīnijas (reizināšanas zīme), ko izmanto, piemēram, kristālisko hidrātu formulās, tiek aizstāts ar parastu punktu.
- Piemērs: CuSO₄ 5H₂O vietā pārveidotājs izmanto pareizrakstību CuSO4.5H2O, lai atvieglotu ievadīšanu.
- sāls (nātrija hlorīds) NaCl
- cukurs (saharoze) C2H22O₁₁
- etiķis (etiķskābes šķīdums) CH₃COOH
- nosaka elementu atommasas pēc periodiskās tabulas;
- nosaka katra elementa atomu skaitu savienojuma formulā;
- nosaka molāro masu, saskaitot savienojumā iekļauto elementu atommasas, kas reizinātas ar to skaitu.
- divi oglekļa atomi
- četri ūdeņraža atomi
- divi skābekļa atomi
- ogleklis C = 2 × 12,0107 g/mol = 24,0214 g/mol
- ūdeņradis H = 4 × 1,00794 g/mol = 4,03176 g/mol
- skābeklis O = 2 × 15,9994 g/mol = 31,9988 g/mol
- molārā masa = 24,0214 + 4,03176 + 31,9988 = 60,05196 g/mol
Lurija Ju.Ju. Analītiskās ķīmijas rokasgrāmata. Maskava, 1972;
Vadlīnija "Instrumentālās analīzes metodes", Perma, 2004;
Vadlīnija "Kvalitatīvā ķīmiskā analīze", Perma, 2003;
Vadlīnija "Kvantitatīvā ķīmiskā analīze", Perma, 2004;
Rabinovičs V.A., Khavins Z.Ya. Īsa ķīmisko vielu atsauces grāmata, Ļeņingrad, 1991;
"Lielā padomju enciklopēdija";
DEFINĪCIJA
Dzelzs- D. I. Mendeļejeva ķīmisko elementu periodiskās sistēmas ceturtā perioda astotās grupas elements.
Un vājš skaitlis ir 26. Simbols ir Fe (lat. “ferrum”). Viens no visizplatītākajiem metāliem zemes garozā (otrā vieta aiz alumīnija).
Dzelzs fizikālās īpašības
Dzelzs ir pelēks metāls. Tīrā veidā tas ir diezgan mīksts, kaļams un elastīgs. Ārējā enerģijas līmeņa elektroniskā konfigurācija ir 3d 6 4s 2 . Savos savienojumos dzelzs uzrāda oksidācijas pakāpi "+2" un "+3". Dzelzs kušanas temperatūra ir 1539 ° C. Dzelzs veido divas kristāliskas modifikācijas: α- un γ-dzelzs. Pirmajam no tiem ir kubiskā korpusa centrālais režģis, otrajam ir kubiskā seja centrēts režģis. α-dzelzs ir termodinamiski stabils divos temperatūras diapazonos: zem 912 un no 1394C līdz kušanas temperatūrai. Starp 912 un 1394C γ-dzelzs ir stabils.
Dzelzs mehāniskās īpašības ir atkarīgas no tā tīrības – pat ļoti neliela daudzuma citu elementu satura tajā. Cietajam dzelzs ir spēja sevī izšķīdināt daudzus elementus.
Dzelzs ķīmiskās īpašības
Mitrā gaisā dzelzs ātri sarūsē, t.i. pārklāts ar brūnu hidratēta dzelzs oksīda pārklājumu, kas tā irdenuma dēļ nepasargā dzelzi no turpmākas oksidēšanās. Ūdenī dzelzs intensīvi korodē; ar bagātīgu skābekļa piekļuvi veidojas dzelzs oksīda (III) hidratētās formas:
2Fe + 3/2O 2 + nH 2 O = Fe 2 O 3 × H 2 O.
Ar skābekļa trūkumu vai ar apgrūtinātu piekļuvi veidojas jaukts oksīds (II, III) Fe 3 O 4:
3Fe + 4H2O (v) ↔ Fe3O4 + 4H2.
Dzelzs izšķīst jebkuras koncentrācijas sālsskābē:
Fe + 2HCl \u003d FeCl 2 + H 2.
Līdzīgi izšķīšana notiek atšķaidītā sērskābē:
Fe + H 2 SO 4 \u003d FeSO 4 + H 2.
Koncentrētos sērskābes šķīdumos dzelzs tiek oksidēts par dzelzi (III):
2Fe + 6H 2 SO 4 \u003d Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O.
Savukārt sērskābē, kuras koncentrācija ir tuvu 100%, dzelzs kļūst pasīva un mijiedarbība praktiski nenotiek. Atšķaidītos un vidēji koncentrētos slāpekļskābes šķīdumos dzelzs izšķīst:
Fe + 4HNO 3 \u003d Fe (NO 3) 3 + NO + 2H 2 O.
Augstās slāpekļskābes koncentrācijās šķīšana palēninās un dzelzs kļūst pasīva.
Tāpat kā citi metāli, dzelzs reaģē ar vienkāršām vielām. Dzelzs mijiedarbības reakcijas ar halogēniem (neatkarīgi no halogēna veida) notiek karsējot. Dzelzs mijiedarbība ar bromu notiek pie paaugstināta pēdējā tvaika spiediena:
2Fe + 3Cl 2 \u003d 2FeCl 3;
3Fe + 4I 2 = Fe 3 I 8.
Karsējot, notiek arī dzelzs mijiedarbība ar sēru (pulveri), slāpekli un fosforu:
6Fe + N 2 = 2Fe 3 N;
2Fe + P = Fe 2 P;
3Fe + P = Fe 3 P.
Dzelzs spēj reaģēt ar nemetāliem, piemēram, oglekli un silīciju:
3Fe + C = Fe 3 C;
Dzelzs mijiedarbības reakcijās ar sarežģītām vielām īpaša loma ir šādām reakcijām - dzelzs spēj reducēt metālus, kas atrodas aktivitāšu rindā pa labi no tā, no sāls šķīdumiem (1), lai redukētu dzelzi (III) savienojumi (2):
Fe + CuSO 4 \u003d FeSO 4 + Cu (1);
Fe + 2FeCl 3 = 3FeCl 2 (2).
Dzelzs paaugstinātā spiedienā reaģē ar sāli neveidojošu oksīdu - CO, veidojot sarežģītas sastāvdaļas - karbonilus - Fe (CO) 5, Fe 2 (CO) 9 un Fe 3 (CO) 12.
Dzelzs, ja tajā nav piemaisījumu, ir stabils ūdenī un atšķaidītos sārmu šķīdumos.
Dzelzs iegūšana
Galvenais dzelzs iegūšanas veids ir no dzelzsrūdas (hematīts, magnetīts) vai tās sāļu šķīdumu elektrolīze (šajā gadījumā iegūst “tīru” dzelzi, t.i., dzelzi bez piemaisījumiem).
Problēmu risināšanas piemēri
1. PIEMĒRS
| Exercise | Dzelzs skalas Fe 3 O 4, kas sver 10 g, vispirms apstrādāja ar 150 ml sālsskābes šķīduma (blīvums 1,1 g/ml) ar hlorūdeņraža masas daļu 20%, un pēc tam iegūtajam šķīdumam pievienoja dzelzs pārpalikumu. Nosaka šķīduma sastāvu (masas %). |
| Lēmums | Mēs rakstām reakcijas vienādojumus atbilstoši uzdevuma nosacījumam: 8HCl + Fe 3 O 4 \u003d FeCl 2 + 2FeCl 3 + 4H 2 O (1); 2FeCl 3 + Fe = 3FeCl 2 (2). Zinot sālsskābes šķīduma blīvumu un tilpumu, varat atrast tā masu: m sol (HCl) = V(HCl) × ρ (HCl); m sol (HCl) \u003d 150 × 1,1 \u003d 165 g. Aprēķiniet hlorūdeņraža masu: m(HCl)=msol(HCl)×ω(HCl)/100%; m(HCl) = 165 x 20%/100% = 33 g. Sālsskābes molārā masa (viena mola masa), kas aprēķināta, izmantojot D.I. ķīmisko elementu tabulu. Mendeļejevs - 36,5 g / mol. Atrodiet hlorūdeņraža vielas daudzumu: v(HCl) = m(HCl)/M(HCl); v (HCl) \u003d 33 / 36,5 \u003d 0,904 mol. Mēroga molārā masa (viena mola masa), kas aprēķināta, izmantojot D.I. ķīmisko elementu tabulu. Mendeļejevs - 232 g/mol. Atrodiet katlakmens vielas daudzumu: v (Fe 3 O 4) \u003d 10/232 \u003d 0,043 mol. Saskaņā ar 1. vienādojumu v(HCl): v(Fe 3 O 4) \u003d 1: 8, tāpēc v (HCl) \u003d 8 v (Fe 3 O 4) \u003d 0,344 mol. Tad ar vienādojumu aprēķinātais ūdeņraža hlorīda daudzums (0,344 mol) būs mazāks par uzdevuma nosacījumā norādīto (0,904 mol). Tāpēc sālsskābe ir pārāk daudz un notiks cita reakcija: Fe + 2HCl = FeCl 2 + H 2 (3). Noteiksim pirmās reakcijas rezultātā radušās dzelzs hlorīda vielas daudzumu (rādītāji apzīmē konkrētu reakciju): v 1 (FeCl 2): v (Fe 2 O 3) = 1:1 = 0,043 mol; v 1 (FeCl 3): v (Fe 2 O 3) = 2:1; v 1 (FeCl 3) = 2 × v (Fe 2 O 3) = 0,086 mol. Noteiksim 1. reakcijā nereaģējušo ūdeņraža hlorīda daudzumu un 3. reakcijā radušās dzelzs (II) hlorīda vielas daudzumu: v rem (HCl) \u003d v (HCl) - v 1 (HCl) \u003d 0,904 - 0,344 \u003d 0,56 mol; v 3 (FeCl 2): v rem (HCl) = 1:2; v 3 (FeCl 2) \u003d 1/2 × v rem (HCl) \u003d 0,28 mol. Noteiksim FeCl 2 vielas daudzumu, kas veidojas 2. reakcijas laikā, kopējo FeCl 2 vielas daudzumu un tās masu: v 2 (FeCl 3) = v 1 (FeCl 3) = 0,086 mol; v 2 (FeCl 2): v 2 (FeCl 3) = 3:2; v 2 (FeCl 2) = 3/2 × v 2 (FeCl 3) = 0,129 mol; v summa (FeCl 2) \u003d v 1 (FeCl 2) + v 2 (FeCl 2) + v 3 (FeCl 2) \u003d 0,043 + 0,129 + 0,28 \u003d 0,452 mol; m (FeCl 2) \u003d v summa (FeCl 2) × M (FeCl 2) \u003d 0,452 × 127 \u003d 57,404 g. Nosakīsim vielas daudzumu un dzelzs masu, kas iekļuva 2. un 3. reakcijā: v 2 (Fe): v 2 (FeCl 3) = 1:2; v 2 (Fe) \u003d 1/2 × v 2 (FeCl 3) \u003d 0,043 mol; v 3 (Fe): v rem (HCl) = 1:2; v 3 (Fe) = 1/2 × v rem (HCl) = 0,28 mol; v summa (Fe) \u003d v 2 (Fe) + v 3 (Fe) \u003d 0,043 + 0,28 \u003d 0,323 mol; m(Fe) = v summa (Fe) × M(Fe) = 0,323 × 56 = 18,088 g. Aprēķināsim 3. reakcijā izdalītās vielas daudzumu un ūdeņraža masu: v (H 2) \u003d 1/2 × v rem (HCl) \u003d 0,28 mol; m (H 2) \u003d v (H 2) × M (H 2) \u003d 0,28 × 2 = 0,56 g. Nosakām iegūtā šķīduma masu m 'sol un FeCl 2 masas daļu tajā: m’ sol \u003d m sol (HCl) + m (Fe 3 O 4) + m (Fe) - m (H 2); |
Cilvēka organismā ir aptuveni 5 g dzelzs, lielākā daļa no tā (70%) ir daļa no asinīs esošā hemoglobīna.
Fizikālās īpašības
Brīvā stāvoklī dzelzs ir sudrabaini balts metāls ar pelēcīgu nokrāsu. Tīrs dzelzs ir kaļamais un tam piemīt feromagnētiskas īpašības. Praksē parasti tiek izmantoti dzelzs sakausējumi - čuguns un tērauds.
Fe ir vissvarīgākais un visizplatītākais VIII grupas sekundārās apakšgrupas deviņu d-metālu elements. Kopā ar kobaltu un niķeli tas veido "dzelzs ģimeni".
Veidojot savienojumus ar citiem elementiem, tas bieži izmanto 2 vai 3 elektronus (B \u003d II, III).
Dzelzs, tāpat kā gandrīz visi VIII grupas d-elementi, neuzrāda augstāku valenci, kas vienāda ar grupas numuru. Tā maksimālā valence sasniedz VI un ir ārkārtīgi reti sastopama.
Tipiskākie savienojumi ir tie, kuros Fe atomi atrodas +2 un +3 oksidācijas pakāpēs.
Dzelzs iegūšanas metodes
1. Tirdzniecības dzelzi (sakausējumā ar oglekli un citiem piemaisījumiem) iegūst, karbotermiski reducējot tā dabiskos savienojumus saskaņā ar shēmu:

Atveseļošanās notiek pakāpeniski, 3 posmos:
1) 3Fe 2 O 3 + CO = 2Fe 3 O 4 + CO 2
2) Fe 3 O 4 + CO = 3FeO + CO 2
3) FeO + CO \u003d Fe + CO 2
Šā procesa rezultātā iegūtais čuguns satur vairāk nekā 2% oglekļa. Nākotnē tēraudus iegūst no čuguna - dzelzs sakausējumiem, kas satur mazāk par 1,5% oglekļa.
2. Ļoti tīru dzelzi iegūst vienā no šiem veidiem:
a) pentakarbonila Fe sadalīšanās
Fe(CO) 5 = Fe + 5CO
b) tīra FeO reducēšana ar ūdeņradi
FeO + H2 \u003d Fe + H2O
c) Fe +2 sāļu ūdens šķīdumu elektrolīze
FeC 2 O 4 \u003d Fe + 2СO 2
dzelzs (II) oksalāts
Ķīmiskās īpašības
Fe - vidējas aktivitātes metāls, uzrāda vispārējas metāliem raksturīgas īpašības.
Unikāla iezīme ir spēja "rūsēt" mitrā gaisā:
Ja nav mitruma ar sausu gaisu, dzelzs sāk manāmi reaģēt tikai pie T > 150°C; kalcinējot, veidojas “dzelzs nogulsnes” Fe 3 O 4:
3Fe + 2O 2 = Fe3O4
Dzelzs nešķīst ūdenī bez skābekļa. Ļoti augstā temperatūrā Fe reaģē ar ūdens tvaikiem, izspiežot ūdeņradi no ūdens molekulām:
3 Fe + 4H 2O (g) \u003d 4H 2
Rūsēšanas process tā mehānismā ir elektroķīmiskā korozija. Rūsas izstrādājums ir parādīts vienkāršotā veidā. Faktiski veidojas irdens slānis no dažāda sastāva oksīdu un hidroksīdu maisījuma. Atšķirībā no Al 2 O 3 plēves šis slānis neaizsargā dzelzi no turpmākas iznīcināšanas.
Korozijas veidi

Dzelzs aizsardzība pret koroziju

1. Mijiedarbība ar halogēniem un sēru augstā temperatūrā.
2Fe + 3Cl 2 = 2FeCl 3
2Fe + 3F 2 = 2FeF 3
Fe + I 2 \u003d FeI 2
Veidojas savienojumi, kuros dominē jonu saišu veids.
2. Mijiedarbība ar fosforu, oglekli, silīciju (dzelzs tieši nesavienojas ar N 2 un H 2, bet izšķīdina tos).
Fe + P = Fe x P y
Fe + C = Fe x C y
Fe + Si = FexSiy
Veidojas mainīga sastāva vielas, jo bertollīdi (savienojumos dominē saites kovalentā daba)
3. Mijiedarbība ar "neoksidējošām" skābēm (HCl, H 2 SO 4 di.)
Fe 0 + 2H + → Fe 2+ + H2
Tā kā Fe atrodas aktivitāšu sērijā pa kreisi no ūdeņraža (E ° Fe / Fe 2+ \u003d -0,44 V), tas spēj izspiest H 2 no parastajām skābēm.
Fe + 2HCl \u003d FeCl 2 + H 2
Fe + H 2 SO 4 \u003d FeSO 4 + H 2
4. Mijiedarbība ar "oksidējošām" skābēm (HNO 3 , H 2 SO 4 koncentr.)
Fe 0 - 3e - → Fe 3+
Koncentrētie HNO 3 un H 2 SO 4 "pasivē" dzelzi, tāpēc parastā temperatūrā metāls tajos nešķīst. Ar spēcīgu karsēšanu notiek lēna šķīšana (bez H 2 izdalīšanās).
In razb. HNO 3 dzelzs izšķīst, nonāk šķīdumā Fe 3+ katjonu veidā, un skābes anjons tiek reducēts līdz NO *:
Fe + 4HNO 3 \u003d Fe (NO 3) 3 + NO + 2H 2 O
Tas ļoti labi šķīst HCl un HNO 3 maisījumā
5. Attieksme pret sārmiem
Fe nešķīst sārmu ūdens šķīdumos. Tas reaģē ar izkausētiem sārmiem tikai ļoti augstā temperatūrā.
6. Mijiedarbība ar mazāk aktīvo metālu sāļiem
Fe + CuSO 4 \u003d FeSO 4 + Cu
Fe 0 + Cu 2+ = Fe 2+ + Cu 0
7. Mijiedarbība ar gāzveida oglekļa monoksīdu (t = 200°C, P)
Fe (pulveris) + 5CO (g) \u003d Fe 0 (CO) 5 dzelzs pentakarbonils
Fe(III) savienojumi
Fe 2 O 3 - dzelzs oksīds (III).
Sarkanbrūns pulveris, n. R. in H 2 O. Dabā - "sarkanā dzelzsrūda".
Veidi, kā iegūt:
1) dzelzs hidroksīda (III) sadalīšanās
2Fe(OH)3 = Fe2O3 + 3H2O
2) pirīta grauzdēšana
4FeS 2 + 11O 2 \u003d 8SO 2 + 2Fe 2 O 3
3) nitrātu sadalīšanās
Ķīmiskās īpašības
Fe 2 O 3 ir bāzes oksīds ar amfotērisma pazīmēm.
I. Galvenās īpašības izpaužas spējā reaģēt ar skābēm:
Fe2O3 + 6H+ = 2Fe3+ + ZH2O
Fe2O3 + 6HCI \u003d 2FeCI3 + 3H2O
Fe 2 O 3 + 6HNO 3 \u003d 2Fe (NO 3) 3 + 3H 2 O
II. Vājas skābes īpašības. Fe 2 O 3 nešķīst sārmu ūdens šķīdumos, bet, sakausējot ar cietiem oksīdiem, sārmiem un karbonātiem, veidojas ferīti:
Fe 2 O 3 + CaO \u003d Ca (FeO 2) 2
Fe 2 O 3 + 2 NaOH \u003d 2 NaFeO 2 + H 2 O
Fe 2 O 3 + MgCO 3 \u003d Mg (FeO 2) 2 + CO 2
III. Fe 2 O 3 - izejviela dzelzs ražošanai metalurģijā:
Fe 2 O 3 + ZS \u003d 2Fe + ZSO vai Fe 2 O 3 + ZSO \u003d 2Fe + ZSO 2
Fe (OH) 3 - dzelzs (III) hidroksīds
Veidi, kā iegūt:
Iegūst, sārmiem iedarbojoties uz šķīstošiem sāļiem Fe 3+:
FeCl 3 + 3NaOH \u003d Fe (OH) 3 + 3NaCl
Fe(OH) 3 saņemšanas brīdī - sarkanbrūnas mukozamorfas nogulsnes.
Fe (III) hidroksīds veidojas arī Fe un Fe (OH) 2 oksidēšanās laikā mitrā gaisā:
4Fe + 6H 2O + 3O 2 \u003d 4Fe (OH) 3
4Fe(OH)2 + 2Н 2O + O 2 = 4Fe(OH)3
Fe(III) hidroksīds ir Fe 3+ sāļu hidrolīzes galaprodukts.
Ķīmiskās īpašības
Fe(OH)3 ir ļoti vāja bāze (daudz vājāka par Fe(OH)2). Parāda manāmas skābes īpašības. Tādējādi Fe (OH) 3 ir amfoterisks raksturs:
1) reakcijas ar skābēm norit viegli:
2) svaigas Fe(OH) 3 nogulsnes izšķīdina karstā konc. KOH vai NaOH šķīdumi, veidojot hidrokso kompleksus:
Fe (OH) 3 + 3 KOH \u003d K 3
Sārmainā šķīdumā Fe (OH) 3 var oksidēties līdz ferātiem (dzelzs skābes H 2 FeO 4 sāļi, kas nav izolēti brīvā stāvoklī):
2Fe(OH)3 + 10KOH + 3Br2 = 2K2FeO4 + 6KBr + 8H2O
Fe 3+ sāļi
Praktiski svarīgākie ir: Fe 2 (SO 4) 3, FeCl 3, Fe (NO 3) 3, Fe (SCN) 3, K 3 4 - dzeltenais asins sāls \u003d Fe 4 3 Prūsijas zils (tumši zilas nogulsnes)
b) Fe 3+ + 3SCN - \u003d Fe (SCN) 3 Fe (III) tiocianāts (asins sarkanais šķīdums)
Pirmie izstrādājumi, kas izgatavoti no dzelzs un tās sakausējumiem, tika atrasti izrakumu laikā un datēti ar aptuveni 4. gadu tūkstoti pirms mūsu ēras. Tas ir, pat senie ēģiptieši un šumeri izmantoja šīs vielas meteorītu nogulsnes, lai izgatavotu rotaslietas un sadzīves priekšmetus, kā arī ieročus.
Mūsdienās visizplatītākās un lietotās vielas ir dažāda veida dzelzs savienojumi, kā arī tīrs metāls. Nav brīnums, ka 20. gadsimts tika uzskatīts par dzelzi. Galu galā pirms plastmasas un ar to saistīto materiālu parādīšanās un plašās izmantošanas šis savienojums bija izšķirošs cilvēkiem. Kas ir šis elements un kādas vielas tas veido, mēs apsvērsim šajā rakstā.
Ķīmiskais elements dzelzs
Ja ņemam vērā atoma struktūru, tad vispirms jānorāda tā atrašanās vieta periodiskajā sistēmā.
Arī ķīmiskajam elementam dzelzs ir aptuveni 20 dažādi izotopi, kas nav stabili. Iespējamie oksidācijas stāvokļi, kas var būt konkrētam atomam, ir:
Svarīgs ir ne tikai pats elements, bet arī dažādi tā savienojumi un sakausējumi.
Fizikālās īpašības
Dzelzs kā vienkārša viela ir ar izteiktu metāliskumu. Tas ir, tas ir sudrabaini balts metāls ar pelēku nokrāsu, kam ir augsta elastības pakāpe un augsta kušanas un viršanas temperatūra. Ja mēs sīkāk apsvērsim īpašības, tad:
Atkarībā no apstākļiem un dažādām temperatūrām dzelzs veido vairākas modifikācijas. To fizikālās īpašības atšķiras no tā, ka atšķiras kristāla režģi.

Visām modifikācijām ir dažāda veida kristāla režģu struktūra, kā arī atšķiras magnētiskās īpašības.
Ķīmiskās īpašības
Kā minēts iepriekš, vienkāršajai vielai dzelzs ir vidēja ķīmiskā aktivitāte. Tomēr smalki izkliedētā stāvoklī tas spēj pašaizdegties gaisā, un pats metāls izdeg tīrā skābeklī.
Korozijas spēja ir augsta, tāpēc šīs vielas sakausējumi ir pārklāti ar leģējošiem savienojumiem. Dzelzs spēj mijiedarboties ar:
Ir skaidrs, ka, parādot šādu aktivitāti, metāls spēj veidot dažādus savienojumus, daudzveidīgus un polārus pēc īpašībām. Un tā arī notiek. Dzelzs un tās savienojumi ir ārkārtīgi daudzveidīgi un tiek izmantoti dažādās zinātnes, tehnikas un rūpnieciskās cilvēka darbības nozarēs.
Izplatība dabā
Dabiskie dzelzs savienojumi ir diezgan izplatīti, jo tas ir otrs izplatītākais elements uz mūsu planētas aiz alumīnija. Tajā pašā laikā metāls tīrā veidā ir ārkārtīgi reti sastopams meteorītu sastāvā, kas norāda uz tā lielajiem uzkrājumiem kosmosā. Galvenā masa ir rūdu, iežu un minerālu sastāvā.

Ja mēs runājam par attiecīgā elementa procentuālo daudzumu dabā, tad var sniegt šādus skaitļus.
Visbiežāk sastopamie dzelzs savienojumi veido šādus minerālus:
Tas joprojām ir garš saraksts, jo to ir patiešām daudz. Turklāt ir plaši izplatīti dažādi sakausējumi, ko radījis cilvēks. Tie ir arī tādi dzelzs savienojumi, bez kuriem grūti iedomāties mūsdienu cilvēku dzīvi. Tie ietver divus galvenos veidus:
Dzelzs ir arī vērtīgs papildinājums daudziem niķeļa sakausējumiem.
Dzelzs(II) savienojumi
Tie ietver tos, kuros veidojošā elementa oksidācijas pakāpe ir +2. To ir diezgan daudz, jo tajos ietilpst:
Ķīmisko savienojumu formulas, kurās dzelzs uzrāda norādīto oksidācijas pakāpi, katrai klasei ir individuālas. Apsveriet svarīgākos un izplatītākos no tiem.
Garuma un attāluma pārveidotājs Masas pārveidotājs Lielapjoma pārtika un ēdiena tilpuma pārveidotājs Apgabala pārveidotājs Tilpuma un receptes vienības Pārveidotājs Temperatūras pārveidotājs Spiediens, spriedze, Janga moduļa pārveidotājs Enerģijas un darba pārveidotājs Jaudas pārveidotājs Spēka pārveidotājs Laika pārveidotājs Lineārais ātruma pārveidotājs Termiskais pārveidotājs Plakanā leņķa efektivitātes un degvielas efektivitātes pārveidotājs skaitļu dažādās skaitļu sistēmās Informācijas daudzuma mērvienību pārveidotājs Valūtu kursi Sieviešu apģērbu un apavu izmēri Vīriešu apģērbu un apavu izmēri Leņķiskā ātruma un rotācijas frekvences pārveidotājs Paātrinājuma pārveidotājs Leņķiskā paātrinājuma pārveidotājs Blīvuma pārveidotājs Īpatnējā tilpuma pārveidotājs Inerces momenta pārveidotājs Moment no spēka pārveidotāja Griezes momenta pārveidotājs Īpašās siltumspējas pārveidotājs (pēc masas) Enerģijas blīvuma un īpatnējās siltumspējas pārveidotājs (pēc tilpuma) Temperatūras starpības pārveidotājs Koeficienta pārveidotājs Siltuma izplešanās koeficienta termiskās pretestības pārveidotāja siltumvadītspējas pārveidotāja īpatnējā siltumietilpība pārveidotāja enerģijas iedarbība un starojuma jauda pārveidotājs siltuma plūsmas blīvuma pārveidotājs siltuma pārneses koeficients pārveidotājs tilpuma plūsmas pārveidotājs masas plūsmas pārveidotājs dinamiskās plūsmas pārveidotājs (Molar plūsmas pārveidotājs masas plūsmas pārveidotājs pārveidotājs masas pārveidotājs pārveidotājs masas blīvums Kinemātiskās viskozitātes pārveidotāja virsmas spraiguma pārveidotājs tvaika caurlaidības pārveidotājs ūdens tvaiku plūsmas blīvuma pārveidotājs skaņas līmeņa pārveidotājs mikrofona jutības pārveidotājs skaņas spiediena līmeņa (SPL) pārveidotājs skaņas spiediena līmeņa pārveidotājs ar atlasāmu atsauces spiedienu. Jauda dioptrijās un fokusa attālums Attāluma jauda dioptrijās un lēcas palielinājums (×) Elektriskā lādiņa pārveidotājs Lineārā lādiņa blīvuma pārveidotājs Virsmas uzlādes blīvuma pārveidotājs Volumetriskā lādiņa blīvuma pārveidotājs Elektriskās strāvas pārveidotājs Lineārās strāvas blīvuma pārveidotājs Virsmas strāvas blīvuma pārveidotājs Elektriskā lauka stipruma pārveidotājs Elektrības lauka stipruma pārveidotājs Elektrības sprieguma pārveidotājs Pretestības elektriskās vadītspējas pārveidotājs Elektriskās vadītspējas pārveidotājs kapacitātes induktivitātes pārveidotājs ASV vadu mērierīces pārveidotāja līmeņi dBm (dBm vai dBm), dBV (dBV), vatos utt. vienības Magnetomotīves spēka pārveidotājs Magnētiskā lauka intensitātes pārveidotājs Magnētiskās plūsmas pārveidotājs Magnētiskās indukcijas pārveidotājs Radiācija. Jonizējošā starojuma absorbētās devas ātruma pārveidotāja radioaktivitāte. Radioaktīvā sabrukšanas pārveidotāja starojums. Ekspozīcijas devas pārveidotāja starojums. Absorbētās devas pārveidotājs decimālo prefiksu pārveidotājs datu pārsūtīšanas tipogrāfijas un attēlu apstrādes vienības pārveidotājs kokmateriālu tilpuma vienību pārveidotājs D. I. Mendeļejeva ķīmisko elementu molārās masas periodiskās tabulas aprēķins
Ķīmiskā formula
Fe 2 (SO 4) 3, dzelzs (III) sulfāta molārā masa 399.8778 g/mol
55,845 2+(32,065+15,9994 4) 3
Elementu masas daļas savienojumā
Izmantojot molārās masas kalkulatoru
Molmasas kalkulators
kurmis
Visas vielas sastāv no atomiem un molekulām. Ķīmijā ir svarīgi precīzi izmērīt to vielu masu, kas nonāk reakcijā un rodas no tās. Pēc definīcijas mols ir vielas daudzuma SI vienība. Viens mols satur tieši 6,02214076 × 10²³ elementārdaļiņas. Šī vērtība ir skaitliski vienāda ar Avogadro konstanti NA, ja to izsaka molu⁻¹ vienībās, un to sauc par Avogadro skaitli. Vielas daudzums (simbols n) ir strukturālo elementu skaita mērs. Struktūras elements var būt atoms, molekula, jons, elektrons vai jebkura daļiņa vai daļiņu grupa.
Avogadro konstante N A = 6,02214076 × 10²³ mol⁻¹. Avogadro numurs ir 6,02214076 × 10²³.
Citiem vārdiem sakot, mols ir vielas daudzums, kas vienāds ar vielas atomu un molekulu atomu masu summu, kas reizināta ar Avogadro skaitli. Kurmis ir viena no septiņām SI sistēmas pamatvienībām, un to apzīmē ar molu. Tā kā vienības nosaukums un tās simbols ir vienādi, jāņem vērā, ka simbols nav locīts, atšķirībā no vienības nosaukuma, no kura var atteikties saskaņā ar parastajiem krievu valodas noteikumiem. Viens mols tīra oglekļa-12 atbilst tieši 12 gramiem.
Molārā masa
Molmasa ir vielas fizikālā īpašība, kas definēta kā šīs vielas masas attiecība pret vielas daudzumu molos. Citiem vārdiem sakot, tā ir viena vielas mola masa. SI sistēmā molārās masas mērvienība ir kilograms/mols (kg/mols). Taču ķīmiķi ir pieraduši izmantot ērtāku mērvienību g/mol.
molārā masa = g/mol

Elementu un savienojumu molārā masa
Savienojumi ir vielas, kas sastāv no dažādiem atomiem, kas ir ķīmiski saistīti viens ar otru. Piemēram, zemāk esošās vielas, kuras var atrast jebkuras mājsaimnieces virtuvē, ir ķīmiski savienojumi:
Ķīmisko elementu molārā masa gramos uz molu ir skaitliski tāda pati kā elementa atomu masa, kas izteikta atomu masas vienībās (vai daltonos). Savienojumu molārā masa ir vienāda ar savienojumu veidojošo elementu molmasu summu, ņemot vērā savienojumā esošo atomu skaitu. Piemēram, ūdens (H₂O) molārā masa ir aptuveni 1 × 2 + 16 = 18 g/mol.
Molekulārā masa

Molekulmasa (vecais nosaukums ir molekulmasa) ir molekulas masa, ko aprēķina kā katra molekulu veidojošā atoma masu summu, kas reizināta ar atomu skaitu šajā molekulā. Molekulmasa ir bezizmēra fizikāls lielums, kas skaitliski vienāds ar molāro masu. Tas ir, molekulmasa atšķiras no molārās masas dimensijā. Lai gan molekulmasa ir bezizmēra lielums, tai joprojām ir vērtība, ko sauc par atommasas vienību (amu) vai daltonu (Da), un tā ir aptuveni vienāda ar viena protona vai neitrona masu. Atomu masas vienība arī skaitliski ir vienāda ar 1 g/mol.
Molmasas aprēķins
Molāro masu aprēķina šādi:
Piemēram, aprēķināsim etiķskābes molāro masu
Tas sastāv no:
Mūsu kalkulators to dara. Tajā varat ievadīt etiķskābes formulu un pārbaudīt, kas notiek.
Vai jums ir grūti pārtulkot mērvienības no vienas valodas uz citu? Kolēģi ir gatavi jums palīdzēt. Publicējiet jautājumu TCTerms un dažu minūšu laikā saņemsi atbildi.