No septiņām aminoskābēm tika sintezēts peptīds. No piecām aminoskābēm tika sintezēts peptīds
kāda masa ir DNS molekulas daļai, kas kodē insulīna molekulu, ja ir zināms, ka šī molekula satur 51 aminoskābi, un vidējiviena nukleotīda molekulmasa ir 345 a. ēst.?
mugurkaulnieku tīklenes stieņu un bezmugurkaulnieku redzes šūnu vizuālā pigmenta gaismas jutīgais proteīns (opsīns) - rodopsīns sastāvno 348 aminoskābju atlikumiem. noteikt šī proteīna relatīvo molekulmasu, ja pieņemam, ka vienas aminoskābes atlikuma vidējā masa ir 116
Uzdevums Nr.1.MRNS ķēdes fragmentam ir nukleotīdu secība: CCCCCCGCAGUA. Nosakiet nukleotīdu secību DNS, antikodonus tRNS un aminoskābju secību proteīna molekulas fragmentā, izmantojot ģenētisko kodu tabulu.
Uzdevums Nr. 2. DNS ķēdes fragmentam ir šāda nukleotīdu secība: TACCCTCTCTTG. Izmantojot ģenētisko kodu tabulu, nosakiet mRNS nukleotīdu secību, atbilstošo tRNS antikodonus un atbilstošā proteīna molekulas fragmenta aminoskābju secību.
Problēma Nr.3
DNS ķēdes fragmenta nukleotīdu secība ir AATGCAGGTCATCA. Noteikt nukleotīdu secību mRNS un aminoskābju secību polipeptīdu ķēdē. Kas notiks polipeptīdā, ja gēna fragmenta mutācijas rezultātā tiks zaudēts otrais nukleotīdu triplets? Izmantojiet tabulu gent.code
Semināra uzdevumu risināšana par tēmu “Olbaltumvielu biosintēze” (10. klase)
Problēma Nr.4
Gēnu reģionam ir šāda struktūra: CGG-AGC-TCA-AAT. Norādiet attiecīgās olbaltumvielas sadaļas struktūru, par kuru informācija ir ietverta šajā gēnā. Kā ceturtā nukleotīda izņemšana no gēna ietekmēs proteīna struktūru?
Problēma Nr.5
Proteīns sastāv no 158 aminoskābēm. Cik garš ir gēns, kas to kodē?
Olbaltumvielu molekulmasa X=50000. Nosakiet atbilstošā gēna garumu. Vienas aminoskābes molekulmasa ir vidēji 100.
Problēma Nr.6
Cik nukleotīdu satur gēns (abas DNS virknes), kurā ir ieprogrammēts 51 aminoskābes proteīna insulīns?
Problēma Nr.7
Vienai no DNS virknēm molekulmasa ir 34155. Nosakiet šajā DNS ieprogrammēto proteīna monomēru skaitu. Viena nukleotīda vidējā molekulmasa ir 345.
Problēma Nr.8
Slāpekļskābes ietekmē citozīns tiek pārveidots par guanīnu. Kā mainīsies sintezētā tabakas mozaīkas vīrusa proteīna struktūra ar aminoskābju secību: serīns-glicīns-serīns-izoleicīns-treonīns-prolīns, ja visi citozīna nukleotīdi tiks pakļauti skābes iedarbībai?
Problēma Nr.9
Kāda ir gēna (divu DNS virkņu) molekulmasa, ja vienā virknē ieprogrammēts proteīns ar molekulmasu 1500? Vienas aminoskābes molekulmasa ir vidēji 100.
Problēma Nr.10
Tiek dots polipeptīdu ķēdes fragments: val-gli-phen-arg. Noteikt atbilstošās t-RNS, mRNS, DNS struktūru.
Problēma Nr.11
Dots DNS gēna fragments: TCT-TCT-TCA-A... Nosakiet: a) šajā reģionā kodētā proteīna primāro struktūru; b) šī gēna garums;
c) proteīna primārā struktūra, kas sintezēta pēc 4. nukleotīda zaudēšanas
šajā DNS.
Problēma Nr.12
Cik kodonu būs mRNS, nukleotīdu un tripletu DNS gēnā un aminoskābju proteīnā, ja dos 30 tRNS molekulas?
Problēma Nr.13
Ir zināms, ka visi RNS veidi tiek sintezēti uz DNS veidnes. DNS molekulas fragmentam, uz kura tiek sintezēts tRNS centrālās cilpas reģions, ir šāda nukleotīdu secība: ATAGCTGAACGGACT. Izveidojiet tRNS reģiona nukleotīdu secību, kas tiek sintezēta uz šī fragmenta, un aminoskābi, ko šī tRNS nesīs proteīna biosintēzes laikā, ja trešais triplets atbilst tRNS antikodonam. Paskaidrojiet savu atbildi. Lai atrisinātu uzdevumu, izmantojiet ģenētiskā koda tabulu.
brūns.Kādus pēcnācējus var sagaidīt no šīs laulības, ja zināms, ka brūno acu gēns dominē pār zilo acu gēnu?
2. Ģimenē bija divi brāļi. Viens no viņiem, pacients ar hemorāģisko diatēzi, apprecējās ar sievieti, kas arī cieš no šīs slimības. Arī visi trīs viņu bērni (2 meitenes un 1 zēns) bija slimi. Otrais brālis bija vesels un apprecējās ar veselu sievieti. No viņu četriem bērniem tikai viens bija slims ar hemorāģisko diatēzi. Nosakiet, kurš gēns nosaka hemorāģisko diatēzi.
3. Ģimenē, kurā abiem vecākiem bija normāla dzirde, piedzima nedzirdīgs bērns. Kura iezīme ir dominējošā Kādi ir visu šīs ģimenes locekļu genotipi?
4. Vīrietis, kas cieš no albīnisma, apprec veselīgu sievieti, kuras tēvs cieta no albīnisma. Kādus bērnus var sagaidīt no šīs laulības, ņemot vērā, ka albīnisms cilvēkiem ir iedzimts kā autosomāli recesīva iezīme?
recesīvs?
2. Viena no šizofrēnijas formām tiek pārmantota kā recesīvā pazīme. Nosakiet iespējamību, ka veseliem vecākiem būs bērns ar šizofrēniju, ja ir zināms, ka no šīs slimības cieta vecmāmiņa no tēva puses un vectēvs no mātes puses.
3. Kas ir analītiskā šķērsošana?
4. Liellopiem apputeksnums (ragu trūkums) dominē pār ragainību.
Aptaujāts bullis krustots ar trim govīm. No krustojuma ar vienu ragainu govi
piedzima ragains teliņš, krustojoties ar citu govi, piedzima ragains teliņš, krustojoties ar aptaukotu govi. Kādi ir visu krustošanā iesaistīto dzīvnieku genotipi?
5. Ja kviešos gēns, kas nosaka īso vārpu garumu, pilnībā nedominē gēnā, kas ir atbildīgs par garāku vārpu parādīšanos, tad kāda garuma vārpas var parādīties, krustojot divus augus ar vidēja garuma vārpām?
6. Andalūzijas (zilās) cāļi ir heterozigoti, parasti parādās krustojoties
baltās un melnās vistas. Kāds apspalvojums būs krustojumā iegūtajiem pēcnācējiem?
baltās un zilās cāļus, ja ir zināms, ka gēns, kas izraisa melno apspalvojumu cāļiem, ir gēns ar nepilnīgu dominējošo stāvokli (attiecībā pret recesīvo gēnu, kas atbild par
balta apspalvojuma veidošanās)?
7. Mātei ir otrā asins grupa un tā ir heterozigota. Manam tēvam ir IV asinsgrupa. Kādi asins veidi ir iespējami bērniem?
8. Formulējiet Mendeļa otro likumu un gametu tīrības likumu.
9. Kādu krustojumu sauc par dihibrīdu? Kurš polihibrīds?
10. Tomātu augu ar sarkaniem bumbierveida augļiem sakrusto ar augu, kuram ir sarkani sfēriski augļi. Iegūti 149 augi ar sarkaniem sfēriskiem augļiem un 53 augi ar dzelteniem sfēriskiem augļiem. Identificējiet dominējošo un
recesīvās pazīmes, vecāku un pēcnācēju genotipi.
11. Ir zināms, ka kataraktu un sarkanos matus cilvēkiem kontrolē dominējošie gēni, kas lokalizēti dažādos hromosomu pāros (autosomāli). Sarkanmataina sieviete, kas neslimo ar kataraktu, ir precējusies ar gaišmatainu vīrieti, kuram nesen veikta kataraktas operācija. Nosakiet, kādi bērni var piedzimt šiem laulātajiem, paturot prātā, ka vīrieša mātei ir tāds pats fenotips kā sievai, tas ir, viņa ir rudmataina un viņai nav kataraktas.
12. Kāda ir ar dzimumu saistītu pazīmju pārmantošanas īpatnība?
14. Kādu nealēlisko gēnu mijiedarbību sauc par epiģenēzi (epistāzi)
15. Zirgiem melnās krāsas (C) un sarkanās krāsas (c) gēnu ietekme izpaužas tikai tad, ja nav dominējošā gēna D. Ja tas ir, tad krāsa ir balta. Kādi pēcnācēji tiks iegūti, krustojot zirgus ar CcDd genotipu?
Olbaltumvielas veido šūnas ķīmiskās aktivitātes materiālo pamatu. Olbaltumvielu funkcijas dabā ir universālas. Vārds olbaltumvielas, terminam atbilst vispieņemtākais termins krievu literatūrā olbaltumvielas(no grieķu val proteios- vispirms). Līdz šim ir gūti lieli panākumi, nosakot attiecības starp olbaltumvielu uzbūvi un funkcijām, to līdzdalības mehānismu svarīgākajos organisma dzīves procesos un izprotot daudzu slimību patoģenēzes molekulāros pamatus.
Atkarībā no to molekulmasas izšķir peptīdus un proteīnus. Peptīdiem ir mazāka molekulmasa nekā olbaltumvielām. Peptīdiem, visticamāk, ir regulējoša funkcija (hormoni, enzīmu inhibitori un aktivatori, jonu transportieri cauri membrānām, antibiotikas, toksīni utt.).
12.1. α -Aminoskābes
12.1.1. Klasifikācija
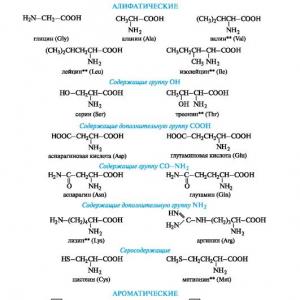
Peptīdi un proteīni ir veidoti no α-aminoskābju atlikumiem. Kopējais dabā sastopamo aminoskābju skaits pārsniedz 100, bet dažas no tām ir sastopamas tikai noteiktā organismu kopienā, 20 svarīgākās α-aminoskābes pastāvīgi atrodamas visos proteīnos (12.1. shēma).
α-aminoskābes ir heterofunkcionāli savienojumi, kuru molekulas pie viena oglekļa atoma satur gan aminogrupu, gan karboksilgrupu.
Shēma 12.1.Svarīgākās α-aminoskābes*

* Saīsinājumus izmanto tikai, lai rakstītu aminoskābju atlikumus peptīdu un olbaltumvielu molekulās. ** Neaizstājamās aminoskābes.
α-aminoskābju nosaukumus var konstruēt, izmantojot aizstājošo nomenklatūru, taču biežāk tiek lietoti to triviālie nosaukumi.

Triviālie α-aminoskābju nosaukumi parasti tiek saistīti ar izolācijas avotiem. Serīns ir daļa no zīda fibroīna (no lat. sēriju- zīdaini); Tirozīns vispirms tika izolēts no siera (no grieķu valodas. tyros- siers); glutamīns - no graudaugu lipekļa (no vācu val. Glutēns- līme); asparagīnskābe - no sparģeļu asniem (no lat. sparģeļi- sparģeļi).
Daudzas α-aminoskābes tiek sintezētas organismā. Dažas aminoskābes, kas nepieciešamas olbaltumvielu sintēzei, netiek ražotas organismā, un tām ir jānāk no ārpuses. Šīs aminoskābes sauc neaizstājams(skat. 12.1. diagrammu).
Neaizstājamās α-aminoskābes ietver:
valīns izoleicīns metionīns triptofāns
leicīns lizīns treonīns fenilalanīns
α-aminoskābes tiek klasificētas vairākos veidos atkarībā no īpašībām, kas kalpo par pamatu to sadalīšanai grupās.
Viena no klasifikācijas pazīmēm ir radikāļa R ķīmiskā daba. Pamatojoties uz šo pazīmi, aminoskābes iedala alifātiskajās, aromātiskajās un heterocikliskajās (sk. 12.1. diagrammu).
Alifātisksα -aminoskābes.Šī ir lielākā grupa. Tajā aminoskābes tiek sadalītas, izmantojot papildu klasifikācijas pazīmes.
Atkarībā no karboksilgrupu un aminogrupu skaita molekulā izšķir:
Neitrālas aminoskābes - katra viena NH grupa 2 un COOH;
Bāzes aminoskābes - divas NH grupas 2 un viena grupa
COOH;
Skābās aminoskābes - viena NH 2 grupa un divas COOH grupas.
Var atzīmēt, ka alifātisko neitrālo aminoskābju grupā oglekļa atomu skaits ķēdē nepārsniedz sešus. Tajā pašā laikā ķēdē nav aminoskābju ar četriem oglekļa atomiem, un aminoskābēm ar pieciem un sešiem oglekļa atomiem ir tikai sazarota struktūra (valīns, leicīns, izoleicīns).
Alifātiskais radikālis var saturēt “papildu” funkcionālās grupas:
Hidroksils - serīns, treonīns;
karbonskābes - asparagīnskābes un glutamīnskābes;
Tiols - cisteīns;
Amīds - asparagīns, glutamīns.
Aromātisksα -aminoskābes.Šajā grupā ietilpst fenilalanīns un tirozīns, kas konstruēti tā, ka tajos esošos benzola gredzenus no kopējā α-aminoskābes fragmenta atdala metilēngrupa -CH 2-.

Heterociklisks α -aminoskābes. Histidīns un triptofāns, kas pieder šai grupai, satur heterociklus - attiecīgi imidazolu un indolu. Šo heterociklu struktūra un īpašības ir aplūkotas turpmāk (sk. 13.3.1.; 13.3.2.). Heterociklisko aminoskābju konstruēšanas vispārējais princips ir tāds pats kā aromātisko.
Heterocikliskās un aromātiskās α-aminoskābes var uzskatīt par alanīna β-aizvietotiem atvasinājumiem.

Aminoskābe pieder arī gerocikliskajam prolīns, kurā sekundārā aminogrupa ir iekļauta pirolidīnā

α-aminoskābju ķīmijā liela uzmanība tiek pievērsta “sānu” radikāļu R struktūrai un īpašībām, kam ir svarīga loma olbaltumvielu struktūras veidošanā un to bioloģisko funkciju veikšanā. Liela nozīme ir tādām īpašībām kā “sānu” radikāļu polaritāte, funkcionālo grupu klātbūtne radikāļos un šo funkcionālo grupu spēja jonizēties.
Atkarībā no sānu radikāļa, aminoskābes ar nepolāri(hidrofobie) radikāļi un aminoskābes c polārais(hidrofilie) radikāļi.
Pirmajā grupā ietilpst aminoskābes ar alifātiskajiem sānu radikāļiem - alanīns, valīns, leicīns, izoleicīns, metionīns - un aromātiskie sānu radikāļi - fenilalanīns, triptofāns.
Otrajā grupā ietilpst aminoskābes, kuru radikāļos ir polāras funkcionālās grupas, kas spēj jonizēties (jonogēnas) vai ķermeņa apstākļos nespēj pārveidoties jonu stāvoklī (nejonu). Piemēram, tirozīnā hidroksilgrupa ir jonu (fenola raksturs), serīnā tā ir nejona (alkoholiska pēc būtības).

Polārās aminoskābes ar jonu grupām radikāļos noteiktos apstākļos var būt jonu (anjonu vai katjonu) stāvoklī.

12.1.2. Stereoizomerisms
Galvenais α-aminoskābju uzbūves veids, t.i., viena un tā paša oglekļa atoma saite ar divām dažādām funkcionālajām grupām, radikāļu un ūdeņraža atomu, pats par sevi nosaka α-oglekļa atoma hiralitāti. Izņēmums ir vienkāršākā aminoskābe glicīns H 2 NCH 2 COOH, kam nav hiralitātes centra.
α-aminoskābju konfigurāciju nosaka konfigurācijas standarts - gliceraldehīds. Aminogrupas atrašanās vieta standarta Fišera projekcijas formulā pa kreisi (līdzīgi kā OH grupai l-gliceraldehīdā) atbilst l-konfigurācijai, bet labajā pusē - hirālā oglekļa atoma d-konfigurācijai. Autors R, S-sistēmā α-oglekļa atomam visās l-sērijas α-aminoskābēs ir S-konfigurācija, bet d-sērijā - R-konfigurācija (izņēmums ir cisteīns, skatīt 7.1.2.). .
Lielākā daļa α-aminoskābju satur vienu asimetrisku oglekļa atomu katrā molekulā un pastāv kā divi optiski aktīvi enantiomēri un viens optiski neaktīvs racemāts. Gandrīz visas dabiskās α-aminoskābes pieder l sērijai.

Aminoskābes izoleicīns, treonīns un 4-hidroksiprolīns satur divus hiralitātes centrus molekulā.

Šādas aminoskābes var pastāvēt kā četri stereoizomēri, kas pārstāv divus enantiomēru pārus, no kuriem katrs veido racemātu. Lai izveidotu dzīvnieku olbaltumvielas, tiek izmantots tikai viens no enantiomēriem.
Izoleicīna stereoizomerisms ir līdzīgs iepriekš apspriestajam treonīna stereoizomerismam (sk. 7.1.3.). No četriem stereoizomēriem olbaltumvielas satur l-izoleicīnu ar abu asimetrisko oglekļa atomu C-α un C-β S konfigurāciju. Citu enantiomēru pāra nosaukumos, kas ir diastereomēri attiecībā uz leicīnu, tiek izmantots prefikss Sveiki-.

Racemātu šķelšanās. L-sērijas α-aminoskābju avots ir olbaltumvielas, kuras šim nolūkam tiek pakļautas hidrolītiskai šķelšanai. Sakarā ar lielo nepieciešamību pēc atsevišķiem enantiomēriem (olbaltumvielu sintēzei, ārstnieciskām vielām utt.) ķīmiska sintētisko racēmisko aminoskābju sadalīšanas metodes. Vēlams fermentatīvs gremošanas metode, izmantojot fermentus. Pašlaik racēmisko maisījumu atdalīšanai izmanto hromatogrāfiju uz hirāliem sorbentiem.
12.1.3. Skābju-bāzes īpašības
Aminoskābju amfoteritāti nosaka skābā (COOH) un bāziskā (NH 2) funkcionālās grupas savās molekulās. Aminoskābes veido sāļus gan ar sārmiem, gan ar skābēm.
Kristāliskā stāvoklī α-aminoskābes pastāv kā dipolāri joni H3N+ - CHR-COO- (parasti lietots apzīmējums
Aminoskābes struktūra nejonizētā formā ir paredzēta tikai ērtībai).
Ūdens šķīdumā aminoskābes eksistē dipolāru jonu, katjonu un anjonu formu līdzsvara maisījuma veidā.

Līdzsvara stāvoklis ir atkarīgs no barotnes pH. Visām aminoskābēm stipri skābā (pH 1–2) vidē dominē katjonu formas, bet stipri sārmainā (pH > 11) vidē – anjonu formas.
Jonu struktūra nosaka vairākas specifiskas aminoskābju īpašības: augsta kušanas temperatūra (virs 200? C), šķīdība ūdenī un nešķīstība nepolārajos organiskajos šķīdinātājos. Lielākajai daļai aminoskābju spēja labi izšķīst ūdenī ir svarīgs faktors to bioloģiskās funkcionēšanas nodrošināšanā, ar to saistīta aminoskābju uzsūkšanās, transportēšana organismā u.c.
Pilnībā protonēta aminoskābe (katjonu forma) no Brønsted teorijas viedokļa ir divvērtīgā skābe,
Ziedojot vienu protonu, šāda divbāziskā skābe pārvēršas par vāju vienbāzisku skābi - dipolāru jonu ar vienu skābes grupu NH 3 + . Dipolārā jona deprotonēšana noved pie aminoskābes anjonu formas veidošanās - karboksilāta jona, kas ir Brønsted bāze. Vērtības raksturo
Aminoskābju karboksilgrupas pamata skābās īpašības parasti ir robežās no 1 līdz 3; vērtības pK a2 raksturojot amonija grupas skābumu - no 9 līdz 10 (12.1. tabula).
12.1. tabula.Svarīgāko α-aminoskābju skābju-bāzes īpašības

Līdzsvara stāvoklis, t.i., dažādu aminoskābju formu attiecība, ūdens šķīdumā pie noteiktām pH vērtībām ir būtiski atkarīga no radikāļa struktūras, galvenokārt no jonu grupu klātbūtnes tajā, spēlējot papildu lomu. skābie un bāzes centri.
PH vērtību, pie kuras dipolāro jonu koncentrācija ir maksimālā un aminoskābes katjonu un anjonu formu minimālā koncentrācija ir vienāda, sauc.izoelektriskais punkts (p/).
Neitrālsα -aminoskābes.Šīm aminoskābēm ir nozīmepInedaudz zemāks par 7 (5,5-6,3), jo ir lielāka spēja jonizēt karboksilgrupu NH 2 grupas -/- efekta ietekmē. Piemēram, alanīnam ir izoelektriskais punkts pie pH 6,0.

Skābsα -aminoskābes.Šīm aminoskābēm radikālā ir papildu karboksilgrupa, un tās ir pilnībā protonētā formā stipri skābā vidē. Skābās aminoskābes ir trīsbāziskas (saskaņā ar Brøndsted) ar trīs nozīmēmpK a,kā redzams asparagīnskābes piemērā (p/ 3,0).

Skābām aminoskābēm (asparagīnskābei un glutamīnskābei) izoelektriskais punkts ir pie pH daudz zemāka par 7 (sk. 12.1. tabulu). Organismā pie fizioloģiskajām pH vērtībām (piemēram, asiņu pH 7,3-7,5) šīs skābes ir anjonu formā, jo abas karboksilgrupas ir jonizētas.
Pamataα -aminoskābes. Bāzisko aminoskābju gadījumā izoelektriskie punkti atrodas pH apgabalā virs 7. Stipri skābā vidē šie savienojumi ir arī trīsbāziskās skābes, kuru jonizācijas stadijas ilustrē lizīna piemērs (p/ 9,8) .

Organismā pamata aminoskābes ir atrodamas katjonu veidā, tas ir, abas aminogrupas ir protonētas.
Kopumā nav α-aminoskābes in vivoneatrodas izoelektriskajā punktā un nenonāk stāvoklī, kas atbilst zemākajai šķīdībai ūdenī. Visas aminoskābes organismā ir jonu formā.
12.1.4. Analītiski svarīgas reakcijas α -aminoskābes
α-aminoskābes kā heterofunkcionāli savienojumi iesaistās reakcijās, kas raksturīgas gan karboksilgrupām, gan aminogrupām. Dažas aminoskābju ķīmiskās īpašības ir saistītas ar funkcionālajām grupām radikālā. Šajā sadaļā ir apskatītas reakcijas, kurām ir praktiska nozīme aminoskābju identificēšanā un analīzē.
Esterifikācija.Aminoskābēm reaģējot ar spirtiem skābes katalizatora (piemēram, hlorūdeņraža gāzes) klātbūtnē, esteri tiek iegūti hidrohlorīdu veidā ar labu ražu. Lai izolētu brīvos esterus, reakcijas maisījumu apstrādā ar amonjaka gāzi.

Aminoskābju esteriem nav dipolāras struktūras, tāpēc atšķirībā no pamatskābēm tie šķīst organiskajos šķīdinātājos un ir gaistoši. Tādējādi glicīns ir kristāliska viela ar augstu kušanas temperatūru (292°C), un tā metilesteris ir šķidrums ar viršanas temperatūru 130°C. Aminoskābju esteru analīzi var veikt, izmantojot gāzes-šķidruma hromatogrāfiju.
Reakcija ar formaldehīdu. Praktiska nozīme ir reakcijai ar formaldehīdu, kas ir pamatā aminoskābju kvantitatīvai noteikšanai ar metodi. formola titrēšana(Sērensena metode).
Aminoskābju amfoteriskais raksturs neļauj veikt tiešu titrēšanu ar sārmu analītiskiem nolūkiem. Aminoskābju mijiedarbība ar formaldehīdu rada relatīvi stabilus aminospirtus (skat. 5.3) - N-hidroksimetilatvasinājumus, kuru brīvo karboksilgrupu pēc tam titrē ar sārmu.
Kvalitatīvas reakcijas. Aminoskābju un olbaltumvielu ķīmijas iezīme ir daudzu kvalitatīvu (krāsu) reakciju izmantošana, kas iepriekš bija ķīmiskās analīzes pamatā. Mūsdienās, kad pētījumi tiek veikti, izmantojot fizikāli ķīmiskās metodes, α-aminoskābju noteikšanai joprojām tiek izmantotas daudzas kvalitatīvas reakcijas, piemēram, hromatogrāfiskajā analīzē.
Helātu veidošanās. Ar smago metālu katjoniem α-aminoskābes kā bifunkcionāli savienojumi veido iekšējos kompleksos sāļus, piemēram, ar svaigi pagatavotu vara(11) hidroksīdu maigos apstākļos iegūst labi kristalizējošos helātus.
zilā vara(11) sāļi (viena no nespecifiskām metodēm α-aminoskābju noteikšanai).

Ninhidrīna reakcija. α-aminoskābju vispārējā kvalitatīvā reakcija ir reakcija ar ninhidrīnu. Reakcijas produktam ir zili violeta krāsa, ko izmanto aminoskābju vizuālai noteikšanai hromatogrammās (uz papīra, plānā kārtā), kā arī spektrofotometriskai noteikšanai uz aminoskābju analizatoriem (produkts absorbē gaismu apvidū 550-570 nm).

Deaminēšana. Laboratorijas apstākļos šī reakcija notiek, slāpekļskābei iedarbojoties uz α-aminoskābēm (sk. 4.3.). Šajā gadījumā veidojas atbilstošā α-hidroksiskābe un izdalās slāpekļa gāze, kuras tilpums tiek izmantots, lai noteiktu reaģējušo aminoskābes daudzumu (Van-Slyke metode).
Ksantoproteīna reakcija. Šo reakciju izmanto, lai noteiktu aromātiskās un heterocikliskās aminoskābes - fenilalanīnu, tirozīnu, histidīnu, triptofānu. Piemēram, koncentrētai slāpekļskābei iedarbojoties uz tirozīnu, veidojas nitroatvasinājums, kas iekrāsojas dzeltenā krāsā. Sārmainā vidē krāsa kļūst oranža, jo notiek fenola hidroksilgrupas jonizācija un palielinās anjona ieguldījums konjugācijā.

Ir arī vairākas privātas reakcijas, kas ļauj noteikt atsevišķas aminoskābes.
Triptofāns konstatēts, reaģējot ar p-(dimetilamino)benzaldehīdu sērskābē, parādoties sarkanvioletā krāsā (Ērliha reakcija). Šo reakciju izmanto triptofāna kvantitatīvai analīzei olbaltumvielu sadalīšanās produktos.
Cisteīns konstatēts, izmantojot vairākas kvalitatīvas reakcijas, pamatojoties uz tajā esošās merkapto grupas reaktivitāti. Piemēram, kad proteīna šķīdumu ar svina acetātu (CH3COO)2Pb karsē sārmainā vidē, veidojas melnas svina sulfīda PbS nogulsnes, kas norāda uz cisteīna klātbūtni olbaltumvielās.
12.1.5. Bioloģiski svarīgas ķīmiskās reakcijas
Organismā dažādu enzīmu ietekmē tiek veiktas vairākas svarīgas aminoskābju ķīmiskās pārvērtības. Šādas transformācijas ietver transaminēšanu, dekarboksilēšanu, elimināciju, aldola šķelšanos, oksidatīvo deamināciju un tiola grupu oksidēšanu.
Transaminācija ir galvenais ceļš α-aminoskābju biosintēzei no α-oksoskābēm. Aminogrupas donors ir aminoskābe, kas šūnās ir pietiekamā daudzumā vai pārmērīgā daudzumā, un tās akceptors ir α-oksoskābe. Šajā gadījumā aminoskābe tiek pārveidota par oksskābi, bet oksskābe par aminoskābi ar atbilstošu radikāļu struktūru. Tā rezultātā transaminēšana ir atgriezenisks aminogrupu un okso grupu apmaiņas process. Šādas reakcijas piemērs ir l-glutamīnskābes ražošana no 2-oksoglutārskābes. Donora aminoskābe var būt, piemēram, l-asparagīnskābe.

α-aminoskābes satur elektronus izvelkošu aminogrupu (precīzāk, protonētu aminogrupu NH) α-pozīcijā pret karboksilgrupu. 3 +), un tāpēc spēj dekarboksilēties.
Likvidēšanaraksturīgs aminoskābēm, kurās sānu radikālis β-pozīcijā pret karboksilgrupu satur elektronus izvelkošu funkcionālu grupu, piemēram, hidroksilgrupu vai tiolu. To izvadīšana noved pie vidēji reaktīvām α-enaminoskābēm, kuras viegli pārvēršas tautomērās iminoskābēs (analogs ar keto-enola tautomēriju). Hidratācijas rezultātā pie C=N saites un sekojošas amonjaka molekulas eliminācijas rezultātā α-iminoskābes tiek pārveidotas par α-okso skābēm.

Šo transformācijas veidu sauc eliminācija-hidratācija. Piemērs ir pirovīnskābes ražošana no serīna.
Aldola šķelšanās rodas α-aminoskābju gadījumā, kuras satur hidroksilgrupu β-pozīcijā. Piemēram, serīns tiek sadalīts, veidojot glicīnu un formaldehīdu (pēdējais neizdalās brīvā formā, bet uzreiz saistās ar koenzīmu).
Oksidatīvā deaminācija var veikt, piedaloties fermentiem un koenzīmam NAD+ vai NADP+ (sk. 14.3.). α-aminoskābes var pārvērst par α-oksoskābēm ne tikai transaminācijas, bet arī oksidatīvās deaminācijas rezultātā. Piemēram, α-oksoglutārskābe veidojas no l-glutamīnskābes. Reakcijas pirmajā posmā glutamīnskābi dehidrogenē (oksidē) līdz α-iminoglutārskābei
skābes. Otrajā posmā notiek hidrolīze, kā rezultātā veidojas α-oksoglutārskābe un amonjaks. Hidrolīzes stadija notiek bez fermenta līdzdalības.

α-okso skābju reducējošās aminēšanas reakcija notiek pretējā virzienā. α-oksoglutārskābe, kas vienmēr atrodas šūnās (kā ogļhidrātu metabolisma produkts), šādā veidā tiek pārveidota par L-glutamīnskābi.
Tiola grupu oksidēšana ir cisteīna un cistīna atlikumu savstarpējās konversijas pamatā, nodrošinot vairākus redoksprocesus šūnā. Cisteīns, tāpat kā visi tioli (sk. 4.1.2.), viegli oksidējas, veidojot disulfīdu, cistīnu. Disulfīda saite cistīnā ir viegli reducējama, veidojot cisteīnu.

Pateicoties tiola grupas spējai viegli oksidēties, cisteīns veic aizsargfunkciju, ja organisms tiek pakļauts vielām ar augstu oksidatīvo spēju. Turklāt tas bija pirmais medikaments, kam bija pretradiācijas iedarbība. Cisteīns tiek izmantots farmācijas praksē kā zāļu stabilizators.
Cisteīna pārvēršanās par cistīnu izraisa disulfīdu saišu veidošanos, piemēram, reducētā glutationā
(sk. 12.2.3.).
12.2. Peptīdu un olbaltumvielu primārā struktūra
Parasti tiek uzskatīts, ka peptīdi satur līdz 100 aminoskābju atlikumiem molekulā (kas atbilst molekulmasai līdz 10 tūkstošiem), un olbaltumvielās ir vairāk nekā 100 aminoskābju atlikumi (molekulārā masa no 10 tūkstošiem līdz vairākiem miljoniem). .
Savukārt peptīdu grupā ierasts atšķirt oligopeptīdi(zemas molekulmasas peptīdi), kuru ķēdē ir ne vairāk kā 10 aminoskābju atlikumi, un polipeptīdi, kuras ķēdē ir līdz 100 aminoskābju atlikumiem. Makromolekulas ar aminoskābju atlikumu skaitu, kas tuvojas 100 vai nedaudz pārsniedz 100, neatšķir polipeptīdus no olbaltumvielām; šie termini bieži tiek izmantoti kā sinonīmi.
Peptīdu un proteīna molekulu formāli var attēlot kā α-aminoskābju polikondensācijas produktu, kas rodas, veidojoties peptīda (amīda) saitei starp monomēra vienībām (12.2. shēma).
Poliamīda ķēdes dizains ir vienāds visiem peptīdiem un proteīniem. Šai ķēdei ir nesazarota struktūra un tā sastāv no mainīgām peptīdu (amīdu) grupām -CO-NH- un fragmentiem -CH(R)-.
Viens ķēdes gals satur aminoskābi ar brīvu NH grupu 2, sauc par N-galu, otru sauc par C-galu,
Shēma 12.2.Peptīdu ķēdes konstruēšanas princips

kas satur aminoskābi ar brīvu COOH grupu. Peptīdu un olbaltumvielu ķēdes ir rakstītas no N-gala.
12.2.1. Peptīdu grupas struktūra
Peptīdu (amīdu) grupā -CO-NH- oglekļa atoms atrodas sp2 hibridizācijas stāvoklī. Slāpekļa atoma vientuļais elektronu pāris nonāk konjugācijā ar C=O dubultsaites π-elektroniem. No elektroniskās struktūras viedokļa peptīdu grupa ir trīscentru p,π-konjugēta sistēma (sk. 2.3.1.), kurā elektronu blīvums ir nobīdīts uz elektronnegatīvāko skābekļa atomu. C, O un N atomi, kas veido konjugētu sistēmu, atrodas vienā plaknē. Elektronu blīvuma sadalījumu amīdu grupā var attēlot, izmantojot robežstruktūras (I) un (II) vai elektronu blīvuma nobīdi attiecīgi NH un C=O grupu +M- un -M-efektu rezultātā. (III).

Konjugācijas rezultātā notiek zināma saišu garumu izlīdzināšana. C=O dubultsaite tiek paplašināta līdz 0,124 nm, salīdzinot ar parasto garumu 0,121 nm, un C-N saite kļūst īsāka - 0,132 nm, salīdzinot ar 0,147 nm parastajā gadījumā (12.1. att.). Plakanā konjugētā sistēma peptīdu grupā rada grūtības rotācijā ap C-N saiti (rotācijas barjera ir 63-84 kJ/mol). Tādējādi elektroniskā struktūra nosaka diezgan stingru plakans peptīdu grupas struktūra.
Kā redzams no att. 12.1, aminoskābju atlikumu α-oglekļa atomi atrodas peptīdu grupas plaknē pretējās C-N saites pusēs, t.i., labvēlīgākā transpozīcijā: aminoskābju atlikumu sānu radikāļi R šajā gadījumā būs Vistālāk viens no otra kosmosā.
Polipeptīdu ķēdei ir pārsteidzoši viendabīga struktūra, un to var attēlot kā viens otra virkni, kas atrodas leņķī.

Rīsi. 12.1.Peptīdu grupas -CO-NH- un aminoskābju atlikumu α-oglekļa atomu plakans izvietojums
viena ar otru peptīdu grupu plaknes, kas savienotas viena ar otru caur α-oglekļa atomiem ar Cα-N un Cα-Csp saitēm 2 (12.2. att.). Rotācija ap šīm atsevišķajām saitēm ir ļoti ierobežota, jo ir grūtības aminoskābju atlikumu sānu radikāļu telpiskajā izvietojumā. Tādējādi peptīdu grupas elektroniskā un telpiskā struktūra lielā mērā nosaka polipeptīdu ķēdes struktūru kopumā.

Rīsi. 12.2.Peptīdu grupu plakņu relatīvais novietojums polipeptīdu ķēdē
12.2.2. Sastāvs un aminoskābju secība
Ar vienmērīgi konstruētu poliamīda ķēdi peptīdu un proteīnu specifiku nosaka divas svarīgākās īpašības - aminoskābju sastāvs un aminoskābju secība.
Peptīdu un proteīnu aminoskābju sastāvs ir to α-aminoskābju raksturs un kvantitatīvā attiecība.
Aminoskābju sastāvu nosaka, analizējot peptīdu un olbaltumvielu hidrolizātus, galvenokārt ar hromatogrāfijas metodēm. Pašlaik šāda analīze tiek veikta, izmantojot aminoskābju analizatorus.
Amīdu saites spēj hidrolizēt gan skābā, gan sārmainā vidē (sk. 8.3.3.). Peptīdi un olbaltumvielas tiek hidrolizētas, veidojot vai nu īsākas ķēdes – tas ir tā sauktais daļēja hidrolīze, vai aminoskābju maisījums (jonu formā) - pilnīga hidrolīze. Hidrolīzi parasti veic skābā vidē, jo daudzas aminoskābes ir nestabilas sārmainas hidrolīzes apstākļos. Jāņem vērā, ka asparagīna un glutamīna amīdu grupas arī ir pakļautas hidrolīzei.

Peptīdu un proteīnu primārā struktūra ir aminoskābju secība, t.i., α-aminoskābju atlikumu maiņas secība.
Primāro struktūru nosaka, secīgi noņemot aminoskābes no abiem ķēdes galiem un identificējot tās.
12.2.3. Peptīdu struktūra un nomenklatūra
Peptīdu nosaukumus veido, secīgi uzskaitot aminoskābju atlikumus, sākot no N-gala, pievienojot sufiksu-il, izņemot pēdējo C-gala aminoskābi, kurai ir saglabāts tās pilnais nosaukums. Citiem vārdiem sakot, nosaukumi
aminoskābes, kas iekļuvušas peptīdu saites veidošanā “savas” COOH grupas dēļ, beidzas peptīda nosaukumā ar -il: alanils, valils utt. (asparagīnskābes un glutamīnskābes atliekām tiek lietoti attiecīgi nosaukumi “aspartils” un “glutamils”). Aminoskābju nosaukumi un simboli norāda uz to piederību l -rinda, ja nav norādīts citādi ( d vai dl).

Dažreiz saīsinātajā apzīmējumā simboli H (kā daļa no aminogrupas) un OH (kā daļa no karboksilgrupas) norāda uz terminālo aminoskābju funkcionālo grupu neaizstāšanu. Šī metode ir ērta peptīdu funkcionālo atvasinājumu attēlošanai; piemēram, iepriekš minētā peptīda amīds C-gala aminoskābē ir rakstīts ar H-Asn-Gly-Phe-NH2.
Peptīdi ir atrodami visos organismos. Atšķirībā no olbaltumvielām tiem ir neviendabīgāks aminoskābju sastāvs, jo īpaši tie diezgan bieži satur aminoskābes d -rinda. Strukturāli tie ir arī daudzveidīgāki: satur cikliskus fragmentus, sazarotas ķēdes utt.
Viens no visizplatītākajiem tripeptīdu pārstāvjiem ir glutations- atrodams visu dzīvnieku, augu un baktēriju organismā.

Cisteīns glutationa sastāvā ļauj glutationam pastāvēt gan reducētā, gan oksidētā veidā.

Glutations ir iesaistīts vairākos redoksprocesos. Tas darbojas kā proteīnu aizsargs, t.i., viela, kas aizsargā proteīnus ar brīvām SH tiola grupām no oksidēšanās, veidojot disulfīda saites -S-S-. Tas attiecas uz tiem proteīniem, kuriem šāds process nav vēlams. Šādos gadījumos glutations pārņem oksidētāja darbību un tādējādi “aizsargā” proteīnu. Glutationa oksidēšanas laikā disulfīda saites dēļ notiek divu tripeptīdu fragmentu starpmolekulāra šķērssavienošanās. Process ir atgriezenisks.
12.3. Polipeptīdu un olbaltumvielu sekundārā struktūra
Augstas molekulmasas polipeptīdiem un olbaltumvielām līdz ar primāro struktūru ir raksturīgi arī augstāki organizētības līmeņi, ko sauc par sekundārais, terciārais Un kvartārs struktūras.
Sekundāro struktūru raksturo galvenās polipeptīdu ķēdes telpiskā orientācija, bet terciāro struktūru - visas proteīna molekulas trīsdimensiju arhitektūra. Gan sekundārā, gan terciārā struktūra ir saistīta ar makromolekulārās ķēdes sakārtotu izvietojumu telpā. Olbaltumvielu terciārā un kvartārā struktūra tiek apspriesta bioķīmijas kursā.
Aprēķinos tika parādīts, ka viena no vislabvēlīgākajām polipeptīdu ķēdes konformācijām ir izkārtojums telpā labās puses spirāles formā, t.s. α-spirāle(12.3. att., a).
α-spirālveida polipeptīdu ķēdes telpisko izvietojumu var iedomāties, iedomājoties, ka tā apvij noteiktu

Rīsi. 12.3.Polipeptīdu ķēdes α-spirālveida konformācija
cilindrs (sk. 12.3. att., b). Vidēji vienā spirāles apgriezienā ir 3,6 aminoskābju atlikumi, spirāles solis ir 0,54 nm un diametrs ir 0,5 nm. Divu blakus esošo peptīdu grupu plaknes atrodas 108° leņķī, un aminoskābju sānu radikāļi atrodas spirāles ārpusē, t.i., tie ir vērsti it kā no cilindra virsmas.
Galvenā loma šādas ķēdes konformācijas nodrošināšanā ir ūdeņraža saitēm, kuras α-spirālē veidojas starp katras pirmās karbonilskābekļa atomu un katras piektās aminoskābes atlikuma NH grupas ūdeņraža atomu.

Ūdeņraža saites ir vērstas gandrīz paralēli α-spirāles asij. Viņi tur ķēdi savīti.
Parasti olbaltumvielu ķēdes nav pilnībā spirālveida, bet tikai daļēji. Proteīni, piemēram, mioglobīns un hemoglobīns, satur diezgan garus α-spirāles reģionus, piemēram, mioglobīna ķēdi
75% spiralizēts. Daudzos citos proteīnos spirālveida reģionu īpatsvars ķēdē var būt neliels.
Cits polipeptīdu un olbaltumvielu sekundārās struktūras veids ir β-struktūra, ko sauc arī par salocīta lapa, vai salocīts slānis. Iegarenās polipeptīdu ķēdes ir sakārtotas salocītās loksnēs, ko starp šo ķēžu peptīdu grupām savieno daudzas ūdeņraža saites (12.4. att.). Daudzi proteīni satur gan α-spirāles, gan β-loksnes struktūras.

Rīsi. 12.4.Polipeptīdu ķēdes sekundārā struktūra salocītas loksnes veidā (β-struktūra)
Katrai zinātnes nozarei ir savs “zilais putns”; Kibernētika sapņo par “domājošām” mašīnām, fiziķi par kontrolētām kodoltermiskām reakcijām, ķīmiķi sapņo par “dzīvās vielas” – proteīna – sintēzi. Olbaltumvielu sintēze jau daudzus gadus ir bijusi zinātniskās fantastikas romānu tēma, kas ir ķīmijas nākamā spēka simbols. Tas izskaidrojams gan ar milzīgo lomu, ko dzīvajā pasaulē spēlē olbaltumvielas, gan ar grūtībām, ar kurām neizbēgami saskārās katrs pārdrošnieks, kurš uzdrošinājās no atsevišķām aminoskābēm “salikt” sarežģītu proteīna mozaīku. Un pat ne pats proteīns, bet tikai.
Atšķirība starp proteīniem un peptīdiem ir ne tikai terminoloģiska, lai gan abu molekulārās ķēdes sastāv no aminoskābju atlikumiem. Kādā posmā kvantitāte pārvēršas kvalitātē: peptīdu ķēde - primārā struktūra - iegūst spēju salocīt spirālēs un bumbiņās, veidojot sekundāras un terciāras struktūras, kas jau raksturīgas dzīvajai vielai. Un tad peptīds kļūst par proteīnu. Šeit nav skaidras robežas - polimēra ķēdei nevar uzlikt demarkācijas zīmi: turpmāk - peptīds, turpmāk - proteīns. Bet ir zināms, piemēram, ka adranokortikotropais hormons, kas sastāv no 39 aminoskābju atlikumiem, ir polipeptīds, un hormona insulīns, kas sastāv no 51 atlikuma divu ķēžu veidā, jau ir proteīns. Vienkāršākais, bet tomēr proteīns.
Metodi aminoskābju apvienošanai peptīdos pagājušā gadsimta sākumā atklāja vācu ķīmiķis Emīls Fišers. Taču ilgu laiku pēc tam ķīmiķi nevarēja nopietni domāt ne tikai par proteīnu vai 39 locekļu peptīdu sintēzi, bet pat par daudz īsākām ķēdēm.
Olbaltumvielu sintēzes process
Lai savienotu divas aminoskābes kopā, ir jāpārvar daudzas grūtības. Katrai aminoskābei, tāpat kā abpusējam Janusam, ir divas ķīmiskās virsmas: karbonskābes grupa vienā galā un amīna bāzes grupa otrā. Ja OH grupa tiek noņemta no vienas aminoskābes karboksilgrupas, bet atoms tiek noņemts no citas aminoskābes amīna grupas, tad iegūtos divus aminoskābju atlikumus var savienot viens ar otru ar peptīdu saiti, un rezultātā parādīsies vienkāršākais no peptīdiem — dipeptīds. Un ūdens molekula atdalās. Atkārtojot šo darbību, peptīda garumu var palielināt.
Tomēr šo šķietami vienkāršo darbību ir praktiski grūti veikt: aminoskābes ļoti nelabprāt savienojas viena ar otru. Jums tie ir jāaktivizē ķīmiski un "uzsilda" viens no ķēdes galiem (visbiežāk karboksilgals) un jāveic reakcija, stingri ievērojot nepieciešamos nosacījumus. Bet tas vēl nav viss: otrā grūtība ir tā, ka savā starpā var savienoties ne tikai dažādu aminoskābju atliekas, bet arī divas vienas un tās pašas skābes molekulas. Šajā gadījumā sintezētā peptīda struktūra jau atšķirsies no vēlamās. Turklāt katrai aminoskābei var būt nevis divas, bet vairākas “Ahileja papēži” - sānu ķīmiski aktīvas grupas, kas spēj piesaistīt aminoskābju atlikumus.
Lai reakcija nenovirzītos no dotā ceļa, ir nepieciešams šos viltus mērķus maskēt - uz reakcijas laiku “noblīvēt” visas aminoskābes reaktīvās grupas, izņemot vienu, pievienojot t.s. aizsardzības grupas. Ja tas nav izdarīts, tad mērķis pieaugs ne tikai no abiem galiem, bet arī uz sāniem, un aminoskābes vairs nevarēs apvienot dotajā secībā. Bet tieši tā ir jebkuras virzītas sintēzes nozīme.
Taču, šādi atbrīvojoties no vienas problēmas, ķīmiķi saskārās ar citu: aizsarggrupas pēc sintēzes pabeigšanas ir jānoņem. Fišera laikos grupas, kas tika atdalītas ar hidrolīzi, tika izmantotas kā "aizsardzība". Tomēr hidrolīzes reakcija parasti izrādījās pārāk spēcīgs “šoks” iegūtajam peptīdam: tā darbietilpīgi uzbūvētā “struktūra” izjuka, tiklīdz no tās tika noņemtas “sastatnes” - aizsarggrupas. Tikai 1932. gadā Fišera skolnieks M. Bergmans atrada izeju no šīs situācijas: viņš ierosināja aizsargāt aminoskābes aminogrupu ar karbobenzoksi grupu, kuru varēja noņemt, nesabojājot peptīdu ķēdi.
Olbaltumvielu sintēze no aminoskābēm
Turpmākajos gados tika ierosinātas vairākas tā sauktās mīkstās metodes aminoskābju savstarpējai savstarpējai “savstarpējai saistīšanai”. Tomēr visas tās patiesībā bija tikai variācijas par Fišera metodes tēmu. Variācijas, kurās reizēm bija pat grūti noķert oriģinālo melodiju. Bet pats princips palika nemainīgs. Un tomēr grūtības, kas saistītas ar neaizsargāto grupu aizsardzību, palika nemainīgas. Par šo grūtību pārvarēšanu bija jāmaksā, palielinot reakcijas posmu skaitu: viens elementārs akts - divu aminoskābju kombinācija - sadalījās četros posmos. Un katrs papildu posms nozīmē neizbēgamus zaudējumus.
Pat ja pieņemam, ka katra posma lietderīgā raža ir 80% (un tā ir laba raža), tad pēc četriem posmiem šie 80% “izkusīs” līdz 40%. Un tas notiek tikai ar dipeptīda sintēzi! Ko darīt, ja ir 8 aminoskābes? Un ja 51, kā insulīnā? Pievienojiet tam sarežģītību, kas saistīta ar divu aminoskābju molekulu optisko "spoguļu" formu esamību, no kurām reakcijā ir nepieciešama tikai viena, kā arī problēmas, kas saistītas ar iegūto peptīdu atdalīšanu no blakusproduktiem, īpaši gadījumos, kad tie ir vienlīdz šķīstoši. Kāda ir kopējā summa: Ceļš uz nekurieni?
Un tomēr šīs grūtības neapturēja ķīmiķus. “Zilā putna” vajāšana turpinājās. 1954. gadā tika sintezēti pirmie bioloģiski aktīvie polipeptīdu hormoni – vazopresīns un oksitocīns. Tie satur astoņas aminoskābes. 1963. gadā tika sintezēts 39 locekļu AKTH polipeptīds, adrenokortikotropais hormons. Visbeidzot, ķīmiķi ASV, Vācijā un Ķīnā sintezēja pirmo proteīnu - hormonu insulīnu.
Kā ir, teiks lasītājs, ka grūtais ceļš, izrādās, veda nevis uz nekurieni un nekur, bet gan uz daudzu ķīmiķu paaudžu sapņu piepildījumu! Šis ir laikmetīgs notikums! Pareizi, šis ir laikmeta notikums. Bet vērtēsim to prātīgi, izvairoties no sensacionālisma, izsaukuma zīmēm un pārmērīgām emocijām.
Neviens neapstrīd: insulīna sintēze ir milzīga ķīmiķu uzvara. Šis ir kolosāls, titānisks darbs, kas ir visas apbrīnas vērts. Bet tajā pašā laikā ego būtībā ir vecās polipeptīdu ķīmijas griesti. Šī ir uzvara uz sakāves robežas.
Olbaltumvielu sintēze un insulīns
Insulīnā ir 51 aminoskābe. Lai tās apvienotu vēlamajā secībā, ķīmiķiem bija jāveic 223 reakcijas. Kad pēdējo pabeidza trīs gadus pēc pirmās, raža bija mazāka par vienu simtdaļu. Trīs gadi, 223 posmi, simtdaļa procenta – piekritīsiet, ka uzvara ir tīri simboliska. Ir ļoti grūti runāt par šīs metodes praktisko pielietojumu: ar tās ieviešanu saistītās izmaksas ir pārāk augstas. Bet galu galā mēs runājam nevis par vērtīgu organiskās ķīmijas godības relikviju sintēzi, bet gan par vitāli svarīgas zāles izlaišanu, kas nepieciešama tūkstošiem cilvēku visā pasaulē. Tātad klasiskā polipeptīdu sintēzes metode sevi izsmēla ar pašu pirmo, vienkāršāko proteīnu. Vai tas nozīmē, ka “zilais putns” atkal ir izkļuvis no ķīmiķu rokām?
Jauna proteīnu sintēzes metode
Apmēram pusotru gadu, pirms pasaule uzzināja par insulīna sintēzi, presē parādījās vēl viena vēsts, kas sākotnēji nepievērsa lielu uzmanību: amerikāņu zinātnieks R. Mērfīlds ierosināja jaunu peptīdu sintēzes metodi. Tā kā pats autors sākotnēji metodi nedeva pienācīgu vērtējumu un tajā bija daudz nepilnību, tā pirmajā tuvinājumā izskatījās pat sliktāka par esošajām. Tomēr jau 1964. gada sākumā, kad Merifīldam, izmantojot savu metodi, izdevās pabeigt 9-locekļu hormona pilnīgu sintēzi ar lietderīgu 70%, zinātnieki bija pārsteigti: 70% pēc visiem posmiem ir 9% no lietderīgā raža katrā sintēzes posmā.
Jaunās metodes galvenā ideja ir tāda, ka augošās peptīdu ķēdes, kas iepriekš tika atstātas haotiskas kustības šķīdumā varā, tagad vienā galā tika piesaistītas cietam nesējam - tās it kā bija spiestas noenkuroties. šķīdumā. Mērifīlds paņēma cietus sveķus un “pievienoja” pirmo aminoskābi, kas samontēta peptīdā, tās aktīvajām grupām karbonilgalā. Reakcijas notika atsevišķās sveķu daļiņās. Tās molekulu “labirintos” pirmo reizi parādījās topošā peptīda pirmie īsie dzinumi. Pēc tam traukā tika ievadīta otrā aminoskābe, tās molekulas ar karbonilgaliem tika šķērssavienotas ar “piesaistītās” aminoskābes brīvajiem amīna galiem, un peptīda nākotnes “ēkas” vēl viens “grīda” izauga. daļiņas. Tātad pakāpeniski tika izveidots viss peptīdu polimērs.
Jaunajai metodei bija neapšaubāmas priekšrocības: pirmkārt, tā atrisināja nevajadzīgo produktu atdalīšanas problēmu pēc katras secīgās aminoskābes pievienošanas - šie produkti tika viegli nomazgāti, un peptīds palika piestiprināts pie sveķu granulām. Tajā pašā laikā tika novērsta augošo peptīdu šķīdības problēma, kas ir viena no galvenajām vecās metodes problēmām; Iepriekš tie bieži nogulsnēja, praktiski pārtraucot piedalīties augšanas procesā. Peptīdi, kas tika “noņemti” no cietā balsta pēc sintēzes beigām, bija gandrīz visi vienāda izmēra un struktūras; jebkurā gadījumā izkliede struktūrā bija mazāka nekā ar klasisko metodi. Un attiecīgi noderīgāks risinājums. Pateicoties šai metodei, peptīdu sintēzi – rūpīgu, darbietilpīgu sintēzi – var viegli automatizēt.
Mērifīlds uzbūvēja vienkāršu iekārtu, kas pēc dotās programmas veica visas nepieciešamās darbības – reaģentu padevi, samaisīšanu, iztukšošanu, mazgāšanu, devu mērīšanu, jaunas porcijas pievienošanu utt. Ja pēc vecās metodes vienas aminoskābes pievienošana prasīja 2-3 dienas, tad Mērifīlds savā aparātā savienoja 5 aminoskābes dienā. Atšķirība ir 15 reizes.
Kādas ir olbaltumvielu sintēzes grūtības?
Mērifīldas metodi, ko sauc par cieto fāzi vai neviendabīgu, nekavējoties pieņēma ķīmiķi visā pasaulē. Tomēr pēc neilga laika kļuva skaidrs: jaunajai metodei līdzās galvenajām priekšrocībām ir arī vairāki nopietni trūkumi.
Peptīdu ķēdēm augot, var gadīties, ka vienai no tām pietrūks, teiksim, trešā “stāva” – trešās aminoskābes: tās molekula nesasniegs krustojumu, pa ceļam kaut kur iestrēgstot strukturālajā “savvaļā” polimērs. Un tad, pat ja visas pārējās aminoskābes, sākot no ceturtās, sarindojas pareizā secībā, tas situāciju vairs neglābs. Iegūtajam polipeptīdam tā sastāvā un līdz ar to arī īpašībās nebūs nekā kopīga ar iegūto vielu. Notiks tas pats, kas zvanot tālruņa numuru; Ja mēs izlaidīsim vienu ciparu, tas, ka esam pareizi ierakstījuši visu pārējo, mums vairs nepalīdzēs. Šādas viltus ķēdes ir gandrīz neiespējami atdalīt no “īstajām”, un preparāts izrādās piesārņots ar piemaisījumiem. Turklāt izrādās, ka sintēzi nevar veikt ne uz kādiem sveķiem - tie ir rūpīgi jāizvēlas, jo augošā peptīda īpašības zināmā mērā ir atkarīgas no sveķu īpašībām. Tāpēc visiem proteīnu sintēzes posmiem ir jāpieiet pēc iespējas rūpīgāk.
DNS proteīnu sintēze, video
Un visbeidzot, mēs piedāvājam jūsu uzmanību izglītojošam video par to, kā proteīnu sintēze notiek DNS molekulās.
Ir izstrādātas metodes aminoskābju (dažos gadījumos di- vai tripeptīdu) polimerizācijai, kā rezultātā veidojas polipeptīdi ar augstu molekulmasu. Šie produkti ir ļoti svarīgas paraugvielas, lai pētītu, piemēram, rentgenstaru difrakcijas modeļu raksturu vai IR spektrus zināmas un salīdzinoši vienkāršas struktūras peptīdiem.
Tomēr vairuma darbu pie peptīdu sintēzes mērķis ir iegūt savienojumus, kas ir identiski dabiskajiem. Šim nolūkam piemērotai metodei jāspēj apvienot optiski aktīvās aminoskābes noteikta garuma ķēdē un ar noteiktu vienību secību. Šāda veida sintēzes ne tikai apstiprināja dabisko peptīdu specifiskās struktūras, bet arī ļāva galīgi pierādīt (un tas ir
peptīdi un proteīni patiešām ir poliamīdi.
Emīls Fišers bija pirmais, kas sintezēja peptīdus (viņa iegūtais peptīds saturēja 18 aminoskābju atlikumus). Tādējādi viņš apstiprināja savu pieņēmumu, ka olbaltumvielās ir amīda saite. Ņemsim vērā, ka peptīdu un proteīnu ķīmijā Fišeram bija tāda pati fundamentālā loma kā ogļhidrātu ķīmijā, kas neapstrīdami liecina par šī zinātnieka ģēniju.
Galvenā problēma peptīdu sintēzē ir aminogrupas aizsardzības problēma. Kad vienas aminoskābes karboksilgrupa mijiedarbojas ar citas aminoskābes aminogrupu, ir jāizslēdz reakcijas iespēja starp karboksilgrupu un tās pašas aminoskābes molekulu aminogrupu. Piemēram, ražojot glicilalanīnu, ir jānovērš vienlaicīga glicilglicīna veidošanās. Reakciju var virzīt vēlamajā virzienā, ja vienā no aminogrupām tiek ievadīts aizvietotājs, kas padarīs šo aminogrupu nereaktīvu. Ir liels skaits šādu aizsarggrupu; no tiem ir jāizvēlas grupa, kuru pēc tam var noņemt, neiznīcinot peptīdu saites.

Mēs varam, piemēram, probenzoilēt glicīnu, pēc tam pārvērst to par skābes hlorīdu, skābes hlorīdu reaģēt ar alanīnu un tādējādi iegūt benzoilglicilalanīnu. Bet, ja mēs mēģināsim noņemt benzoilgrupu ar hidrolīzi, mēs vienlaikus hidrolizēsim citas amīda saites (peptīdu saites) un tādējādi iznīcināsim peptīdu, kuru vēlējāmies sintezēt.
No daudzajām metodēm, kas izstrādātas, lai aizsargātu aminogrupu, mēs apsvērsim tikai vienu: acilēšanu ar benzilhlorkarbonātu, ko sauc arī par karbobenzoksihlorīdu. (Šo metodi 1932. gadā izstrādāja M. Bergmans un L. Zervass Berlīnes Universitātē, vēlāk Rokfellera institūtā.) Reaģents ir gan ogļskābes esteris, gan skābes hlorīds, un to ir viegli pagatavot, benzilspirtam reaģējot ar fosgēns. (Kādā secībā jāsajauc spirts un fosgēns?)

Tāpat kā jebkurš skābes hlorīds, reaģents var pārvērst amīnu par amīdu
Tomēr šādi amīdi vienā aspektā atšķiras no vairuma amīdu, kas ir ļoti svarīgi peptīdu sintēzei. Karbobenzoksigrupu var atdalīt, izmantojot reaģentus, kas neietekmē peptīdu saiti: katalītisko hidrogenēšanu vai hidrolīzi ar bromūdeņraža šķīdumu etiķskābē.

Ilustrēsim acilēšanas metodi ar karbobenzoksihlorīdu, izmantojot glicilalanīna (Gly-Ala) sintēzes piemēru:

(skatīt skenēšanu)
Izcils sasniegums bija peptīdu hormona oksitocīna sintēze, ko Kornelas medicīnas koledžā veica V. Du Vinjo, kurš par šo un citiem darbiem 1955. gadā saņēma Nobela prēmiju. 1963. gadā tika publicēta pilnīga insulīna sintēze, kas satur 51 aminoskābi secībā, ko iepriekš atšifrēja Sanger.