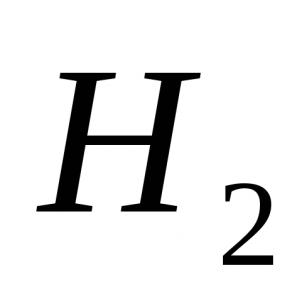Test „Stickstoff und seine Verbindungen. Thema: Stickstoff und seine Verbindungen (Prüfungs-)Klausur in Chemie (Klasse 9) zum Thema Klausur zum Thema Stickstoff und seine Verbindungen
Test "Stickstoff und seine Verbindungen"
Variante 1 1. Das stärkste Molekül a) H2; b) F2; c) O2; d) N2. 2. Phenolphthaleinfarbe in Ammoniaklösung: a) purpurrot; b) grün; c) gelb; d) blau. 3. Die Oxidationsstufe ist +3 am Stickstoffatom in der Verbindung: a) NH 4 NO 3; b) NaNO 3 ; c) NO2; d) KNO 2. 4. Bei der thermischen Zersetzung von Kupfer(II)nitrat entstehen:a) Kupfer(II)nitrit und O 2 ;b) Stickoxid(IV) und O 2 ;c) Kupfer(II)oxid, Braungas NO 2 und O 2 ; d) Kupfer(II)hydroxid, N 2 und O 2. 5. Welches Ion wird durch den Donor-Akzeptor-Mechanismus gebildet? a) NH4+; b) NO 3 – ; c) Cl – ; d) SO 4 2–. 6. Geben Sie starke Elektrolyte an: a) Salpetersäure; b) salpetrige Säure; c) eine wässrige Ammoniaklösung; d) Ammoniumnitrat. 7. Bei der Wechselwirkung wird Wasserstoff freigesetzt: a) Zn + HNO 3 (razb.); b) Cu + HCl (Lösung), c) Al + NaOH + H 2 O, d) Zn + H 2 SO 4 (razb.), e) Fe + HNO 3 (konz.). 8. Schreiben Sie eine Gleichung für die Reaktion von Zink mit sehr verdünnter Salpetersäure auf, wenn eines der Reaktionsprodukte Ammoniumnitrat ist. Geben Sie den Koeffizienten vor dem Oxidationsmittel an. 9.Nennen Sie die Stoffe A, B, C. Option 2 1. Es ist unmöglich, durch die Methode der Wasserverdrängung zu sammeln: a) Stickstoff; b) Wasserstoff; c) Sauerstoff; d) Ammoniak. 2. Das Reagens für das Ammoniumion ist eine Lösung aus: a) Kaliumsulfat; b) Silbernitrat; c) Natriumhydroxid; d) Bariumchlorid. 3. Bei der Interaktion mit HNO 3 (konz.) Gas entsteht mit Kupferspänen: a) N20; b) NH3; c) NO2; d) H2. 4. Die thermische Zersetzung von Natriumnitrat erzeugt: a) Natriumoxid, Braungas NO 2, O 2; b) Natriumnitrit und O 2, c) Natrium, Braungas NO 2, O 2, d) Natriumhydroxid, N 2, O 2. 5. Der Grad der Stickstoffoxidation in Ammoniumsulfat: a) -3; b) -1; c) +1; d) +3. 6. Mit welchen der folgenden Stoffe reagiert konzentrierte HNO? 3 unter normalen Bedingungen? a) NaOH; b) AgCl; c) Al; d) Fe; e) Cu. 7. Geben Sie die Anzahl der Ionen in der abgekürzten Ionengleichung für die Wechselwirkung von Natriumsulfat und Silbernitrat an: a) 1; b) 2; in 3; d) 4. 8. Schreiben Sie eine Reaktionsgleichung für die Wechselwirkung von Magnesium mit verdünnter Salpetersäure auf, wenn eines der Reaktionsprodukte ein einfacher Stoff ist. Geben Sie den Koeffizienten in der Gleichung vor dem Oxidationsmittel an. 9. Schreiben Sie Reaktionsgleichungen für die folgenden Transformationen:
Nennen Sie die Stoffe A, B, C, D.
Antworten
Variante 1 1 - G; 2 - a; 3 - G; 4 - in; 5 - a; 6 - Anzeige; 7 - CD; 8 – 10,


2Ag + + SO 4 2– = Ag 2 SO 4;
8 – 12, 9. A - NO, B - NO 2, C - HNO 3, D - NH 4 NO 3,
Variante 1.
Chemisches Zeichen von Stickstoff: a) P b) N c) As d) Ne
Ein Stickstoffmolekül enthält: a) eine Doppelbindung b) eine Einfachbindung c) eine Dreifachbindung
Summenformel von Stickstoff: a) N b) N 2 c) N 3 d) Ne
Über die physikalischen Eigenschaften des Stickstoffs unzutreffend : a) gasförmig b) geruchlos c) schwer wasserlöslich d) braun.
Stickstoff in Verbindungen kann nicht die Oxidationsstufe a) +1 b) -3 c) +6 d) +5 aufweisen
Stickstoff reagiert nicht mit a) Metallen b) Phosphor c) Wasserstoff d) Sauerstoff
Bei der Reaktion von Stickstoff mit Wasserstoff entsteht a) Phosphin b) Stickoxid (II) c) Methan d) Ammoniak
Bei der Reaktion von Stickstoff mit Sauerstoff entsteht a) Stickoxid (II) b) Stickoxid (I) c) Stickoxid (IV) d) Stickoxid (V)
Verbindungen von Stickstoff mit Metallen nennt man a) Nitrite b) Nitride c) Nitrate d) Ammoniakate.
Die Oxidationsstufe von Stickstoff in Ammoniak a) -3 b) +5 c) +3 d) +2
Welche der Eigenschaften unzutreffend zu Ammoniak: a) gasförmig c) schwer wasserlöslich c) hat einen stechenden Geruch d) verflüssigt sich leicht unter Druck
Ammoniaklösung hat ein Medium: a) sauer b) alkalisch c) neutral d) schwach sauer
Ammoniak interagiert nicht a) mit Säuren b) mit Laugen c) mit Wasser d) mit Sauerstoff
Bei der Verbrennung von Ammoniak entsteht a) Stickoxid (II) b) Wasser c) Stickstoff d) Stickoxid (IV)
Bei der katalytischen Oxidation von Ammoniak entsteht neben Wasser a) Stickoxid (II) b) Stickoxid (IV) c) Stickoxid (III) d) Stickoxid (V)
Bei der Reaktion von Ammoniak mit Salzsäure entsteht a) Ammoniumchlorid b) Ammoniumchlorid c) Ammoniumsulfat d) Ammoniumnitrat
Ammoniak kann im Labor gewonnen werden, indem man a) Ammoniumsalz mit Alkali b) Ammoniumsalz mit Säure c) Wasserstoff mit Stickstoff d) Ammoniumsalz mit anderen Salzen umsetzt.
Ammoniak wird industriell hergestellt a) Ammoniumsalze mit Alkali b) Ammoniumsalze mit Säure c) Wasserstoff mit Stickstoff d) Ammoniumsalze mit anderen Salzen.
kann nicht bilden Salze a) sauer b) mittel c) basisch
Ammoniumsalze können nicht erhalten werden a) durch Wechselwirkung von Ammoniak mit Säuren b) durch Wechselwirkung einer Ammoniaklösung mit Säuren c) durch Wechselwirkung von Ammoniumsalzen mit Säuren d) durch Wechselwirkung von Ammoniumsalzen mit Alkali.
Welche Reaktion ist qualitativ für Ammoniumsalze a) Wechselwirkung mit Alkali b) Wechselwirkung mit Säuren c) Wechselwirkung mit anderen Salzen d) Wechselwirkung mit Wasser.
Ein Zeichen für eine qualitative Reaktion auf das Ammoniumion ist a) die Entwicklung eines Gases, das eine Trübung des Kalkwassers verursacht b) die Entwicklung eines Gases mit dem Geruch von Ammoniak c) die Entwicklung eines weißen Niederschlags d) die Entwicklung eines braunen Gases .
Beim Erhitzen von Ammoniumsalzen kommt es zu a) Wasserfreisetzung b) Zersetzung unter Freisetzung von Gasen c) Verdunstung d) Farbänderung.
Die Zersetzung von Ammoniumnitrat erzeugt: a) Stickstoff und Wasser b) Stickstoffmonoxid (I) und Wasser c) Stickstoffmonoxid (II) und Wasser d) Stickstoffmonoxid (IV) und Wasser.
Stickstoff bildet sich nicht Oxid mit der Formel a) NO 2 b) NO 3 c) NO d) N 2 O
Saures Oxid ist nicht a) NO 2 b) N 2 O 3 c) N 2 O 5 d) NO
Nicht salzbildende Oxide umfassen a) NO 2 b) N 2 O 3 c) N 2 O 5 d) N 2 O
Salpetersäure enthält nicht a) flüssig b) einbasisch c) starkes Oxidationsmittel d) geruchlos
Die Oxidationsstufe von Stickstoff in Salpetersäure a) +3 b) +5 c) +1 d) -3
nicht gebildet
Die Wechselwirkung von Salpetersäure mit Metallen bildet kein a) Wasser b) Wasserstoff c) Stickoxid d) Salz
Wenn konzentrierte Salpetersäure neben Wasser und Salz mit Metallen in der Spannungsreihe nach Wasserstoff interagiert,
Wenn verdünnte Salpetersäure neben Wasser und Salz mit Kupfer reagiert,
a) Stickoxid (II) b) Stickoxid (I) c) Stickoxid (IV) d) Ammoniak.
Salpetersäure reagiert nicht mit a) Schwefeloxid (IV) b) Natriumhydroxid c) Bariumoxid d) Calciumcarbonat.
Test zum Thema „Stickstoff und seine Verbindungen“.
Option 2.
Chemisches Zeichen von Stickstoff: a) N b) Nb c) Ar d) S
Ein Stickstoffmolekül enthält: a) eine Wasserstoffbindung b) eine kovalente polare Bindung c) eine kovalente unpolare Bindung
Strukturformel von Stickstoff: a) N=N b) N≡ N c) N- N d) :N::: N:
Über die physikalischen Eigenschaften des Stickstoffs unzutreffend : a) Gas b) mit stechendem Geruch c) schwer wasserlöslich d) schwerer als Luft.
Stickstoff in der Luft nach Volumen: a) 50 % b) 65 % c) 78 % d) 85 %
Stickstoff in Verbindungen kann nicht die Oxidationsstufe a) -1 b) +3 c) +4 d) +5 aufweisen
Stickstoff reagiert bei Raumtemperatur mit a) Sauerstoff b) Lithium c) Wasserstoff d) Natrium
Bei der Reaktion von Stickstoff mit Wasserstoff entsteht a) Schwefelwasserstoff b) Stickoxide (IV) c) Ammoniak d) Stickoxide (II)
Die Wechselwirkung von Stickstoff mit Sauerstoff erzeugt a) Stickoxid (II) b) Stickoxid (I) c) Stickoxid (IV) d) Stickoxid (III)
Verbindungen von Stickstoff mit Metallen nennt man a) Nitrate b) Nitrite c) Nitride d) Ammoniumsalze.
Die Oxidationsstufe von Stickstoff in Ammoniak a) +3 b) +4 c) -3 d) +2
Welche der Eigenschaften unzutreffend zu Ammoniak: a) gasförmig c) gut wasserlöslich c) geruchlos d) leichter als Luft
Ammoniaklösung hat ein Medium: a) sauer b) neutral c) alkalisch d) schwach alkalisch
Ammoniak interagiert nicht a) mit Sauerstoff b) mit Wasserstoff c) mit Wasser d) mit Säuren
Beim Verbrennen von Ammoniak gebildet a) Stickoxid (V) b) Stickoxid (I) c) Stickstoff d) Wasser
Bei der katalytischen Oxidation von Ammoniak entsteht neben Wasser a) Stickoxid (V) b) Stickoxid (III) c) Stickoxid (IV) d) Stickoxid (II)
Bei der Reaktion von Ammoniak mit Schwefelsäure entsteht a) Ammoniakchlorid b) Ammoniumchlorid c) Ammoniumsulfat d) Ammoniumnitrat
Ammoniak kann im Labor gewonnen werden, indem man a) Ammoniumchlorid mit Kaliumhydroxid b) Ammoniumsulfat mit Salzsäure c) Wasserstoff mit Stickstoff d) Ammoniumsalze mit anderen mit Säuren umsetzt.
Ammoniak wird technisch hergestellt durch die Wechselwirkung von a) Wasserstoff mit Stickstoff b) Ammoniumchlorid mit Alkali c) Ammoniumsalz mit Säure d) Ammoniumsalz mit anderen Salzen.
Bei Wechselwirkung mit Säuren Ammoniak kann nicht bilden Salze a) basisch
b) mittel c) sauer
Ammoniumsalze kann nicht bekommen a) die Wechselwirkung von Ammoniumsalzen mit Alkali b) die Wechselwirkung von Ammoniaklösung mit Alkalien c) die Wechselwirkung von Ammoniaklösung mit Säuren d) die Wechselwirkung von Ammoniumsalzen mit Säuren.
Ammoniumsalze erkennt man mit Hilfe von a) Säure b) Lauge c) einem anderen Salz d) Wasser.
Ein Zeichen für eine qualitative Reaktion auf das Ammoniumion ist a) Gasentwicklung mit Ammoniakgeruch; Gasentwicklung; b) Entwicklung eines Gases, das Kalkwasser trübt; c) Entwicklung von braunem Gas; d) Entwicklung von ein weißer Niederschlag.
Wenn Ammoniumcarbonat erhitzt wird passiert nicht
a) Freisetzung von Wasser b) Kohlendioxid c) Freisetzung von Ammoniak d) Freisetzung von Stickoxid (I).
Bei der Zersetzung von Ammoniumnitrit entsteht:
a) Stickstoff und Wasser b) Stickoxid (I) und Wasser c) Stickoxid (II) und Wasser d) Stickoxid (IV) und Wasser.
Stickstoff bildet sich nicht Oxid mit der Formel a) NO 2 b) N 2 O 5 c) NO d) N 2 O 7
Es ist kein Säureoxid a) NO 2 b) N 2 O 3 c) N 2 O d) N 2 O 5
Nicht salzbildende Oxide umfassen a) NO b) N 2 O 3 c) N 2 O 5 d) NO 2
Salpetersäure umfasst nicht a) flüssig b) zweibasisch c) starkes Oxidationsmittel d) sauerstoffhaltig
Die Oxidationsstufe von Stickstoff in Salpetersäure a) -3 b) +5 c) +4 d) +3
Wenn sich Salpetersäure im Licht zersetzt gebildet a) Wasser b) Sauerstoff c) Ammoniak d) Stickstoffmonoxid (IV).
Wenn Salpetersäure mit Metallen reagiert, entsteht sie nicht
a) Stickstoffverbindung b) Salz c) Wasser d) Wasserstoff
Bei der Wechselwirkung von konzentrierter Salpetersäure mit Silber entsteht neben Wasser und Salz a) Stickstoffmonoxid (I) b) Stickstoffmonoxid (IV) c) Stickstoffmonoxid (II) d) Ammoniak.
Wenn verdünnte Salpetersäure neben Wasser und Salz mit Silber reagiert,
a) Stickoxid (II) b) Stickoxid (I) c) Stickoxid (IV) d) Ammoniak.
Salpetersäure reagiert nicht mit a) Phosphor(V)oxid b) Natriumoxid c) Bariumhydroxid d) Natriumcarbonat.
Option Nummer 1.
Aufgabe Nummer 1
1. Hat keinen Geruch.
2. Hat einen Geruch.
3. Verbrennt in Sauerstoff.
4. Interagiert mit Säuren unter Bildung von Salzen.
5. In einem Molekül zwischen Atomen gibt es eine kovalente unpolare Bindung.
6. In einem Molekül zwischen Atomen gibt es eine kovalente polare Bindung.
7. Brennt nicht an der Luft.
8. Stickstoffoxidationszustand -3.
9. Etwas wasserlöslich.
10. Die wässrige Lösung hat ein alkalisches Milieu.
Aufgabe Nummer 2
1. N 2 O 3 A) Ammoniumnitrat
2. NH 3 B) Ammoniumsulfat
3. NH 4 NO 3 B) Stickstoffmonoxid (III)
4. NH 4 HSO 4 D) Ammoniumhydrosulfat
5. NO 2 D) Stickoxid (V)
E) Stickoxid (IV)
G) Ammoniak
Aufgabe Nummer 3
N 2 NEIN NEIN 2 HNO 3 NEIN 2
Die Übung№4
C + HNO 3 \u003d CO 2 + NO 2 + H 2 O
Aufgabe Nummer 5
NH 4 NEIN 2 = N 2 Ö + H 2 Ö
.
4) Feste Nitrate werden ins Feuer geworfen, und wenn es keinen hellen Blitz gibt, ist es Nitrat.
Test zum Thema "STICKSTOFF UND SEINE VERBINDUNGEN".
Option Nummer 2.
Aufgabe Nummer 1
Verteilen Sie, welche der Eigenschaften zu Stickstoff und welche zu Ammoniak gehören? Erfassen Sie Daten mit Eigenschaftsnummern in einer Tabelle.
1. Hat einen stechenden Geruch
2. Hochlöslich in Wasser.
3. Interagiert nicht mit Luft.
4. In einem Molekül zwischen Atomen ist die Bindung kovalent polar.
5. In einem Molekül zwischen Atomen ist die Bindung kovalent unpolar.
6. Farb- und geruchloses Gas.
7. Stickstoffoxidationszustand -3.
8. Die wässrige Lösung hat ein alkalisches Milieu.
9. Gibt während eines Gewitters eine Reaktion mit Sauerstoff.
10. Wird in Röhren zur Aufbewahrung alter Gemälde verwendet.
Aufgabe Nummer 2
Ordnen Sie Formeln und Namen von Stoffen zu.
1. N 2 O 5 A) Ammoniumsulfat
2. NO B) Ammoniumcarbonat
3. (NH 4 ) 2 SO 4 B) Stickstoffmonoxid (II)
4. NH 4 H CO 3 D) Ammoniumbicarbonat
5.N 2 O D) Stickoxid (V)
E) Stickoxid (I)
G) Ammoniumhydrosulfat
Aufgabe Nummer 3
Schreiben Sie Reaktionsgleichungen für die folgenden Transformationen.
NO NO 2 HNO 3 NaNO 3 NaNO 2
Die Übung№4
Ordnen Sie die Koeffizienten nach der Methode der elektronischen Waage an, geben Sie das Oxidationsmittel und das Reduktionsmittel an.
S + HNO 3 \u003d H 2 SO 4 + NO 2 + H 2 O
Aufgabe Nummer 5
Finden Sie 4 Fehler in diesem Text, schreiben Sie die Fehler auf. Schreibe es dann richtig daneben auf.
1) Beim Erhitzen zersetzen sich Nitrate. In gleicher Weise verläuft die Zersetzungsreaktion von Nitraten verschiedener Metalle.
2) Nur der Prozess der thermischen Zersetzung von Ammoniumnitrat verläuft auf besondere Weise:
NH 4 NEIN 2 = N 2 Ö + H 2 Ö
3) Nitratlösungen werden mit Kupfer ohne Erhitzen bestimmt.
4) Feste Nitrate werden ins Feuer geworfen, und wenn es keinen hellen Blitz gibt, ist es Nitrat.