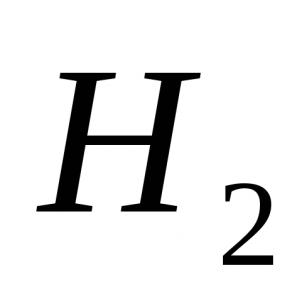Eisensalze 3 Farbe. Chemische Eigenschaften von Eisen und seinen Verbindungen, ihre Anwendung
Formel:
Eisen(II)sulfat, Eisensulfat, FeSO 4 - ein Salz aus Schwefelsäure und 2-wertigem Eisen. Härte - 2.
In der Chemie wird Eisensulfat als kristallines Hydrat bezeichnet Eisen(II)sulfat. Hellgrüne Kristalle. Es wird in der Textilindustrie, in der Landwirtschaft als Insektizid zur Herstellung von Mineralfarben verwendet.
Natürliches Analogon - Mineral Melanterit; in der Natur kommt es in Kristallen des monoklinoedrischen Systems vor, grün-gelb gefärbt, in Form von Schlieren oder Schlieren.
Molmasse: 151,91 g/mol
Dichte: 1,8-1,9 g/cm³
Schmelztemperatur: 400°C
Löslichkeit in Wasser: 25,6 g/100 ml
Sulfat von 2-wertigem Eisen wird bei Temperaturen von 1,82 ° C bis 56,8 ° C aus wässrigen Lösungen in Form von hellgrünen Kristallen von FeSO 4 · 7H 2 O freigesetzt, wird in der Technik Eisensulfat (Kristallhydrat) genannt. Löst sich in 100 g Wasser auf: 26,6 g wasserfreies FeSO 4 bei 20 °C und 54,4 g bei 56 °C.
Lösungen von Sulfat von 2-wertigem Eisen unter dem Einfluss von Luftsauerstoff oxidieren im Laufe der Zeit zu Eisen (III) -sulfat:
12FeSO 4 + O 2 + 6H 2 O \u003d 4Fe 2 (SO 4) 3 + 4Fe (OH) 3 ↓
Beim Erhitzen über 480 °C zersetzt es sich:
2FeSO 4 → Fe 2 O 3 + SO 2 + SO 3
Erhalt.
Eisenvitriol kann durch Einwirkung von verdünnter Schwefelsäure auf Eisenschrott, Dachspäne etc. hergestellt werden. In der Industrie fällt es als Nebenprodukt an, wenn Eisenbleche, Draht etc. mit verdünnter H 2 SO 4 angeätzt werden Kalk entfernen.
Fe + H 2 SO 4 \u003d FeSO 4 + H 2
Ein anderer Weg ist das oxidative Rösten von Pyrit:
2FeS 2 + 7O 2 + 2H 2 O \u003d 2FeSO 4 + 2H 2 SO 4
Qualitative Analyse.
Analytische Reaktionen für das Eisenkation (II).
1. Mit Kaliumhexacyanoferrat(III) K 3 unter Bildung eines dunkelblauen, in Säuren unlöslichen Niederschlags von Kalium-Eisen(II)-Hexacyanoferrat(III) ("Turnbull-Blau"), der sich mit Alkalien zu Fe(OH) 3 (HF) zersetzt.
FeSO 4 + K 3 KFe + K 2 SO 4
Der optimale pH-Wert für die Reaktion liegt bei 2-3. Die Reaktion ist fraktioniert, hochempfindlich. Hohe Konzentrationen an Fe 3+ stören.
2. Mit Ammoniumsulfid (NH 4 ) 2 S unter Bildung eines schwarzen Niederschlags, der in starken Säuren (HF) löslich ist.
FeSO 4
+ (NH4)2S  FeS + (NH 4) 2 SO 4
FeS + (NH 4) 2 SO 4
3.2. Analytische Reaktionen für Sulfationen.
1. Mit dem Gruppenreagenz BaCl 2 + CaCl 2 oder BaCl 2 (GF).
Die fraktionierte Öffnung des Sulfations erfolgt im sauren Milieu, wodurch die störende Wirkung von CO 3 2-, PO 4 3- usw. eliminiert wird, und durch Kochen der Testlösung mit 6 mol/dm 3 HCl zur Entfernung von S 2 -, SO 3 2 -, S 2 O 3 2- -Ionen, die elementaren Schwefel bilden können, dessen Niederschlag als Niederschlag von BaSO 4 aufgefasst werden kann. Der BaSO 4 -Niederschlag kann mit KMnO 4 isomorphe Kristalle bilden und sich rosa färben (die Spezifität der Reaktion steigt).
Methodik Durchführen der Reaktion in Gegenwart von 0,002 mol/dm 3 KMnO 4 .
Zu 3-5 Tropfen der Testlösung gleiche Volumina Lösungen von Kaliumpermanganat, Bariumchlorid und Salzsäure hinzufügen und 2-3 Minuten kräftig mischen. Absetzen lassen und, ohne den Niederschlag von der Lösung zu trennen, 1–2 Tropfen einer 3%igen H 2 O 2 -Lösung zugeben, mischen und zentrifugieren. Der Niederschlag sollte eine rosa Farbe behalten und die Lösung über dem Niederschlag sollte farblos werden.
2. Mit Bleiacetat.
SO 4
2-
+Pb2+  PbSO 4
PbSO 4
Methodik : zu 2 cm 3 einer Sulfatlösung 0,5 cm 3 verdünnte Salzsäure und 0,5 cm 3 einer Bleiacetatlösung hinzufügen; es bildet sich ein weißer Niederschlag, der in einer gesättigten Ammoniumacetat- oder Natriumhydroxidlösung löslich ist.
PbSO 4 + 4 NaOH  Na 2 + Na 2 SO 4
Na 2 + Na 2 SO 4
Mit Strontiumsalzen - die Bildung eines weißen Niederschlags, der in Säuren unlöslich ist (im Gegensatz zu Sulfiten).
SO 4
2
-+Sr2+  SrSO 4
SrSO 4
Methodik : Zu 4-5 Tropfen der analysierten Lösung fügen Sie 4-5 Tropfen einer konzentrierten Strontiumchloridlösung hinzu, es bildet sich ein weißer Niederschlag.
Mit Calciumsalzen - die Bildung von nadelartigen Kristallen aus Gips CaSO 4 2H 2 O.
SO 4 2- + Ca 2+ + 2H 2 O
 CaSO 4 2H 2 O
CaSO 4 2H 2 O
Methodik: Geben Sie einen Tropfen der analysierten Lösung und Calciumsalze auf einen Glasobjektträger, leicht trocken. Die gebildeten Kristalle werden unter einem Mikroskop untersucht.
Quantitative Analyse.
Permanganatometrie.
Bestimmung des Massenanteils von Eisen in einer Probe von Mohrschem Salz (NH 4) 2 Fe (SO 4) 2 6H 2 O nach der permanganometrischen Methode
(direkte Titrationsoption)
Die Definition basiert auf der Oxidation von Eisen(II) durch Kaliumpermanganat zu Eisen(III).
10 FeSO 4 + 2 KMnO 4 + 8 Std 2 SO 4 = 5Fe 2 (SO 4 ) 3 + 2 MnSO 4 +K 2 SO 4 + 8 Std 2 Ö
M (Fe) = 55,85 g/mol
Methodik: In einen Messkolben mit 100 cm 3 Fassungsvermögen, gelöst in wenig destilliertem Wasser, wird nach Beendigung die genaue Menge an Mohrschem Salz, die zur Herstellung von 100 cm 3 einer 0,1 M Lösung von Mohrschem Salz benötigt wird, quantitativ überführt Auflösung, mit Wasser zur Marke gebracht, gemischt. Ein Aliquot der erhaltenen Lösung (Einzelaufgabe) wird in einen Titrierkolben gegeben, mit dem gleichen Volumen verdünnter Schwefelsäure (1:5) versetzt und langsam mit einer Lösung von Kaliumpermanganat titriert, bis eine leicht rosa Färbung der Lösung stabil ist für 30 Sekunden.
Anwendung.
Wird in der Produktion verwendet Tinte;
Im Farbstoffgeschäft (zum Färben wolle in schwarzer Farbe)
Für den Baumschutz.
Referenzliste.
- Ordnungszahl - 26.
- Die Periode ist die vierte große.
- Die achte Gruppe, die sekundäre Untergruppe.
- Das Atomgewicht beträgt 55,847.
- Die Struktur der äußeren Elektronenhülle wird durch die Formel 3d 6 4s 2 bezeichnet.
- - Fe.
- Der Name ist Eisen, die Lesung in der Formel lautet „Ferrum“.
- In der Natur gibt es vier stabile Isotope des betreffenden Elements mit den Massenzahlen 54, 56, 57, 58.
- Schmelzpunkt - 1539 0 С;
- sieden - 2862 0 С;
- Aktivität - Durchschnitt;
- Feuerfestigkeit - hoch;
- weist ausgeprägte magnetische Eigenschaften auf.
- Säuren;
- Sauerstoff (einschließlich Luft);
- grau;
- Halogene;
- beim Erhitzen - mit Stickstoff, Phosphor, Kohlenstoff und Silizium;
- mit Salzen weniger aktiver Metalle zu einfachen Substanzen reduzieren;
- mit scharfem Wasserdampf;
- mit Eisensalzen in der Oxidationsstufe +3.
- Die Kerne der terrestrischen Planeten - 90%.
- In der Erdkruste - 5%.
- Im Erdmantel - 12%.
- Im Erdkern - 86%.
- Im Flusswasser - 2 mg/l.
- Im Meer und Ozean - 0,02 mg / l.
- Magnetit;
- Limonit oder braunes Eisenerz;
- Vivianit;
- Pyrrhotit;
- Pyrit;
- Siderit;
- Markasit;
- Lellingit;
- Mispikel;
- Milanterit und andere.
- Gusseisen;
- werden.
- Oxid;
- Hydroxid;
- binäre Verbindungen;
- komplexe Salze;
- komplexe Verbindungen.
- Eisen(II)-oxid. Schwarzes Pulver, wasserunlöslich. Die Art der Verbindung ist grundlegend. Es kann schnell oxidieren, lässt sich aber auch leicht zu einer einfachen Substanz reduzieren. In Säuren löst es sich zu den entsprechenden Salzen auf. Formel - FeO.
- Eisen(II)hydroxid. Es ist ein weißer amorpher Niederschlag. Entsteht durch die Reaktion von Salzen mit Basen (Laugen). Es zeigt schwach basische Eigenschaften, kann an der Luft schnell zu Eisenverbindungen +3 oxidieren. Formel - Fe (OH) 2.
- Die Salze eines Elements in der angegebenen Oxidationsstufe. In der Regel haben sie eine blassgrüne Farbe der Lösung, oxidieren gut auch an der Luft, erwerben und verwandeln sich in Eisensalze 3. Sie lösen sich in Wasser auf. Beispiele für Verbindungen: FeCL 2 , FeSO 4 , Fe(NO 3 ) 2 .

Unter den bezeichneten Stoffen sind mehrere Verbindungen von praktischer Bedeutung. Erstens (II). Dies ist der Hauptlieferant von Ionen für den menschlichen Körper mit Anämie. Wenn bei einem Patienten eine solche Krankheit diagnostiziert wird, werden ihm komplexe Präparate verschrieben, die auf der betreffenden Verbindung basieren. So wird der Eisenmangel im Körper wieder aufgefüllt.
Zweitens wird Eisen(II)sulfat zusammen mit Kupfer verwendet, um landwirtschaftliche Schädlinge in Feldfrüchten zu vernichten. Die Methode hat sich seit mehr als einem Dutzend Jahren bewährt und wird daher von Gärtnern und Gärtnern sehr geschätzt.
Mora-Salz
Dies ist eine Verbindung, die ein kristallines Hydrat aus Eisen und Ammoniumsulfat ist. Seine Formel wird als FeSO 4 * (NH 4) 2 SO 4 * 6H 2 O geschrieben. Eine der Eisen(II)-Verbindungen, die in der Praxis weit verbreitet ist. Die Hauptbereiche der menschlichen Verwendung sind wie folgt.
- Pharmazie.
- Wissenschaftliche Forschung und titrimetrische Laboranalysen (zur Bestimmung des Gehalts an Chrom, Kaliumpermanganat, Vanadium).
- Medizin - als Zusatz zu Lebensmitteln mit Eisenmangel im Körper des Patienten.
- Zur Imprägnierung von Holzprodukten, da Morasalz vor Fäulnisprozessen schützt.
Es gibt andere Bereiche, in denen diese Substanz Anwendung findet. Es erhielt seinen Namen zu Ehren des deutschen Chemikers, der als erster die manifestierten Eigenschaften entdeckte.
Stoffe mit der Oxidationsstufe Eisen (III)
Die Eigenschaften von Eisenverbindungen, in denen es eine Oxidationsstufe von +3 aufweist, unterscheiden sich etwas von den oben diskutierten. Somit ist die Natur der entsprechenden Oxide und Hydroxide nicht mehr basisch, sondern ausgeprägt amphoter. Wir geben eine Beschreibung der wichtigsten Substanzen.

Unter den angegebenen Beispielen ist aus praktischer Sicht ein solches kristallines Hydrat wie FeCl 3 * 6H 2 O oder Eisen(III)-Chlorid-Hexahydrat wichtig. Es wird in der Medizin verwendet, um Blutungen zu stoppen und Eisenionen im Körper mit Anämie aufzufüllen.
Eisen(III)sulfat-Pentahydrat wird zur Reinigung von Trinkwasser verwendet, da es sich wie ein Gerinnungsmittel verhält.
Eisen(VI)-Verbindungen
Die Formeln der chemischen Verbindungen von Eisen, bei denen es eine besondere Oxidationsstufe von +6 aufweist, können wie folgt geschrieben werden:
- K 2 FeO 4 ;
- Na 2 FeO 4 ;
- MgFeO 4 und andere.
Alle haben einen gemeinsamen Namen - Ferrate - und ähnliche Eigenschaften (starke Reduktionsmittel). Sie sind auch in der Lage zu desinfizieren und haben eine bakterizide Wirkung. Dadurch können sie für die Aufbereitung von Trinkwasser im industriellen Maßstab eingesetzt werden.
Komplexe Verbindungen
Spezielle Substanzen sind nicht nur in der analytischen Chemie sehr wichtig. Solche, die sich in wässrigen Lösungen von Salzen bilden. Dies sind komplexe Eisenverbindungen. Die beliebtesten und am besten untersuchten von ihnen sind die folgenden.
- Kaliumhexacyanoferrat (II) K 4 . Ein anderer Name für die Verbindung ist gelbes Blutsalz. Es dient zur qualitativen Bestimmung von Eisenionen Fe 3+ in Lösung. Durch die Belichtung erhält die Lösung eine schöne hellblaue Farbe, da ein weiterer Komplex gebildet wird - Preußischblau KFe 3+. Seit der Antike wurde es als verwendet
- Kaliumhexacyanoferrat (III) K 3 . Ein anderer Name ist rotes Blutsalz. Es dient als qualitatives Reagenz zur Bestimmung von Eisenionen Fe 2+ . Als Ergebnis bildet sich ein blauer Niederschlag, der als Turnbull-Blau bezeichnet wird. Wird auch als Farbstoff für Stoffe verwendet.

Eisen in organischen Stoffen
Eisen und seine Verbindungen sind, wie wir bereits gesehen haben, von großer praktischer Bedeutung im Wirtschaftsleben des Menschen. Darüber hinaus ist seine biologische Rolle im Körper jedoch nicht weniger groß, im Gegenteil.
Es gibt ein sehr wichtiges Protein, das dieses Element enthält. Das ist Hämoglobin. Ihm ist es zu verdanken, dass Sauerstoff transportiert und ein gleichmäßiger und rechtzeitiger Gasaustausch durchgeführt wird. Daher ist die Rolle von Eisen im lebenswichtigen Prozess - der Atmung - einfach enorm.

Insgesamt enthält der menschliche Körper etwa 4 Gramm Eisen, das durch die aufgenommene Nahrung ständig wieder aufgefüllt werden muss.
- Bei chemischen Formeln muss die Groß-/Kleinschreibung beachtet werden
- Indizes werden als normale Zahlen eingegeben
- Der Punkt auf der Mittellinie (Multiplikationszeichen), der beispielsweise in den Formeln kristalliner Hydrate verwendet wird, wird durch einen regelmäßigen Punkt ersetzt.
- Beispiel: Statt CuSO₄ 5H₂O im Konverter wird zur leichteren Eingabe die Schreibweise CuSO4.5H2O verwendet.
- Salz (Natriumchlorid) NaCl
- Zucker (Saccharose) C₁₂H₂₂O₁₁
- Essig (Essigsäurelösung) CH₃COOH
- die Atommassen der Elemente nach dem Periodensystem bestimmen;
- Bestimmen Sie die Anzahl der Atome jedes Elements in der Verbindungsformel;
- Bestimmen Sie die Molmasse, indem Sie die Atommassen der in der Verbindung enthaltenen Elemente multipliziert mit ihrer Anzahl addieren.
- zwei Kohlenstoffatome
- vier Wasserstoffatome
- zwei Sauerstoffatome
- Kohlenstoff C = 2 × 12,0107 g/mol = 24,0214 g/mol
- Wasserstoff H = 4 × 1,00794 g/mol = 4,03176 g/mol
- Sauerstoff O = 2 × 15,9994 g/mol = 31,9988 g/mol
- Molmasse = 24,0214 + 4,03176 + 31,9988 = 60,05196 g/mol
Lurie Yu.Yu. Handbuch der analytischen Chemie. Moskau, 1972;
Richtlinie „Instrumentelle Analysemethoden“, Perm, 2004;
Richtlinie „Qualitative chemische Analytik“, Perm, 2003;
Richtlinie „Quantitative chemische Analytik“, Perm, 2004;
Rabinovich V.A., Khavin Z.Ya. Kurzes chemisches Nachschlagewerk, Leningrad, 1991;
"Große sowjetische Enzyklopädie";
DEFINITION
Eisen- ein Element der achten Gruppe der vierten Periode des Periodensystems der chemischen Elemente von D. I. Mendeleev.
Und die träge Zahl ist 26. Das Symbol ist Fe (lat. „Ferrum“). Eines der häufigsten Metalle in der Erdkruste (an zweiter Stelle nach Aluminium).
Physikalische Eigenschaften von Eisen
Eisen ist ein graues Metall. In seiner reinen Form ist es ziemlich weich, formbar und dehnbar. Die elektronische Konfiguration des externen Energieniveaus ist 3d 6 4s 2 . Eisen weist in seinen Verbindungen die Oxidationsstufen „+2“ und „+3“ auf. Der Schmelzpunkt von Eisen liegt bei 1539 °C. Eisen bildet zwei kristalline Modifikationen: α- und γ-Eisen. Das erste hat ein kubisch raumzentriertes Gitter, das zweite ein kubisch flächenzentriertes. α-Eisen ist in zwei Temperaturbereichen thermodynamisch stabil: unter 912 und von 1394 °C bis zum Schmelzpunkt. Zwischen 912 und 1394C ist γ-Eisen stabil.
Die mechanischen Eigenschaften von Eisen hängen von seiner Reinheit ab - dem Gehalt an selbst sehr geringen Mengen anderer Elemente. Massives Eisen hat die Fähigkeit, viele Elemente in sich aufzulösen.
Chemische Eigenschaften von Eisen
An feuchter Luft rostet Eisen schnell, d.h. bedeckt mit einer braunen Beschichtung aus hydratisiertem Eisenoxid, das Eisen aufgrund seiner Brüchigkeit nicht vor weiterer Oxidation schützt. In Wasser korrodiert Eisen intensiv; Bei reichlichem Zugang zu Sauerstoff werden hydratisierte Formen von Eisenoxid (III) gebildet:
2Fe + 3/2O 2 + nH 2 O = Fe 2 O 3 × H 2 O.
Bei Sauerstoffmangel oder erschwerter Zugänglichkeit entsteht ein Mischoxid (II, III) Fe 3 O 4:
3Fe + 4H 2 O (v) ↔ Fe 3 O 4 + 4H 2.
Eisen löst sich in Salzsäure beliebiger Konzentration:
Fe + 2 HCl \u003d FeCl 2 + H 2.
Ebenso erfolgt die Auflösung in verdünnter Schwefelsäure:
Fe + H 2 SO 4 \u003d FeSO 4 + H 2.
In konzentrierten Schwefelsäurelösungen wird Eisen zu Eisen(III) oxidiert:
2Fe + 6H 2 SO 4 \u003d Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O.
In Schwefelsäure, deren Konzentration nahe 100 % liegt, wird Eisen jedoch passiv und es gibt praktisch keine Wechselwirkung. In verdünnten und mäßig konzentrierten Salpetersäurelösungen löst sich Eisen:
Fe + 4HNO 3 \u003d Fe (NO 3) 3 + NO + 2H 2 O.
Bei hohen Salpetersäurekonzentrationen verlangsamt sich die Auflösung und Eisen wird passiv.
Wie andere Metalle reagiert Eisen mit einfachen Substanzen. Die Reaktionen der Wechselwirkung von Eisen mit Halogenen (unabhängig von der Art des Halogens) laufen beim Erhitzen ab. Die Wechselwirkung von Eisen mit Brom erfolgt bei einem erhöhten Dampfdruck des letzteren:
2Fe + 3Cl 2 \u003d 2FeCl 3;
3Fe + 4I 2 = Fe 3 I 8.
Die Wechselwirkung von Eisen mit Schwefel (Pulver), Stickstoff und Phosphor tritt auch beim Erhitzen auf:
6Fe + N2 = 2Fe3N;
2Fe + P = Fe2P;
3Fe + P = Fe 3 P.
Eisen kann mit Nichtmetallen wie Kohlenstoff und Silizium reagieren:
3Fe + C = Fe 3 C;
Unter den Wechselwirkungsreaktionen von Eisen mit komplexen Substanzen spielen folgende Reaktionen eine besondere Rolle - Eisen kann Metalle, die sich in der Aktivitätsreihe rechts davon befinden, aus Salzlösungen (1) zu Eisen (III) reduzieren Verbindungen (2):
Fe + CuSO 4 \u003d FeSO 4 + Cu (1);
Fe + 2FeCl 3 = 3FeCl 2 (2).
Eisen reagiert bei erhöhtem Druck mit einem nicht salzbildenden Oxid - CO zu Substanzen komplexer Zusammensetzung - Carbonyle - Fe (CO) 5, Fe 2 (CO) 9 und Fe 3 (CO) 12.
Eisen ist in Abwesenheit von Verunreinigungen in Wasser und in verdünnten Alkalilösungen stabil.
Eisen bekommen
Eisen wird hauptsächlich aus Eisenerz (Hämatit, Magnetit) oder durch Elektrolyse von Lösungen seiner Salze gewonnen (in diesem Fall wird „reines“ Eisen gewonnen, d. H. Eisen ohne Verunreinigungen).
Beispiele für Problemlösungen
BEISPIEL 1
| Die Übung | 10 g Eisenzunder Fe 3 O 4 wurden zunächst mit 150 ml Salzsäurelösung (Dichte 1,1 g/ml) mit einem Massenanteil an Chlorwasserstoff von 20 % behandelt und anschließend wurde der resultierenden Lösung ein Überschuss an Eisen zugesetzt. Bestimmen Sie die Zusammensetzung der Lösung (in Gew.-%). |
| Entscheidung | Wir schreiben die Reaktionsgleichungen entsprechend der Bedingung des Problems: 8HCl + Fe 3 O 4 \u003d FeCl 2 + 2FeCl 3 + 4H 2 O (1); 2FeCl 3 + Fe = 3FeCl 2 (2). Wenn Sie die Dichte und das Volumen einer Salzsäurelösung kennen, können Sie ihre Masse finden: m sol (HCl) = V(HCl) × ρ (HCl); m sol (HCl) \u003d 150 × 1,1 \u003d 165 g. Berechnen Sie die Masse von Chlorwasserstoff: m(HCl) = msol(HCl) × ω(HCl)/100 %; m(HCl) = 165 x 20 %/100 % = 33 g. Die Molmasse (Masse von einem Mol) von Salzsäure, berechnet anhand der Tabelle der chemischen Elemente von D.I. Mendelejew - 36,5 g / mol. Finden Sie die Menge an Chlorwasserstoffsubstanz: v(HCl) = m(HCl)/M(HCl); v (HCl) \u003d 33 / 36,5 \u003d 0,904 mol. Molmasse (Masse eines Mols) der Skala, berechnet anhand der Tabelle der chemischen Elemente von D.I. Mendelejew - 232 g/mol. Finden Sie die Menge an Kalksubstanz: v (Fe 3 O 4) \u003d 10/232 \u003d 0,043 mol. Gemäß Gleichung 1 v(HCl): v(Fe 3 O 4) \u003d 1: 8, daher v (HCl) \u003d 8 v (Fe 3 O 4) \u003d 0,344 mol. Dann ist die gemäß der Gleichung berechnete Menge an Chlorwasserstoffsubstanz (0,344 Mol) geringer als die in der Bedingung des Problems angegebene (0,904 Mol). Daher ist Salzsäure im Überschuss und eine andere Reaktion wird ablaufen: Fe + 2HCl = FeCl 2 + H 2 (3). Bestimmen wir die Menge an Eisenchloridsubstanz, die als Ergebnis der ersten Reaktion gebildet wird (Indizes bezeichnen eine bestimmte Reaktion): v 1 (FeCl 2): v (Fe 2 O 3) = 1:1 = 0,043 mol; v 1 (FeCl 3): v (Fe 2 O 3) = 2:1; v 1 (FeCl 3) = 2 × v (Fe 2 O 3) = 0,086 mol. Lassen Sie uns die Menge an Chlorwasserstoff bestimmen, die in Reaktion 1 nicht reagiert hat, und die Menge an Eisen(II)-Chlorid-Substanz, die während Reaktion 3 gebildet wurde: v rem (HCl) \u003d v (HCl) - v 1 (HCl) \u003d 0,904 - 0,344 \u003d 0,56 mol; v 3 (FeCl 2): v rem (HCl) = 1:2; v 3 (FeCl 2) \u003d 1/2 × v rem (HCl) \u003d 0,28 mol. Bestimmen wir die Menge an FeCl 2 -Substanz, die während Reaktion 2 gebildet wird, die Gesamtmenge an FeCl 2 -Substanz und ihre Masse: v 2 (FeCl 3) = v 1 (FeCl 3) = 0,086 mol; v 2 (FeCl 2): v 2 (FeCl 3) = 3:2; v 2 (FeCl 2) = 3/2 × v 2 (FeCl 3) = 0,129 mol; v Summe (FeCl 2) \u003d v 1 (FeCl 2) + v 2 (FeCl 2) + v 3 (FeCl 2) \u003d 0,043 + 0,129 + 0,28 \u003d 0,452 mol; m (FeCl 2) \u003d v Summe (FeCl 2) × M (FeCl 2) \u003d 0,452 × 127 \u003d 57,404 g. Bestimmen wir die Stoffmenge und die Eisenmasse, die in die Reaktionen 2 und 3 eingegangen sind: v 2 (Fe): v 2 (FeCl 3) = 1:2; v 2 (Fe) \u003d 1/2 × v 2 (FeCl 3) \u003d 0,043 mol; v 3 (Fe): v rem (HCl) = 1:2; v 3 (Fe) = 1/2 × v rem (HCl) = 0,28 mol; v Summe (Fe) \u003d v 2 (Fe) + v 3 (Fe) \u003d 0,043 + 0,28 \u003d 0,323 mol; m(Fe) = v Summe (Fe) × M(Fe) = 0,323 × 56 = 18,088 g. Berechnen wir die in Reaktion 3 freigesetzte Stoffmenge und Wasserstoffmasse: v (H 2) \u003d 1/2 × v rem (HCl) \u003d 0,28 mol; m (H 2) \u003d v (H 2) × M (H 2) \u003d 0,28 × 2 \u003d 0,56 g. Wir bestimmen die Masse der resultierenden Lösung m ' sol und den Massenanteil von FeCl 2 darin: m’ sol \u003d m sol (HCl) + m (Fe 3 O 4) + m (Fe) - m (H 2); |
Der menschliche Körper enthält etwa 5 g Eisen, das meiste davon (70%) ist Teil des Hämoglobins im Blut.
Physikalische Eigenschaften
Im freien Zustand ist Eisen ein silbrig-weißes Metall mit einem gräulichen Schimmer. Reines Eisen ist duktil und hat ferromagnetische Eigenschaften. In der Praxis werden häufig Eisenlegierungen verwendet - Gusseisen und Stähle.
Fe ist das wichtigste und häufigste Element der neun d-Metalle der sekundären Nebengruppe der Gruppe VIII. Zusammen mit Kobalt und Nickel bildet es die „Eisenfamilie“.
Bei der Bildung von Verbindungen mit anderen Elementen werden häufig 2 oder 3 Elektronen verwendet (B \u003d II, III).
Eisen weist, wie fast alle d-Elemente der Gruppe VIII, keine höhere Wertigkeit gleich der Gruppennummer auf. Seine maximale Wertigkeit erreicht VI und ist äußerst selten.
Die typischsten Verbindungen sind solche, in denen die Fe-Atome in den Oxidationsstufen +2 und +3 vorliegen.
Methoden zur Gewinnung von Eisen
1. Kommerzielles Eisen (in einer Legierung mit Kohlenstoff und anderen Verunreinigungen) wird durch carbothermische Reduktion seiner natürlichen Verbindungen nach dem Schema gewonnen:

Die Wiederherstellung erfolgt allmählich in 3 Stufen:
1) 3Fe 2 O 3 + CO = 2Fe 3 O 4 + CO 2
2) Fe 3 O 4 + CO = 3 FeO + CO 2
3) FeO + CO \u003d Fe + CO 2
Das dabei entstehende Gusseisen enthält mehr als 2 % Kohlenstoff. In Zukunft werden Stähle aus Gusseisen gewonnen - Eisenlegierungen mit weniger als 1,5% Kohlenstoff.
2. Sehr reines Eisen wird auf eine der folgenden Arten gewonnen:
a) Zersetzung von Pentacarbonyl-Fe
Fe(CO) 5 = Fe + 5CO
b) Wasserstoffreduktion von reinem FeO
FeO + H 2 \u003d Fe + H 2 O
c) Elektrolyse von wässrigen Lösungen von Fe +2 -Salzen
FeC 2 O 4 \u003d Fe + 2СO 2
Eisen(II)oxalat
Chemische Eigenschaften
Fe - ein Metall mit mittlerer Aktivität, weist allgemeine Eigenschaften auf, die für Metalle charakteristisch sind.
Ein einzigartiges Merkmal ist die Fähigkeit, in feuchter Luft zu "rosten":
In Abwesenheit von Feuchtigkeit mit trockener Luft beginnt Eisen erst bei T > 150 °C merklich zu reagieren; Beim Kalzinieren entsteht „Eisenhaut“ Fe 3 O 4:
3Fe + 2O 2 = Fe 3 O 4
Eisen löst sich in Abwesenheit von Sauerstoff nicht in Wasser auf. Bei sehr hohen Temperaturen reagiert Fe mit Wasserdampf und verdrängt Wasserstoff aus Wassermolekülen:
3 Fe + 4H 2 O (g) \u003d 4H 2
Der Rostprozess in seinem Mechanismus ist elektrochemische Korrosion. Das Rostprodukt wird in vereinfachter Form dargestellt. Tatsächlich wird eine lockere Schicht aus einer Mischung von Oxiden und Hydroxiden unterschiedlicher Zusammensetzung gebildet. Anders als der Al 2 O 3 -Film schützt diese Schicht das Eisen nicht vor weiterer Zerstörung.
Arten von Korrosion

Korrosionsschutz von Eisen

1. Wechselwirkung mit Halogenen und Schwefel bei hoher Temperatur.
2Fe + 3Cl 2 = 2FeCl 3
2Fe + 3F 2 = 2FeF 3
Fe + I 2 \u003d FeI 2
Es entstehen Verbindungen, in denen der ionische Bindungstyp überwiegt.
2. Wechselwirkung mit Phosphor, Kohlenstoff, Silizium (Eisen verbindet sich nicht direkt mit N 2 und H 2, sondern löst sie auf).
Fe + P = Fe x P y
Fe + C = Fe x Cy
Fe + Si = FexSiy
Es entstehen Substanzen unterschiedlicher Zusammensetzung, da Berthollide (in den Verbindungen überwiegt die kovalente Natur der Bindung)
3. Wechselwirkung mit "nicht oxidierenden" Säuren (HCl, H 2 SO 4 verd.)
Fe 0 + 2H + → Fe 2+ + H 2
Da sich Fe in der Aktivitätsreihe links von Wasserstoff befindet (E ° Fe / Fe 2+ \u003d -0,44 V), kann es H 2 aus gewöhnlichen Säuren verdrängen.
Fe + 2 HCl \u003d FeCl 2 + H 2
Fe + H 2 SO 4 \u003d FeSO 4 + H 2
4. Wechselwirkung mit „oxidierenden“ Säuren (HNO 3 , H 2 SO 4 konz.)
Fe 0 - 3e - → Fe 3+
Konzentriertes HNO 3 und H 2 SO 4 „passivieren“ Eisen, sodass sich das Metall bei normalen Temperaturen nicht darin auflöst. Bei starker Erwärmung erfolgt eine langsame Auflösung (ohne Freisetzung von H 2).
Im Razb. HNO 3 -Eisen löst sich auf, geht in Form von Fe 3+ -Kationen in Lösung und das Säureanion wird zu NO * reduziert:
Fe + 4HNO 3 \u003d Fe (NO 3) 3 + NO + 2H 2 O
Es löst sich sehr gut in einer Mischung aus HCl und HNO 3
5. Einstellung zu Laugen
Fe löst sich nicht in wässrigen Lösungen von Alkalien. Es reagiert mit geschmolzenen Alkalien nur bei sehr hohen Temperaturen.
6. Wechselwirkung mit Salzen weniger aktiver Metalle
Fe + CuSO 4 \u003d FeSO 4 + Cu
Fe 0 + Cu 2+ = Fe 2+ + Cu 0
7. Wechselwirkung mit gasförmigem Kohlenmonoxid (t = 200°C, P)
Fe (Pulver) + 5 CO (g) \u003d Fe 0 (CO) 5 Eisenpentacarbonyl
Fe(III)-Verbindungen
Fe 2 O 3 - Eisenoxid (III).
Rotbraunes Pulver, n. R. in H 2 O. In der Natur - "rotes Eisenerz".
Wege zu bekommen:
1) Zersetzung von Eisenhydroxid (III)
2Fe(OH) 3 = Fe 2 O 3 + 3 H 2 O
2) Pyritrösten
4FeS 2 + 11O 2 \u003d 8SO 2 + 2Fe 2 O 3
3) Zersetzung von Nitrat
Chemische Eigenschaften
Fe 2 O 3 ist ein basisches Oxid mit Anzeichen von Amphoterismus.
I. Die Haupteigenschaften manifestieren sich in der Fähigkeit, mit Säuren zu reagieren:
Fe 2 O 3 + 6H + = 2Fe 3+ + ZN 2 O
Fe 2 O 3 + 6 HCl \u003d 2 Fe Cl 3 + 3 H 2 O
Fe 2 O 3 + 6HNO 3 \u003d 2Fe (NO 3) 3 + 3H 2 O
II. Schwache Säureeigenschaften. Fe 2 O 3 löst sich nicht in wässrigen Lösungen von Alkalien, aber wenn es mit festen Oxiden, Alkalien und Carbonaten verschmolzen wird, bilden sich Ferrite:
Fe 2 O 3 + CaO \u003d Ca (FeO 2) 2
Fe 2 O 3 + 2NaOH \u003d 2NaFeO 2 + H 2 O
Fe 2 O 3 + MgCO 3 \u003d Mg (FeO 2) 2 + CO 2
III. Fe 2 O 3 - Ausgangsmaterial für die Eisenerzeugung in der Metallurgie:
Fe 2 O 3 + ZS \u003d 2Fe + ZSO oder Fe 2 O 3 + ZSO \u003d 2Fe + ZSO 2
Fe (OH) 3 - Eisen (III) -hydroxid
Wege zu bekommen:
Erhalten durch Einwirkung von Alkalien auf lösliche Salze Fe 3+:
FeCl 3 + 3NaOH \u003d Fe (OH) 3 + 3NaCl
Zum Zeitpunkt des Erhalts von Fe(OH) 3 - rotbrauner schleimiger Niederschlag.
Fe (III) -Hydroxid entsteht auch bei der Oxidation von Fe und Fe (OH) 2 in feuchter Luft:
4Fe + 6H 2 O + 3O 2 \u003d 4Fe (OH) 3
4Fe(OH) 2 + 2Н 2 O + O 2 = 4Fe(OH) 3
Fe(III)-Hydroxid ist das Endprodukt der Hydrolyse von Fe 3+ -Salzen.
Chemische Eigenschaften
Fe(OH) 3 ist eine sehr schwache Base (viel schwächer als Fe(OH) 2). Zeigt merkliche saure Eigenschaften. Somit hat Fe (OH) 3 einen amphoteren Charakter:
1) Reaktionen mit Säuren verlaufen leicht:
2) ein frischer Niederschlag von Fe(OH) 3 wird in heißer konz. Lösungen von KOH oder NaOH unter Bildung von Hydroxokomplexen:
Fe (OH) 3 + 3 KOH \u003d K 3
In alkalischer Lösung kann Fe (OH) 3 zu Ferraten (Salze der Eisensäure H 2 FeO 4 nicht im freien Zustand isoliert) oxidiert werden:
2Fe(OH) 3 + 10KOH + 3Br 2 = 2K 2 FeO 4 + 6KBr + 8H 2 O
Fe 3+ Salze
Die praktisch wichtigsten sind: Fe 2 (SO 4) 3, FeCl 3, Fe (NO 3) 3, Fe (SCN) 3, K 3 4 - gelbes Blutsalz \u003d Fe 4 3 Preußischblau (dunkelblauer Niederschlag)
b) Fe 3+ + 3SCN - \u003d Fe (SCN) 3 Fe (III) Thiocyanat (blutrote Lösung)
Die ersten Produkte aus Eisen und seinen Legierungen wurden bei Ausgrabungen gefunden und stammen etwa aus dem 4. Jahrtausend vor Christus. Das heißt, selbst die alten Ägypter und Sumerer verwendeten Meteoritenvorkommen dieser Substanz, um Schmuck und Haushaltsgegenstände sowie Waffen herzustellen.
Heutzutage sind verschiedene Arten von Eisenverbindungen sowie reines Metall die am häufigsten verwendeten und verwendeten Substanzen. Kein Wunder, dass das 20. Jahrhundert als Eisen galt. Denn vor dem Aufkommen und der weiten Verbreitung von Kunststoff und verwandten Materialien war diese Verbindung für den Menschen von entscheidender Bedeutung. Was ist dieses Element und welche Substanzen es bildet, werden wir in diesem Artikel betrachten.
Chemisches Element Eisen
Wenn wir die Struktur des Atoms betrachten, sollten wir zunächst seine Position im Periodensystem angeben.
Auch das chemische Element Eisen hat etwa 20 verschiedene Isotope, die nicht stabil sind. Die möglichen Oxidationszustände, die ein bestimmtes Atom aufweisen kann, sind:
Nicht nur das Element selbst ist wichtig, sondern auch seine verschiedenen Verbindungen und Legierungen.
Physikalische Eigenschaften
Als einfacher Stoff hat Eisen eine ausgeprägte Metallizität. Das heißt, es ist ein silbrig-weißes Metall mit einem grauen Farbton, das ein hohes Maß an Duktilität und Duktilität sowie einen hohen Schmelz- und Siedepunkt aufweist. Betrachten wir die Eigenschaften genauer, dann gilt:
Abhängig von den Bedingungen und unterschiedlichen Temperaturen gibt es verschiedene Modifikationen, die Eisen bildet. Ihre physikalischen Eigenschaften unterscheiden sich dadurch, dass sich die Kristallgitter unterscheiden.

Alle Modifikationen haben unterschiedliche Arten von Kristallgitterstrukturen und unterscheiden sich auch in den magnetischen Eigenschaften.
Chemische Eigenschaften
Wie oben erwähnt, weist die einfache Substanz Eisen eine mittlere chemische Aktivität auf. In fein verteiltem Zustand ist es jedoch in der Lage, sich an Luft selbst zu entzünden, und das Metall selbst verbrennt in reinem Sauerstoff.
Die Korrosionsfähigkeit ist hoch, daher werden die Legierungen dieses Stoffes mit Legierungsverbindungen beschichtet. Eisen kann interagieren mit:
Es ist offensichtlich, dass das Metall, das eine solche Aktivität zeigt, in der Lage ist, verschiedene Verbindungen mit unterschiedlichen und polaren Eigenschaften zu bilden. Und so passiert es. Eisen und seine Verbindungen sind äußerst vielfältig und werden in verschiedenen Bereichen der Wissenschaft, Technologie und industriellen menschlichen Tätigkeit verwendet.
Verbreitung in der Natur
Natürliche Eisenverbindungen sind weit verbreitet, da es nach Aluminium das zweithäufigste Element auf unserem Planeten ist. Gleichzeitig ist das Metall in seiner reinen Form als Teil von Meteoriten äußerst selten, was auf seine großen Ansammlungen im Weltraum hinweist. Die Hauptmasse ist in der Zusammensetzung von Erzen, Gesteinen und Mineralien enthalten.

Wenn wir über den Prozentsatz des betreffenden Elements in der Natur sprechen, können die folgenden Zahlen angegeben werden.
Die häufigsten Eisenverbindungen bilden folgende Mineralien:
Das ist noch eine lange Liste, denn davon gibt es wirklich viele. Darüber hinaus sind verschiedene Legierungen weit verbreitet, die vom Menschen hergestellt werden. Auch das sind solche Eisenverbindungen, die aus dem modernen Leben der Menschen nicht mehr wegzudenken sind. Dazu gehören zwei Haupttypen:
Eisen ist auch ein wertvoller Zusatz für viele Nickellegierungen.
Eisen(II)-Verbindungen
Dazu gehören solche, bei denen die Oxidationsstufe des bildenden Elements +2 ist. Sie sind ziemlich zahlreich, denn sie beinhalten:
Die Formeln chemischer Verbindungen, in denen Eisen den angegebenen Oxidationsgrad aufweist, sind für jede Klasse individuell. Betrachten Sie die wichtigsten und häufigsten von ihnen.
Längen- und Entfernungsumrechner Massenumrechner Schüttgut- und Lebensmittelvolumenumrechner Flächenumrechner Volumen- und Rezepteinheitenumrechner Temperaturumrechner Druck, Spannung, E-Modul Umrechner Energie und Arbeit Umrechner Kraftumrechner Kraftumrechner Zeitumrechner Lineargeschwindigkeitsumrechner Flachwinkelumrechner Thermischer Wirkungsgrad und Kraftstoffeffizienz Umrechner von Zahlen in verschiedenen Zahlensystemen Umrechner von Maßeinheiten von Informationsmengen Währungskurse Maße von Damenbekleidung und -schuhen Maße von Herrenbekleidung und -schuhen Winkelgeschwindigkeits- und Drehfrequenz-Umrechner Beschleunigungs-Umrechner Winkelbeschleunigungs-Umrechner Dichte-Umrechner Spezifisches Volumen-Umrechner Trägheitsmoment-Umrechner Moment des Kraftwandlers Drehmomentwandler spezifischer Heizwertwandler (nach Masse) Energiedichte und spezifischer Heizwertwandler (nach Volumen) Temperaturdifferenzwandler Koeffizientenwandler Wärmeausdehnungskoeffizient Wärmewiderstand Umrechner Wärmeleitfähigkeit Umrechner Spezifische Wärmekapazität Umrechner Energieeinwirkung und Strahlungsleistung Umrechner Wärmestromdichte Umrechner Wärmeübertragungskoeffizient Umrechner Volumendurchfluss Umrechner Massendurchfluss Umrechner Molarer Durchfluss Umrechner Massenflussdichte Umrechner Molare Konzentration Umrechner Massenkonzentration in Lösung Umrechner Dynamisch ( Umrechner für kinematische Viskosität Umrechner für Oberflächenspannung Umrechner für Dampfdurchlässigkeit Umrechner für Wasserdampfflussdichte Umrechner für Schallpegel Umrechner für Mikrofonempfindlichkeit Umrechner für Schalldruckpegel (SPL) Umrechner für Schalldruckpegel (SPL) Umrechner für Schalldruckpegel mit wählbarem Referenzdruck Umrechner für Helligkeit Umrechner für Lichtintensität Umrechner für Beleuchtungsstärke Umrechner für Computergrafikauflösung Umrechner für Frequenz und Wellenlänge Leistung in Dioptrien und Brennweite Entfernung Leistung in Dioptrien und Linsenvergrößerung (×) Umrechner für elektrische Ladung Umrechner für lineare Ladungsdichte Umrechner für Oberflächenladungsdichte Umrechner für volumetrische Ladungsdichte Umrechner für elektrischen Strom Umrechner für lineare Stromdichte Umrechner für Oberflächenstromdichte Umrechner für elektrische Feldstärke Umrechner für elektrostatisches Potential und Spannung Umrechner für elektrischen Widerstand Umrechner Elektrisch Widerstand Elektrische Leitfähigkeit Konverter Elektrische Leitfähigkeit Konverter Kapazität Induktivität Konverter US Drahtstärke Konverter Pegel in dBm (dBm oder dBm), dBV (dBV), Watt usw. Einheiten Magnetomotorischer Kraft-Konverter Magnetfeldstärke-Konverter Magnetischer Fluss-Konverter Magnetischer Induktions-Konverter Strahlung. Ionisierende Strahlung Energiedosisleistungskonverter Radioaktivität. Radioaktive Zerfallskonverterstrahlung. Expositionsdosiskonverter Strahlung. Energiedosis-Umrechner Dezimalpräfix-Umrechner Datenübertragung Typographie und Bildverarbeitung Einheitenumrechner Holzvolumen-Einheitenumrechner Berechnung der Molmasse Periodensystem der chemischen Elemente von D. I. Mendelejew
Chemische Formel
Molmasse von Fe 2 (SO 4) 3 , Eisen(III)sulfat 399.8778 g/Mol
55,845 2+(32,065+15,9994 4) 3
Massenanteile von Elementen in der Verbindung
Verwenden des Molmassenrechners
Molmassenrechner
Maulwurf
Alle Stoffe bestehen aus Atomen und Molekülen. In der Chemie ist es wichtig, die Masse von Stoffen, die in eine Reaktion eintreten und daraus resultieren, genau zu messen. Per Definition ist das Mol die SI-Einheit für die Menge eines Stoffes. Ein Mol enthält genau 6,02214076×10²³ Elementarteilchen. Dieser Wert ist numerisch gleich der Avogadro-Konstante N A , ausgedrückt in Einheiten von Mol&supmin;¹, und wird als Avogadro-Zahl bezeichnet. Stoffmenge (Symbol n) eines Systems ist ein Maß für die Anzahl der Strukturelemente. Ein Strukturelement kann ein Atom, Molekül, Ion, Elektron oder irgendein Teilchen oder eine Gruppe von Teilchen sein.
Avogadro-Konstante N A = 6,02214076 × 10²³ mol⁻¹. Avogadros Zahl ist 6,02214076×10²³.
Mit anderen Worten, ein Mol ist die Menge einer Substanz, deren Masse gleich der Summe der Atommassen der Atome und Moleküle der Substanz ist, multipliziert mit der Avogadro-Zahl. Der Maulwurf ist eine der sieben Grundeinheiten des SI-Systems und wird mit dem Maulwurf bezeichnet. Da der Name der Einheit und ihr Symbol identisch sind, ist zu beachten, dass das Symbol nicht gebeugt ist, im Gegensatz zum Namen der Einheit, der nach den üblichen Regeln der russischen Sprache abgelehnt werden kann. Ein Mol reines Kohlenstoff-12 entspricht genau 12 Gramm.
Molmasse
Die Molmasse ist eine physikalische Eigenschaft einer Substanz, definiert als das Verhältnis der Masse dieser Substanz zur Menge der Substanz in Mol. Mit anderen Worten, es ist die Masse von einem Mol einer Substanz. Im SI-System ist die Einheit der Molmasse Kilogramm/Mol (kg/mol). Chemiker sind jedoch daran gewöhnt, die bequemere Einheit g/mol zu verwenden.
Molmasse = g/mol

Molmasse von Elementen und Verbindungen
Verbindungen sind Substanzen, die aus verschiedenen Atomen bestehen, die chemisch miteinander verbunden sind. Chemische Verbindungen sind zum Beispiel folgende Stoffe, die in der Küche jeder Hausfrau zu finden sind:
Die Molmasse chemischer Elemente in Gramm pro Mol ist numerisch gleich der Masse der Atome des Elements, ausgedrückt in atomaren Masseneinheiten (oder Dalton). Die Molmasse von Verbindungen ist gleich der Summe der Molmassen der Elemente, aus denen die Verbindung besteht, unter Berücksichtigung der Anzahl der Atome in der Verbindung. Beispielsweise beträgt die Molmasse von Wasser (H₂O) ungefähr 1 × 2 + 16 = 18 g/mol.
Molekulare Masse

Das Molekulargewicht (der alte Name ist Molekulargewicht) ist die Masse eines Moleküls, berechnet als Summe der Massen jedes Atoms, aus dem das Molekül besteht, multipliziert mit der Anzahl der Atome in diesem Molekül. Das Molekulargewicht ist dimensionslos eine physikalische Größe, die numerisch gleich der Molmasse ist. Das heißt, das Molekulargewicht unterscheidet sich von der Molmasse in der Dimension. Obwohl die Molekülmasse eine dimensionslose Größe ist, hat sie immer noch einen Wert, der als atomare Masseneinheit (amu) oder Dalton (Da) bezeichnet wird, und entspricht ungefähr der Masse eines Protons oder Neutrons. Die atomare Masseneinheit ist auch numerisch gleich 1 g/mol.
Berechnung der Molmasse
Die Molmasse errechnet sich wie folgt:
Lassen Sie uns zum Beispiel die Molmasse von Essigsäure berechnen
Es besteht aus:
Unser Rechner macht genau das. Sie können die Formel von Essigsäure hineingeben und überprüfen, was passiert.
Fällt es Ihnen schwer, Maßeinheiten von einer Sprache in eine andere zu übersetzen? Kollegen sind bereit, Ihnen zu helfen. Stellen Sie eine Frage an TCTerms und innerhalb weniger Minuten erhalten Sie eine Antwort.