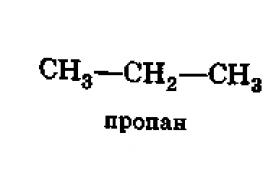
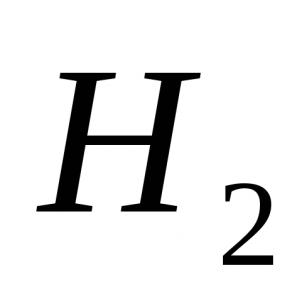Kohle bekommen. Chemische Eigenschaften gesättigter einbasiger Carbonsäuren
Carbonsäuren sind Derivate von Kohlenwasserstoffen, die eine oder mehrere Carboxylgruppen enthalten.
Die Anzahl der Carboxylgruppen charakterisiert die Basizität der Säure.
Abhängig von der Anzahl der Carboxylgruppen werden Carbonsäuren in einbasige Carbonsäuren (mit einer Carboxylgruppe), zweibasige (mit zwei Carboxylgruppen) und mehrbasige Carbonsäuren unterteilt.
Je nach Art des mit der Carboxylgruppe verbundenen Restes werden Carbonsäuren in gesättigt, ungesättigt und aromatisch eingeteilt. Limitierende und ungesättigte Säuren werden unter dem allgemeinen Namen aliphatische oder Fettsäuren zusammengefasst.
Monobasische Carbonsäuren
1.1 Homologe Serien und Nomenklatur
Die homologe Reihe einbasiger gesättigter Carbonsäuren (manchmal auch als Fettsäuren bezeichnet) beginnt mit Ameisensäure
Homologe Reihenformel
Die IUPAC-Nomenklatur erlaubt die Erhaltung vieler Säuren unter ihren Trivialnamen, die normalerweise die natürliche Quelle angeben, aus der diese oder jene Säure isoliert wurde, z. B. Ameisensäure, Essigsäure, Buttersäure, Valeriansäure usw.
Für komplexere Fälle leiten sich die Namen von Säuren von den Namen von Kohlenwasserstoffen mit der gleichen Anzahl an Kohlenstoffatomen wie im Säuremolekül ab, ergänzt um die Endung -owaja und Worte Säure. Ameisensäure H-COOH heißt Methansäure, Essigsäure CH 3 -COOH heißt Ethansäure usw.
Daher werden Säuren als Derivate von Kohlenwasserstoffen betrachtet, von denen eine Verknüpfung in Carboxyl umgewandelt wird:

Bei der Benennung von verzweigtkettigen Säuren nach rationaler Nomenklatur werden sie als Derivate von Essigsäure betrachtet, in deren Molekül Wasserstoffatome durch Radikale ersetzt sind, beispielsweise Trimethylessigsäure (CH 3) 3 C - COOH.
1.2 Physikalische Eigenschaften von Carbonsäuren
Nur aus rein formalen Positionen kann die Carboxylgruppe als Kombination von Carbonyl- und Hydroxylfunktionen betrachtet werden. Tatsächlich ist ihre gegenseitige Beeinflussung so, dass sie ihre Eigenschaften vollständig verändert.
Die für Carbonyle übliche Polarisation der C=0-Doppelbindung nimmt durch die zusätzliche Kontraktion eines freien Elektronenpaares vom benachbarten Sauerstoffatom der Hydroxylgruppe stark zu:

Die Folge davon ist eine signifikante Schwächung der O-H-Bindung in Hydroxyl und die Leichtigkeit, ein Wasserstoffatom davon in Form eines Protons (H +) abzuspalten. Das Auftreten einer verringerten Elektronendichte (δ+) am zentralen Kohlenstoffatom des Carboxyls führt auch zur Kontraktion der σ-Elektronen der benachbarten C-C-Bindung zur Carboxylgruppe und dem Auftreten (wie in Aldehyden und Ketonen) von a reduzierte Elektronendichte (δ +) am α-Kohlenstoffatom der Säure .
Alle Carbonsäuren sind sauer (erkennbar durch Indikatoren) und bilden Salze mit Hydroxiden, Oxiden und Carbonaten von Metallen und mit aktiven Metallen:
Carbonsäuren dissoziieren in den meisten Fällen in wässriger Lösung nur in geringem Maße und sind schwache Säuren, die solchen Säuren wie Salz-, Salpeter- und Schwefelsäure deutlich unterlegen sind. Beim Auflösen von einem Mol in 16 Liter Wasser beträgt der Dissoziationsgrad von Ameisensäure 0,06, Essigsäure - 0,0167, während Salzsäure mit dieser Verdünnung fast vollständig dissoziiert.
Für die meisten einbasigen Carbonsäuren RK a \u003d 4,8, nur Ameisensäure hat einen niedrigeren pKa-Wert (ca. 3,7), was durch das Fehlen der elektronenspendenden Wirkung von Alkylgruppen erklärt wird.
In wasserfreien Mineralsäuren werden Carbonsäuren am Sauerstoff zu Carbokationen protoniert:

Die oben erwähnte Verschiebung der Elektronendichte im Molekül der undissoziierten Carbonsäure verringert die Elektronendichte am Hydroxyl-Sauerstoffatom und erhöht sie am Carbonyl-Sauerstoffatom. Diese Verschiebung wird im Anion der Säure noch verstärkt:

Das Ergebnis der Verschiebung ist ein vollständiger Ladungsausgleich im Anion, das tatsächlich in der Form A vorliegt - der Resonanz des Carboxylat-Anions.
Die ersten vier Vertreter der Carbonsäurereihe sind bewegliche Flüssigkeiten, die in jeder Hinsicht mit Wasser mischbar sind. Säuren, deren Molekül fünf bis neun Kohlenstoffatome enthält (sowie Isobuttersäure), sind ölige Flüssigkeiten, ihre Löslichkeit in Wasser ist gering.
Höhere Säuren (ab C 10) sind in Wasser praktisch unlösliche Feststoffe, die sich bei der Destillation unter Normalbedingungen zersetzen.
Ameisen-, Essig- und Propionsäure haben einen stechenden Geruch; die mittleren Vertreter der Reihe haben einen unangenehmen Geruch, die höheren Säuren haben keinen Geruch.

Die physikalischen Eigenschaften von Carbonsäuren werden durch einen erheblichen Assoziationsgrad aufgrund der Bildung von Wasserstoffbrückenbindungen beeinflusst. Säuren bilden starke Wasserstoffbrückenbindungen, da die O-H-Bindungen in ihnen stark polarisiert sind. Darüber hinaus können Carbonsäuren unter Beteiligung des Sauerstoffatoms des Carbonyldipols, das eine signifikante Elektronegativität aufweist, Wasserstoffbrückenbindungen bilden. Tatsächlich existieren Carbonsäuren im festen und flüssigen Zustand hauptsächlich in Form von cyclischen Dimeren:
Solche dimeren Strukturen bleiben bis zu einem gewissen Grad sogar im gasförmigen Zustand und in verdünnten Lösungen in unpolaren Lösungsmitteln bestehen.
13.1.1. Kohlenwasserstoffoxidation. Es gibt zwei Wege: die Oxidation von niederen C 4 -C 8 -Alkanen hauptsächlich zu Essigsäure und die Oxidation von festem Paraffin unter Bildung von synthetischen Fettsäuren (FFA) mit einer geraden Kette von C 10 -C 20 -Kohlenstoffatomen, die sind Rohstoffe für die Synthese von Tensiden (Tenside) .
Das Verfahren läuft in flüssiger Phase ab, wenn es erhitzt wird oder in Gegenwart von Katalysatoren. Bei der Oxidation von Alkanen findet entlang der Bindungen zwischen sekundären Kohlenstoffatomen eine Zerstörung statt, daher entsteht aus n-Butan hauptsächlich Essigsäure und als Nebenprodukte Methylethylketon und Ethylacetat.
13.1.2 Synthesen auf Basis von Kohlenmonoxid (II). Carbonsäuren werden aus Kohlenmonoxid durch die Carbonylierungsreaktion erhalten:
Die Doppelbindungsaddition in der Säurekatalyse verläuft immer nach der Markovnikov-Regel, wodurch aus Ethylen nur eine geradkettige Säure und aus ihren Homologen α-Methyl-substituierte Säuren erhalten werden. Dieses Verfahren ist von besonderem Interesse für die Synthese von Säuren mit einem tertiären Rest (Nicht-Säuren) aus verzweigten Olefinen. (Koch-Reaktion):

Der Reaktionsmechanismus besteht in der vorläufigen Protonierung des Alkens mit einer Säure unter Bildung eines Carbeniumions, dessen Wechselwirkung mit CO erhalten wird Acylium - Kation und deren Reaktionen mit Wasser zu einer Carbonsäure:
Neosäuren und ihre Salze haben eine sehr hohe Löslichkeit und Viskosität, und ihre Ester sind hydrolysestabil, was ihnen eine breite Anwendung in einer Reihe von Industrien verschafft.
Die Carbonylierung von Alkoholen wird durch Metallkomplexe (Ni, Co, Fe, Pd) katalysiert. Das Verfahren wurde zur Synthese von Essigsäure aus Methanol industriell umgesetzt und zeichnet sich durch eine hohe Wirtschaftlichkeit aus.
Säuren werden auch durch Oxidation von Aldehyden (einem Produkt der Oxosynthese) gewonnen.
Labormethoden zur Gewinnung von Carbonsäuren
Oxidation von Alkanen.
Alkenoxidation.
13.2.3. Oxidation primärer Alkohole.
13.2.4. Oxidation von Aldehyden und Ketonen. Aldehyde werden viel leichter oxidiert als Ketone. Darüber hinaus führt die Oxidation von Aldehyden zur Bildung von Säuren mit der gleichen Anzahl von Kohlenstoffatomen, während die Oxidation von Ketonen unter Aufbrechen von Kohlenstoff-Kohlenstoff-Bindungen verläuft (es entstehen zwei Säuren oder eine Säure und ein Keton):

Die Oxidationsmittel sind Kaliumpermanganat oder Dichromat. Die Oxidation von Ketonen erfordert strengere Bedingungen als die von Aldehyden.
13.2.5. Hydrolyse von Nitrilen. Nitrile werden durch die Wechselwirkung von Halogenalkanen mit Kaliumcyanid erhalten, die Hydrolyse wird mit wässrigen Lösungen von Säuren oder Laugen durchgeführt. In saurer Umgebung wird Stickstoff in Form eines Ammoniumsalzes freigesetzt:

alkalisch - in Form von Ammoniumhydroxid, das sich unter Freisetzung von Ammoniak zersetzt, wird die Säure in Form eines Salzes erhalten:

13.2.6. Grignard-Synthese. Wenn Organomagnesiumverbindungen mit Kohlendioxid interagieren, werden Salze von Carbonsäuren gebildet:
Eine starke Säure (normalerweise HCl) wandelt das Salz in eine Säure um:
Hydrolyse von Fetten
Fette sind Ester aus Carbonsäuren und Glycerin (Triglyceride). Die Carbonsäuren, aus denen Fette bestehen, haben eine Kohlenstoffkette von 3 bis 18 Kohlenstoffatomen.
Das Kochen von Fetten oder Ölen mit wässrigen Lösungen von Alkalien (NaOH, KOH) führt zur Bildung von Salzen von Carbonsäuren und Glycerin.
Dieser Vorgang wird als Verseifung bezeichnet, da Salze von Carbonsäuren zur Herstellung von Seife verwendet werden.
Hydrolyse von Derivaten von Carbonsäuren.
Physikalische Eigenschaften
Niedere Säuren mit bis zu 3 Kohlenstoffatomen sind flüchtige, farblose Flüssigkeiten mit charakteristisch stechendem Geruch, in jedem Verhältnis mit Wasser mischbar. Die meisten Säuren C 4 - C 9 sind ölige Flüssigkeiten mit einem unangenehmen Geruch. Die Löslichkeit in Wasser nimmt mit zunehmender Molmasse stark ab. Säuren ab C 10 sind wasserunlösliche Feststoffe. Die Dichten von Ameisen- und Essigsäure sind größer als eins, der Rest kleiner als eins. Der Siedepunkt steigt mit zunehmender Molmasse, bei gleicher Anzahl an Kohlenstoffatomen sieden Säuren normaler Struktur höher als Säuren mit verzweigtem Kohlenstoffgerüst. Ein Vergleich der Siedepunkte von Säuren und Alkoholen mit gleicher Anzahl an Kohlenstoffatomen zeigte, dass Säuren bei wesentlich höheren Temperaturen sieden als Alkohole. Dies deutet auf eine höhere Assoziation von Säuremolekülen im Vergleich zu Alkoholen aufgrund der Bildung von Wasserstoffbrückenbindungen hin.
Carbonsäuren sind wie Alkohole in der Lage, Wasserstoffbrückenbindungen zu bilden. Wenn der Akzeptor eine ausreichend starke Base ist, geht die Bildung einer Wasserstoffbrücke der vollständigen Übertragung eines Protons auf die Base voraus. Laut Bronsted wird eine Verbindung, die ein Wasserstoffspender ist, als "Säure" betrachtet. Ob eine bestimmte Verbindung ein „Wasserstoffdonator“ („Säure“) ist, hängt von der Natur des „Wasserstoffakzeptors“ („Base“) ab. Je stärker die Base ist, desto wahrscheinlicher ist es, dass sich die Verbindung ihr gegenüber wie eine Säure verhält:

Die intermolekularen Wasserstoffbrückenbindungen, die zwischen den Molekülen von Carbonsäuren entstehen, sind so stark, dass selbst im gasförmigen Zustand ein erheblicher Teil der Moleküle in Form von Dimeren vorliegt:

Mit zunehmender Kohlenwasserstoffkette nimmt die Fähigkeit von Säuren zur Bildung von Wasserstoffbrückenbindungen ab.
DEFINITION
Als organische Substanzen werden organische Substanzen bezeichnet, deren Moleküle eine oder mehrere Carboxylgruppen enthalten, die mit einem Kohlenwasserstoffrest verbunden sind Carbonsäuren.
Die ersten drei Mitglieder der homologen Reihe von Carbonsäuren, einschließlich Propionsäure, sind Flüssigkeiten, die einen stechenden Geruch haben und in Wasser gut löslich sind. Die folgenden Homologen, beginnend mit Buttersäure, sind ebenfalls Flüssigkeiten, die einen scharfen unangenehmen Geruch haben, aber in Wasser schlecht löslich sind. Höhere Säuren mit einer Kohlenstoffzahl von 10 oder mehr sind Feststoffe, geruchlos, in Wasser unlöslich. Im Allgemeinen nimmt in der Reihe der Homologen mit steigendem Molekulargewicht die Wasserlöslichkeit ab, die Dichte ab und der Siedepunkt zu (Tabelle 1).
Table 1. Homologe Reihe von Carbonsäuren.
Carbonsäuren erhalten
Carbonsäuren werden durch Oxidation von gesättigten Kohlenwasserstoffen, Alkoholen, Aldehyden erhalten. Zum Beispiel Essigsäure - durch Oxidation von Ethanol mit einer Lösung von Kaliumpermanganat in einem sauren Medium beim Erhitzen:
Chemische Eigenschaften von Carbonsäuren
Die chemischen Eigenschaften von Carbonsäuren sind in erster Linie auf die Besonderheiten ihrer Struktur zurückzuführen. Wasserlösliche Säuren können also in Ionen dissoziieren:
R-COOH↔R-COO – + H + .
Aufgrund des Vorhandenseins des H + -Ions im Wasser haben sie einen sauren Geschmack, können die Farbe der Indikatoren ändern und Strom leiten. In wässriger Lösung sind diese Säuren schwache Elektrolyte.
Carbonsäuren haben chemische Eigenschaften, die für Lösungen anorganischer Säuren charakteristisch sind, d.h. interagieren mit Metallen (1), ihren Oxiden (2), Hydroxiden (3) und schwachen Salzen (4):
2CH 3 -COOh + Zn → (CH 3 COO) 2 Zn + H 2 (1);
2CH 3 -COOH + CuO → (CH 3 COO) 2 Cu + H 2 O (2);
R-COOH + KOH → R-COOK + H 2 O (3);
2CH 3 -COOH + NaHCO 3 → CH 3 COONa + H 2 O + CO 2 (4).
Eine spezifische Eigenschaft der Limitierung sowie ungesättigter Carbonsäuren, die sich aufgrund der funktionellen Gruppe manifestiert, ist die Wechselwirkung mit Alkoholen.
Carbonsäuren reagieren mit Alkoholen beim Erhitzen und in Gegenwart von konzentrierter Schwefelsäure. Wenn beispielsweise Essigsäure mit Ethylalkohol und etwas Schwefelsäure versetzt wird, tritt beim Erhitzen der Geruch von Essigsäureethylester (Ethylacetat) auf:
CH3-COOH + C2H5OH ↔CH3-C(O)-O-C2H5 + H20.
Eine spezifische Eigenschaft gesättigter Carbonsäuren, die sich aufgrund des Radikals manifestiert, ist die Halogenierungs- (Chlorierungs-) Reaktion.

Anwendung von Carbonsäuren
Carbonsäuren dienen als Ausgangsmaterial für die Herstellung von Ketonen, Säurehalogeniden, Vinylestern und anderen wichtigen Klassen organischer Verbindungen.
Ameisensäure wird häufig verwendet, um Ester zu erhalten, die in der Parfümerie, Leder (Gerben), Textilindustrie (als Beizmittel beim Färben), als Lösungsmittel und Konservierungsmittel verwendet werden.
Eine wässrige Lösung (70–80 %) von Essigsäure wird Essigessenz genannt, und eine 3–9 %ige wässrige Lösung wird Tafelessig genannt. Die Essenz wird oft verwendet, um zu Hause durch Verdünnung Essig herzustellen.
Beispiele für Problemlösungen
BEISPIEL 1
| Die Übung | Welche chemischen Reaktionen können verwendet werden, um die folgenden Umwandlungen durchzuführen: a) CH 4 → CH 3 Cl → CH 3 OH → HCHO → HCOOH → HCOOK. Schreiben Sie die Reaktionsgleichungen auf und geben Sie die Bedingungen für ihr Auftreten an. |
| Antworten | a) Chlorierung von Methan in Gegenwart von Licht führt zur Produktion von Chlormethan: CH 4 + Cl 2 → CH 3 Cl + HCl. Halogenderivate von Alkanen hydrolysieren in wässrigem oder alkalischem Medium unter Bildung von Alkoholen: CH 3 Cl + NaOH → CH 3 OH + NaCl. Durch die Oxidation von primären Alkoholen beispielsweise mit Kaliumdichromat in saurem Medium in Gegenwart eines Katalysators (Cu, CuO, Pt, Ag) entstehen Aldehyde: CH 3 OH + [O] → HCHO. Aldehyde werden beispielsweise mit Kaliumpermanganat leicht zu den entsprechenden Carbonsäuren oxidiert: HCHO + [O]→HCOOH. Carbonsäuren weisen alle Eigenschaften auf, die schwachen Mineralsäuren innewohnen, d.h. können mit aktiven Metallen Salze bilden: 2HCOOH+ 2K→2HCOOK + H2. |
BEISPIEL 2
| Die Übung | Schreiben Sie die Reaktionsgleichungen zwischen den folgenden Stoffen auf: a) 2-Methylpropansäure und Chlor; b) Essigsäure und Propanol-2; c) Acrylsäure und Bromwasser; d) 2-Methylbutansäure und Phosphor(V)chlorid. Geben Sie die Reaktionsbedingungen an. |
| Antworten | a) durch die Wechselwirkungsreaktion zwischen 2-Methylpropansäure und Chlor das Wasserstoffatom in dem in a-Stellung befindlichen Kohlenwasserstoffrest ausgetauscht wird; Es entsteht 2-Methyl-2-chlorpropansäure H 3 C-C (CH 3) H-COOH + Cl 2 → H 3 C-C (CH 3) Cl-COOH + HCl (kat \u003d P). b) Als Ergebnis der Wechselwirkungsreaktion zwischen Essigsäure und Propanol-2 wird ein Ester gebildet - Isopropylester von Essigsäure. CH3-COOH + CH3-C(OH)H-CH3 → CH3-C(O)-O-C(CH3)-CH3. c) als Ergebnis der Wechselwirkungsreaktion zwischen Acrylsäure und Bromwasser die Addition eines Halogens an der Doppelbindungsstelle gemäß der Regel von Markovnikov; Es entsteht 2,3-Dibrompropansäure CH 2 \u003d CH-COOH + Br 2 → CH 2 Br-CHBr-COOH d) als Ergebnis der Wechselwirkungsreaktion zwischen 2-Methylbutansäure und Phosphor(V)chlorid wird das entsprechende Säurechlorid gebildet CH 3 -CH 2 -C(CH 3 )H-COOH + PCl 5 →CH 3 -CH 2 -C(CH 3 )H-COOCl + POCl 3 + HCl. |
Einstufung
a) Durch Basizität (d. h. die Anzahl der Carboxylgruppen in einem Molekül):
Monobasisches (monocarboxylisches) RCOOH; Zum Beispiel:
CH 3 CH 2 CH 2 COOH;
HOOS-CH 2 -COOH Propandisäure (Malonsäure).

Tribasisch (Tricarbonsäure) R (COOH) 3 usw.
b) Nach der Struktur des Kohlenwasserstoffrestes:
Aliphatisch
Grenze; zum Beispiel: CH 3 CH 2 COOH;
ungesättigt; zum Beispiel: CH 2 \u003d CHCOOH Propensäure (Acrylsäure).

Alizyklisch, zum Beispiel:

Aromatisch zum Beispiel:

Begrenzen Sie Monocarbonsäuren
(monobasische gesättigte Carbonsäuren) - Carbonsäuren, bei denen ein gesättigter Kohlenwasserstoffrest mit einer Carboxylgruppe -COOH verbunden ist. Sie haben alle die allgemeine Formel C n H 2n+1 COOH (n ≥ 0); oder CnH 2n O 2 (n≥1)
Nomenklatur
Die systematischen Namen von einbasigen gesättigten Carbonsäuren werden durch den Namen des entsprechenden Alkans mit der Endung -ovaya und dem Wort Säure angegeben.
1. HCOOH Methan (Ameisen) Säure
2. CH 3 COOH Essigsäure
3. CH 3 CH 2 COOH-Propansäure (Propionsäure).
Isomerie
Die Isomerie des Skeletts im Kohlenwasserstoffradikal manifestiert sich ausgehend von Butansäure, die zwei Isomere aufweist:

Die Isomerie zwischen den Klassen manifestiert sich, beginnend mit Essigsäure:
CH3-COOH Essigsäure;
H-COO-CH 3 Methylformiat (Methylester der Ameisensäure);
HO-CH 2 -COH-Hydroxyethanal (Hydroxyessigaldehyd);
HO-CHO-CH 2 Hydroxyethylenoxid.
Homologe serie
Trivialname |
IUPAC-Name |
|
Ameisensäure |
Methansäure |
|
Essigsäure |
Essigsäure |
|
Propionsäure |
Propionsäure |
|
Buttersäure |
Buttersäure |
|
Valeriansäure |
Pentansäure |
|
Capronsäure |
Hexansäure |
|
Enanthsäure |
Heptansäure |
|
Caprylsäure |
Octansäure |
|
Pelargonsäure |
Nonansäure |
|
Caprinsäure |
Decansäure |
|
Undecylsäure |
Undecansäure |
|
Palmitinsäure |
Hexadecansäure |
|
Stearinsäure |
Octadecansäure |
Säurereste und Säureradikale
Säurerest |
Säureradikal (Acyl) |
|
UNSD |
NSOO- |
|
CH3COOH |
CH 3 SOO- |
|
CH 3 CH 2 COOH |
CH 3 CH 2 COO- |
|
CH3(CH2)2COOH |
CH 3 (CH 2) 2 COO- |
|
CH 3 (CH 2 ) 3 COOH |
CH 3 (CH 2) 3 COO- |
|
CH3(CH2)4COOH |
CH 3 (CH 2) 4 COO- |
Elektronische Struktur von Carbonsäuremolekülen

Die in der Formel gezeigte Verschiebung der Elektronendichte zum Carbonylsauerstoffatom bewirkt eine starke Polarisierung der O-H-Bindung, wodurch die Ablösung des Wasserstoffatoms in Form eines Protons erleichtert wird - in wässrigen Lösungen der Vorgang Säuredissoziation tritt auf:
RCOOH ↔ RCOO – + H +
Im Carboxylation (RCOO-) findet eine p,π-Konjugation des freien Elektronenpaares des Sauerstoffatoms der Hydroxylgruppe mit p-Wolken unter Bildung einer π-Bindung statt, wodurch die π-Bindung delokalisiert wird und die negative Ladung ist gleichmäßig zwischen den beiden Sauerstoffatomen verteilt:

Insofern sind für Carbonsäuren im Gegensatz zu Aldehyden Additionsreaktionen nicht charakteristisch.
Physikalische Eigenschaften

Die Siedepunkte von Säuren sind viel höher als die Siedepunkte von Alkoholen und Aldehyden mit der gleichen Anzahl von Kohlenstoffatomen, was durch die Bildung von zyklischen und linearen Assoziaten zwischen Säuremolekülen aufgrund von Wasserstoffbrückenbindungen erklärt wird:
Chemische Eigenschaften
I. Säureeigenschaften
Die Stärke von Säuren nimmt in der Reihe ab:
HCOOH → CH 3 COOH → C 2 H 6 COOH → ...
1. Neutralisationsreaktionen
CH 3 COOH + KOH → CH 3 COOK + n 2 O
2. Reaktionen mit basischen Oxiden
2HCOOH + CaO → (HCOO) 2 Ca + H 2 O
3. Reaktionen mit Metallen
2CH 3 CH 2 COOH + 2 Na → 2 CH 3 CH 2 COONa + H 2
4. Reaktionen mit Salzen schwächerer Säuren (einschließlich Carbonate und Bicarbonate)
2CH 3 COOH + Na 2 CO 3 → 2CH 3 COONa + CO 2 + H 2 O
2HCOOH + Mg(HCO 3) 2 → (HCOO) 2 Mg + 2CO 2 + 2H 2 O
(HCOOH + HCO 3 - → HCOO - + CO2 + H2O)
5. Reaktionen mit Ammoniak
CH 3 COOH + NH 3 → CH 3 COONH 4
II. -OH-Gruppensubstitution
1. Wechselwirkung mit Alkoholen (Veresterungsreaktionen)

2. Wechselwirkung mit NH 3 beim Erhitzen (Bildung von Säureamiden)

Säureamide  zu Säuren hydrolysiert:
zu Säuren hydrolysiert:

oder ihre Salze:

3. Bildung von Säurehalogeniden
Säurechloride sind von größter Bedeutung. Chlorierungsreagenzien – PCl 3 , PCl 5 , Thionylchlorid SOCl 2 .

4. Bildung von Säureanhydriden (intermolekulare Dehydratisierung)

Säureanhydride werden auch durch die Wechselwirkung von Säurechloriden mit wasserfreien Salzen von Carbonsäuren gebildet; in diesem Fall können gemischte Anhydride verschiedener Säuren erhalten werden; Zum Beispiel:

III. Substitutionsreaktionen von Wasserstoffatomen am α-Kohlenstoffatom

Merkmale der Struktur und Eigenschaften von Ameisensäure
Die Struktur des Moleküls

Das Ameisensäuremolekül enthält im Gegensatz zu anderen Carbonsäuren eine Aldehydgruppe in seiner Struktur.
Chemische Eigenschaften
Ameisensäure geht Reaktionen ein, die sowohl für Säuren als auch für Aldehyde charakteristisch sind. Es zeigt die Eigenschaften eines Aldehyds und wird leicht zu Kohlensäure oxidiert:
Insbesondere wird HCOOH mit einer Ammoniaklösung von Ag 2 O und Kupfer (II) -hydroxid Сu (OH) 2 oxidiert, d. H. Gibt qualitative Reaktionen an der Aldehydgruppe:

Beim Erhitzen mit konzentrierter H 2 SO 4 zerfällt Ameisensäure zu Kohlenmonoxid (II) und Wasser:

Ameisensäure ist deutlich stärker als andere aliphatische Säuren, da die Carboxylgruppe darin an ein Wasserstoffatom und nicht an einen elektronenspendenden Alkylrest gebunden ist.
Verfahren zur Gewinnung gesättigter Monocarbonsäuren
1. Oxidation von Alkoholen und Aldehyden
Das allgemeine Schema für die Oxidation von Alkoholen und Aldehyden:
Als Oxidationsmittel werden KMnO 4 , K 2 Cr 2 O 7 , HNO 3 und andere Reagenzien verwendet.
Zum Beispiel:
5C 2 H 5 OH + 4 KMnO 4 + 6 H 2 SO 4 → 5 CH 3 COOH + 2 K 2 SO 4 + 4 MnSO 4 + 11 H 2 O
2. Hydrolyse von Estern

3. Oxidative Spaltung von Doppel- und Dreifachbindungen in Alkenen und Alkinen

Methoden zur Gewinnung von HCOOH (spezifisch)
1. Wechselwirkung von Kohlenmonoxid (II) mit Natriumhydroxid
CO + NaOH → HCOONa Natriumformiat
2HCOONa + H 2 SO 4 → 2HCOOH + Na 2 SO 4
2. Decarboxylierung von Oxalsäure

Verfahren zur Gewinnung von CH 3 COOH (spezifisch)
1. Katalytische Oxidation von Butan

2. Synthese aus Acetylen

3. Katalytische Carbonylierung von Methanol

4. Essigsäuregärung von Ethanol
So entsteht lebensmittelechte Essigsäure.
Erhalt höherer Carbonsäuren
Hydrolyse natürlicher Fette

Ungesättigte Monocarbonsäuren
Schlüsselvertreter
Allgemeine Formel von Alkensäuren: C n H 2n-1 COOH (n ≥ 2)
CH 2 \u003d CH-COOH Propensäure (Acrylsäure).

Höher ungesättigte Säuren
Die Reste dieser Säuren sind Bestandteil von Pflanzenölen.
C 17 H 33 COOH - Ölsäure, oder cis-Octadien-9-säure

Trance-Isomer der Ölsäure wird Elaidinsäure genannt.
C 17 H 31 COOH - Linolsäure, oder cis, cis-Octadien-9,12-säure

C 17 H 29 COOH - Linolensäure, oder cis, cis, cis-Octadecatrien-9,12,15-säure
Ungesättigte Säuren zeichnen sich neben den allgemeinen Eigenschaften von Carbonsäuren durch Additionsreaktionen an Mehrfachbindungen im Kohlenwasserstoffrest aus. So werden ungesättigte Säuren wie Alkene hydriert und entfärben Bromwasser, zum Beispiel:

Einzelne Vertreter von Dicarbonsäuren
Limitierende Dicarbonsäuren HOOC-R-COOH
HOOC-CH 2 -COOH Propandisäure (Malonsäure), (Salze und Ester - Malonate)
HOOC-(CH 2) 2 -COOH Butadien(bernstein)säure, (Salze und Ester - Succinate)
HOOC-(CH 2) 3 -COOH Pentadisäure (Glutarsäure), (Salze und Ester - Glutorate)
HOOC-(CH 2) 4 -COOH Hexadiinsäure (Adipinsäure), (Salze und Ester - Adipinate)
Merkmale der chemischen Eigenschaften
Dicarbonsäuren ähneln Monocarbonsäuren in vielerlei Hinsicht, sind aber stärker. Beispielsweise ist Oxalsäure fast 200-mal stärker als Essigsäure.
Dicarbonsäuren verhalten sich wie zweibasige Säuren und bilden zwei Salzreihen - sauer und mittel:
HOOC-COOH + NaOH → HOOC-COONa + H 2 O
HOOC-COOH + 2NaOH → NaOOC-COONa + 2H 2 O
Beim Erhitzen werden Oxal- und Malonsäure leicht decarboxyliert: