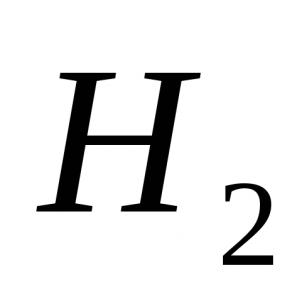Co2 im festen Zustand besteht aus Molekülen. Atomar-molekulare Lehre
Die atommolekulare Theorie wurde von dem großen russischen Wissenschaftler M. V. Lomonosov entwickelt und erstmals in der Chemie angewendet. Die Hauptbestimmungen dieser Lehre sind in dem Werk "Elements of Mathematical Chemistry" (1741) und einer Reihe anderer dargelegt. Die Essenz von Lomonosovs Lehren kann auf die folgenden Bestimmungen reduziert werden.
1. Alle Substanzen bestehen aus "Körperchen" (wie Lomonosov Moleküle nannte).
2. Moleküle bestehen aus "Elementen" (wie Lomonosov Atome nannte).
3. Teilchen – Moleküle und Atome – sind in ständiger Bewegung. Der thermische Zustand von Körpern ist das Ergebnis der Bewegung ihrer Teilchen.
4. Moleküle einfacher Substanzen bestehen aus identischen Atomen, Moleküle komplexer Substanzen bestehen aus verschiedenen Atomen.
67 Jahre nach Lomonosov wandte der englische Wissenschaftler John Dalton die atomistische Lehre in der Chemie an. Er skizzierte die wichtigsten Bestimmungen des Atomismus in dem Buch "The New System of Chemical Philosophy" (1808). Im Kern wiederholt Daltons Lehre die Lehren von Lomonosov. Dalton bestritt jedoch die Existenz von Molekülen in einfachen Substanzen, was im Vergleich zu den Lehren von Lomonosov einen Rückschritt darstellt. Laut Dalton bestehen einfache Substanzen nur aus Atomen und nur komplexe Substanzen - aus "komplexen Atomen" (im modernen Sinne - Molekülen). Die atomar-molekulare Lehre in der Chemie wurde erst Mitte des 19. Jahrhunderts endgültig etabliert. Auf dem internationalen Chemikerkongress 1860 in Karlsruhe wurden Definitionen der Begriffe Molekül und Atom verabschiedet.
Ein Molekül ist das kleinste Teilchen einer bestimmten Substanz, das seine chemischen Eigenschaften hat. Die chemischen Eigenschaften eines Moleküls werden durch seine Zusammensetzung und seinen chemischen Aufbau bestimmt.
Ein Atom ist das kleinste Teilchen eines chemischen Elements, das Teil der Moleküle einfacher und komplexer Substanzen ist. Die chemischen Eigenschaften eines Elements werden durch die Struktur seines Atoms bestimmt. Daraus folgt die den modernen Vorstellungen entsprechende Definition des Atoms:
Ein Atom ist ein elektrisch neutrales Teilchen, das aus einem positiv geladenen Atomkern und negativ geladenen Elektronen besteht.
Gas- und dampfförmige Stoffe sind nach moderner Vorstellung aus Molekülen zusammengesetzt. Im Festkörper bestehen Moleküle nur aus Stoffen, deren Kristallgitter eine molekulare Struktur hat. Die meisten festen anorganischen Stoffe haben keine molekulare Struktur: Ihr Gitter besteht nicht aus Molekülen, sondern aus anderen Teilchen (Ionen, Atomen); sie existieren in Form von Makrokörpern (ein Kristall aus Natriumchlorid, ein Stück Kupfer usw.). Salze, Metalloxide, Diamant, Silizium, Metalle haben keine Molekularstruktur.
Chemische Elemente
Die Atom- und Molekültheorie ermöglichte es, die Grundbegriffe und Gesetze der Chemie zu erklären. Aus Sicht der Atom- und Molekularwissenschaft wird jede einzelne Art von Atom als chemisches Element bezeichnet. Das wichtigste Merkmal eines Atoms ist die positive Ladung seines Kerns, die numerisch gleich der Ordnungszahl des Elements ist. Der Wert der Kernladung dient als Unterscheidungsmerkmal für verschiedene Arten von Atomen, wodurch wir den Begriff eines Elements vollständiger definieren können:
Chemisches Element Eine bestimmte Art von Atom mit der gleichen positiven Kernladung.
107 Elemente sind bekannt. Derzeit wird an der künstlichen Herstellung chemischer Elemente mit höheren Seriennummern gearbeitet.
Alle Elemente werden üblicherweise in Metalle und Nichtmetalle unterteilt. Diese Teilung ist jedoch bedingt. Ein wichtiges Merkmal der Elemente ist ihre Häufigkeit in der Erdkruste, d.h. in der oberen festen Schale der Erde, deren Dicke üblicherweise mit 16 km angenommen wird. Die Verteilung der Elemente in der Erdkruste untersucht die Geochemie, die Wissenschaft von der Chemie der Erde. Der Geochemiker A. P. Vinogradov hat eine Tabelle mit der durchschnittlichen chemischen Zusammensetzung der Erdkruste zusammengestellt. Nach diesen Daten ist das häufigste Element Sauerstoff - 47,2% der Masse der Erdkruste, gefolgt von Silizium - 27,6, Aluminium - 8,80, Eisen -5,10, Kalzium - 3,6, Natrium - 2,64, Kalium - 2,6, Magnesium - 2,10, Wasserstoff - 0,15 %.
Kovalente chemische Bindung, ihre Varianten und Bildungsmechanismen. Eigenschaften einer kovalenten Bindung (Polarität und Bindungsenergie). Ionenverbindung. Metallverbindung. Wasserstoffverbindung
Die Lehre von der chemischen Bindung ist die Grundlage aller theoretischen Chemie.
Eine chemische Bindung ist eine solche Wechselwirkung von Atomen, die sie zu Molekülen, Ionen, Radikalen, Kristallen verbindet.
Es gibt vier Arten von chemischen Bindungen: ionische, kovalente, metallische und Wasserstoff.
Die Einteilung chemischer Bindungen in Typen ist bedingt, da sich alle durch eine gewisse Einheit auszeichnen.
Als Grenzfall einer kovalenten polaren Bindung kann eine ionische Bindung angesehen werden.
Eine metallische Bindung kombiniert die kovalente Wechselwirkung von Atomen mit Hilfe gemeinsamer Elektronen und der elektrostatischen Anziehung zwischen diesen Elektronen und Metallionen.
Bei Stoffen gibt es oft keine Grenzfälle chemischer Bindungen (oder rein chemischer Bindungen).
Beispielsweise wird Lithiumfluorid $LiF$ als ionische Verbindung klassifiziert. Tatsächlich ist die Bindung darin zu 80 %$ ionisch und zu 20 %$ kovalent. Daher ist es offensichtlich richtiger, vom Grad der Polarität (Ionizität) einer chemischen Bindung zu sprechen.
In der Reihe der Halogenwasserstoffe $HF-HCl-HBr-HI-HAt$ nimmt der Polaritätsgrad der Bindung ab, da der Unterschied in den Elektronegativitätswerten der Halogen- und Wasserstoffatome abnimmt und in Astat die Bindung wird fast unpolar $(EO(H) = 2,1; EO(At) = 2,2)$.
In ein und demselben Stoff können verschiedene Arten von Bindungen enthalten sein, zum Beispiel:
- in Basen: zwischen den Sauerstoff- und Wasserstoffatomen in den Hydroxogruppen ist die Bindung polar kovalent und zwischen dem Metall und der Hydroxogruppe ist sie ionisch;
- in Salzen sauerstoffhaltiger Säuren: zwischen dem Nichtmetallatom und dem Sauerstoff des Säurerests - kovalent polar und zwischen dem Metall und dem Säurerest - ionisch;
- in Ammonium-, Methylammoniumsalzen usw.: zwischen Stickstoff- und Wasserstoffatomen – kovalent polar, und zwischen Ammonium- oder Methylammoniumionen und einem Säurerest – ionisch;
- in Metallperoxiden (z. B. $Na_2O_2$) ist die Bindung zwischen Sauerstoffatomen kovalent unpolar, und zwischen Metall und Sauerstoff ist sie ionisch und so weiter.
Verschiedene Arten von Verbindungen können ineinander übergehen:
- während der elektrolytischen Dissoziation von kovalenten Verbindungen in Wasser geht eine kovalente polare Bindung in eine ionische über;
- Beim Verdampfen von Metallen wird die metallische Bindung zu einer kovalenten unpolaren usw.
Der Grund für die Einheit aller Arten und Typen chemischer Bindungen ist ihre identische chemische Natur - Elektron-Kern-Wechselwirkung. Die Bildung einer chemischen Bindung ist in jedem Fall das Ergebnis einer Elektron-Kern-Wechselwirkung von Atomen, begleitet von der Freisetzung von Energie.
Methoden zur Bildung einer kovalenten Bindung. Eigenschaften einer kovalenten Bindung: Bindungslänge und Energie
Eine kovalente chemische Bindung ist eine Bindung, die zwischen Atomen aufgrund der Bildung gemeinsamer Elektronenpaare auftritt.
Der Mechanismus der Bildung einer solchen Bindung kann Austausch und Donor-Akzeptor sein.
ICH. Austauschmechanismus wirkt, wenn Atome gemeinsame Elektronenpaare bilden, indem sie ungepaarte Elektronen kombinieren.
1) $H_2$ - Wasserstoff:
Die Bindung entsteht durch die Bildung eines gemeinsamen Elektronenpaares durch $s$-Elektronen von Wasserstoffatomen (überlappende $s$-Orbitale):

2) $HCl$ - Chlorwasserstoff:
Die Bindung entsteht durch die Bildung eines gemeinsamen Elektronenpaares aus $s-$- und $p-$-Elektronen (überlappende $s-p-$-Orbitale):
3) $Cl_2$: In einem Chlormolekül entsteht durch ungepaarte $p-$Elektronen (überlappende $p-p-$Orbitale) eine kovalente Bindung:

4) $N_2$: Drei gemeinsame Elektronenpaare werden zwischen Atomen in einem Stickstoffmolekül gebildet:
II. Donor-Akzeptor-Mechanismus Betrachten wir die Bildung einer kovalenten Bindung am Beispiel des Ammoniumions $NH_4^+$.

Der Donor hat ein Elektronenpaar, der Akzeptor hat ein leeres Orbital, das dieses Paar besetzen kann. Im Ammoniumion sind alle vier Bindungen mit Wasserstoffatomen kovalent: Drei wurden aufgrund der Bildung gemeinsamer Elektronenpaare durch das Stickstoffatom und die Wasserstoffatome durch den Austauschmechanismus gebildet, eine - durch den Donor-Akzeptor-Mechanismus.
Kovalente Bindungen können nach der Art und Weise klassifiziert werden, in der sich die Elektronenorbitale überlappen, sowie nach ihrer Verschiebung zu einem der gebundenen Atome.
Chemische Bindungen, die als Ergebnis der Überlappung von Elektronenorbitalen entlang der Bindungslinie entstehen, werden als $σ$ bezeichnet -Anleihen (Sigma-Anleihen). Die Sigma-Bindung ist sehr stark.

$p-$-Orbitale können sich in zwei Regionen überlappen und durch seitliche Überlappung eine kovalente Bindung bilden:

Chemische Bindungen, die als Ergebnis der "lateralen" Überlappung von Elektronenorbitalen außerhalb der Kommunikationslinie entstehen, d.h. in zwei Regionen heißen $π$ -Bindungen (pi-Bindungen).
Von Grad der Voreingenommenheit Gemeinsame Elektronenpaare zu einem der Atome, die sie binden, kann eine kovalente Bindung sein Polar- und unpolar.
Eine kovalente chemische Bindung zwischen Atomen mit gleicher Elektronegativität wird genannt unpolar. Elektronenpaare werden zu keinem der Atome verschoben, weil Atome haben das gleiche ER - die Eigenschaft, Valenzelektronen von anderen Atomen zu sich zu ziehen. Zum Beispiel:
jene. durch eine kovalente unpolare Bindung werden Moleküle einfacher nichtmetallischer Substanzen gebildet. Eine kovalente chemische Bindung zwischen Atomen von Elementen, deren Elektronegativität sich unterscheidet, wird als bezeichnet Polar.
Die Länge und Energie einer kovalenten Bindung.
charakteristisch kovalente Bindungseigenschaften ist seine Länge und Energie. Linklänge ist der Abstand zwischen den Atomkernen. Eine chemische Bindung ist umso stärker, je kürzer sie ist. Das Maß der Bindungsstärke ist jedoch Bindungsenergie, die durch die zum Brechen der Bindung erforderliche Energiemenge bestimmt wird. Sie wird üblicherweise in kJ/mol gemessen. So betragen gemäß experimentellen Daten die Bindungslängen der Moleküle $H_2, Cl_2$ und $N_2$ $0.074, 0.198$ bzw. $0.109$ nm und die Bindungsenergien $436, 242$ und $946$ kJ/ mol bzw.
Ionen. Ionenverbindung
Stellen Sie sich vor, dass sich zwei Atome "treffen": ein Metallatom der Gruppe I und ein Nichtmetallatom der Gruppe VII. Ein Metallatom hat ein einzelnes Elektron in seinem äußeren Energieniveau, während einem Nichtmetallatom nur ein Elektron fehlt, um sein äußeres Niveau zu vervollständigen.
Das erste Atom wird dem zweiten sein kernfernes und schwach an ihn gebundenes Elektron leicht überlassen, und das zweite wird ihm einen freien Platz auf seiner äußeren elektronischen Ebene geben.
Dann wird ein Atom, dem eine seiner negativen Ladungen entzogen ist, zu einem positiv geladenen Teilchen, und das zweite wird aufgrund des empfangenen Elektrons zu einem negativ geladenen Teilchen. Solche Teilchen werden genannt Ionen.
Die chemische Bindung, die zwischen Ionen auftritt, wird als ionisch bezeichnet.
Betrachten Sie die Bildung dieser Bindung am Beispiel der bekannten Natriumchloridverbindung (Kochsalz):
Der Prozess der Umwandlung von Atomen in Ionen ist im Diagramm dargestellt:

Eine solche Umwandlung von Atomen in Ionen findet immer während der Wechselwirkung von Atomen typischer Metalle und typischer Nichtmetalle statt.
Betrachten Sie den Algorithmus (Abfolge) der Argumentation, wenn Sie die Bildung einer Ionenbindung beispielsweise zwischen Calcium- und Chloratomen aufzeichnen:

Es werden Zahlen genannt, die die Anzahl der Atome oder Moleküle angeben Koeffizienten, und die Zahlen, die die Anzahl der Atome oder Ionen in einem Molekül angeben, werden genannt Indizes.
Metallverbindung
Machen wir uns damit vertraut, wie die Atome von Metallelementen miteinander interagieren. Metalle liegen normalerweise nicht in Form isolierter Atome vor, sondern in Form eines Stücks, Barrens oder Metallprodukts. Was hält Metallatome zusammen?
Die Atome der meisten Metalle auf der äußeren Ebene enthalten eine kleine Anzahl von Elektronen - 1, 2, 3 $. Diese Elektronen werden leicht abgelöst und die Atome werden in positive Ionen umgewandelt. Die losgelösten Elektronen bewegen sich von einem Ion zum anderen und verbinden sie zu einem einzigen Ganzen. Diese Elektronen verbinden sich mit Ionen und bilden vorübergehend Atome, brechen dann wieder ab und verbinden sich mit einem anderen Ion und so weiter. Folglich werden im Volumen eines Metalls kontinuierlich Atome in Ionen umgewandelt und umgekehrt.
Die Bindung in Metallen zwischen Ionen durch sozialisierte Elektronen wird als metallisch bezeichnet.
Die Abbildung zeigt schematisch die Struktur eines Natriummetallfragments.

In diesem Fall bindet eine kleine Anzahl sozialisierter Elektronen eine große Anzahl von Ionen und Atomen.

Die metallische Bindung hat eine gewisse Ähnlichkeit mit der kovalenten Bindung, da sie auf der gemeinsamen Nutzung äußerer Elektronen beruht. Bei einer kovalenten Bindung werden jedoch nur die äußeren ungepaarten Elektronen zweier benachbarter Atome sozialisiert, während bei einer metallischen Bindung alle Atome an der Sozialisierung dieser Elektronen teilnehmen. Deshalb sind Kristalle mit kovalenter Bindung spröde, während solche mit metallischer Bindung in der Regel plastisch, elektrisch leitfähig und metallisch glänzend sind.
Die metallische Bindung ist charakteristisch sowohl für reine Metalle als auch für Mischungen verschiedener Metalle – Legierungen, die in festem und flüssigem Zustand vorliegen.
Wasserstoffverbindung
Eine chemische Bindung zwischen positiv polarisierten Wasserstoffatomen eines Moleküls (oder eines Teils davon) und negativ polarisierten Atomen stark elektronegativer Elemente mit ungeteilten Elektronenpaaren ($F, O, N$ und seltener $S$ und $Cl$), einem anderen Molekül (oder seine Teile) heißt Wasserstoff.
Der Mechanismus der Wasserstoffbrückenbildung ist teilweise elektrostatisch, teilweise Donor-Akzeptor.
Beispiele für intermolekulare Wasserstoffbrücken:
Bei Vorliegen einer solchen Bindung können auch niedermolekulare Substanzen unter Normalbedingungen Flüssigkeiten (Alkohol, Wasser) oder leicht verflüssigbare Gase (Ammoniak, Fluorwasserstoff) sein.
Substanzen mit einer Wasserstoffbrücke haben molekulare Kristallgitter.
Substanzen molekularer und nichtmolekularer Struktur. Art des Kristallgitters. Die Abhängigkeit der Eigenschaften von Stoffen von ihrer Zusammensetzung und Struktur
Molekulare und nichtmolekulare Struktur von Substanzen
Es sind nicht einzelne Atome oder Moleküle, die chemische Wechselwirkungen eingehen, sondern Substanzen. Ein Stoff kann sich unter gegebenen Bedingungen in einem von drei Aggregatzuständen befinden: fest, flüssig oder gasförmig. Die Eigenschaften eines Stoffes hängen auch von der Art der chemischen Bindung zwischen den ihn bildenden Teilchen ab – Molekülen, Atomen oder Ionen. Nach der Art der Bindung werden Substanzen mit molekularer und nichtmolekularer Struktur unterschieden.
Aus Molekülen aufgebaute Substanzen werden genannt molekulare Substanzen. Die Bindungen zwischen Molekülen in solchen Substanzen sind sehr schwach, viel schwächer als zwischen Atomen innerhalb eines Moleküls, und sie brechen bereits bei relativ niedrigen Temperaturen - die Substanz wird flüssig und dann gasförmig (Jodsublimation). Die Schmelz- und Siedepunkte von Stoffen, die aus Molekülen bestehen, steigen mit zunehmendem Molekulargewicht.
Molekulare Substanzen umfassen Substanzen mit atomarer Struktur ($C, Si, Li, Na, K, Cu, Fe, W$), darunter Metalle und Nichtmetalle.
Betrachten Sie die physikalischen Eigenschaften von Alkalimetallen. Die relativ geringe Bindungsstärke zwischen Atomen verursacht eine geringe mechanische Festigkeit: Alkalimetalle sind weich und können leicht mit einem Messer geschnitten werden.
Die große Größe der Atome führt zu einer geringen Dichte von Alkalimetallen: Lithium, Natrium und Kalium sind sogar leichter als Wasser. In der Gruppe der Alkalimetalle sinken die Siede- und Schmelzpunkte mit zunehmender Ordnungszahl des Elements, weil. Die Größe der Atome nimmt zu und die Bindungen werden schwächer.
Zu Substanzen nicht molekular Strukturen umfassen ionische Verbindungen. Die meisten Verbindungen von Metallen mit Nichtmetallen haben diese Struktur: alle Salze ($NaCl, K_2SO_4$), einige Hydride ($LiH$) und Oxide ($CaO, MgO, FeO$), Basen ($NaOH, KOH$). Ionische (nicht molekulare) Substanzen haben hohe Schmelz- und Siedepunkte.
Kristallgitter
Ein Stoff kann bekanntlich in drei Aggregatzuständen vorliegen: gasförmig, flüssig und fest.
Feststoffe: amorph und kristallin.
Überlegen Sie, wie sich die Merkmale chemischer Bindungen auf die Eigenschaften von Festkörpern auswirken. Feststoffe werden unterteilt in kristallin und amorph.
Amorphe Substanzen haben keinen klaren Schmelzpunkt - beim Erhitzen werden sie allmählich weicher und werden flüssig. Im amorphen Zustand befinden sich beispielsweise Plastilin und verschiedene Harze.
Kristalline Substanzen zeichnen sich durch die richtige Anordnung der Teilchen aus, aus denen sie bestehen: Atome, Moleküle und Ionen - an genau definierten Punkten im Raum. Wenn diese Punkte durch gerade Linien verbunden werden, entsteht ein räumlicher Rahmen, der als Kristallgitter bezeichnet wird. Die Punkte, an denen sich Kristallteilchen befinden, werden Gitterknoten genannt.
Abhängig von der Art der Teilchen, die sich an den Knoten des Kristallgitters befinden, und der Art der Verbindung zwischen ihnen werden vier Arten von Kristallgittern unterschieden: ionisch, atomar, molekular und Metall.
Ionenkristallgitter.
Ionisch sogenannte Kristallgitter, in deren Knoten sich Ionen befinden. Sie werden von Substanzen mit ionischer Bindung gebildet, die sowohl einfache Ionen $Na^(+), Cl^(-)$ als auch komplexe $SO_4^(2−), OH^-$ binden können. Folglich haben Salze, einige Oxide und Hydroxide von Metallen Ionenkristallgitter. Beispielsweise besteht ein Natriumchloridkristall aus abwechselnd $Na^+$ positiven Ionen und $Cl^-$ negativen Ionen, die ein würfelförmiges Gitter bilden. Die Bindungen zwischen Ionen in einem solchen Kristall sind sehr stabil. Substanzen mit einem Ionengitter zeichnen sich daher durch eine relativ hohe Härte und Festigkeit aus, sie sind feuerfest und nicht flüchtig.

Atomare Kristallgitter.
nuklear sogenannte Kristallgitter, in deren Knoten sich einzelne Atome befinden. In solchen Gittern sind die Atome durch sehr starke kovalente Bindungen miteinander verbunden. Ein Beispiel für Substanzen mit einem solchen Kristallgitter ist Diamant, eine der allotropen Modifikationen des Kohlenstoffs.
Die meisten Substanzen mit einem atomaren Kristallgitter haben sehr hohe Schmelzpunkte (zB für Diamant über 3500°C$), sie sind fest und hart, praktisch unlöslich.

Molekulare Kristallgitter.
Molekular sogenannte Kristallgitter, an deren Knoten sich Moleküle befinden. Chemische Bindungen in diesen Molekülen können entweder polar ($HCl, H_2O$) oder unpolar ($N_2, O_2$) sein. Trotz der Tatsache, dass die Atome innerhalb der Moleküle durch sehr starke kovalente Bindungen gebunden sind, gibt es zwischen den Molekülen selbst schwache intermolekulare Anziehungskräfte. Daher haben Substanzen mit molekularen Kristallgittern eine geringe Härte, niedrige Schmelzpunkte und sind flüchtig. Die meisten festen organischen Verbindungen haben molekulare Kristallgitter (Naphthalin, Glucose, Zucker).

Metallische Kristallgitter.
Stoffe mit metallischer Bindung haben metallische Kristallgitter. An den Knoten solcher Gitter befinden sich Atome und Ionen (entweder Atome oder Ionen, in die sich Metallatome leicht verwandeln und ihre Außenelektronen „zur gemeinsamen Nutzung“ abgeben). Eine solche innere Struktur von Metallen bestimmt ihre charakteristischen physikalischen Eigenschaften: Verformbarkeit, Plastizität, elektrische und thermische Leitfähigkeit und einen charakteristischen metallischen Glanz.
Molekulare und nichtmolekulare Struktur von Substanzen. Die Struktur der Materie

Es sind nicht einzelne Atome oder Moleküle, die chemische Wechselwirkungen eingehen, sondern Substanzen. Stoffe werden nach der Art der Bindung unterschieden molekular und nichtmolekulare Struktur. Aus Molekülen aufgebaute Substanzen werden genannt molekulare Substanzen. Die Bindungen zwischen Molekülen in solchen Substanzen sind sehr schwach, viel schwächer als zwischen Atomen innerhalb eines Moleküls, und sie brechen bereits bei relativ niedrigen Temperaturen - die Substanz wird flüssig und dann gasförmig (Jodsublimation). Die Schmelz- und Siedepunkte von Stoffen, die aus Molekülen bestehen, steigen mit zunehmendem Molekulargewicht. Zu molekulare Substanzen umfassen Substanzen mit atomarer Struktur (C, Si, Li, Na, K, Cu, Fe, W), darunter Metalle und Nichtmetalle. Zu Substanzen nichtmolekulare Struktur umfassen ionische Verbindungen. Die meisten Verbindungen von Metallen mit Nichtmetallen haben diese Struktur: alle Salze (NaCl, K 2 SO 4), einige Hydride (LiH) und Oxide (CaO, MgO, FeO), Basen (NaOH, KOH). Ionische (nicht molekulare) Substanzen haben hohe Schmelz- und Siedepunkte.

Feststoffe: amorph und kristallin
Feststoffe werden unterteilt in kristallin und amorph.
Amorphe Substanzen haben keinen klaren Schmelzpunkt - beim Erhitzen werden sie allmählich weicher und werden flüssig. Im amorphen Zustand befinden sich beispielsweise Plastilin und verschiedene Harze.
Kristalline Substanzen zeichnen sich durch die richtige Anordnung der Teilchen aus, aus denen sie bestehen: Atome, Moleküle und Ionen - an genau definierten Punkten im Raum. Wenn diese Punkte durch gerade Linien verbunden werden, entsteht ein räumlicher Rahmen, der als Kristallgitter bezeichnet wird. Die Punkte, an denen sich Kristallteilchen befinden, werden Gitterknoten genannt. Abhängig von der Art der Teilchen, die sich an den Knoten des Kristallgitters befinden, und der Art der Verbindung zwischen ihnen werden vier Arten von Kristallgittern unterschieden: ionische, atomare, molekulare und metallische.
Kristallgitter werden als ionisch bezeichnet, an deren Stellen sich Ionen befinden. Sie werden von Substanzen mit einer Ionenbindung gebildet, die sowohl mit einfachen Ionen Na +, Cl - als auch mit komplexen SO 4 2-, OH - assoziiert sein kann. Folglich haben Salze, einige Oxide und Hydroxide von Metallen Ionenkristallgitter. Beispielsweise ist ein Natriumchloridkristall aus abwechselnd positiven Na + - und negativen Cl – -Ionen aufgebaut, die ein würfelförmiges Gitter bilden. Die Bindungen zwischen Ionen in einem solchen Kristall sind sehr stabil. Substanzen mit einem Ionengitter zeichnen sich daher durch eine relativ hohe Härte und Festigkeit aus, sie sind feuerfest und nicht flüchtig.
Kristallgitter - a) und amorphes Gitter - b).
 Kristallgitter - a) und amorphes Gitter - b).
Kristallgitter - a) und amorphes Gitter - b). Atomare Kristallgitter
nuklear sogenannte Kristallgitter, in deren Knoten sich einzelne Atome befinden. In solchen Gittern sind Atome miteinander verbunden sehr starke kovalente Bindungen. Ein Beispiel für Substanzen mit einem solchen Kristallgitter ist Diamant, eine der allotropen Modifikationen des Kohlenstoffs. Die meisten Substanzen mit einem atomaren Kristallgitter haben sehr hohe Schmelzpunkte (zum Beispiel in Diamant sind es über 3500 ° C), sie sind fest und hart, praktisch unlöslich.


Molekulare Kristallgitter
Molekular sogenannte Kristallgitter, an deren Knoten sich Moleküle befinden. Chemische Bindungen in diesen Molekülen können sowohl polar (HCl, H 2 O) als auch unpolar (N 2 , O 2) sein. Trotz der Tatsache, dass Atome innerhalb von Molekülen durch sehr starke kovalente Bindungen gebunden sind, Zwischen den Molekülen selbst wirken schwache intermolekulare Anziehungskräfte. Daher haben Substanzen mit molekularen Kristallgittern eine geringe Härte, niedrige Schmelzpunkte und sind flüchtig. Die meisten festen organischen Verbindungen haben molekulare Kristallgitter (Naphthalin, Glucose, Zucker).
 Molekulares Kristallgitter (Kohlendioxid)
Molekulares Kristallgitter (Kohlendioxid) Metallische Kristallgitter
Substanzen mit metallische Bindung haben metallische Kristallgitter. An den Knoten solcher Gitter befinden sich Atome und Ionen(entweder Atome oder Ionen, in die sich Metallatome leicht verwandeln und ihre Außenelektronen „zur allgemeinen Verwendung“ abgeben). Eine solche innere Struktur von Metallen bestimmt ihre charakteristischen physikalischen Eigenschaften: Verformbarkeit, Plastizität, elektrische und thermische Leitfähigkeit und einen charakteristischen metallischen Glanz.

Spickzettel


Ein Molekül, bei dem die Schwerpunkte der positiv und negativ geladenen Abschnitte nicht zusammenfallen, nennt man Dipol. Lassen Sie uns das Konzept des "Dipols" definieren.
Ein Dipol ist eine Ansammlung von zwei gleichen elektrischen Ladungen entgegengesetzter Größe, die sich in einiger Entfernung voneinander befinden.
Das Wasserstoffmolekül H 2 ist kein Dipol (Abb. 50 a), und das Chlorwasserstoffmolekül ist ein Dipol (Abb. 50 b). Auch das Wassermolekül ist ein Dipol. Die Elektronenpaare in H 2 O werden stärker von den Wasserstoffatomen zum Sauerstoffatom verschoben.
Der Schwerpunkt der negativen Ladung befindet sich in der Nähe des Sauerstoffatoms und der Schwerpunkt der positiven Ladung befindet sich in der Nähe der Wasserstoffatome.
In einer kristallinen Substanz befinden sich Atome, Ionen oder Moleküle in einer strengen Ordnung.
Der Ort, an dem sich ein solches Teilchen befindet, wird genannt Knoten des Kristallgitters. Die Position von Atomen, Ionen oder Molekülen in den Knoten des Kristallgitters ist in Abb. 1 dargestellt. 51.
im g
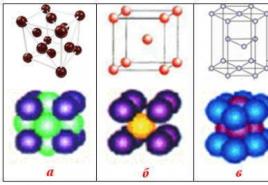
Reis. 51. Modelle von Kristallgittern (eine Ebene eines massiven Kristalls ist gezeigt): a) kovalent oder atomar (Diamant C, Silizium Si, Quarz SiO 2); b) ionisch (NaCl); in) molekular (Eis, I 2); G) metallisch (Li, Fe). Im Metallgittermodell bezeichnen Punkte Elektronen
Je nach Art der chemischen Bindung zwischen Partikeln werden Kristallgitter in kovalente (atomare), ionische und metallische Gitter unterteilt. Es gibt eine andere Art von Kristallgitter - molekular. In einem solchen Gitter werden einzelne Moleküle festgehalten zwischenmolekulare Anziehungskräfte.
Ionenkristalle(Abb. 51 b) enthalten an den Stellen des Kristallgitters positiv und negativ geladene Ionen. Das Kristallgitter ist so aufgebaut, dass die elektrostatischen Anziehungskräfte entgegengesetzt geladener Ionen und die Abstoßungskräfte gleich geladener Ionen ausgeglichen sind. Solche Kristallgitter sind charakteristisch für Verbindungen wie LiF, NaCl und viele andere.
molekulare Kristalle(Abb. 51 in) enthalten an den Stellen des Kristalls Dipolmoleküle, die wie Ionen in einem Ionenkristallgitter durch elektrostatische Anziehungskräfte relativ zueinander gehalten werden. Zum Beispiel ist Eis ein molekulares Kristallgitter, das von Wasserdipolen gebildet wird. Auf Abb. 51 in die Symbole werden für die Ladungen nicht angegeben, um die Figur nicht zu überladen.
Kristall aus Metall(Abb. 51 G) enthält an den Gitterplätzen positiv geladene Ionen. Einige der äußeren Elektronen bewegen sich frei zwischen den Ionen. " E-Gas"hält positiv geladene Ionen in den Knoten des Kristallgitters. Beim Aufprall sticht das Metall nicht wie Eis, Quarz oder ein Salzkristall, sondern ändert nur seine Form. Elektronen haben aufgrund ihrer Beweglichkeit im Moment Zeit, sich zu bewegen des Aufpralls und halten Ionen in einer neuen Position.Deshalb biegen sich Metalle und Kunststoffe, ohne zu brechen.
Reis. 52. Die Struktur von Siliziumoxid: a) kristallin; b) amorph. Schwarze Punkte bezeichnen Siliziumatome, offene Kreise bezeichnen Sauerstoffatome. Die Ebene des Kristalls ist dargestellt, daher ist die vierte Bindung am Siliziumatom nicht angegeben. Die gestrichelte Linie markiert die Nahordnung in der Unordnung einer amorphen Substanz
Bei einer amorphen Substanz ist die für den kristallinen Zustand charakteristische dreidimensionale Periodizität der Struktur verletzt (Abb. 52 b).
Flüssigkeiten und Gase unterscheiden sich von kristallinen und amorphen Körpern durch die zufällige Bewegung von Atomen und
Moleküle. In Flüssigkeiten sind Anziehungskräfte in der Lage, Mikropartikel in engen Abständen relativ zueinander zu halten, die den Abständen in einem Festkörper entsprechen. In Gasen fehlt praktisch die Wechselwirkung von Atomen und Molekülen, daher nehmen Gase im Gegensatz zu Flüssigkeiten das gesamte ihnen zur Verfügung gestellte Volumen ein. Ein Mol flüssiges Wasser nimmt bei 100 0 C ein Volumen von 18,7 cm 3 ein und ein Mol gesättigter Wasserdampf 30.000 cm 3 bei gleicher Temperatur. 
Reis. 53. Verschiedene Arten der Wechselwirkung von Molekülen in Flüssigkeiten und Gasen: a) Dipol–Dipol; b) Dipol–Nicht-Dipol; in) Nicht-Dipol – Nicht-Dipol
Im Gegensatz zu Festkörpern bewegen sich Moleküle in Flüssigkeiten und Gasen frei. Durch die Bewegung werden sie auf eine bestimmte Weise orientiert. Zum Beispiel in Abb. 53 ein, b. es wird gezeigt, wie Dipolmoleküle sowie unpolare Moleküle mit Dipolmolekülen in Flüssigkeiten und Gasen wechselwirken.
Wenn sich ein Dipol einem Dipol nähert, drehen sich die Moleküle aufgrund von Anziehung und Abstoßung. Der positiv geladene Teil eines Moleküls befindet sich in der Nähe des negativ geladenen Teils eines anderen. So interagieren Dipole in flüssigem Wasser.
Wenn sich zwei unpolare Moleküle (Nicht-Dipole) in ziemlich geringem Abstand nähern, beeinflussen sie sich auch gegenseitig (Abb. 53 in). Moleküle werden durch negativ geladene Elektronenhüllen zusammengebracht, die die Kerne bedecken. Die Elektronenhüllen werden so verformt, dass in beiden Molekülen vorübergehend positive und negative Zentren auftreten, die sich gegenseitig anziehen. Es genügt, dass sich die Moleküle auflösen, da temporäre Dipole wieder zu unpolaren Molekülen werden.
Ein Beispiel ist die Wechselwirkung zwischen Molekülen von gasförmigem Wasserstoff. (Abb. 53 in).
3.2. Klassifizierung anorganischer Stoffe. Einfache und komplexe Substanzen
Zu Beginn des 19. Jahrhunderts schlug der schwedische Chemiker Berzelius vor, Substanzen zu nennen, die aus lebenden Organismen gewonnen werden organisch. Es wurden Stoffe benannt, die für die unbelebte Natur charakteristisch sind anorganisch oder Mineral(abgeleitet von Mineralien).
Alle festen, flüssigen und gasförmigen Stoffe lassen sich in einfache und komplexe einteilen.
Substanzen werden einfach genannt und bestehen aus Atomen eines chemischen Elements.
Beispielsweise sind Wasserstoff, Brom und Eisen bei Raumtemperatur und atmosphärischem Druck einfache Substanzen, die jeweils in gasförmigem, flüssigem und festem Zustand vorliegen (Abb. 54 ein BC).
Gasförmiger Wasserstoff H 2 (g) und flüssiges Brom Br 2 (l) bestehen aus zweiatomigen Molekülen. Festes Eisen Fe(t) liegt in Form eines Kristalls mit einem metallischen Kristallgitter vor.
Einfache Substanzen werden in zwei Gruppen eingeteilt: Nichtmetalle und Metalle.
a) b) in)
Reis. 54. Einfache Substanzen: a) gasförmiger Wasserstoff. Da es leichter als Luft ist, wird das Reagenzglas verschlossen und auf den Kopf gestellt; b) flüssiges Brom (normalerweise in versiegelten Ampullen aufbewahrt); in) Eisenpulver
Nichtmetalle sind einfache Substanzen mit einem kovalenten (atomaren) oder molekularen Kristallgitter im festen Zustand.
Bei Raumtemperatur ist ein kovalentes (atomares) Kristallgitter charakteristisch für solche Nichtmetalle wie Bor B(t), Kohlenstoff C(t), Silizium Si(t). Das Molekülkristallgitter hat weißen Phosphor P (t), Schwefel S (t), Jod I 2 (t). Manche Nichtmetalle gehen erst bei sehr tiefen Temperaturen in einen flüssigen oder festen Aggregatzustand über. Unter normalen Bedingungen sind sie Gase. Solche Substanzen umfassen beispielsweise Wasserstoff H 2 (g), Stickstoff N 2 (g), Sauerstoff O 2 (g), Fluor F 2 (g), Chlor Cl 2 (g), Helium He (g), Neon Ne (d), Argon Ar(d). Bei Raumtemperatur liegt molekulares Brom Br 2 (l) in flüssiger Form vor.
Metalle sind einfache Substanzen mit einem metallischen Kristallgitter im festen Zustand.
Dies sind formbare, duktile Substanzen, die einen metallischen Glanz haben und in der Lage sind, Wärme und Strom zu leiten.
Ungefähr 80 % der Elemente des Periodensystems bilden einfache Substanzen – Metalle. Bei Raumtemperatur sind Metalle Festkörper. Zum Beispiel Li(t), Fe(t). Nur Quecksilber, Hg (l) ist eine Flüssigkeit, die sich bei -38,89 0 С verfestigt.
Verbindungen sind Substanzen, die aus Atomen verschiedener chemischer Elemente aufgebaut sind.
Die Atome der Elemente in einer komplexen Substanz sind durch konstante und wohldefinierte Beziehungen verbunden.
Beispielsweise ist Wasser H 2 O eine komplexe Substanz. Sein Molekül enthält Atome von zwei Elementen. Wasser enthält immer und überall auf der Erde 11,1 Massenprozent Wasserstoff und 88,9 Massenprozent Sauerstoff.
Je nach Temperatur und Druck kann Wasser in einem festen, flüssigen oder gasförmigen Zustand vorliegen, was rechts neben der chemischen Formel des Stoffes angegeben ist - H 2 O (g), H 2 O (g), H 2 O ( t).
In der Praxis haben wir es in der Regel nicht mit Reinstoffen zu tun, sondern mit deren Mischungen.
Ein Gemisch ist eine Ansammlung chemischer Verbindungen unterschiedlicher Zusammensetzung und Struktur
Stellen wir einfache und komplexe Stoffe sowie deren Mischungen in Form eines Diagramms dar:
Einfach
Nichtmetalle
Emulsionen
Stiftungen
Komplexe Substanzen in der anorganischen Chemie werden in Oxide, Basen, Säuren und Salze unterteilt.
Oxide
Es gibt Oxide von Metallen und Nichtmetallen. Metalloxide sind Verbindungen mit ionischen Bindungen. Im festen Zustand bilden sie Ionenkristallgitter.
Nichtmetalloxide- Verbindungen mit kovalenten chemischen Bindungen.
Oxide sind komplexe Substanzen, die aus Atomen zweier chemischer Elemente bestehen, von denen eines Sauerstoff ist, dessen Oxidationsstufe -2 ist.
Nachfolgend sind die Molekular- und Strukturformeln einiger Oxide von Nichtmetallen und Metallen aufgeführt.
Summenformel Strukturformel
CO 2 - Kohlenmonoxid (IV) O \u003d C \u003d O
 SO 2 - Schwefeloxid (IV)
SO 2 - Schwefeloxid (IV)
SO 3 - Schwefeloxid (VI)
SiO 2 - Siliziumoxid (IV)
Na 2 O - Natriumoxid
CaO - Calciumoxid
K 2 O - Kaliumoxid, Na 2 O - Natriumoxid, Al 2 O 3 - Aluminiumoxid. Kalium, Natrium und Aluminium bilden jeweils ein Oxid.
Wenn ein Element mehrere Oxidationsstufen hat, gibt es mehrere seiner Oxide. Dabei wird nach dem Namen des Oxids der Oxidationsgrad des Elements durch eine römische Zahl in Klammern angegeben. Beispielsweise ist FeO Eisen(II)-oxid, Fe 2 O 3 ist Eisen(III)-oxid.
Zusätzlich zu den nach den Regeln der internationalen Nomenklatur gebildeten Namen werden traditionelle russische Namen von Oxiden verwendet, zum Beispiel: CO 2 Kohlenmonoxid (IV) - Kohlendioxid, CO Kohlenmonoxid (II) – Kohlenmonoxid, CaO Calciumoxid - Branntkalk, SiO 2 Siliziumoxid– Quarz, Kieselerde, Sand.
Es gibt drei Gruppen von Oxiden, die sich in ihren chemischen Eigenschaften unterscheiden, - basisch, sauer und amphoter(anderes Griechisch , - beide, dual).
Basische Oxide gebildet durch Elemente der Hauptuntergruppen der Gruppen I und II des Periodensystems (die Oxidationsstufe der Elemente ist +1 und +2) sowie Elemente sekundärer Untergruppen, deren Oxidationsstufe ebenfalls +1 oder + ist 2. Alle diese Elemente sind Metalle, also basische Oxide sind Metalloxide, Zum Beispiel:
Li 2 O - Lithiumoxid
MgO - Magnesiumoxid
CuO - Kupfer (II) -oxid
Basische Oxide entsprechen Basen.
Säureoxide
gebildet durch Nichtmetalle und Metalle, deren Oxidationsstufe größer als +4 ist, zum Beispiel:
CO 2 - Kohlenmonoxid (IV)
SO 2 - Schwefeloxid (IV)
SO 3 - Schwefeloxid (VI)
P 2 O 5 - Phosphoroxid (V)
Säureoxide entsprechen Säuren.
Amphotere Oxide
gebildet durch Metalle, deren Oxidationsstufe +2, +3, manchmal +4 ist, zum Beispiel:
ZnO - Zinkoxid
Al 2 O 3 - Aluminiumoxid
Amphotere Oxide entsprechen amphoteren Hydroxiden.
Darüber hinaus gibt es eine kleine Gruppe von sog indifferente Oxide:
N 2 O - Stickoxid (I)
NO - Stickoxid (II)
CO - Kohlenmonoxid (II)
Es sollte beachtet werden, dass eines der wichtigsten Oxide auf unserem Planeten Wasserstoffoxid ist, das Ihnen als Wasser H 2 O bekannt ist.
Stiftungen
Im Abschnitt „Oxide“ wurde erwähnt, dass Basen basischen Oxiden entsprechen:
Natriumoxid Na 2 O - Natriumhydroxid NaOH.
Calciumoxid CaO - Calciumhydroxid Ca (OH) 2.
Kupferoxid CuO - Kupferhydroxid Cu (OH) 2
Basen sind komplexe Substanzen, die aus einem Metallatom und einer oder mehreren Hydroxogruppen -OH bestehen.
Basen sind Festkörper mit einem ionischen Kristallgitter.
Beim Auflösen in Wasser entstehen Kristalle löslicher Basen ( Laugen) werden durch die Einwirkung polarer Wassermoleküle zerstört und es entstehen Ionen:
NaOH(t) Na + (Lösung) + OH - (Lösung)
Eine ähnliche Aufzeichnung von Ionen: Na + (Lösung) oder OH – (Lösung) bedeutet, dass die Ionen in Lösung sind.
Der Name der Stiftung enthält das Wort Hydroxid und der russische Name des Metalls im Genitiv. Beispielsweise ist NaOH Natriumhydroxid, Ca(OH) 2 ist Calciumhydroxid.
Bildet das Metall mehrere Basen, so wird die Oxidationsstufe des Metalls im Namen mit einer römischen Ziffer in Klammern angegeben. Zum Beispiel: Fe (OH) 2 - Eisen (II) -hydroxid, Fe (OH) 3 - Eisen (III) -hydroxid.
Darüber hinaus gibt es traditionelle Namen für einige Gründe:
NaOH- Natronlauge, Ätzmittel Sprudel
KOH - Ätzkali
Ca(OH)2- gelöschter Kalk, Kalkwasser
R
Wasserlösliche Basen genannt Laugen
Unterscheiden lösliche und unlösliche Basen in Wasser.
Dies sind Metallhydroxide der Hauptuntergruppen der Gruppen I und II, mit Ausnahme der Hydroxide von Be und Mg.
Amphotere Hydroxide umfassen:
HCl (g) H + (Lösung) + Cl - (Lösung)
Säuren werden komplexe Substanzen genannt, die Wasserstoffatome enthalten, die ersetzt oder gegen Metallatome ausgetauscht werden können, und Säurereste.
Abhängig von der Anwesenheit oder Abwesenheit von Sauerstoffatomen im Molekül, anoxisch und sauerstoffhaltig Säuren.
Um sauerstofffreie Säuren zu benennen, wird dem russischen Namen eines Nichtmetalls ein Buchstabe hinzugefügt - Über- und das Wort Wasserstoff :
HF - Flusssäure
HCl - Salzsäure
HBr - Bromwasserstoffsäure
HI - Jodwasserstoffsäure
H 2 S - Schwefelwasserstoffsäure
Traditionelle Namen für einige Säuren:
HCl- Salzsäure; HF- Fluorwasserstoffsäure
Um sauerstoffhaltige Säuren zu benennen, werden der Wurzel des russischen Namens eines Nichtmetalls Endungen hinzugefügt - naja,
-owaja wenn sich das Nichtmetall in der höchsten Oxidationsstufe befindet. Die höchste Oxidationsstufe stimmt mit der Nummer der Gruppe überein, in der sich das Nichtmetallelement befindet:
H 2 SO 4 - ser nein Säure
HNO 3 - Stickstoff nein Säure
HClO 4 - Chlor nein Säure
HMnO 4 - Mangan Neu Säure
Wenn ein Element Säuren in zwei Oxidationsstufen bildet, wird die Endung verwendet, um die Säure zu benennen, die der niedrigeren Oxidationsstufe des Elements entspricht - wahr:
H 2 SO 3 - Gämse wahr Säure
HNO 2 - Stickstoff wahr Säure
Je nach Anzahl der Wasserstoffatome in einem Molekül monobasisch(HCl, HNO3), zweibasisch(H 2 SO 4), tribasisch Säuren (H 3 PO 4).
Viele sauerstoffhaltige Säuren entstehen durch die Wechselwirkung der entsprechenden sauren Oxide mit Wasser. Das Oxid, das einer bestimmten Säure entspricht, wird als ihr bezeichnet Anhydrid:
Schwefeldioxid SO 2 - schweflige Säure H 2 SO 3
Schwefelsäureanhydrid SO 3 - Schwefelsäure H 2 SO 4
Salpetriges Anhydrid N 2 O 3 - salpetrige Säure HNO 2
Salpetersäureanhydrid N 2 O 5 - Salpetersäure HNO 3
Phosphorsäureanhydrid P 2 O 5 - Phosphorsäure H 3 PO 4
Beachten Sie, dass die Oxidationsstufen eines Elements im Oxid und der entsprechenden Säure gleich sind.
Bildet ein Element in gleicher Oxidationsstufe mehrere sauerstoffhaltige Säuren, so wird dem Namen der Säure mit dem geringeren Gehalt an Sauerstoffatomen das Präfix „“ vorangestellt. Meta", mit hohem Sauerstoffgehalt - Präfix " orth". Zum Beispiel:
HPO 3 - Metaphosphorsäure
H 3 PO 4 - Orthophosphorsäure, die oft einfach als Phosphorsäure bezeichnet wird
H 2 SiO 3 - Metakieselsäure, üblicherweise Kieselsäure genannt
H 4 SiO 4 - Orthokieselsäure.
Kieselsäuren entstehen nicht durch die Wechselwirkung von SiO 2 mit Wasser, sie werden auf anderem Wege gewonnen.
Mit
Salze sind komplexe Substanzen, die aus Metallatomen und Säureresten bestehen.
oli
NaNO 3 - Natriumnitrat
CuSO 4 - Kupfersulfat (II)
CaCO 3 - Calciumcarbonat
Beim Auflösen in Wasser werden Salzkristalle zerstört, Ionen entstehen:
NaNO 3 (t) Na + (Lösung) + NO 3 - (Lösung).
Salze können als Produkte des vollständigen oder teilweisen Ersatzes von Wasserstoffatomen in einem Säuremolekül durch Metallatome oder als Produkte des vollständigen oder teilweisen Ersatzes basischer Hydroxogruppen durch Säurereste betrachtet werden.
Mit dem vollständigen Austausch von Wasserstoffatomen mittlere Salze: Na 2 SO 4, MgCl 2. . Bei teilweiser Substitution saure Salze (Hydrosalze) NaHSO4 und basische Salze (Hydroxosalze) MgOHCI.
Nach den Regeln der internationalen Nomenklatur werden die Namen von Salzen aus dem Namen des Säurerests im Nominativ und dem russischen Namen des Metalls im Genitiv gebildet (Tabelle 12):
NaNO 3 - Natriumnitrat
CuSO 4 - Kupfer(II)sulfat
CaCO 3 - Calciumcarbonat
Ca 3 (RO 4) 2 - Calciumorthophosphat
Na 2 SiO 3 - Natriumsilikat
Der Name des Säurerests leitet sich aus der Wurzel des lateinischen Namens des säurebildenden Elements (z. B. Nitrogenium - Stickstoff, die Wurzel nitr-) und den Endungen ab:
-beim für die höchste Oxidationsstufe, -es für eine niedrigere Oxidationsstufe des säurebildenden Elements (Tabelle 12).
Tabelle 12
Namen von Säuren und Salzen
| Name der Säure | Säureformel | Der Name der Salze | Beispiele Soleil |
| Chlorwasserstoff (Salz) | HCl | Chloride | AgCl Silberchlorid |
| Schwefelwasserstoff | H 2 S | Sulfide | FeS Sulf Ich würde Eisen(II) |
| schwefelhaltig | H2SO3 | Sulfite | Na 2 SO 3 Sulf es Natrium |
| Schwefel | H2SO4 | Sulfate | K 2 SO 4 Sulf beim Kalium |
| stickstoffhaltig | HNO 2 | Nitrite | LiNO 2 Nitr es Lithium |
| Stickstoff | HNO3 | Nitrate | Al(NO 3 ) 3 Nitr beim Aluminium |
| Orthophosphorsäure | H3PO4 | Orthophosphate | Ca 3 (PO 4) 2 Calciumorthophosphat |
| Kohle | H2CO3 | Karbonate | Na 2 CO 3 Natriumcarbonat |
| Silizium | H2SiO3 | Silikate | Na 2 SiO 3 Natriumsilikat |
NaHSO 4 - Natriumhydrogensulfat
NaHS - Natriumhydrogensulfid
Die Namen basischer Salze werden gebildet, indem das Präfix " hydroxo": MgOHCl - Magnesiumhydroxochlorid.
Darüber hinaus haben viele Salze traditionelle Namen, wie zum Beispiel:
Na 2 CO 3 - Sprudel;
NaHCO3 - Essen (Trinken) Soda;
CaCO 3 - Kreide, Marmor, Kalkstein.