Koncentrēta sērskābe: īpašības, reakcijas. Sērskābe Sērskābes vārīšanās temperatūra no spiediena
Fizikālās īpašības.Tīra 100% sērskābe (monohidrāts) ir bezkrāsains eļļains šķidrums, kas + 10 ° C temperatūrā sacietē kristāliskā masā. Reaktīvās sērskābes blīvums parasti ir 1,84 g / cm 3, un tā satur apmēram 95% H 2 SO 4. Tas sacietē tikai zem -20 ° С.
Monohidrāta kušanas temperatūra ir 10,37 ° C pie kausēšanas siltuma 10,5 kJ / mol. Normālos apstākļos tas ir ļoti viskozs šķidrums ar ļoti augstu dielektrisko konstanti (e \u003d 100 pie 25 ° C). Nenozīmīga monohidrāta iekšējā elektrolītiskā disociācija notiek paralēli divos virzienos: [Н 3 SO 4 +] · [НSO 4 -] \u003d 2 · 10 -4 un [Н 3 О +] · [НS 2 О 7 -] \u003d 4 · 10 - pieci. Tās molekulāro jonu sastāvu var aptuveni raksturot ar šādiem datiem (%):
|
Pievienojot pat nelielu daudzumu ūdens, saskaņā ar shēmu dominē disociācija:
H 2 O + H 2 SO 4<==> H 3 O + + HSO 4 -
Ķīmiskās īpašības.
H 2 SO 4 ir spēcīga divdabskābe.
H 2 SO 4<--> H + + HSO 4 -<--> 2H + + SO4 2-
Pirmais posms (vidējas koncentrācijas gadījumā) izraisa 100% disociāciju:
K2 \u003d (·) / \u003d 1,2 · 10 -2
1) Mijiedarbība ar metāliem:
a) atšķaidīta sērskābe izšķīdina tikai metālus, kas stāv spriegumu virknē pa kreisi no ūdeņraža:
Zn 0 + H 2 +1 SO 4 (sadalīts) -\u003e Zn +2 SO 4 + H 2 O
b) koncentrēts H 2 + 6 SO 4 ir spēcīgs oksidētājs; mijiedarbojoties ar metāliem (izņemot Au, Pt), to var reducēt līdz S +4 O 2, S 0 vai H 2 S -2 (Fe, Al, Cr arī nereaģē bez karsēšanas - tie ir pasivēti):
2Ag 0 + 2H 2 +6 SO 4 -\u003e Ag 2 +1 SO 4 + S +4 O 2 + 2H 2 O
8Na 0 + 5H 2 +6 SO 4 -\u003e 4Na 2 +1 SO 4 + H 2 S -2 + 4H 2 O
2) koncentrēts H2S +6O4 reaģē sildot ar daži nemetāli spēcīgo oksidējošo īpašību dēļ pārvēršoties sēra savienojumos ar zemāku oksidācijas pakāpi (piemēram, S +4 O 2)
C0 + 2H2S +6O4 (konc) -\u003e C +4O2 + 2S +4O2 + 2H2O
S0 + 2H2S +6O4 (konc) -\u003e 3S +4O2 + 2H20
2P 0 + 5H 2S +6 O4 (konc) -\u003e 5S +4O2 + 2H3P +5O4 + 2H2O
3) ar bāzes oksīdiem:
CuO + H2S04 -\u003e CuSO4 + H2O
CuO + 2H + -\u003e Cu2 + + H20
4) ar hidroksīdiem:
H2S04 + 2NaOH -\u003e Na2S04 + 2H2O
H + + OH - -\u003e H20
H 2SO 4 + Cu (OH) 2 -\u003e CuSO 4 + 2H 2 O
2H + + Cu (OH) 2 -\u003e Cu2 + + 2H20
5) apmainās ar reakcijām ar sāļiem:
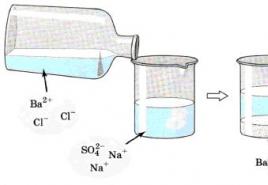
BaCl2 + H2SO4 -\u003e BaSO4 + 2HCl
Ba 2+ + SO 4 2- -\u003e BaSO 4
Balto BaSO 4 nogulsņu veidošanos (nešķīst skābēs) izmanto, lai identificētu sērskābi un šķīstošos sulfātus.
Monohidrāts (tīrs, 100% sērskābe) ir jonizējošs šķīdinātājs ar skābu raksturu. Tajā izšķīst daudzu metālu sulfāti (pārejot bisulfātos), savukārt citu skābju sāļi parasti izšķīst tikai tad, ja to solvolīze ir iespējama (ar pārvēršanos bisulfātos). Slāpekļskābe monohidrātā darbojas kā vāja bāze
HNO 3 + 2 H 2 SO 4<==> H 3 O + + NO 2 + + 2 HSO 4 -
perhlors - kā ļoti vāja skābe
H2S04 + HClO4 \u003d H3S04 + + ClO4 -
Fluorsulfoskābes un hlorsulfoskābes ir nedaudz spēcīgākas (HSO 3 F\u003e HSO 3 Cl\u003e HClO 4). Monohidrāts labi izšķīdina daudzas organiskās vielas, kas satur atomus ar vientuļiem elektronu pāriem (kas spēj piesaistīt protonu). Pēc tam dažus no tiem var nemainīti izolēt, vienkārši atšķaidot šķīdumu ar ūdeni. Monohidrātam ir augsta krioskopiskā konstante (6.12 °), un to dažreiz izmanto kā barotni molekulmasas noteikšanai.
Koncentrēts H 2 SO 4 ir diezgan spēcīgs oksidētājs, īpaši sildot (parasti reducē līdz SO 2). Piemēram, tas oksidē HI un daļēji HBr (bet ne HCl) līdz brīvajiem halogēniem. Tas oksidē arī daudzus metālus - Cu, Hg utt. (Savukārt zelts un platīns ir stabili attiecībā pret H 2 SO 4). Tātad mijiedarbība ar varu notiek saskaņā ar vienādojumu:
Cu + 2 H 2 SO 4 \u003d CuSO 4 + SO 2 + H 2 O
Darbojoties kā oksidētājs, sērskābe parasti tiek reducēta līdz SO 2. Tomēr ar visspēcīgākajiem reducētājiem to var reducēt līdz S un pat H 2 S. Koncentrēta sērskābe reaģē ar sērūdeņradi saskaņā ar vienādojumu:
H2S04 + H2S \u003d 2H2O + SO2 + S
Jāatzīmē, ka to daļēji reducē arī gāzveida ūdeņradis, un tāpēc to nevar izmantot tā žāvēšanai.

Attēls: 13. Sērskābes šķīdumu elektrovadītspēja.
Koncentrētas sērskābes izšķīdināšana ūdenī notiek ar ievērojamu siltuma izdalīšanos (un zināmu sistēmas kopējā tilpuma samazināšanos). Monohidrāts gandrīz nevada elektrību. Turpretim sērskābes ūdens šķīdumi ir labi vadītāji. Kā redzams zīm. 13, aptuveni 30% skābes ir maksimālā elektrovadītspēja. Līknes minimums atbilst kompozīcijas H 2 SO 4 · H 2 O hidrātam.
Siltuma izdalīšanās, izšķīdinot monohidrātu ūdenī, ir (atkarībā no šķīduma galīgās koncentrācijas) līdz 84 kJ / mol H 2 SO 4. Gluži pretēji, sajaucot 66% sērskābi, kas iepriekš atdzesēta līdz 0 ° C, ar sniegu (1: 1 pēc svara), temperatūru var samazināt līdz -37 ° C.
H2S04 ūdens šķīdumu blīvuma izmaiņas ar koncentrāciju (masas%) ir norādītas zemāk:
|
|
Kā redzams no šiem datiem, sērskābes koncentrācijas noteikšana virs 90 svara% pēc blīvuma. % kļūst ļoti neprecīzs.
Ūdens tvaiku spiediens virs dažādu koncentrāciju H 2 SO 4 šķīdumiem dažādās temperatūrās parādīts attēlā. 15. Sērskābe var darboties kā žāvētājs tikai tik ilgi, kamēr ūdens tvaiku spiediens virs tā šķīduma ir mazāks par tā daļējo spiedienu žāvētajā gāzē.

Attēls: 15. Ūdens tvaiku spiediens.

Attēls: 16. Viršanas punkti virs H 2 SO 4 šķīdumiem. H 2 SO 4 šķīdumi.
Vārot atšķaidītu sērskābes šķīdumu, ūdens tiek destilēts, un viršanas temperatūra paaugstinās līdz 337 ° C, kad sāk destilēt 98,3% H 2 SO 4 (16. attēls). Gluži pretēji, sēra anhidrīda pārpalikums iztvaiko no koncentrētākiem šķīdumiem. Sērskābes tvaiki, kas vārās 337 ° C temperatūrā, daļēji sadalās H 2 O un SO 3, kas pēc atdzesēšanas atkal apvienojas. Augsta sērskābes viršanas temperatūra ļauj to izmantot, sildot, gaistošās skābes no sāļiem (piemēram, HCl no NaCl).
Saņemšana.
Monohidrātu var iegūt, kristalizējot koncentrētu sērskābi -10 ° C temperatūrā.
Sērskābes ražošana.
1. posms. Pirīta krāsns.
4FeS 2 + 11O2 -\u003e 2Fe2O3 + 8SO2 + Q
Process ir neviendabīgs:
1) dzelzs pirīta (pirīta) malšana
2) "lejasdaļas" metode
3) 800 ° C; liekā siltuma noņemšana
4) skābekļa koncentrācijas palielināšanās gaisā
2. posms. Pēc attīrīšanas, žāvēšanas un siltuma apmaiņas sēra dioksīds nonāk kontaktaparatūrā, kur tas tiek oksidēts līdz sērskābes anhidrīdam (450 ° C - 500 ° C; katalizators V 2 O 5):
2SO 2 + O 2<--> 2SO 3
3. posms. Absorbcijas tornis:
nSO 3 + H 2 SO 4 (konc) -\u003e (H 2 SO 4 nSO 3) (oleums)
Ūdeni nevar izmantot miglas veidošanās dēļ. Tiek izmantotas keramikas sprauslas un pretplūsmas princips.
Pieteikums.
Atcerieties! Sērskābe jāielej ūdenī nelielās porcijās, nevis otrādi. Pretējā gadījumā var notikt vardarbīga ķīmiska reakcija, kā rezultātā cilvēks var gūt smagus apdegumus.

Sērskābe ir viens no galvenajiem ķīmiskās rūpniecības produktiem. Tiek izmantots minerālmēslu (superfosfāta, amonija sulfāta), dažādu skābju un sāļu, zāļu un mazgāšanas līdzekļu, krāsvielu, mākslīgo šķiedru, sprāgstvielu ražošanai. To lieto metalurģijā (rūdu sadalīšana, piemēram, urāns), naftas produktu attīrīšanai, kā žāvētājs utt.
Praktiski svarīgi ir fakts, ka ļoti spēcīga (virs 75%) sērskābe nedarbojas uz dzelzi. Tas ļauj to uzglabāt un transportēt tērauda tvertnēs. Turpretim atšķaidītais H 2 SO 4 viegli izšķīdina dzelzi, attīstoties ūdeņradim. Oksidējošās īpašības tam nepavisam nav raksturīgas.
Spēcīga sērskābe enerģiski absorbē mitrumu, un tāpēc to bieži izmanto gāzu žāvēšanai. Tas noņem ūdeni no daudzām organiskām vielām, kas satur ūdeņradi un skābekli, ko bieži izmanto tehnoloģijās. Ar to (kā arī ar spēcīgo H 2 SO 4 oksidējošajām īpašībām) ir saistīta tā destruktīvā iedarbība uz augu un dzīvnieku audiem. Sērskābe, kas darba laikā nejauši nokļūst ādā vai kleitā, nekavējoties jānomazgā ar lielu daudzumu ūdens, pēc tam skarto zonu samitrina ar atšķaidītu amonjaka šķīdumu un vēlreiz noskalo ar ūdeni.
Tīras sērskābes molekulas.

1. attēls. Ūdeņraža saišu diagramma H 2 SO 4 kristālā.
Molekulas, kas veido monohidrāta kristālu (HO) 2 SO 2, ir savienotas viena ar otru ar diezgan spēcīgām (25 kJ / mol) ūdeņraža saitēm, kā shematiski parādīts attēlā. 1. Molekulai (HO) 2 SO 2 ir deformēta tetraedra struktūra ar sēra atomu centra tuvumā, un to raksturo šādi parametri: (d (S-OH) \u003d 154 pm, PHO-S-OH \u003d 104 °, d (S \u003d O) \u003d 143 pm, POSO \u003d 119 °. HOSO 3 - jonā d (S-OH) \u003d 161 un d (SO) \u003d 145 pm, un, pārejot uz SO 4 jonu, 2-tetraedrs iegūst pareizu formu un parametri ir izlīdzināti.
Sērskābes kristāliskie hidrāti.
Sērskābei ir zināmi vairāki kristāliskie hidrāti, kuru sastāvs parādīts attēlā. 14. No tiem nabadzīgākais ūdenī ir oksonija sāls: H 3 O + HSO 4 -. Tā kā aplūkojamā sistēma ir ļoti pakļauta pārdzesēšanai, tajā faktiski novērotās sasalšanas temperatūras ir daudz zemākas nekā kušanas temperatūras.

Attēls: 14. Kušanas punkti H 2 O · H 2 SO 4 sistēmā.
Fizikālās īpašības
Tīra 100% sērskābe (monohidrāts) ir bezkrāsains eļļains šķidrums, kas + 10 ° C temperatūrā sacietē kristāliskā masā. Reaktīvās sērskābes blīvums parasti ir 1,84 g / cm 3, un tā satur apmēram 95% H 2 SO 4. Tas sacietē tikai zem -20 ° С.
Monohidrāta kušanas temperatūra ir 10,37 ° C pie kausēšanas siltuma 10,5 kJ / mol. Normālos apstākļos tas ir ļoti viskozs šķidrums ar ļoti augstu dielektrisko konstanti (e \u003d 100 pie 25 ° C). Nenozīmīga monohidrāta iekšējā elektrolītiskā disociācija notiek paralēli divos virzienos: [Н 3 SO 4 +] · [НSO 4 -] \u003d 2 · 10 -4 un [Н 3 О +] · [НS 2 О 7 -] \u003d 4 · 10 - pieci. Tās molekulāro jonu sastāvu var aptuveni raksturot ar šādiem datiem (%):
H 2 SO 4 HSO 4 - H 3 SO 4 + H 3 O + HS 2 O 7 - H 2 S 2 O 7
99,50,180,140,090,050,04
Pievienojot pat nelielu daudzumu ūdens, saskaņā ar shēmu dominē disociācija: Н 2 О + Н 2 SO 4<==> H 3 O + + HSO 4 -
Ķīmiskās īpašības
H 2 SO 4 ir spēcīga divdabskābe.
H 2 SO 4<--> H + + HSO 4 -<--> 2H + + SO4 2-
Pirmais posms (vidējas koncentrācijas gadījumā) izraisa 100% disociāciju:
K2 \u003d () / \u003d 1,2 10-2
1) Mijiedarbība ar metāliem:
a) atšķaidītā sērskābe izšķīdina tikai metālus virknē spriegumu pa kreisi no ūdeņraža:
Zn 0 + H 2 +1 SO 4 (sadalīts) -\u003e Zn + 2 SO 4 + H 2 O
b) koncentrēts H2 +6 SO4 ir spēcīgs oksidētājs; mijiedarbojoties ar metāliem (izņemot Au, Pt), to var reducēt līdz S +4 O 2, S 0 vai H 2 S -2 (Fe, Al, Cr arī nereaģē bez karsēšanas - tie ir pasivēti):
- 2Ag 0 + 2H 2 +6 SO 4 -\u003e Ag 2 +1 SO 4 + S +4 O 2 + 2H 2 O
- 8Na 0 + 5H 2 +6 SO 4 -\u003e 4Na 2 +1 SO 4 + H 2 S -2 + 4H 2 O
- 2) koncentrēts H 2 S + 6 O 4 reaģē, karsējot ar dažiem nemetāliem, pateicoties tā spēcīgajām oksidēšanas īpašībām, pārvēršoties zemāka oksidācijas pakāpes sēra savienojumos (piemēram, S + 4 O 2):
C0 + 2H2S +6O4 (konc) -\u003e C +4O2 + 2S +4O2 + 2H2O
S0 + 2H2S +6O4 (konc) -\u003e 3S +4O2 + 2H20
- 2P 0 + 5H 2S +6 O4 (konc) -\u003e 5S +4O2 + 2H3P +5O4 + 2H2O
- 3) ar bāzes oksīdiem:
CuO + H2S04 -\u003e CuSO4 + H2O
CuO + 2H + -\u003e Cu2 + + H20
4) ar hidroksīdiem:
H2S04 + 2NaOH -\u003e Na2S04 + 2H2O
H + + OH - -\u003e H20
H 2SO 4 + Cu (OH) 2 -\u003e CuSO 4 + 2H 2 O
- 2H + + Cu (OH) 2 -\u003e Cu2 + + 2H20
- 5) apmainās ar reakcijām ar sāļiem:
BaCl2 + H2SO4 -\u003e BaSO4 + 2HCl
Ba 2+ + SO 4 2- -\u003e BaSO 4
Balto BaSO 4 nogulsņu veidošanos (nešķīst skābēs) izmanto, lai identificētu sērskābi un šķīstošos sulfātus.
MgCO 3 + H 2 SO 4 -\u003e MgSO 4 + H 2 O + CO 2 H 2 CO 3
Monohidrāts (tīrs, 100% sērskābe) ir jonizējošs šķīdinātājs ar skābu raksturu. Tajā izšķīst daudzu metālu sulfāti (nonākot bisulfātos), savukārt citu skābju sāļi parasti izšķīst tikai tad, ja to solvolīze ir iespējama (ar pārvēršanos bisulfātos). Slāpekļskābe izturas kā vāja bāze monohidrāta HNO 3 + 2 H 2 SO 4 sastāvā<==> H 3 O + + NO 2 + + 2 HSO 4 - hlors - kā ļoti vāja skābe H 2 SO 4 + HClO 4 \u003d H 3 SO 4 + + ClO 4 - Fluorsulfoskābes un hlorsulfoskābes ir nedaudz stiprākas skābes (HSO 3 F\u003e HSO 3 Cl\u003e HClO 4). Monohidrāts labi izšķīdina daudzas organiskās vielas, kas satur atomus ar vientuļiem elektronu pāriem (kas spēj piesaistīt protonu). Pēc tam dažus no tiem var nemainīti izolēt, vienkārši atšķaidot šķīdumu ar ūdeni. Monohidrātam ir augsta krioskopiskā konstante (6.12 °), un to dažreiz izmanto kā barotni molekulmasas noteikšanai.
Koncentrēts H 2 SO 4 ir diezgan spēcīgs oksidētājs, īpaši sildot (parasti reducē līdz SO 2). Piemēram, tas oksidē HI un daļēji HBr (bet ne HCl) līdz brīvajiem halogēniem. Tas oksidē arī daudzus metālus - Cu, Hg utt. (Savukārt zelts un platīns ir stabili attiecībā pret H 2 SO 4). Tātad mijiedarbība ar varu notiek saskaņā ar vienādojumu:
Cu + 2 H 2 SO 4 \u003d CuSO 4 + SO 2 + H 2 O
Darbojoties kā oksidētājs, sērskābe parasti tiek reducēta līdz SO 2. Tomēr ar visspēcīgākajiem reducētājiem to var reducēt līdz S un pat H 2 S. Koncentrēta sērskābe reaģē ar sērūdeņradi saskaņā ar vienādojumu:
H2S04 + H2S \u003d 2H2O + SO2 + S
Jāatzīmē, ka to daļēji reducē arī gāzveida ūdeņradis, un tāpēc to nevar izmantot tā žāvēšanai.
Attēls: 13.
Koncentrētas sērskābes izšķīdināšana ūdenī notiek ar ievērojamu siltuma izdalīšanos (un zināmu sistēmas kopējā tilpuma samazināšanos). Monohidrāts gandrīz nevada elektrību. Turpretim sērskābes ūdens šķīdumi ir labi vadītāji. Kā redzams zīm. 13, aptuveni 30% skābes ir maksimālā elektrovadītspēja. Līknes minimums atbilst kompozīcijas H 2 SO 4 · H 2 O hidrātam.
Siltuma izdalīšanās, izšķīdinot monohidrātu ūdenī, ir (atkarībā no šķīduma galīgās koncentrācijas) līdz 84 kJ / mol H 2 SO 4. Gluži pretēji, sajaucot 66% sērskābi, kas iepriekš atdzesēta līdz 0 ° C, ar sniegu (1: 1 pēc svara), temperatūru var samazināt līdz -37 ° C.
H2S04 ūdens šķīdumu blīvuma izmaiņas ar koncentrāciju (masas%) ir norādītas zemāk:
Kā redzams no šiem datiem, sērskābes koncentrācijas noteikšana pēc blīvuma ir lielāka par 90 masas%. % kļūst ļoti neprecīzs. Ūdens tvaika spiediens virs dažādas koncentrācijas H 2 SO 4 šķīdumiem dažādās temperatūrās parādīts attēlā. 15. Sērskābe var darboties kā žāvētājs tikai tik ilgi, kamēr ūdens tvaiku spiediens virs tā šķīduma ir mazāks par tā daļējo spiedienu žāvētajā gāzē.

Attēls: piecpadsmit.

Attēls: sešpadsmit. Viršanas punkti virs H 2 SO 4 šķīdumiem. H 2 SO 4 šķīdumi.
Vārot atšķaidītu sērskābes šķīdumu, ūdens tiek destilēts, un viršanas temperatūra paaugstinās līdz 337 ° C, kad sāk destilēt 98,3% H 2 SO 4 (16. attēls). Gluži pretēji, sēra anhidrīda pārpalikums iztvaiko no koncentrētākiem šķīdumiem. Sērskābes tvaiki, kas vārās 337 ° C temperatūrā, daļēji sadalās H 2 O un SO 3, kas pēc atdzesēšanas atkal apvienojas. Sērskābes augstā viršanas temperatūra ļauj to izmantot, lai karsējot atdalītu gaistošās skābes no to sāļiem (piemēram, HCl no NaCl).
Saņemšana
Monohidrātu var iegūt, kristalizējot koncentrētu sērskābi -10 ° C temperatūrā.
Sērskābes ražošana.
- 1. posms. Pirīta krāsns.
- 4FeS 2 + 11O2 -\u003e 2Fe2O3 + 8SO2 + Q
Process ir neviendabīgs:
- 1) dzelzs pirīta (pirīta) slīpēšana
- 2) "lejasdaļas" metode
- 3) 800 ° C; liekā siltuma noņemšana
- 4) skābekļa koncentrācijas palielināšanās gaisā
- 2. posms. Pēc attīrīšanas, žāvēšanas un siltuma apmaiņas sēra dioksīds nonāk kontaktaparatūrā, kur tas tiek oksidēts līdz sērskābes anhidrīdam (450 ° C - 500 ° C; katalizators V 2 O 5):
- 2SO 2 + O 2
- 3. posms. Absorbcijas tornis:
nSO 3 + H 2 SO 4 (konc) -\u003e (H 2 SO 4 nSO 3) (oleums)
Ūdeni nevar izmantot miglas veidošanās dēļ. Tiek izmantotas keramikas sprauslas un pretplūsmas princips.
Pieteikums.
Atcerieties! Sērskābe jāielej nelielās porcijās ūdenī, nevis uz priekšu un atpakaļ. Pretējā gadījumā var notikt vardarbīga ķīmiska reakcija, kā rezultātā cilvēks var gūt smagus apdegumus.
Sērskābe ir viens no galvenajiem ķīmiskās rūpniecības produktiem. Tiek izmantots minerālmēslu (superfosfāta, amonija sulfāta), dažādu skābju un sāļu, zāļu un mazgāšanas līdzekļu, krāsvielu, mākslīgo šķiedru, sprāgstvielu ražošanai. To lieto metalurģijā (rūdu sadalīšana, piemēram, urāns), naftas produktu attīrīšanai, kā žāvētājs utt.
Praktiski svarīgi ir fakts, ka ļoti spēcīga (virs 75%) sērskābe nedarbojas uz dzelzi. Tas ļauj to uzglabāt un transportēt tērauda tvertnēs. Turpretim atšķaidītais H 2 SO 4 viegli izšķīdina dzelzi ar ūdeņraža attīstību. Oksidējošās īpašības tam nepavisam nav raksturīgas.
Spēcīga sērskābe enerģiski absorbē mitrumu, un tāpēc to bieži izmanto gāzu žāvēšanai. Tas noņem ūdeni no daudzām organiskām vielām, kas satur ūdeņradi un skābekli, ko bieži izmanto tehnoloģijās. Ar to (kā arī ar spēcīgo H 2 SO 4 oksidējošajām īpašībām) ir saistīta tā destruktīvā iedarbība uz augu un dzīvnieku audiem. Sērskābe, kas darba laikā nejauši nokļūst ādā vai kleitā, nekavējoties jānomazgā ar lielu daudzumu ūdens, pēc tam skarto zonu samitrina ar atšķaidītu amonjaka šķīdumu un atkal noskalo ar ūdeni.
Katrs cilvēks ķīmijas stundās mācījās skābes. Vienu no tiem sauc par sērskābi un apzīmē ar HSO 4. Mūsu raksts jums pateiks par sērskābes īpašībām.
Sērskābes fizikālās īpašības
Tīra sērskābe vai monohidrāts ir bezkrāsains eļļains šķidrums, kas + 10 ° C temperatūrā sacietē kristāliskā masā. Sērskābe reakcijām satur 95% H 2 SO 4, un tās blīvums ir 1,84 g / cm 3. 1 litrs šīs skābes sver 2kg. Skābe sacietē -20 ° C temperatūrā. Kausēšanas siltums ir 10,5 kJ / mol 10,37 ° C temperatūrā.
Koncentrētas sērskābes īpašības ir dažādas. Piemēram, kad šī skābe tiek izšķīdināta ūdenī, hidrātu veidošanās dēļ tiks atbrīvots liels siltuma daudzums (19 kcal / mol). Šos hidrātus var izdalīt no šķīduma zemā temperatūrā cietā formā.
Sērskābe ir viens no pamata produktiem ķīmijas rūpniecībā. Tas ir paredzēts minerālmēslu (amonija sulfāta, superfosfāta), dažādu sāļu un skābju, mazgāšanas līdzekļu un zāļu, mākslīgo šķiedru, krāsvielu, sprāgstvielu ražošanai. Sērskābi var izmantot arī metalurģijā (piemēram, urāna rūdu sadalīšanās procesā), naftas produktu attīrīšanai, gāzu žāvēšanai utt.
Sērskābes ķīmiskās īpašības
Sērskābes ķīmiskās īpašības ir šādas:
- Mijiedarbība ar metāliem:
- atšķaidītā skābe spriegumu virknē izšķīdina tikai tos metālus, kas atrodas pa kreisi no ūdeņraža, piemēram, H 2 +1 SO 4 + Zn 0 \u003d H 2 O + Zn + 2 SO 4;
- sērskābes oksidējošās īpašības ir lieliskas. Mijiedarbojoties ar dažādiem metāliem (izņemot Pt, Au), to var reducēt līdz H 2 S -2, S + 4 O 2 vai S 0, piemēram:
- 2H2 +6S04 + 2Ag 0 \u003d S +4O2 + Ag2 +1S04 + 2H20;
- 5H2 +6S04 + 8Na0 \u003d H2S -2 + 4Na2 +1 SO4 + 4H20;
- Koncentrēta skābe H 2 S + 6 O 4 reaģē (karsējot) arī ar dažiem nemetāliem, tajā pašā laikā pārvēršoties sēra savienojumos ar zemāku oksidācijas pakāpi, piemēram:
- 2H2S +6O4 + C0 \u003d 2S +4O2 + C +4O2 + 2H20;
- 2H2S +6O4 + S0 \u003d 3S +4O2 + 2H20;
- 5H2S +6O4 + 2P0 \u003d 2H3P +5O4 + 5S +4O2 + 2H20;
- Ar pamata oksīdiem:
- H2S04 + CuO \u003d CuSO4 + H20;
- Ar hidroksīdiem:
- Cu (OH) 2 + H2S04 \u003d CuSO4 + 2H20;
- 2NaOH + H2S04 \u003d Na2S04 + 2H20;
- Mijiedarbība ar sāļiem apmaiņas reakciju laikā:
- H2S04 + BaCl2 \u003d 2HCl + BaS04;
Šīs skābes un šķīstošo sulfātu noteikšanai izmanto BaSO 4 veidošanos (baltas nogulsnes, nešķīst skābēs).
Monohidrāts ir jonizējošs šķīdinātājs, kam ir skābs raksturs. Ir ļoti labi tajā izšķīdināt daudzu metālu sulfātus, piemēram:
- 2H2S04 + HNO3 \u003d NO2 + + H3O + + 2HSO4-;
- HClO4 + H2S04 \u003d ClO4 - + H3SO4 +.
Koncentrēta skābe ir diezgan spēcīgs oksidētājs, īpaši sildot, piemēram, 2H 2 SO 4 + Cu \u003d SO 2 + CuSO 4 + H 2 O.
Sērskābe, kas darbojas kā oksidētājs, parasti tiek reducēta līdz SO 2. Bet to var atjaunot uz S un pat uz H 2 S, piemēram, H 2 S + H 2 SO 4 \u003d SO 2 + 2H 2 O + S.
Monohidrāts gandrīz nespēj vadīt elektrību. Un otrādi, skābes ūdens šķīdumi ir labi vadītāji. Sērskābe spēcīgi absorbē mitrumu, tāpēc to izmanto dažādu gāzu žāvēšanai. Kā sausskābe sērskābe darbojas tik ilgi, kamēr ūdens tvaiku spiediens virs tā šķīduma ir mazāks par spiedienu žāvējamā gāzē.
Ja vārīsit atšķaidītu sērskābes šķīdumu, no tā tiks noņemts ūdens, savukārt viršanas temperatūra paaugstināsies līdz 337 ° C, piemēram, destilējot sērskābi 98,3% koncentrācijā. Un otrādi, sēra anhidrīda pārpalikums iztvaiko no koncentrētākiem šķīdumiem. Skābes tvaiki, kas vārās 337 ° C temperatūrā, daļēji sadalās SO 3 un H 2 O, kas pēc atdzesēšanas atkal tiks apvienoti. Šīs skābes augstā viršanas temperatūra ir piemērota izmantošanai gaistošo skābju atdalīšanā no to sāļiem, karsējot.
Skābes piesardzība
Esiet īpaši piesardzīgs, rīkojoties ar sērskābi. Kad šī skābe nokļūst uz ādas, āda kļūst balta, tad brūngana un parādās apsārtums. Tajā pašā laikā apkārtējie audi uzbriest. Ja šī skābe nokļūst kādā ķermeņa daļā, tā ātri jānomazgā ar ūdeni un ieeļļo sadedzināto vietu ar sodas šķīdumu.
Tagad jūs zināt, ka sērskābe, kuras īpašības ir labi izpētītas, ir vienkārši neaizstājama daudzveidīgai ražošanai un kalnrūpniecībai.
DEFINĪCIJA
Bezūdens sērskābe ir smags, viskozs šķidrums, kas viegli sajaucas ar ūdeni jebkurā proporcijā: mijiedarbību raksturo ārkārtīgi augsta eksotermiskā iedarbība (~ 880 kJ / mol bezgalīgā atšķaidījumā) un var izraisīt maisījuma eksplozīvu vārīšanos un šļakstīšanos, ja skābei pievieno ūdeni; tāpēc šķīdumu pagatavošanai ir tik svarīgi vienmēr izmantot apgriezto secību un ūdenim lēnām un maisot pievienot skābi.
Dažas sērskābes fizikālās īpašības ir parādītas tabulā.
Bezūdens H 2 SO 4 ir ievērojams savienojums ar neparasti augstu dielektrisko konstanti un ļoti augstu elektrovadītspēju, kas ir saistīts ar savienojuma jonu autodisociāciju (auto-protolīzi), kā arī releja sacīkšu vadīšanas mehānismu ar protonu pārnesi, kas nodrošina elektriskās strāvas plūsmu caur viskozu šķidrumu ar lielu skaitu ūdeņraža saišu.
1. tabula. Sērskābes fizikālās īpašības.
Sērskābes ražošana
Sērskābe ir vissvarīgākā rūpnieciskā ķīmiskā viela un vislētākā liela apjoma skābe jebkurā pasaules valstī.
Koncentrētu sērskābi ("vitriola eļļu") vispirms ieguva, sildot "zaļo vitriolu" FeSO 4 × nH 2 O, un patērēja lielos daudzumos, lai iegūtu Na 2 SO 4 un NaCl.
Mūsdienu sērskābes ražošanas procesā tiek izmantots katalizators, kas sastāv no vanādija (V) oksīda, pievienojot kālija sulfātu uz silīcija dioksīda vai diatomīta zemes. Sēra dioksīdu SO 2 iegūst, sadedzinot tīru sēru vai grauzdējot sulfīda rūdu (galvenokārt pirītu vai Cu, Ni un Zn rūdas) šo metālu ekstrakcijas procesā. Tad SO 2 oksidē līdz trioksīdam, un tad sērskābi iegūst, izšķīdinot ūdenī:
S + O2 → SO2 (ΔH0 - 297 kJ / mol);
SO2 + ½ O2 → SO3 (ΔH0 - 9,8 kJ / mol);
SO 3 + H 2 O → H 2 SO 4 (ΔH 0 - 130 kJ / mol).
Sērskābes ķīmiskās īpašības
Sērskābe ir spēcīga divbāzskābe. Pirmajā zemas koncentrācijas šķīdumu stadijā tas gandrīz pilnībā disociējas:
H2S04H + + HSO4 -.
Disociācija otrajā posmā
HSO 4 - ↔H + + SO4 2-
ienāk mazāk. Sērskābes disociācijas konstante otrajā posmā, izteikta ar jonu aktivitāti, K 2 \u003d 10 -2.
Sērskābe kā divbāzskābe veido divas sāļu sērijas: vidējas un skābas. Vidējos sērskābes sāļus sauc par sulfātiem, bet skābos - par hidrosulfātiem.
Sērskābe alkatīgi absorbē ūdens tvaikus, un tāpēc to bieži izmanto gāzu žāvēšanai. Spēja absorbēt ūdeni izskaidro arī daudzu organisko vielu, jo īpaši ogļhidrātu (šķiedrvielu, cukura utt.) Klasei piededzināšanu, saskaroties ar koncentrētu sērskābi. Sērskābe atdala ūdeņradi un skābekli no ogļhidrātiem, kas veido ūdeni, un ogleklis izdalās ogļu veidā.
Koncentrēta sērskābe, īpaši karsta, ir spēcīgs oksidētājs. Tas oksidē HI un HBr (bet ne HCl), atbrīvojot halogēnus, ogles līdz CO 2, sēru līdz SO 2. Šīs reakcijas izsaka ar vienādojumiem:
8HI + H2S04 \u003d 4I2 + H2S + 4H20;
2HBr + H2S04 \u003d Br2 + SO2 + 2H20;
C + 2H2S04 \u003d CO2 + 2SO2 + 2H20;
S + 2H 2SO 4 \u003d 3SO 2 + 2H 2 O.
Sērskābes mijiedarbība ar metāliem notiek atšķirīgi atkarībā no tā koncentrācijas. Atšķaidīta sērskābe oksidējas ar tās ūdeņraža jonu. Tāpēc tas mijiedarbojas tikai ar tiem metāliem, kas stresa virknē atrodas tikai līdz ūdeņradim, piemēram:
Zn + H2S04 \u003d ZnSO4 + H2.
Tomēr svins nešķīst atšķaidītā skābē, jo iegūtais PbSO 4 sāls nešķīst.
Koncentrēta sērskābe ir oksīds sēra (VI) dēļ. Tas oksidē metālus līdz sudrabam ieskaitot. Tās reducēšanas produkti var būt dažādi atkarībā no metāla aktivitātes un apstākļiem (skābes koncentrācija, temperatūra). Mijiedarbojoties ar zemas aktivitātes metāliem, piemēram, ar varu, skābe tiek reducēta līdz SO 2:
Cu + 2H 2 SO 4 \u003d CuSO 4 + SO 2 + 2H 2 O.
Mijiedarbojoties ar aktīvākiem metāliem, reducēšanās produkti var būt gan dioksīds, gan brīvais sērs un sērūdeņradis. Piemēram, mijiedarbojoties ar cinku, var rasties reakcijas:
Zn + 2H2S04 \u003d ZnSO4 + SO2 + 2H20;
3Zn + 4H2S04 \u003d 3ZnSO4 + S ↓ + 4H20;
4Zn + 5H2SO4 \u003d 4ZnSO4 + H2S + 4H2O.
Sērskābes lietošana
Sērskābes lietošana dažādās valstīs un gadu desmitos ir atšķirīga. Piemēram, Amerikas Savienotajās Valstīs pašlaik galvenā H 2 SO 4 patēriņa joma ir mēslošanas līdzekļu ražošana (70%), kam seko ķīmiskā ražošana, metalurģija, eļļas pārstrāde (~ 5% katrā reģionā). Lielbritānijā patēriņa sadalījums pa nozarēm ir atšķirīgs: tikai 30% no saražotā H 2 SO 4 izmanto mēslošanas līdzekļu ražošanā, bet 18% - krāsām, pigmentiem un starpproduktiem krāsvielu ražošanai, 16% - ķīmijas rūpniecībai, 12% - ziepju un mazgāšanas līdzekļu ražošanai, 10 % dabisko un mākslīgo šķiedru ražošanai un 2,5% tiek izmantoti metalurģijā.
Problēmu risināšanas piemēri
1. PIEMĒRS
| Uzdevums | Nosakiet sērskābes masu, ko var iegūt no vienas tonnas pirīta, ja sēra (IV) oksīda raža grauzdēšanas reakcijā ir 90%, un sēra oksīds (VI) sēra (IV) katalītiskajā oksidēšanā - 95% no teorētiskās. |
| Lēmums | Pierakstīsim reakcijas vienādojumu pirīta grauzdēšanai: 4FeS 2 + 11O2 \u003d 2Fe2O3 + 8SO2. Aprēķināsim pirīta vielas daudzumu: n (FeS2) \u003d m (FeS2) / M (FeS2); M (FeS2) \u003d Ar (Fe) + 2 × Ar (S) \u003d 56 + 2 × 32 \u003d 120 g / mol; n (FeS 2) \u003d 1000 kg / 120 \u003d 8,33 kmol. Tā kā reakcijas vienādojumā sēra dioksīda koeficients ir divas reizes lielāks nekā FeS 2 koeficients, tad teorētiski iespējamais sēra oksīda (IV) vielas daudzums ir: n (SO 2) teorija \u003d 2 × n (FeS 2) \u003d 2 × 8,33 \u003d 16,66 kmol. Praktiski iegūtais sēra (IV) oksīda molu daudzums ir: n (SO 2) praks \u003d η × n (SO 2) teorija \u003d 0,9 × 16,66 \u003d 15 kmol. Uzrakstīsim reakcijas vienādojumu sēra (IV) oksīda oksidēšanai sēra (VI) oksīdā: 2SO 2 + O 2 \u003d 2SO 3. Teorētiski iespējamais sēra oksīda (VI) vielas daudzums ir: n (SO 3) teorija \u003d n (SO 2) praks \u003d 15 kmol. Praktiski iegūtais sēra oksīda (VI) molu daudzums ir: n (SO 3) praks \u003d η × n (SO 3) teorija \u003d 0,5 × 15 \u003d 14,25 kmol. Uzrakstīsim vienādojumu sērskābes iegūšanas reakcijai: SO 3 + H 2 O \u003d H 2 SO 4. Atradīsim sērskābes vielas daudzumu: n (H2S04) \u003d n (SO3) praks \u003d 14,25 kmol. Reakcijas iznākums ir 100%. Sērskābes masa ir: m (H2S04) \u003d n (H2S04) × M (H2S04); M (H2S04) \u003d 2 × Ar (H) + Ar (S) + 4 × Ar (O) \u003d 2 × 1 + 32 + 4 × 16 \u003d 98 g / mol; m (H2S04) \u003d 14,25 × 98 \u003d 1397 kg. |
| Atbilde | Sērskābes masa ir 1397 kg |
SĒRSKĀBE H2S04, molekulmasa 98,082; bezkrāsains eļļains šķidrums bez smaržas. Ļoti stipra divdabīnskābe, 18 ° C temperatūrā pK a 1 - 2,8, K 2 1,2 10 -2, pK a 2 l, 92; saites garumi molekulā S \u003d O 0,143 nm, S-OH 0,154 nm, HOSOH leņķis 104 °, OSO 119 °; vārās ar dažādiem, veidojot azeotropu maisījumu (98,3% H 2 SO 4 un 1,7% H 2 O ar viršanas temperatūru 338,8 ° C; skat. arī 1. tabulu). SĒRES SKĀBE, kas atbilst 100% H 2 SO 4 saturam, sastāvs (%): H 2 SO 4 99,5, 0,18, 0,14, H 3 O + 0,09, H 2 S 2 O 7 0,04, HS 2 O 7 0,05. Sajaucas ar ūdeni un SO 3 visās proporcijās. Ūdens šķīdumos SURSKĀBE k. Gandrīz pilnībā disociējas H + un. Veido hidrātus H 2SO 4 nH 2 O, kur n \u003d 1, 2, 3, 4 un 6,5.
SO 3 šķīdumus Sērskābē sauc par oleumu, tie veido divus savienojumus H 2 SO 4 SO 3 un H 2 SO 4 2SO 3. Oleums satur arī pirosērskābi, ko iegūst, reaģējot: H 2 SO 4 + + SO 3: H 2 S 2 O 7.


Sērskābes ūdens šķīdumu viršanas temperatūra r. Palielinās, palielinoties tā koncentrācijai, un sasniedz maksimumu pie 98,3% H 2 SO 4 satura (2. tabula). Oleuma viršanas temperatūra samazinās, palielinoties SO 3 saturam. Palielinoties ūdens šķīdumu koncentrācijai, SĒRSKĀBE K. Kopējais tvaiku spiediens virs šķīdumiem samazinās un pie 98,3% H 2 SO 4 satura sasniedz minimumu. Palielinoties SO 3 koncentrācijai oleumā, kopējais tvaika spiediens virs tā palielinās. Tvaika spiedienu virs sērskābes ūdens šķīdumiem līdz. no ūdens tvaiku maisījuma, H 2 SO 4 un SO 3, savukārt tvaiku sastāvs atšķiras no šķidruma sastāva visās SĒSKĀBES SKĀBES koncentrācijās, izņemot attiecīgo azeotropo maisījumu.
Temperatūrai paaugstinoties, palielinās H 2 SO 4 H 2 O + SO 3 - Q disociācija, līdzsvara konstantes atkarības no temperatūras vienādojums lnК p \u003d 14,74965 - 6,71464ln (298 / T) - 8, 10161 10 4 T 2 -9643,04 / T-9.4577 10-3 T + 2.19062 x 10-6 T2. Pie normāla spiediena disociācijas pakāpe: 10 -5 (373 K), 2,5 (473 K), 27,1 (573 K), 69,1 (673 K). 100% Sērskābes blīvums līdz. Var noteikt pēc vienādojuma: d \u003d 1,8517 - - 1,1 10-3 t + 2 10-6 t 2 g / cm 3. Palielinoties sērskābes šķīdumu koncentrācijai, to siltuma jauda samazinās un sasniedz minimumu 100% sērskābei, oleuma siltuma jauda palielinās, palielinoties SO 3 saturam.
Palielinoties koncentrācijai un samazinoties temperatūrai, siltuma vadītspēja l samazinās: l \u003d 0,518 + 0,0016t - (0,25 + + t / 1293) С / 100, kur С ir SĒRSKĀBES koncentrācija,%. Maks. viskozitātei ir oleums H 2 SO 4 SO 3, paaugstinoties temperatūrai, h samazinās. Elektrisks. izturība pret Sērskābi līdz minimālajai koncentrācijai 30 un 92% H 2 SO 4 un maksimālajai koncentrācijai 84 un 99,8% H 2 SO 4. Oleumam min. r koncentrācijā 10% SO 3. Temperatūrai paaugstinoties, paaugstinās SĒSKĀBE K. Dielektriskais 100% Sērskābes caurlaidība 101 (298,15 K), 122 (281,15 K); krioskopisks nemainīgs 6,12, ebulioskopisks. nemainīgs 5,33; tvaika difūzijas koeficients SURSKĀBE K. gaisā mainās atkarībā no temperatūras; D \u003d 1,67 10 -5 T 3/2 cm 2 / s.
SĒRKĀBE K. ir diezgan spēcīgs oksidētājs, īpaši sildot; oksidē HI un daļēji HBr līdz brīvajiem halogēniem, ogleklis līdz CO 2, S līdz SO 2, oksidē daudzus metālus (Cu, Hg utt.). Šajā gadījumā sērskābe tiek reducēta līdz SO 2, bet jaudīgākie reducētāji līdz S un H 2 S. Conc. H 2 SO 4 daļēji reducē H 2, tāpēc to nevar izmantot tā žāvēšanai. Parāds. H 2 SO 4 mijiedarbība ar visiem metāliem spriegumu elektroķīmiskajā virknē pa kreisi no ūdeņraža, izdalot H 2. Oksidīts. atšķaidītā H 2 SO 4 īpašības ir neparastas. SĒRKĀBE. Sniedz divas sāļu sērijas: vidēji sulfātus un skābes hidrosulfātus (sk. Neorganiskos sulfātus), kā arī ēterus (sk. Organiskos sulfātus). Zināmās peroksomonosērskābes (karoskābes) H 2 SO 5 un peroksodisērskābes H 2 S 2 O 8 skābes (sk. Sērs).
Saņemšana.SĒRĶSKĀBES iegūšanai ir šādas izejvielas: S, metāla sulfīdi, H 2 S, termoelektrostaciju izplūdes gāzes, Fe, Ca sulfāti utt. SĒRSKĀBES iegūšanas posmi k.: 1) izejvielu grauzdēšana ar SO 2 iegūšanu; 2) SO2 oksidēšana SO3 (konversija); 3) SO 3 absorbcija. Rūpniecībā sērskābes iegūšanai tiek izmantotas divas metodes, kas atšķiras ar SO 2 oksidēšanas veidu, - saskare ar cieto katalizatoru (kontaktu) izmantošanu un slāpekļa - ar slāpekļa oksīdiem. Sērskābes iegūšanai ar kontakta metodi mūsdienu rūpnīcās tiek izmantoti vanādija katalizatori, izspiežot Pt un Fe oksīdus. Tīram V 2 O 5 ir vāja katalītiskā aktivitāte, kas sārmu metālu sāļu klātbūtnē strauji palielinās, un visvairāk ietekmē K sāļus. Sārmu metālu veicinošā loma ir saistīta ar zemu kūstošu pirosulfovanadātu veidošanos (3K 2 S 2 O 7 V 2 O 5, 2K 2 S 2 O 7 V 2 O 5 un K 2 S 2 O 7 V 2 O 5, sadaloties attiecīgi 315-330, 365-380 un 400-405 ° C temperatūrā). Aktīvais komponents katalīzes apstākļos ir izkusis.
SO 2 oksidācijas shēmu līdz SO 3 var attēlot šādi:
Pirmajā posmā tiek panākts līdzsvars, otrais posms ir lēns un nosaka procesa ātrumu.
SĒRSKĀBES ražošana no sēra ar divkāršās saskares un dubultās absorbcijas metodi (1. attēls) sastāv no šādiem posmiem. Gaiss pēc attīrīšanas no putekļiem ar gāzes pūtēju tiek piegādāts žāvēšanas tornim, kur to žāvē ar 93-98% SĒSKĀBI līdz mitruma saturam 0,01%. Sausā krāsnī pēc iepriekšējas uzsildīšanas nokļūst sausināts gaiss. sildīšana vienā no kontakta vienības siltummaiņiem. Sprauslu piegādātais sērs tiek sadedzināts krāsnī: S + О 2: SO 2 + + 297,028 kJ. Gāzi, kas satur 10–14% SO 2, atdzesē katlā un pēc atšķaidīšanas ar gaisu līdz SO 2 9–10% tilpumam 420 ° C temperatūrā nonāk saskares aparātā pirmajam konversijas posmam, kas notiek uz trim katalizatora slāņiem (SO 2 + V 2 O 2 :: SO 3 + 96,296 kJ), pēc tam gāzi atdzesē siltummaiņos. Tad gāze, kas satur 8,5–9,5% SO 3 200 ° C temperatūrā, nonāk absorbcijas pirmajā posmā absorbētājā, kas apūdeņots ar oleumu un 98% SĒSKĀBI: SO 3 + H 2 O: H 2 SO 4 + + 130,56 kJ. Tad gāzi notīra no SĒRKĀBES SKĀBES šļakatām, uzkarsē līdz 420 ° C un nonāk otrajā konversijas posmā, kas notiek uz divām katalizatora gultām. Pirms otrās absorbcijas pakāpes gāzi atdzesē ekonomaizerī un padod otrās pakāpes absorbētājam, apūdeņo ar 98% SĒSKĀBI un pēc tam, kad to notīra no šļakatām, izlaiž atmosfērā. 
Attēls: 1. Sērskābes ražošanas shēma no sēra: 1-sēra krāsns; 2 atkritumu siltuma katls; 3 - ekonomaizers; 4 startu krāsns; Izejas krāsns 5, 6 siltummaiņi; 7 kontaktu ierīce; 8 siltummaiņi; 9-oleuma absorbētājs; 10 žāvēšanas tornis; 11. un 12. attiecīgi pirmais un otrais monohidrāta absorbētājs; 13 skābes savācēji.

2. attēls. Shēma sērskābes ražošanai no pirīta: 1 diska padevējs; 2-krāsns; 3 atkritumu siltuma katls; 4-cikloni; 5-elektrostatiskie nogulsnētāji; 6 mazgāšanas torņi; 7-mitri elektrostatiskie nogulsnētāji; 8 pūšošs tornis; 9 žāvēšanas tornis; 10 šļakatu slazds; 11-pirmais monohidrāta absorbētājs; 12 siltuma apmaiņas wiki; 13 - kontakta ierīce; 14-oleuma absorbētājs; 15 sekunžu monohidrāta absorbētājs; 16 ledusskapji; 17 kolekcijas.

Attēls: 3. Sērskābes ražošanas shēma ar slāpekļa metodi: 1 - denitraks. tornis; 2, 3-pirmais un otrais produkts. torņi; 4-oksidējas. tornis; 5, 6, 7 absorbē. torņi; 8 - elektrostatiskie nogulsnētāji.
Sēra skābes ražošana no metāla sulfīdiem (2. attēls) ir daudz sarežģītāka un sastāv no šādām darbībām. Grauzdēšanu FeS 2 veic plūstošās slāņa krāsnī ar gaisa strūklu: 4FeS 2 + 11О 2: 2Fe 2 O 3 + 8SO 2 + 13476 kJ. Dedzināšanas gāze ar SO 2 saturu 13–14% ar 900 ° C temperatūru nonāk katlā, kur to atdzesē līdz 450 ° C. Putekļus noņem ciklonā un elektrostatiskajā nogulsnēšanā. Tad gāze iziet cauri diviem mazgāšanas torņiem, kas apūdeņoti ar 40% un 10% sērskābi.Šajā gadījumā gāzi beidzot attīra no putekļiem, fluora un arsēna. Lai attīrītu gāzi no veļas torņos izveidotā SURFURIC ACID aerosola, tiek nodrošināti divi mitru elektrostatisko nogulsnētāju posmi. Pēc žāvēšanas žāvēšanas tornī, pirms kura gāzi atšķaida līdz 9% SO 2, tā tiek piegādāta ar gāzes izpūšanu līdz pirmajai konversijas pakāpei (3 katalizatora gultas). Siltummaiņos gāze tiek uzkarsēta līdz 420 ° C, pateicoties gāzes siltumam, kas nāk no pārvēršanas pirmās pakāpes. SO 2, oksidēts par 92–95% SO 3, nonāk pirmajā absorbcijas posmā oleuma un monohidrātu absorbentos, kur tas tiek atbrīvots no SO 3. Tālāk gāze ar SO 2 saturu ~ 0,5% nonāk otrajā konversijas posmā, kas notiek uz vienas vai divām katalizatora gultām. Gāze tiek iepriekš uzkarsēta citā siltummaiņu grupā līdz 420 ° C, pateicoties gāzu siltumam, kas nāk no otrās katalīzes pakāpes. Pēc SO 3 atdalīšanas otrajā absorbcijas posmā gāze tiek izvadīta atmosfērā.
SO 2 pārveidošanās par SO 3 pakāpe kontakta metodē ir 99,7%, SO 3 absorbcijas pakāpe ir 99,97%. Siera skābes ražošana uz. Tiek veikta vienā katalīzes stadijā, bet SO 2 pārveidošanās par SO 3 pakāpe nepārsniedz 98,5%. Pirms izlaišanas atmosfērā gāze tiek attīrīta no atlikušā SO 2 (sk. Gāzes attīrīšana). Mūsdienu iekārtu produktivitāte ir 1500-3100 tonnas dienā.
Slāpekļa metodes (3. attēls) būtība ir tāda, ka degošo gāzi pēc atdzesēšanas un attīrīšanas no putekļiem apstrādā ar tā saukto nitrozi-C. K., kurā sol. slāpekļa oksīdi. SO 2 absorbē nitroze un pēc tam oksidē: SO 2 + N 2 O 3 + H 2 O: H 2 SO 4 + NO. Iegūtais NO slikti šķīst nitrozē un izdalās no tā, un pēc tam skābekļa gāzes fāzē daļēji oksidējas līdz NO 2. NO un NO 2 maisījumu atkal absorbē sērskābe. utt. Slāpekļa oksīdi netiek patērēti slāpekļa procesā un tiek atgriezti ražošanā. sēra skābes nepilnīgas absorbcijas dēļ, jo izplūdes gāzes tos daļēji aiznes. Slāpekļa metodes priekšrocības: aparatūras projektēšanas vienkāršība, zemākas izmaksas (par 10-15% zemākas nekā kontakta), iespēja 100% apstrādāt SO 2.
Torņa slāpekļa procesa aprīkojums nav grūts: SO 2 apstrādā 7-8 torņos ar keramiku. sprausla, viens no torņiem (dobs) ir regulējams, lai oksidētos. skaļums. Torņos ir skābes savācēji, ledusskapji, sūkņi, kas piegādā skābi spiediena tvertnēm virs torņiem. Pēdējo divu torņu priekšā ir uzstādīts astes ventilators. Lai attīrītu gāzi no aerosola SĒRKĀBES, tiek izmantots elektrostatiskais nogulsnētājs. Procesam nepieciešamos slāpekļa oksīdus iegūst no HNO 3. Lai samazinātu slāpekļa oksīdu emisiju atmosfērā un 100% pārstrādātu SO 2, starp ražošanas un absorbcijas zonām tiek izveidots bez slāpekļa slāpekļa pārstrādes cikls kopā ar slāpekļa oksīdu dziļas uztveršanas ūdens-skābes metodi. Slāpekļa metodes trūkums ir zemā produkta kvalitāte: SĒRSKĀBES koncentrācija ir 75%, slāpekļa oksīdu, Fe un citu piemaisījumu klātbūtne.
Lai samazinātu sērskābes kristalizācijas iespēju, transportēšanas un uzglabāšanas laikā ir noteikti standarti sērskābes komerciālajām kategorijām, kuru koncentrācija atbilst zemākajām kristalizācijas temperatūrām. Saturs Sērskābe līdz. šķirnes (%): tornis (slāpekļveida) 75, kontakts 92,5-98,0, oleums 104,5, augsts procentuālais daudzums oleums 114,6, akumulators 92-94. SĒRKĀBE tiek uzglabāta tērauda tvertnēs ar tilpumu līdz 5000 m 3, to kopējā uzglabāšanas jauda ir paredzēta desmit dienu produkcijas izlaidei. Oleum un SURFURIC ACID tiek pārvadāti tērauda dzelzceļa cisternās. Konc. un akumulators SURFURIC ACID K. tiek pārvadāti skābes izturīgās tērauda tvertnēs. Oleuma transportēšanas tvertnes pirms oleuma ielešanas pārklāj ar siltumizolāciju un silda.
Kolorimetriski un fotometriski nosaka sēra skābes K. kolorimetriski un fotometriski BaSO 4 suspensijas veidā - fototurbidimetriski, kā arī kulometriski. metodi.
Pieteikums. SĒRKĀBE tiek izmantota minerālmēslu ražošanā kā elektrolīts svina-skābes akumulatoros, dažādu minerālskābju un sāļu, ķīmisko šķiedru, krāsvielu, dūmus veidojošu vielu un sprāgstvielu ražošanai naftas, metālapstrādes, tekstila, ādas un citās nozarēs. To izmanto nozarē. organiskā sintēze dehidratācijas reakcijās (iegūstot dietilēteri, esterus), hidratācijā (etanols no etilēna), sulfonējot (sintētiskie mazgāšanas līdzekļi un starpprodukti krāsvielu ražošanā), alkilējot (iegūstot izooktānu, polietilēnglikolu, kaprolaktamu) utt. Lielākais sērskābes patērētājs ir minerālmēslu ražošana. Par 1 tonnu fosfora mēslošanas līdzekļu P 2 O 5 tiek patērētas 2,2-3,4 tonnas SĒSKĀBES un par 1 tonnu (NH 4) 2 SO 4 -0,75 t SĒSKĀBES. Tāpēc sērskābes rūpnīcas mēdz būvēt kompleksā ar rūpnīcām minerālmēslu ražošanai. Sēra skābes ražošana pasaulē 1987. gadā sasniedza 152 miljonus tonnu.
SĒRSKĀBE uz. Un oleums - ārkārtīgi agresīvas vielas, kas ietekmē elpošanas traktu, ādu, gļotādas, izraisa apgrūtinātu elpošanu, klepu, bieži laringītu, traheītu, bronhītu utt. 0 mg / m 3 atm. gaiss 0,3 mg / m 3 (maks. vienreizējs) un 0,1 mg / m 3 (vidēji dienā). Pārsteidzoša sēra skābes tvaiku koncentrācija, 0,008 mg / l (iedarbība 60 min), letāla 0,18 mg / l (60 min). 2. bīstamības klase. Sēra skābes aerosols k. Var veidoties atmosfērā ķīmisko un metalurģisko emisiju rezultātā. nozarēs, kas satur S oksīdus, un izkrīt skābā lietus veidā.
Literatūra: Sērskābes rokasgrāmata, ed. K.M. Malina, 2. izdevums, M., 1971. gads; Amelin A.G., sērskābes tehnoloģija, 2. izdevums, M., 1983; Vasiļjevs B. T., Otvagina M. I., Sērskābes tehnoloģija, M., 1985. Yu.V. Filatovs.
Ķīmiskā enciklopēdija. 4. sējums \u003e\u003e