Kā uzrakstīt kodolīgu jonu vienādojumu. Jonu vienādojumu sastādīšanas piemēri
Tā kā elektrolīti šķīdumā ir jonu formā, reakcijas starp sāļu, bāzu un skābju šķīdumiem ir reakcijas starp joniem, t.i. jonu reakcijas. Daži no joniem, piedaloties reakcijā, noved pie jaunu vielu (zemu disociācijas vielu, nogulsņu, gāzu, ūdens) veidošanās, savukārt citi joni, atrodoties šķīdumā, nedod jaunas vielas, bet paliek šķīdumā. Lai parādītu, kuru jonu mijiedarbība noved pie jaunu vielu veidošanās, tiek sastādīti molekulāri, pilnīgi un kodolīgi jonu vienādojumi.
IN molekulārie vienādojumivisas vielas ir uzrādītas molekulu formā. Pilnīgi jonu vienādojumiparādīt visu jonu sarakstu, kas pieejams šķīdumā konkrētai reakcijai. Īsi jonu vienādojumi sastāv tikai no tiem joniem, kuru mijiedarbība izraisa jaunu vielu (zemu disociācijas vielu, nokrišņu, gāzu, ūdens) veidošanos.
Sastādot jonu reakcijas, jāatceras, ka vielas ir nedaudz disociētas (vāji elektrolīti), maz - un maz šķīstošas \u200b\u200b(nogulsnētas) “ H”, “M”, Sk. Pielikuma 4. tabulu) un gāzveida sugas reģistrē kā molekulas. Spēcīgi, gandrīz pilnībā disociēti elektrolīti ir jonu formā. Zīme “↓” pēc vielas formulas norāda, ka šī viela tiek nogulsnēta no reakcijas sfēras nogulsņu veidā, un “” zīme norāda uz vielas atdalīšanos gāzes formā.
Jonu vienādojumu sastādīšanas secība, izmantojot zināmus molekulāros vienādojumus aplūkosim reakcijas piemēru starp Na 2 CO 3 un HCl šķīdumiem.
1. Reakcijas vienādojumu raksta molekulārā formā:
Na 2 CO 3 + 2HCl → 2NaCl + H 2 CO 3
2. Vienādojums tiek pārrakstīts jonu formā, savukārt labi disociējošas vielas tiek uzrakstītas jonu formā, bet maz disociējošas vielas (ieskaitot ūdeni), gāzes vai grūti šķīstošas \u200b\u200b- molekulu formā. Molekulas vienādojumā vielas formulas priekšā esošais koeficients vienādi attiecas uz katru no joniem, kas veido vielu, un tāpēc tas tiek izņemts jonu vienādojumā jonu priekšā:
2 Na + + CO 3 2- + 2H + + 2Cl -<=> 2Na + + 2Cl - + CO 2 + H20
3. No abām līdztiesības pusēm kreisajā un labajā pusē esošie joni tiek izslēgti (atcelti) (pasvītroti ar attiecīgajām domuzīmēm):
2 Na + + CO 3 2- + 2H + + 2Cl -<=> 2Na + + 2Cl - + CO 2 + H 2 O
4. Jonu vienādojums ir uzrakstīts tā galīgajā formā (īss jonu vienādojums):
2H + + CO 3 2-<=> CO 2 + H 2 O
Ja reakcijas laikā ir izveidojušās un / vai slikti disociētas un / vai grūti šķīstošas \u200b\u200bun / vai gāzveida vielas un / vai ūdens, un izejmateriālos šādu savienojumu nav, tad reakcija būs praktiski neatgriezeniska (→), un tai ir molekulāra pilnīgs un kodolīgs jonu vienādojums. Ja šādas vielas ir gan reaģentos, gan produktos, reakcija būs atgriezeniska (<=>):
Molekulārais vienādojums: CaCO 3 + 2HCl<=> CaCl2 + H2O + CO 2
Pilnīgs jonu vienādojums: CaCO 3 + 2H + + 2Cl -<=> Ca 2+ + 2Cl - + H 2 O + CO 2
\u003e\u003e Ķīmija: jonu vienādojumi
Jonu vienādojumi
Kā jūs jau zināt no iepriekšējām ķīmijas stundām, lielākā daļa ķīmisko reakciju notiek šķīdumos. Tā kā visos elektrolītu šķīdumos ir joni, mēs varam teikt, ka reakcijas elektrolītu šķīdumos tiek reducētas līdz reakcijām starp joniem.
Šīs reakcijas, kas notiek starp joniem, sauc par jonu reakcijām. Un jonu vienādojumi ir tieši šo reakciju vienādojumi.
Parasti jonu reakcijas vienādojumus iegūst no molekulārajiem vienādojumiem, bet tas notiek, ja tiek ievēroti šādi noteikumi:
Pirmkārt, vāju elektrolītu formulas, kā arī nešķīstošas \u200b\u200bun nedaudz šķīstošas \u200b\u200bvielas, gāzes, oksīdi utt. jonu veidā netiek reģistrēts, izņēmums no šī noteikuma ir HSO-4 jons un pēc tam atšķaidītā veidā.
Otrkārt, jonu veidā parasti tiek uzrādītas stipru skābju, sārmu un arī ūdenī šķīstošo sāļu formulas. Jāņem vērā arī tas, ka tāda formula kā Ca (OH) 2 tiek uzrādīta jonu formā, ja tiek izmantots kaļķu ūdens. Ja tiek izmantots kaļķu piens, kas satur nešķīstošas \u200b\u200bCa (OH) 2 daļiņas, tad arī formula jonu formā nav uzrakstīta.
Sastādot jonu vienādojumus, viņi parasti izmanto pilnu jonu un saīsinātu, tas ir, īsu jonu reakcijas vienādojumu. Ja mēs ņemam vērā jonu vienādojumu, kuram ir saīsināta forma, tad mēs tajā neievērojam jonus, tas ir, tie nav pilnīga jonu vienādojuma abās pusēs.
Apskatīsim piemērus, kā tiek rakstīti molekulārie, pilnīgie un saīsinātie jonu vienādojumi:
Tāpēc jāatceras, ka vielu, kas nesadalās, kā arī nešķīstošās un gāzveida, formulas, sastādot jonu vienādojumus, parasti tiek rakstītas molekulārā formā.
Tāpat jāatceras, ka gadījumā, ja viela nokrīt, tad blakus šādai formulai tiek attēlota lejup vērsta bultiņa (↓). Nu, ja reakcijas laikā izdalās gāzveida viela, tad blakus formulai jābūt ikonai, piemēram, bultiņai, kas vērsta uz augšu ().
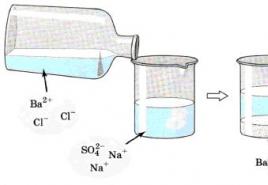
Apskatīsim tuvāk piemēru. Ja mums ir nātrija sulfāta Na2SO4 šķīdums un tam pievienojam bārija hlorīda BaCl2 šķīdumu (132. attēls), mēs redzēsim, ka esam izveidojuši baltas bārija sulfāta BaSO4 nogulsnes.
Cieši apskatiet attēlu, kurā parādīta nātrija sulfāta un bārija hlorīda mijiedarbība:

Tagad pierakstīsim reakcijas molekulāro vienādojumu:
Nu, tagad pārrakstīsim šo vienādojumu, kur spēcīgi elektrolīti tiks attēloti jonu formā, un reakcijas, kas atstāj sfēru, tiek pasniegtas molekulu formā:
Pirms mums ir pilns reakcijas jonu vienādojums.
Tagad mēģināsim noņemt identiskus jonus no vienas un otras vienlīdzības daļas, tas ir, no tiem joniem, kuri nepiedalās reakcijā 2Na + un 2Сl, tad mēs iegūsim saīsinātu jonu reakcijas vienādojumu, kas izskatīsies šādi:
![]()
No šī vienādojuma mēs redzam, ka visa šīs reakcijas būtība tiek reducēta līdz bārija jonu Ba2 + un sulfāta jonu mijiedarbībai.
un ka rezultātā veidojas BaSO4 nogulsnes, pat neatkarīgi no šo jonu elektrolīta sastāva pirms reakcijas.
Kā atrisināt jonu vienādojumus
Visbeidzot, apkoposim mūsu stundu un noteiksim, kā atrisināt jonu vienādojumus. Mēs jau zinām, ka visas reakcijas, kas notiek elektrolītu šķīdumos starp joniem, ir jonu reakcijas. Šīs reakcijas parasti tiek atrisinātas vai aprakstītas, izmantojot jonu vienādojumus.
Tāpat jāatceras, ka visi savienojumi, kas ir gaistoši, grūti šķīstoši vai slikti disociēti, atrod šķīdumu molekulārā formā. Nevajadzētu aizmirst arī to, ka gadījumā, ja elektrolītu šķīdumu mijiedarbības laikā neviena no iepriekšminētajiem savienojumu veidiem neveidojas, tas nozīmē, ka reakcijas praktiski nenotiek.
Noteikumi jonu vienādojumu risināšanai
Par piemēru ņemiet slikti šķīstoša savienojuma veidošanos, piemēram:
Na2SO4 + BaCl2 \u003d BaSO4 + 2NaCl
Jonu formā šī izteiksme būs:
2Nа + + SО42- + Ba2 + + 2Сl- \u003d BaSО4 + 2Nа + + 2Сl-
Tā kā mēs novērojam, ka reakcijā iekļuva tikai bārija un sulfāta joni, un pārējie joni nereaģēja un to stāvoklis palika nemainīgs. No tā izriet, ka mēs varam vienkāršot šo vienādojumu un rakstīt saīsinātā formā:
Ba2 + + SO42- \u003d BaSO4
Tagad atcerēsimies, kas mums jādara, risinot jonu vienādojumus:
Pirmkārt, no vienādojuma abām pusēm ir jāizslēdz vieni un tie paši joni;
Otrkārt, nevajadzētu aizmirst, ka vienādojuma elektrisko lādiņu summai jābūt vienādai gan tās labajā, gan kreisajā pusē.
1. piemērs.
Fe (OH) 2 + H2S04 FeSO4 + 2H20
Fe (OH) 2 ir praktiski nešķīstošs savienojums (sk. Šķīdības tabulu), un tāpēc to raksta nedisociētā (molekulārā) formā: Fe (OH) 2.
H 2 SO 4 ir labi šķīstošs savienojums, kas vienlaikus ir arī spēcīgs elektrolīts (sk. Iepriekš sniegto skābju - spēcīgo elektrolītu sarakstu), un tāpēc tas ir uzrakstīts disociētā formā: 2H + + SO4 2-.
FeSO 4 ir labi šķīstošs savienojums (skat. Šķīdības tabulu), kas vienlaikus ir arī spēcīgs elektrolīts (jo tas ir sāls), un tāpēc tas ir uzrakstīts disociētā formā: Fe 2+ + SO 4 2-.
Ūdens H 2 O ir vājš elektrolīts, un tāpēc to nedisociētā formā raksta: 2H 2 O.
Fe (OH) 2 + 2H + + SO4 2- Fe2+ \u200b\u200b+ SO4 2- + 2H20
vai pēc identisku daļiņu atcelšanas vienādojuma kreisajā un labajā pusē (SO 4 2-):
Fe (OH) 2 + 2H + Fe 2+ + 2H 2 O
Piemērs 2 ... Uzrakstiet jonu-molekulu reakcijas vienādojumu:
FeCl3 + 3NH4OH Fe (OH) 3 ↓ + 3NH 4 Cl
FeCl 3 ir labi šķīstošs savienojums, kas ir arī spēcīgs elektrolīts (jo tas ir sāls), un tāpēc tas ir rakstīts disociētā formā: Fe 3+ + 3Cl -.
NH 4 OH ir arī šķīstošs savienojums, bet tas ir vājš elektrolīts (nav iekļauts spēcīgo bāzu sarakstā, skatīt iepriekš), un tāpēc molekulu formā ir uzrakstīts: 3NH4OH.
Fe (OH) 3 ir praktiski nešķīstošs savienojums, un tāpēc molekulu formā ir uzrakstīts: Fe (OH) 3.
NH 4 Cl ir labi šķīstošs savienojums, kas vienlaikus ir spēcīgs elektrolīts (jo tas ir sāls), un tāpēc tas ir uzrakstīts disociētā formā: 3NH 4 + + 3Cl -.
Kopējais jonu-molekulārais vienādojums ir rakstīts šādi:
Fe3 + + 3Cl - + 3NH4OH Fe (OH) 3 ↓ + 3NH 4 + + 3Cl -
vai pēc identisku jonu (Cl -) reducēšanas
Fe 3+ + 3NH 4 OH Fe (OH) 3 ↓ + 3NH 4 +.
3. piemērs. Uzrakstiet jonu-molekulu reakcijas vienādojumu:
KI + AgI K.
KI ir ļoti šķīstošs savienojums, kas vienlaikus ir arī spēcīgs elektrolīts (jo tas ir sāls), un tāpēc tas ir rakstīts disociētā formā: K + + I -.
AgI ir praktiski nešķīstošs savienojums, un tāpēc to nedisociētā (molekulārā) formā raksta: AgI.
K ir komplekss savienojums, par ko liecina kvadrātiekavu klātbūtne savienojuma formulā. Pats savienojums ir sāls, kas labi šķīst ūdenī (nogulsnes zīme nav izteikta), un tāpēc tam vajadzētu sadalīties K + un - jonos. Šajā gadījumā izveidojies jons ir sarežģīts (stabils), tas ir, tas praktiski vairs netiek pakļauts disociācijai. Tādējādi savienojums tiek rakstīts šādi: K + + -.
Kopējais jonu-molekulārais vienādojums ir rakstīts šādi:
K + + I - + AgI \u003d K + + -
vai pēc identisku daļiņu atcelšanas vienādojuma kreisajā un labajā pusē (K +)
AgI + I - - .
Darba pabeigšana
Pieredze 1. Slikti šķīstošo bāzu veidošanās.Vienā mēģenē ielej 3-5 pilienus dzelzs (III) sāls šķīduma, citā - tādu pašu vara (II) sāls šķīdumu un trešajā - niķeļa (II) sāls šķīdumu. Katrā mēģenē pievieno dažus pilienus sārma šķīduma, līdz notiek nokrišņi. Saglabājiet nokrišņus līdz nākamajam eksperimentam.
Kādai klasei pieder iegūtās metāla hidroksīda nogulsnes? Vai šie hidroksīdi ir spēcīgas bāzes?
Pieredze 2. Slikti šķīstošo bāzu šķīdināšana.Iepriekšējā eksperimentā iegūtajām nogulsnēm pievieno vairākus pilienus sālsskābes šķīduma ar koncentrāciju 15%, līdz tie pilnībā izšķīst.
Kāds jauns zemas disociācijas savienojums rodas, izšķīdinot bāzes skābē?
Pieredze 3. Vāji šķīstošo sāļu veidošanās.
A. Divās mēģenēs ielej 3-5 pilienus svina (II) nitrāta šķīduma un vienā mēģenē pievieno dažus pilienus kālija jodīda, bet otrā - bārija hlorīdu.
Kas tiek novērots katrā mēģenē?
B. Vienā mēģenē ielej 3-5 pilienus nātrija sulfāta šķīduma, bet otrā - tādu pašu daudzumu hroma (III) sulfāta šķīduma. Katrā mēģenē pievieno dažus pilienus bārija hlorīda šķīduma, līdz notiek nokrišņi.
Kāda viela veidojas kā nogulsnes? Vai notiks līdzīga bārija hlorīda reakcija, piemēram, ar dzelzs (III) sulfātu?
Pieredze 4. Amfoterisko hidroksīdu īpašību izpēte.
UN . Pievienojiet 3 pilienus cinka sāls šķīduma un dažus pilienus divām mēģenēm atšķaidītskaustiskās soda šķīdums (no statīva ar reaģentiem), līdz izveidojas cinka hidroksīda nogulsnes. Izšķīdiniet iegūtās nogulsnes: vienā mēģenē - sālsskābes šķīdumā, otrā - pārmērīgā daudzumā koncentrētskaustiskā soda šķīdums (no tvaika nosūcēja).
B. Divās mēģenēs pievieno 3 pilienus alumīnija sāls šķīduma un dažus pilienus atšķaidītsnātrija hidroksīda šķīdums (no statīva ar reaģentiem), līdz veidojas alumīnija hidroksīda nogulsnes. Izšķīdiniet iegūtās nogulsnes: vienā mēģenē - sālsskābes šķīdumā, citā - pārmērīgā daudzumā koncentrēts
B. Divās mēģenēs pievieno 3 pilienus hroma (III) sāls šķīduma un dažus pilienus atšķaidītskaustiskās soda šķīdums (no statīva ar reaģentiem), līdz izveidojas hroma (III) hidroksīda nogulsnes. Izšķīdiniet iegūtās nogulsnes: vienā mēģenē - sālsskābes šķīdumā, otrā - pārmērīgā daudzumā koncentrētskaustiskā soda šķīdums (no tvaika nosūcēja).
Pieredze 5. Zemas disociācijas savienojumu veidošanās.Testa mēģenē pievieno 3-5 pilienus amonija hlorīda šķīduma un pievieno dažus pilienus nātrija hidroksīda šķīduma. Pievērsiet uzmanību smaržai, izskaidrojiet tās izskatu, pamatojoties uz reakcijas vienādojumu.
Pieredze 6. Kompleksu veidošanās.Testa mēģenē ielej 3-5 pilienus vara (II) sulfāta šķīduma, pēc tam pievieno pilienus atšķaidīts(no statīva ar reaģentiem!) amonjaka šķīdums, līdz reakcijas rezultātā izveidojas hidroksimetija (II) sulfāta nogulsnes:
2CuSO 4 + 2NH 4 OH \u003d (CuOH) 2 SO 4 ↓ + (NH 4) 2 SO 4
Pievieno pārpalikumu nogulsnēm koncentrētsamonjaka šķīdums (no tvaika nosūcēja!). Pievērsiet uzmanību nogulumu izšķīdināšanai atbilstoši reakcijai:
(CuOH) 2S04 + (NH4) 2S04 + 6NH4OH \u003d 2SO4 + 8H2O
Kāda ir iegūtā šķīstošā vara ammīna kompleksa krāsa?
Pieredze 7. Gāzu veidošanās.
A. Testa mēģenē ielej 3-5 pilienus nātrija karbonāta šķīduma un dažus pilienus sērskābes. Kas tiek novērots?
B. Testa mēģenē ielej 3-5 pilienus nātrija sulfīda šķīduma un 1 pilienu sērskābes. Ievērojiet izplūstošās gāzes smaržu.
Sastādot jonu vienādojumus, jāvadās no tā, ka zemu disociācijas, nešķīstošo un gāzveida vielu formulas ir uzrakstītas molekulārā formā. Ja viela nogulsnējas, tad, kā jūs jau zināt, blakus tās formulai tiek novietota bultiņa, kas vērsta uz leju (↓), un, ja reakcijas laikā izdalās gāzveida viela, tad blakus tās formulai tiek novietota bultiņa, kas norāda uz augšu ().
Piemēram, ja nātrija sulfāta Na 2 SO 4 šķīdumam pievieno bārija hlorīda BaCl 2 šķīdumu (132. attēls), reakcijas rezultātā rodas baltas bārija sulfāta BaSO 4 nogulsnes. Pierakstīsim reakcijas molekulāro vienādojumu:

Attēls: 132.
Reakcija starp nātrija sulfātu un bārija hlorīdu
Pārrakstīsim šo vienādojumu, attēlojot spēcīgus elektrolītus jonu formā un atstājot reakcijas sfēru molekulu formā:
Tādējādi mēs esam pierakstījuši pilnu reakcijas jonu vienādojumu. Ja izslēdzam tos pašus jonus no vienlīdzības abām pusēm, t.i., jonus, kas nepiedalās reakcijā (2Na + un 2Сl - vienādojuma kreisajā un labajā pusē), tad iegūstam saīsināto reakcijas jonu vienādojumu:
Šis vienādojums parāda, ka reakcijas būtība tiek reducēta līdz bārija jonu Ba 2+ un sulfāta jonu mijiedarbībai, kā rezultātā veidojas BaSO 4 nogulsnes. Šajā gadījumā nav svarīgi, kādos elektrolītos šie joni bija pirms reakcijas. Līdzīgu mijiedarbību var novērot starp K 2 SO 4 un Ba (NO 3) 2, H 2 SO 4 un BaCl 2.
Laboratorijas eksperiments Nr. 17
Nātrija hlorīda un sudraba nitrāta šķīdumu mijiedarbība
- Pievienojiet dažus pilienus sudraba nitrāta šķīduma 1 ml nātrija hlorīda šķīduma mēģenē, izmantojot pipeti. Ko tu skaties? Pierakstiet molekulāro un jonu reakciju vienādojumus. Saskaņā ar saīsināto jonu vienādojumu iesakiet vairākas iespējas, kā veikt šādu reakciju ar citiem elektrolītiem. Pierakstiet veikto reakciju molekulāros vienādojumus.
Tādējādi saīsināti jonu vienādojumi ir vienādojumi vispārīgā formā, kas raksturo ķīmiskās reakcijas būtību un parāda, kuri joni reaģē un kura viela veidojas tā rezultātā.

Attēls: 133.
Reakcija starp slāpekļskābi un nātrija hidroksīdu
Ja slāpekļskābes šķīduma pārpalikumu pievieno nātrija hidroksīda šķīdumam, kas krāsots ar fenolftaleīnu sārtinātā krāsā (133. attēls), tad šķīdums mainīs krāsu, kas kalpos kā signāls ķīmiskai reakcijai:
NaOH + HNO3 \u003d NaNO3 + H20.
Šīs reakcijas pilnīgais jonu vienādojums ir:
Na + + OH - + H + + NO 3 \u003d Na + + NO - 3 + H 2 O
Bet, tā kā joni Na + un NO - 3 šķīdumā paliek nemainīgi, tos var izlaist, un galu galā saīsinātais reakcijas jonu vienādojums tiek rakstīts šādi:
H + + OH - \u003d H20.
Tas parāda, ka stipras skābes un sārma mijiedarbība tiek reducēta līdz H + jonu un OH - jonu mijiedarbībai, kā rezultātā veidojas maz disociējoša viela - ūdens.
Līdzīga apmaiņas reakcija var notikt ne tikai starp skābēm un sārmiem, bet arī starp skābēm un nešķīstošajām bāzēm. Piemēram, ja, mijiedarbojoties vara (II) sulfātam ar sārmu, iegūstat zilu nešķīstoša vara (II) hidroksīda nogulsnes:

un pēc tam sadaliet iegūtos nogulsnes trīs daļās un pievienojiet sērskābes šķīdumu nogulsnēm pirmajā mēģenē, sālsskābes nogulsnēm otrajā mēģenē un slāpekļskābes šķīdumu nogulumiem trešajā mēģenē, tad nogulsnes izšķīdīs visās trijās mēģenēs (135. attēls). ...

Attēls: 135.
Vara (II) hidroksīda mijiedarbība ar skābēm:
a - sērskābe; b - sāls; c - slāpeklis
Tas nozīmēs, ka visos gadījumos ir notikusi ķīmiska reakcija, kuras būtība tiek atspoguļota, izmantojot to pašu jonu vienādojumu.
Cu (OH) 2 + 2H + \u003d Cu2 + + 2H20.
Lai to pārbaudītu, pierakstiet doto reakciju molekulāros, pilnīgos un saīsinātos jonu vienādojumus.
Laboratorijas eksperiments Nr. 18
Nešķīstoša hidroksīda iegūšana un tā mijiedarbība ar skābēm
- Trīs mēģenēs ielej 1 ml dzelzs (III) hlorīda vai sulfāta šķīduma. Katrā mēģenē ielej 1 ml sārma šķīduma. Ko tu skaties? Tad testa mēģenēs attiecīgi pievieno sērskābes, slāpekļskābes un sālsskābes šķīdumus, līdz nogulsnes izzūd. Pierakstiet molekulāro un jonu reakciju vienādojumus.
Iesakiet vairākas iespējas, kā veikt šādu reakciju ar citiem elektrolītiem. Pierakstiet piedāvāto reakciju molekulāros vienādojumus.
Apsveriet jonu reakcijas, kas rodas, veidojoties gāzei.
Divās mēģenēs ielej 2 ml nātrija karbonāta un kālija karbonāta šķīdumu. Tad pirmajā sālsskābes devā, bet otrajā - slāpekļskābes šķīdumā (136. attēls). Abos gadījumos mēs pamanīsim raksturīgu "vārīšanos" izdalītā oglekļa dioksīda dēļ.

Attēls: 136.
Šķīstošo karbonātu mijiedarbība:
a - ar sālsskābi; b - ar slāpekļskābi
Pirmajā gadījumā pierakstīsim molekulārās un jonu reakcijas vienādojumus:

Elektrolītu šķīdumos notiekošās reakcijas tiek uzrakstītas, izmantojot jonu vienādojumus. Šīs reakcijas sauc par jonu apmaiņas reakcijām, jo \u200b\u200bšķīdumā elektrolīti apmaina savus jonus. Tādējādi var izdarīt divus secinājumus.
Atslēgas vārdi un frāzes
- Molekulāro un jonu reakciju vienādojumi.
- Jonu apmaiņas reakcijas.
- Neitralizācijas reakcijas.
Darbs ar datoru
- Skatiet elektronisko pieteikumu. Izpētiet stundu un izpildiet ieteiktos uzdevumus.
- Meklējiet internetā e-pasta adreses, kuras var kalpot kā papildu avoti, lai atklātu rindkopā esošo atslēgvārdu un frāžu saturu. Piedāvājiet palīdzēt skolotājam sagatavot jaunu stundu, ziņojot par atslēgvārdiem un frāzēm nākamajā rindkopā.
Jautājumi un uzdevumi

Atšķaidītos elektrolītu (skābju, bāzu, sāļu) šķīdumos ķīmiskās reakcijas parasti notiek, piedaloties joni.
Šajā gadījumā visi reaģentu elementi var saglabāt oksidācijas pakāpes ( apmainīties ar reakcijām) vai mainiet tos ( redoksreakcijas).
Saskaņā ar bertoleta likums, jonu reakcijas turpinās gandrīz neatgriezeniski, ja veidojas cietas, nedaudz šķīstošas \u200b\u200bvielas (tie nogulsnējas), ļoti gaistošas \u200b\u200bvielas (tās izdalās ūdens gāzēs) vai šķīstošās vielas - vāji elektrolīti (ieskaitot ūdeni). Jonu reakcijas attēlo vienādojumu sistēma - molekulāra, pilnīgs un kodolīgs jonu... Pilni jonu vienādojumi ir izlaisti zemāk.
Rakstot jonu reakciju vienādojumus, obligāti jāvadās.
Reakciju ar nokrišņiem piemēri:
a) Ba (OH) 2 + H 2 SO 4 \u003d BaSO 4 ↓ + 2H 2 O
Ba 2+ + SO 4 2- \u003d BaSO 4 ↓
b) AgNO 3 + KI \u003d AgI ↓ + KNO 3
Ag + + I - \u003d AgI ↓
c) MgCl2 + 2KOH \u003d Mg (OH) 2 ↓ + 2KCl
Mg 2+ + 2OH - \u003d Mg (OH) 2 ↓
d) 3Zn (CH 3 COO) 2 + 2Na 3 PO 4 \u003d Zn 3 (PO 4) 2 ↓ + 6Na (CH 3 COO)
3Zn 2+ + 2PO 4 3- \u003d Zn 3 (PO 4) 2 ↓
Lūdzu, ņemiet vērā, ka AgCO 3, BaCO 3 un CaCO 3 PRAKTISKI IR RISINĀJUŠI ŪDENĪ UN NODROŠINĀT SEDIMENTĀ, KĀ PIEMĒRO:
Ba (NO 3) 2 + K 2 CO 3 \u003d BaCO 3 ↓ + 2KNO 3
Ba 2+ + CO 3 2- \u003d BaCO 3 ↓
Citu katjonu, piemēram, MgCO 3, CuCO 3, FeCO 3, ZnCO 3 un citu, sāļi, lai arī ūdenī nešķīstoši, jonu reakciju laikā no ūdens šķīduma neizgulsnējas (t.i., tos nevar iegūt ar šo metodi).
Piemēram, dzelzs (II) karbonāts FeCO 3, kas iegūts "sauss" vai ņemts kā minerāls siderīts, nonākot ūdenī, nogulsnējas bez redzamas mijiedarbības. Tomēr, ja to mēģina iegūt, veicot apmaiņas reakciju šķīdumā starp FeSO 4 un K 2 CO 3, nogulsnējas bāzisks sāls (tiek sniegts nosacītais sastāvs, praksē sastāvs ir sarežģītāks) un izdalās oglekļa dioksīds:
2FeSO 4 + H 2 O + 2Na 2 CO 3 \u003d 2Na 2 SO 4 + Fe 2 CO 3 (OH) 2 ↓ + CO 2
2Fe 2+ + H 2 O + 2CO 3 2- \u003d Fe 2 CO 3 (OH) 2 ↓ + CO 2
Līdzīgi kā FeCO 3, arī hroma (3) sulfīds Cr 2 S 3 (ūdenī nešķīstošs) no šķīduma neizgulsnējas:
2CrCl 3 + 6H 2 O + 3Na 2 S \u003d 6NaCl + 2Cr (OH) 3 ↓ + 3H 2 S
2Cr 3+ + 6H 2 O + 3S 2- \u003d 2Cr (OH) 3 ↓ + 3H 2 S
Daži sāļi sadalītiesūdens - sulfīds alumīnijs Al 2 S 3 (kā arī BeS) un acetāts hroms (III) Cr (CH3COO) 3:
a) Al 2S 3 + 6H 2 O \u003d 2Al (OH) 3 ↓ + 3H 2S
b) Cr (CH 3 COO) 3 + 2H 2 O \u003d Cr (CH 3 COO) (OH) 2 ↓ + 2CH 3 COOH
Tādēļ šos sāļus nevar iegūt ar apmaiņas reakciju šķīdumā:
a) 2AlCl 3 + 6H 2 O + 3K 2 S \u003d 6KCl + 2Al (OH) 3 ↓ + 3H 2 S
2Al 3+ + 6H 2 O + 3S 2- \u003d 2Al (OH) 3 ↓ + 3H 2 S
b) CrCl3 + 2H2O + 3Na (CH3COO) \u003d
3NaCl + Cr (CH3COO) (OH) 2 ↓ + 2CH3 COOH
Cr 3+ + 2H 2 O + 3CH 3 COO - \u003d
Cr (CH 3 COO) (OH) 2 ↓ + CH 3 COOH
Gāzes evolūcijas reakciju piemēri:
a) BaS + 2HCl \u003d BaCl2 + H2S
S 2- + 2H + \u003d H2S
b) Na 2 CO 3 + H 2 SO 4 \u003d Na 2 SO 4 + CO 2 + H 2 O
CO 3 2- + 2H + \u003d CO 2 + H 2 O
c) CaCO 3 (T) + 2HNO3 \u003d Ca (NO 3) 2 + CO 2 + H 2 O
CaCO 3 (T) + 2H + \u003d Ca 2+ + CO 2 + H 2 O
Reakciju ar vāju elektrolītu veidošanos piemēri:
a) 3NaOH + H3P04 \u003d Na3P04 + 3H20
3OH - + H3 PO4 \u003d PO4 3- + 3H20
b) Mg (CH3COO) 2 + H2S04 \u003d MgSO4 + 2CH3COOH
CH3COO - + H + \u003d CH3COOH
c) NH4F + HBr \u003d NH4Br + HF
F - + H + \u003d HF
Ja apmaiņas reakcijas reaģenti un produkti nav spēcīgi elektrolīti, vienādojuma jonu forma nav, piemēram:
Mg (OH) 2 (T) + 2HF \u003d MgF2 ↓ + 2H20