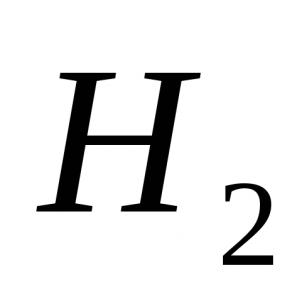Sels de fer 3 couleurs. Propriétés chimiques du fer et de ses composés, leur application
Formule:
Sulfate de fer (II), sulfate ferreux, FeSO 4 - un sel d'acide sulfurique et de fer 2-valent. Dureté - 2.
En chimie, le sulfate de fer est appelé hydrate cristallin sulfate de fer(II). Cristaux vert clair. Il est utilisé dans l'industrie textile, dans l'agriculture comme insecticide, pour la préparation de peintures minérales.
Analogue naturel - minéral mélantérite; dans la nature, il se produit dans les cristaux du système monoclinoédrique, de couleur vert-jaune, sous forme de traînées ou de stries.
Masse molaire: 151,91 g/mole
Densité: 1,8-1,9 g/cm³
Température de fusion: 400°C
solubilité dans l'eau: 25,6 g/100 ml
Le sulfate de fer 2-valent est libéré à des températures de 1,82 ° C à 56,8 ° C à partir de solutions aqueuses sous forme de cristaux vert clair de FeSO 4 7H 2 O, est appelé sulfate ferreux (hydrate cristallin) en technologie. Dissout dans 100 g d'eau : 26,6 g de FeSO 4 anhydre à 20°C et 54,4 g à 56°C.
Les solutions de sulfate de fer bivalent sous l'influence de l'oxygène atmosphérique s'oxydent avec le temps, se transformant en sulfate de fer (III):
12FeSO 4 + O 2 + 6H 2 O \u003d 4Fe 2 (SO 4) 3 + 4Fe (OH) 3 ↓
Chauffé au-dessus de 480 °C, il se décompose :
2FeSO 4 → Fe 2 O 3 + SO 2 + SO 3
Le reçu.
Le vitriol ferreux peut être préparé par l'action de l'acide sulfurique dilué sur la ferraille, les chutes de fer de toiture, etc. Dans l'industrie, il est obtenu comme sous-produit lorsque des tôles de fer, des fils, etc. sont attaqués avec du H 2 SO 4 dilué pour enlever le tartre.
Fe + H 2 SO 4 \u003d FeSO 4 + H 2
Une autre façon est la torréfaction oxydative de la pyrite :
2FeS 2 + 7O 2 + 2H 2 O \u003d 2FeSO 4 + 2H 2 SO 4
Analyse qualitative.
Réactions analytiques pour le cation de fer (II).
1. Avec de l'hexacyanoferrate de potassium(III) K 3 avec formation d'un précipité bleu foncé d'hexacyanoferrate(III) de fer(II) de potassium (« bleu turnbull »), insoluble dans les acides, se décomposant avec les alcalis pour former Fe(OH) 3 (HF).
FeSO 4 + K 3 KFe + K 2 SO 4
La valeur de pH optimale pour la réaction est de 2-3. La réaction est fractionnée, très sensible. Des concentrations élevées de Fe 3+ interfèrent.
2. Avec du sulfure d'ammonium (NH 4 ) 2 S avec formation d'un précipité noir, soluble dans les acides forts (HF).
FeSO 4
+ (NH4)2S  FeS + (NH 4) 2 SO 4
FeS + (NH 4) 2 SO 4
3.2. Réactions analytiques pour l'ion sulfate.
1. Avec le réactif de groupe BaCl 2 + CaCl 2 ou BaCl 2 (GF).
L'ouverture fractionnée de l'ion sulfate est réalisée dans un environnement acide, ce qui élimine l'effet gênant de CO 3 2-, PO 4 3-, etc., et en faisant bouillir la solution d'essai avec 6 mol / dm 3 HCl pour éliminer S 2 -, SO 3 2 -, S 2 O 3 2-, qui peuvent former du soufre élémentaire dont le précipité peut être pris comme précipité de BaSO 4 . Le précipité de BaSO 4 est capable de former des cristaux isomorphes avec KMnO 4 et de virer au rose (la spécificité de la réaction augmente).
Méthodologie effectuer la réaction en présence de 0,002 mol/dm 3 KMnO 4 .
A 3-5 gouttes de la solution d'essai, ajouter des volumes égaux de solutions de permanganate de potassium, de chlorure de baryum et d'acide chlorhydrique et mélanger vigoureusement pendant 2-3 minutes. Laisser décanter et, sans séparer le précipité de la solution, ajouter 1 à 2 gouttes d'une solution à 3 % de H 2 O 2 , mélanger et centrifuger. Le précipité doit rester de couleur rose et la solution au-dessus du précipité doit devenir incolore.
2. Avec de l'acétate de plomb.
ALORS 4
2-
+Pb2+  PbSO4
PbSO4
Méthodologie : à 2 cm 3 de solution de sulfate ajouter 0,5 cm 3 d'acide chlorhydrique dilué et 0,5 cm 3 de solution d'acétate de plomb ; il se forme un précipité blanc, soluble dans une solution saturée d'acétate d'ammonium ou de soude.
PbSO 4 + 4 NaOH  Na2 + Na2SO4
Na2 + Na2SO4
Avec les sels de strontium - la formation d'un précipité blanc, insoluble dans les acides (contrairement aux sulfites).
ALORS 4
2
-+Sr2+  SrSO4
SrSO4
Méthodologie : À 4-5 gouttes de la solution analysée, ajoutez 4-5 gouttes d'une solution concentrée de chlorure de strontium, un précipité blanc se forme.
Avec des sels de calcium - la formation de cristaux aciculaires de gypse CaSO 4 2H 2 O.
SO 4 2- + Ca 2+ + 2H 2 O
 CaSO 4 2H 2 O
CaSO 4 2H 2 O
Méthodologie: déposer une goutte de la solution analysée et des sels de calcium sur une lame de verre légèrement sèche. Les cristaux formés sont examinés au microscope.
Analyse quantitative.
Permanganatométrie.
Détermination de la fraction massique de fer dans un échantillon de sel de Mohr (NH 4) 2 Fe (SO 4) 2 6H 2 O par la méthode permanganométrique
(option de titrage direct)
La définition est basée sur l'oxydation du fer(II) par le permanganate de potassium en fer(III).
10 FeSO 4 + 2 KMnO 4 + 8H 2 ALORS 4 = 5 Fe 2 (ALORS 4 ) 3 + 2 MnSO 4 +K 2 ALORS 4 + 8H 2 O
M(Fe) = 55,85 g/mol
Méthodologie: Le poids exact de sel de Mohr, nécessaire à la préparation de 100 cm 3 d'une solution 0,1 M de sel de Mohr, est transféré quantitativement dans une fiole jaugée d'une contenance de 100 cm 3, dissous dans un peu d'eau distillée, après dissolution, portée au trait avec de l'eau, mélangée. Une aliquote de la solution résultante (tâche individuelle) est placée dans un flacon de titrage, un volume égal d'acide sulfurique dilué (1:5) est ajouté et titré lentement avec une solution de permanganate de potassium jusqu'à ce qu'une couleur légèrement rose de la solution soit stable pendant 30 secondes.
Application.
Utilisé en fabrication encrer;
Dans le commerce des teintures (pour colorer la laine de couleur noire)
Pour la conservation des arbres.
Bibliographie.
- Nombre ordinal - 26.
- La période est la quatrième grande.
- Le huitième groupe, le sous-groupe secondaire.
- Le poids atomique est de 55,847.
- La structure de la couche électronique externe est désignée par la formule 3d 6 4s 2 .
- -Fé.
- Le nom est fer, la lecture dans la formule est "ferrum".
- Dans la nature, il existe quatre isotopes stables de l'élément en question avec des nombres de masse 54, 56, 57, 58.
- point de fusion - 1539 0 С;
- ébullition - 2862 0 C;
- activité - moyenne ;
- réfractaire - élevé;
- présente des propriétés magnétiques prononcées.
- acides;
- oxygène (y compris l'air);
- grise;
- halogènes;
- lorsqu'il est chauffé - avec de l'azote, du phosphore, du carbone et du silicium;
- avec des sels de métaux moins actifs, les réduisant en substances simples;
- avec de la vapeur d'eau vive;
- avec des sels de fer à l'état d'oxydation +3.
- Les noyaux des planètes terrestres - 90%.
- Dans la croûte terrestre - 5%.
- Dans le manteau terrestre - 12%.
- Dans le noyau terrestre - 86%.
- Dans l'eau de rivière - 2 mg/l.
- Dans la mer et l'océan - 0,02 mg / l.
- magnétite;
- limonite ou minerai de fer brun;
- vivianite;
- pyrrhotite;
- pyrite;
- sidérite;
- marcassite;
- lellingite;
- erreur de piqûre ;
- milanterite et autres.
- Fers moulés;
- devenir.
- oxyde;
- hydroxyde;
- composés binaires;
- sels complexes;
- composés complexes.
- Oxyde de fer(II). Poudre noire, insoluble dans l'eau. La nature de la connexion est basique. Il est capable de s'oxyder rapidement, cependant, il peut aussi être facilement réduit en une substance simple. Il se dissout dans les acides pour former les sels correspondants. Formule - FeO.
- Hydroxyde de fer(II). C'est un précipité blanc amorphe. Formé par la réaction de sels avec des bases (alcalis). Il présente de faibles propriétés basiques, est capable de s'oxyder rapidement dans l'air en composés de fer +3. Formule - Fe (OH) 2.
- Les sels d'un élément à l'état d'oxydation spécifié. En règle générale, ils ont une couleur vert pâle de la solution, s'oxydent bien même dans l'air, acquérant et se transformant en sels de fer 3. Ils se dissolvent dans l'eau. Exemples de composés : FeCL 2 , FeSO 4 , Fe(NO 3 ) 2 .

Plusieurs composés ont une importance pratique parmi les substances désignées. Tout d'abord, (II). C'est le principal fournisseur d'ions au corps humain souffrant d'anémie. Lorsqu'une telle maladie est diagnostiquée chez un patient, on lui prescrit des préparations complexes, basées sur le composé en question. C'est ainsi que la carence en fer dans le corps est reconstituée.
Deuxièmement, c'est-à-dire que le sulfate de fer (II), associé au cuivre, est utilisé pour détruire les ravageurs agricoles des cultures. La méthode a prouvé son efficacité depuis plus d'une douzaine d'années, elle est donc très appréciée des jardiniers et jardinières.
Sel Mora
Il s'agit d'un composé qui est un hydrate cristallin de sulfate de fer et d'ammonium. Sa formule s'écrit FeSO 4 * (NH 4) 2 SO 4 * 6H 2 O. L'un des composés du fer (II), largement utilisé dans la pratique. Les principaux domaines d'utilisation humaine sont les suivants.
- Pharmacie.
- Recherches scientifiques et analyses titrimétriques en laboratoire (pour déterminer la teneur en chrome, permanganate de potassium, vanadium).
- Médecine - comme additif aux aliments avec un manque de fer dans le corps du patient.
- Pour l'imprégnation des produits en bois, car le sel de Mora protège contre les processus de décomposition.
Il existe d'autres domaines dans lesquels cette substance trouve une application. Il tire son nom en l'honneur du chimiste allemand qui a découvert le premier les propriétés manifestées.
Substances à l'état d'oxydation du fer (III)
Les propriétés des composés du fer, dans lesquels il présente un état d'oxydation de +3, sont quelque peu différentes de celles décrites ci-dessus. Ainsi, la nature de l'oxyde et de l'hydroxyde correspondants n'est plus basique, mais amphotère prononcée. Nous donnons une description des principales substances.

Parmi les exemples donnés, d'un point de vue pratique, un hydrate cristallin tel que FeCL 3 * 6H 2 O, ou chlorure de fer (III) hexahydraté, est important. Il est utilisé en médecine pour arrêter les saignements et reconstituer les ions de fer dans le corps souffrant d'anémie.
Le sulfate de fer(III) pentahydraté est utilisé pour purifier l'eau potable, car il se comporte comme un coagulant.
Composés de fer(VI)
Les formules des composés chimiques du fer, où il présente un état d'oxydation spécial de +6, peuvent s'écrire comme suit :
- K 2 FeO 4 ;
- Na 2 FeO 4 ;
- MgFeO 4 et autres.
Tous ont un nom commun - ferrates - et ont des propriétés similaires (réducteurs puissants). Ils sont également capables de désinfecter et ont un effet bactéricide. Cela leur permet d'être utilisés pour le traitement de l'eau potable à l'échelle industrielle.
Composés complexes
Les substances spéciales sont très importantes en chimie analytique et pas seulement. Ceux qui se forment dans les solutions aqueuses de sels. Ce sont des composés complexes de fer. Les plus populaires et les mieux étudiés d'entre eux sont les suivants.
- Hexacyanoferrate de potassium (II) K 4 . Un autre nom pour le composé est le sel de sang jaune. Il est utilisé pour la détermination qualitative de l'ion fer Fe 3+ en solution. À la suite de l'exposition, la solution acquiert une belle couleur bleu vif, car un autre complexe se forme - le bleu de Prusse KFe 3+. Depuis l'Antiquité, il a été utilisé comme
- Hexacyanoferrate de potassium (III) K 3 . Un autre nom est le sel de sang rouge. Il est utilisé comme réactif qualitatif pour la détermination des ions fer Fe 2+ . En conséquence, un précipité bleu se forme, appelé bleu de Turnbull. Également utilisé comme teinture pour le tissu.

Fer dans la matière organique
Le fer et ses composés, comme nous l'avons déjà vu, ont une grande importance pratique dans la vie économique de l'homme. Cependant, en plus de cela, son rôle biologique dans l'organisme n'en est pas moins important, au contraire.
Il existe une protéine très importante qui comprend cet élément. C'est l'hémoglobine. C'est grâce à lui que l'oxygène est transporté et qu'un échange de gaz uniforme et rapide est effectué. Par conséquent, le rôle du fer dans le processus vital - la respiration - est tout simplement énorme.

Au total, le corps humain contient environ 4 grammes de fer, qui doivent être constamment reconstitués par les aliments consommés.
- Les formules chimiques doivent être saisies en respectant la casse
- Les index sont saisis sous forme de nombres normaux
- Le point sur la ligne médiane (signe de multiplication), utilisé par exemple dans les formules des hydrates cristallins, est remplacé par un point régulier.
- Exemple : au lieu de CuSO₄ 5H₂O, le convertisseur utilise l'orthographe CuSO4.5H2O pour faciliter la saisie.
- sel (chlorure de sodium) NaCl
- sucre (saccharose) C₁₂H₂₂O₁₁
- vinaigre (solution d'acide acétique) CH₃COOH
- déterminer les masses atomiques des éléments selon le tableau périodique;
- déterminer le nombre d'atomes de chaque élément dans la formule du composé ;
- déterminer la masse molaire en additionnant les masses atomiques des éléments compris dans le composé, multipliées par leur nombre.
- deux atomes de carbone
- quatre atomes d'hydrogène
- deux atomes d'oxygène
- carbone C = 2 × 12,0107 g/mol = 24,0214 g/mol
- hydrogène H = 4 × 1,00794 g/mol = 4,03176 g/mol
- oxygène O = 2 × 15,9994 g/mol = 31,9988 g/mol
- masse molaire = 24,0214 + 4,03176 + 31,9988 = 60,05196 g/mol
Lurie Yu.Yu. Manuel de chimie analytique. Moscou, 1972 ;
Ligne directrice "Méthodes instrumentales d'analyse", Perm, 2004 ;
Ligne directrice "Analyse chimique qualitative", Perm, 2003 ;
Ligne directrice "Analyse chimique quantitative", Perm, 2004 ;
Rabinovich V.A., Khavin Z.Ya. Bref ouvrage de référence chimique, Leningrad, 1991 ;
"Grande Encyclopédie soviétique" ;
DÉFINITION
Fer- un élément du huitième groupe de la quatrième période du système périodique des éléments chimiques de D. I. Mendeleïev.
Et le nombre languissant est 26. Le symbole est Fe (lat. "ferrum"). L'un des métaux les plus courants de la croûte terrestre (deuxième place après l'aluminium).
Propriétés physiques du fer
Le fer est un métal gris. Dans sa forme pure, il est assez mou, malléable et ductile. La configuration électronique du niveau d'énergie externe est 3d 6 4s 2 . Dans ses composés, le fer présente les états d'oxydation "+2" et "+3". Le point de fusion du fer est de 1539C. Le fer forme deux modifications cristallines : le fer α et γ. Le premier d'entre eux a un réseau cubique centré sur le corps, le second a un réseau cubique centré sur les faces. Le fer α est thermodynamiquement stable dans deux plages de température : en dessous de 912 et de 1394C au point de fusion. Entre 912 et 1394C, le fer γ est stable.
Les propriétés mécaniques du fer dépendent de sa pureté - de sa teneur même en très petites quantités d'autres éléments. Le fer solide a la capacité de dissoudre de nombreux éléments en lui-même.
Propriétés chimiques du fer
Dans l'air humide, le fer rouille rapidement, c'est-à-dire recouvert d'une couche brune d'oxyde de fer hydraté qui, en raison de sa friabilité, ne protège pas le fer d'une oxydation ultérieure. Dans l'eau, le fer se corrode intensément ; avec un accès abondant d'oxygène, des formes hydratées d'oxyde de fer (III) se forment:
2Fe + 3/2O 2 + nH 2 O = Fe 2 O 3 × H 2 O.
En cas de manque d'oxygène ou d'accès difficile, un oxyde mixte (II, III) Fe 3 O 4 se forme :
3Fe + 4H 2 O (v) ↔ Fe 3 O 4 + 4H 2.
Le fer se dissout dans l'acide chlorhydrique de toute concentration :
Fe + 2HCl \u003d FeCl 2 + H 2.
De même, la dissolution se produit dans l'acide sulfurique dilué :
Fe + H 2 SO 4 \u003d FeSO 4 + H 2.
Dans les solutions concentrées d'acide sulfurique, le fer est oxydé en fer (III) :
2Fe + 6H 2 SO 4 \u003d Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O.
Or, dans l'acide sulfurique dont la concentration est proche de 100 %, le fer devient passif et il n'y a pratiquement pas d'interaction. Dans les solutions diluées et modérément concentrées d'acide nitrique, le fer dissout :
Fe + 4HNO 3 \u003d Fe (NO 3) 3 + NO + 2H 2 O.
A des concentrations élevées d'acide nitrique, la dissolution ralentit et le fer devient passif.
Comme les autres métaux, le fer réagit avec des substances simples. Les réactions d'interaction du fer avec les halogènes (quel que soit le type d'halogène) se déroulent lorsqu'elles sont chauffées. L'interaction du fer avec le brome se produit à une pression de vapeur accrue de ce dernier :
2Fe + 3Cl 2 \u003d 2FeCl 3;
3Fe + 4I 2 = Fe 3 I 8.
L'interaction du fer avec le soufre (poudre), l'azote et le phosphore se produit également lorsqu'il est chauffé :
6Fe + N2 = 2Fe3N;
2Fe + P = Fe2P;
3Fe + P = Fe3P.
Le fer est capable de réagir avec des non-métaux tels que le carbone et le silicium :
3Fe + C = Fe3C;
Parmi les réactions d'interaction du fer avec des substances complexes, les réactions suivantes jouent un rôle particulier - le fer est capable de réduire les métaux qui se trouvent dans la série d'activités à sa droite, à partir de solutions salines (1), pour réduire le fer (III) composés (2) :
Fe + CuSO 4 \u003d FeSO 4 + Cu (1);
Fe + 2FeCl3 = 3FeCl2 (2).
Le fer, à pression élevée, réagit avec un oxyde non salifiant - CO pour former des substances de composition complexe - carbonyles - Fe (CO) 5, Fe 2 (CO) 9 et Fe 3 (CO) 12.
Le fer, en l'absence d'impuretés, est stable dans l'eau et dans les solutions alcalines diluées.
Obtenir du fer
Le principal moyen d'obtenir du fer est le minerai de fer (hématite, magnétite) ou l'électrolyse de solutions de ses sels (dans ce cas, on obtient du fer "pur", c'est-à-dire du fer sans impuretés).
Exemples de résolution de problèmes
EXEMPLE 1
| Exercer | Le tartre de fer Fe 3 O 4 pesant 10 g a d'abord été traité avec 150 ml d'une solution d'acide chlorhydrique (densité 1,1 g/ml) avec une fraction massique de chlorure d'hydrogène de 20 %, puis un excès de fer a été ajouté à la solution résultante. Déterminer la composition de la solution (en % en poids). |
| Décision | Nous écrivons les équations de réaction en fonction de la condition du problème : 8HCl + Fe 3 O 4 \u003d FeCl 2 + 2FeCl 3 + 4H 2 O (1); 2FeCl3 + Fe = 3FeCl2 (2). Connaissant la densité et le volume d'une solution d'acide chlorhydrique, vous pouvez trouver sa masse : m sol (HCl) = V(HCl) × ρ (HCl); m sol (HCl) \u003d 150 × 1,1 \u003d 165 g. Calculer la masse de chlorure d'hydrogène : m(HCl) = msol(HCl) x ω(HCl)/100% ; m(HCl) = 165 x 20 %/100 % = 33 g. La masse molaire (masse d'une mole) d'acide chlorhydrique, calculée à l'aide du tableau des éléments chimiques de D.I. Mendeleev - 36,5 g / mol. Trouvez la quantité de substance de chlorure d'hydrogène : v(HCl) = m(HCl)/M(HCl); v (HCl) \u003d 33 / 36,5 \u003d 0,904 mol. Masse molaire (masse d'une mole) d'échelle, calculée à l'aide du tableau des éléments chimiques de D.I. Mendeleïev - 232 g/mol. Trouver la quantité de substance calcaire : v (Fe 3 O 4) \u003d 10/232 \u003d 0,043 mol. Selon l'équation 1, v(HCl): v(Fe 3 O 4) \u003d 1 : 8, donc v (HCl) \u003d 8 v (Fe 3 O 4) \u003d 0,344 mol. Ensuite, la quantité de substance chlorhydrique calculée par l'équation (0,344 mol) sera inférieure à celle indiquée dans la condition du problème (0,904 mol). Par conséquent, l'acide chlorhydrique est en excès et une autre réaction se produira : Fe + 2HCl = FeCl2 + H2 (3). Déterminons la quantité de substance de chlorure de fer formée à la suite de la première réaction (les indices indiquent une réaction spécifique): v 1 (FeCl 2) : v (Fe 2 O 3) = 1:1 = 0,043 mol ; v 1 (FeCl 3) : v (Fe 2 O 3) = 2:1; v 1 (FeCl 3) = 2 × v (Fe 2 O 3) = 0,086 mol. Déterminons la quantité de chlorure d'hydrogène qui n'a pas réagi dans la réaction 1 et la quantité de chlorure de fer (II) formé lors de la réaction 3 : v rem (HCl) \u003d v (HCl) - v 1 (HCl) \u003d 0,904 - 0,344 \u003d 0,56 mol; v 3 (FeCl 2): v rem (HCl) = 1: 2; v 3 (FeCl 2) \u003d 1/2 × v rem (HCl) \u003d 0,28 mol. Déterminons la quantité de substance FeCl 2 formée lors de la réaction 2, la quantité totale de substance FeCl 2 et sa masse : v 2 (FeCl 3) = v 1 (FeCl 3) = 0,086 mol; v 2 (FeCl 2) : v 2 (FeCl 3) = 3:2; v 2 (FeCl 2) = 3/2× v 2 (FeCl 3) = 0,129 mol; v somme (FeCl 2) \u003d v 1 (FeCl 2) + v 2 (FeCl 2) + v 3 (FeCl 2) \u003d 0,043 + 0,129 + 0,28 \u003d 0,452 mol; m (FeCl 2) \u003d v somme (FeCl 2) × M (FeCl 2) \u003d 0,452 × 127 \u003d 57,404 g. Déterminons la quantité de substance et la masse de fer qui sont entrées dans les réactions 2 et 3 : v2(Fe) : v2(FeCl3) = 1:2; v 2 (Fe) \u003d 1/2 × v 2 (FeCl 3) \u003d 0,043 mol; v3(Fe) : vrem(HCl) = 1:2; v 3 (Fe) = 1/2 x v rem (HCl) = 0,28 mol ; v somme (Fe) \u003d v 2 (Fe) + v 3 (Fe) \u003d 0,043 + 0,28 \u003d 0,323 mol; m(Fe) = v somme (Fe) ×M(Fe) = 0,323 ×56 = 18,088 g. Calculons la quantité de substance et la masse d'hydrogène libérée dans la réaction 3 : v (H 2) \u003d 1/2 × v rem (HCl) \u003d 0,28 mol; m (H 2) \u003d v (H 2) × M (H 2) \u003d 0,28 × 2 \u003d 0,56 g. Nous déterminons la masse de la solution résultante m ' sol et la fraction massique de FeCl 2 qu'elle contient: m' sol \u003d m sol (HCl) + m (Fe 3 O 4) + m (Fe) - m (H 2); |
Le corps humain contient environ 5 g de fer, dont la majeure partie (70%) fait partie de l'hémoglobine dans le sang.
Propriétés physiques
A l'état libre, le fer est un métal blanc argenté avec une teinte grisâtre. Le fer pur est ductile et possède des propriétés ferromagnétiques. En pratique, les alliages de fer sont couramment utilisés - fontes et aciers.
Fe est l'élément le plus important et le plus courant des neuf métaux d du sous-groupe secondaire du groupe VIII. Avec le cobalt et le nickel, il forme la "famille du fer".
Lors de la formation de composés avec d'autres éléments, il utilise souvent 2 ou 3 électrons (B \u003d II, III).
Le fer, comme presque tous les éléments d du groupe VIII, ne présente pas une valence supérieure égale au numéro de groupe. Sa valence maximale atteint VI et est extrêmement rare.
Les composés les plus typiques sont ceux dans lesquels les atomes de Fe sont dans les états d'oxydation +2 et +3.
Méthodes d'obtention du fer
1. Le fer commercial (dans un alliage avec du carbone et d'autres impuretés) est obtenu par réduction carbothermique de ses composés naturels selon le schéma :

La récupération se fait progressivement, en 3 étapes :
1) 3Fe 2 O 3 + CO = 2Fe 3 O 4 + CO 2
2) Fe 3 O 4 + CO = 3FeO + CO 2
3) FeO + CO \u003d Fe + CO 2
La fonte issue de ce procédé contient plus de 2% de carbone. A l'avenir, les aciers seront obtenus à partir de fonte - alliages de fer contenant moins de 1,5% de carbone.
2. Le fer très pur est obtenu de l'une des manières suivantes :
a) décomposition du pentacarbonyl Fe
Fe(CO) 5 = Fe + 5CO
b) réduction par l'hydrogène de FeO pur
FeO + H 2 \u003d Fe + H 2 O
c) électrolyse de solutions aqueuses de sels de Fe +2
FeC 2 O 4 \u003d Fe + 2СO 2
oxalate de fer(II)
Propriétés chimiques
Fe - un métal d'activité moyenne, présente des propriétés générales caractéristiques des métaux.
Une caractéristique unique est la capacité de "rouiller" dans l'air humide :
En l'absence d'humidité avec de l'air sec, le fer ne commence à réagir sensiblement qu'à T > 150°C ; lorsqu'il est calciné, il se forme une "calcaire de fer" Fe 3 O 4 :
3Fe + 2O 2 = Fe 3 O 4
Le fer ne se dissout pas dans l'eau en l'absence d'oxygène. À très haute température, Fe réagit avec la vapeur d'eau, déplaçant l'hydrogène des molécules d'eau :
3 Fe + 4H 2 O (g) \u003d 4H 2
Le processus de rouille dans son mécanisme est la corrosion électrochimique. Le produit de la rouille est présenté sous une forme simplifiée. En effet, une couche meuble d'un mélange d'oxydes et d'hydroxydes de composition variable se forme. Contrairement au film Al 2 O 3 , cette couche ne protège pas le fer d'une destruction ultérieure.
Types de corrosion

Protection contre la corrosion du fer

1. Interaction avec les halogènes et le soufre à haute température.
2Fe + 3Cl 2 = 2FeCl 3
2Fe + 3F 2 = 2FeF 3
Fe + I 2 \u003d FeI 2
Des composés se forment dans lesquels le type de liaison ionique prédomine.
2. Interaction avec le phosphore, le carbone, le silicium (le fer ne se combine pas directement avec N 2 et H 2, mais les dissout).
Fe + P = Fe x P y
Fe + C = Fe x C y
Fe + Si = FexSiy
Des substances de composition variable se forment, puisque les berthollides (la nature covalente de la liaison prévaut dans les composés)
3. Interaction avec des acides "non oxydants" (HCl, H 2 SO 4 dil.)
Fe 0 + 2H + → Fe 2+ + H 2
Puisque Fe est situé dans la série d'activités à gauche de l'hydrogène (E ° Fe / Fe 2+ \u003d -0,44 V), il est capable de déplacer H 2 des acides ordinaires.
Fe + 2HCl \u003d FeCl 2 + H 2
Fe + H 2 SO 4 \u003d FeSO 4 + H 2
4. Interaction avec les acides "oxydants" (HNO 3 , H 2 SO 4 conc.)
Fe 0 - 3e - → Fe 3+
HNO 3 et H 2 SO 4 concentrés "passivent" le fer, de sorte qu'à des températures ordinaires, le métal ne s'y dissout pas. Avec un fort chauffage, une dissolution lente se produit (sans dégagement de H 2).
En razb. Le fer HNO 3 se dissout, passe en solution sous forme de cations Fe 3+ et l'anion acide est réduit en NO * :
Fe + 4HNO 3 \u003d Fe (NO 3) 3 + NO + 2H 2 O
Il se dissout très bien dans un mélange de HCl et HNO 3
5. Attitude envers les alcalis
Fe ne se dissout pas dans les solutions aqueuses d'alcalis. Il ne réagit avec les alcalis fondus qu'à des températures très élevées.
6. Interaction avec des sels de métaux moins actifs
Fe + CuSO 4 \u003d FeSO 4 + Cu
Fe 0 + Cu 2+ = Fe 2+ + Cu 0
7. Interaction avec le monoxyde de carbone gazeux (t = 200°C, P)
Fe (poudre) + 5CO (g) \u003d Fe 0 (CO) 5 fer pentacarbonyle
Composés Fe(III)
Fe 2 O 3 - oxyde de fer (III).
Poudre rouge-brun, n. R dans H 2 O. Dans la nature - "minerai de fer rouge".
Façons d'obtenir :
1) décomposition de l'hydroxyde de fer (III)
2Fe(OH) 3 = Fe 2 O 3 + 3H 2 O
2) torréfaction de la pyrite
4FeS 2 + 11O 2 \u003d 8SO 2 + 2Fe 2 O 3
3) décomposition du nitrate
Propriétés chimiques
Fe 2 O 3 est un oxyde basique avec des signes d'amphotère.
I. Les principales propriétés se manifestent dans la capacité de réagir avec les acides:
Fe 2 O 3 + 6H + = 2Fe 3+ + ZH 2 O
Fe 2 O 3 + 6HCI \u003d 2FeCI 3 + 3H 2 O
Fe 2 O 3 + 6HNO 3 \u003d 2Fe (NO 3) 3 + 3H 2 O
II. Propriétés acides faibles. Fe 2 O 3 ne se dissout pas dans les solutions aqueuses d'alcalis, mais lorsqu'il est fusionné avec des oxydes solides, des alcalis et des carbonates, des ferrites se forment :
Fe 2 O 3 + CaO \u003d Ca (FeO 2) 2
Fe 2 O 3 + 2NaOH \u003d 2NaFeO 2 + H 2 O
Fe 2 O 3 + MgCO 3 \u003d Mg (FeO 2) 2 + CO 2
III. Fe 2 O 3 - matière première pour la production de fer en métallurgie :
Fe 2 O 3 + ZS \u003d 2Fe + ZSO ou Fe 2 O 3 + ZSO \u003d 2Fe + ZSO 2
Fe (OH) 3 - hydroxyde de fer (III)
Façons d'obtenir :
Obtenu par action des alcalis sur les sels solubles Fe 3+ :
FeCl 3 + 3NaOH \u003d Fe (OH) 3 + 3NaCl
Au moment de la réception de Fe(OH) 3 - précipité mucosamorphe rouge-brun.
L'hydroxyde de Fe(III) se forme également lors de l'oxydation de Fe et Fe(OH) 2 en air humide :
4Fe + 6H 2 O + 3O 2 \u003d 4Fe (OH) 3
4Fe(OH) 2 + 2Í 2 O + O 2 = 4Fe(OH) 3
L'hydroxyde de Fe(III) est le produit final de l'hydrolyse des sels de Fe 3+.
Propriétés chimiques
Fe(OH) 3 est une base très faible (beaucoup plus faible que Fe(OH) 2). Présente des propriétés acides notables. Ainsi, Fe(OH) 3 a un caractère amphotère :
1) les réactions avec les acides se déroulent facilement :
2) un précipité frais de Fe(OH) 3 est dissous dans du concentré chaud. solutions de KOH ou NaOH avec formation de complexes hydroxo :
Fe (OH) 3 + 3KOH \u003d K 3
En solution alcaline, Fe(OH) 3 peut être oxydé en ferrates (sels de fer acide H 2 FeO 4 non isolés à l'état libre) :
2Fe(OH) 3 + 10KOH + 3Br 2 = 2K 2 FeO 4 + 6KBr + 8H 2 O
Fe 3+ sels
Les plus importants dans la pratique sont: Fe 2 (SO 4) 3, FeCl 3, Fe (NO 3) 3, Fe (SCN) 3, K 3 4 - sel de sang jaune \u003d Fe 4 3 bleu de Prusse (précipité bleu foncé)
b) Fe 3+ + 3SCN - \u003d Fe (SCN) 3 Fe (III) thiocyanate (solution rouge sang)
Les premiers produits à base de fer et de ses alliages ont été découverts lors de fouilles et remontent aux environs du IVe millénaire av. C'est-à-dire que même les anciens Égyptiens et Sumériens utilisaient des dépôts de météorites de cette substance pour fabriquer des bijoux et des articles ménagers, ainsi que des armes.
Aujourd'hui, divers types de composés de fer, ainsi que le métal pur, sont les substances les plus courantes et les plus utilisées. Pas étonnant que le 20e siècle ait été considéré comme du fer. Après tout, avant l'avènement et l'utilisation généralisée du plastique et des matériaux connexes, c'était ce composé qui avait une importance décisive pour l'homme. Quel est cet élément et quelles substances il forme, nous examinerons dans cet article.
Élément chimique fer
Si nous considérons la structure de l'atome, nous devons tout d'abord indiquer son emplacement dans le système périodique.
L'élément chimique du fer possède également environ 20 isotopes différents qui ne sont pas stables. Les états d'oxydation possibles qu'un atome donné peut présenter sont :
Non seulement l'élément lui-même est important, mais aussi ses divers composés et alliages.
Propriétés physiques
En tant que substance simple, le fer a une métallicité prononcée. C'est-à-dire qu'il s'agit d'un métal blanc argenté avec une teinte grise, qui a un degré élevé de ductilité et de ductilité et un point de fusion et d'ébullition élevé. Si nous considérons les caractéristiques plus en détail, alors:
Selon les conditions et les différentes températures, il existe plusieurs modifications que le fer forme. Leurs propriétés physiques diffèrent du fait que les réseaux cristallins diffèrent.

Toutes les modifications ont différents types de structure de réseaux cristallins et diffèrent également par leurs propriétés magnétiques.
Propriétés chimiques
Comme mentionné ci-dessus, la substance simple fer présente une activité chimique moyenne. Cependant, à l'état finement dispersé, il est capable de s'auto-enflammer dans l'air et le métal lui-même brûle dans l'oxygène pur.
La capacité de corrosion est élevée, de sorte que les alliages de cette substance sont recouverts de composés d'alliage. Le fer est capable d'interagir avec :
Il est évident que, montrant une telle activité, le métal est capable de former divers composés, de propriétés diverses et polaires. Et c'est ainsi que cela se produit. Le fer et ses composés sont extrêmement divers et sont utilisés dans diverses branches de la science, de la technologie et de l'activité humaine industrielle.
Répartition dans la nature
Les composés de fer naturel sont assez courants, car c'est le deuxième élément le plus courant sur notre planète après l'aluminium. Dans le même temps, sous sa forme pure, le métal est extrêmement rare, dans le cadre des météorites, ce qui indique ses grandes accumulations dans l'espace. La masse principale est contenue dans la composition des minerais, des roches et des minéraux.

Si nous parlons du pourcentage de l'élément en question dans la nature, les chiffres suivants peuvent être donnés.
Les composés de fer les plus courants forment les minéraux suivants :
C'est encore une longue liste, car il y en a vraiment beaucoup. De plus, divers alliages créés par l'homme sont répandus. Ce sont aussi de tels composés de fer, sans lesquels il est difficile d'imaginer la vie moderne des gens. Ceux-ci comprennent deux types principaux :
Le fer est également un ajout précieux à de nombreux alliages de nickel.
Composés de fer(II)
Ceux-ci incluent ceux dans lesquels l'état d'oxydation de l'élément de formation est +2. Ils sont assez nombreux, car ils comprennent :
Les formules des composés chimiques dans lesquels le fer présente le degré d'oxydation indiqué sont individuelles pour chaque classe. Considérez les plus importants et les plus courants d'entre eux.
Convertisseur de longueur et de distance Convertisseur de masse Aliments en vrac et convertisseur de volume Convertisseur de surface Convertisseur d'unités de volume et de recette Convertisseur de température Convertisseur de pression, de contrainte et de module d'Young Convertisseur d'énergie et de travail Convertisseur de puissance Convertisseur de force Convertisseur de temps Convertisseur de vitesse linéaire Convertisseur d'angle plat Convertisseur d'efficacité thermique et d'efficacité énergétique de nombres dans différents systèmes de numération Convertisseur d'unités de mesure de la quantité d'informations Taux de change Dimensions des vêtements et des chaussures pour femmes Dimensions des vêtements et des chaussures pour hommes Convertisseur de vitesse angulaire et de fréquence de rotation Convertisseur d'accélération Convertisseur d'accélération angulaire Convertisseur de densité Convertisseur de volume spécifique Convertisseur de moment d'inertie Moment de force Convertisseur de couple Convertisseur de pouvoir calorifique spécifique (en masse) Convertisseur de densité d'énergie et de pouvoir calorifique spécifique (en volume) Convertisseur de différence de température Convertisseur de coefficient Coefficient de dilatation thermique Convertisseur de résistance thermique Convertisseur de conductivité thermique Convertisseur de capacité thermique spécifique Convertisseur d'exposition à l'énergie et de puissance rayonnante Convertisseur de densité de flux thermique Convertisseur de coefficient de transfert de chaleur Convertisseur de débit volumique Convertisseur de débit massique Convertisseur de débit molaire Convertisseur de densité de flux massique Convertisseur de concentration molaire Convertisseur de concentration massique en solution Dynamique ( Convertisseur de viscosité cinématique Convertisseur de tension superficielle Convertisseur de perméabilité à la vapeur Convertisseur de densité de flux de vapeur d'eau Convertisseur de niveau sonore Convertisseur de sensibilité du microphone Convertisseur de niveau de pression sonore (SPL) Convertisseur de niveau de pression sonore avec pression de référence sélectionnable Convertisseur de luminosité Convertisseur d'intensité lumineuse Convertisseur d'éclairement Convertisseur de résolution d'infographie Convertisseur de fréquence et de longueur d'onde Puissance en dioptries et distance focale Distance Puissance en dioptries et grossissement de l'objectif (×) Convertisseur de charge électrique Convertisseur de densité de charge linéaire Convertisseur de densité de charge de surface Convertisseur de densité de charge volumétrique Convertisseur de courant électrique Convertisseur de densité de courant linéaire Convertisseur de densité de courant de surface Convertisseur d'intensité de champ électrique Convertisseur de potentiel et de tension électrostatique Convertisseur de résistance électrique Convertisseur électrique Convertisseur de conductivité électrique de résistance Convertisseur de conductivité électrique Convertisseur d'inductance de capacité Convertisseur de jauge de fil américain Niveaux en dBm (dBm ou dBm), dBV (dBV), watts, etc. Convertisseur de force magnétomotrice Convertisseur d'intensité de champ magnétique Convertisseur de flux magnétique Convertisseur d'induction magnétique Rayonnement. Ionizing Radiation Absorbed Dose Rate Converter Radioactivité. Radiation du convertisseur de désintégration radioactive. Radiation du convertisseur de dose d'exposition. Convertisseur de dose absorbée Convertisseur de préfixe décimal Transfert de données Typographie et convertisseur d'unité de traitement d'image Convertisseur d'unité de volume de bois Calcul de la masse molaire Tableau périodique des éléments chimiques par D. I. Mendeleïev
Formule chimique
Masse molaire de Fe 2 (SO 4) 3 , sulfate de fer (III) 399.8778 g/mole
55.845 2+(32.065+15.9994 4) 3
Fractions massiques des éléments dans le composé
Utilisation du calculateur de masse molaire
Calculateur de masse molaire
Môle
Toutes les substances sont constituées d'atomes et de molécules. En chimie, il est important de mesurer avec précision la masse des substances entrant dans une réaction et en résultant. Par définition, la mole est l'unité SI de la quantité d'une substance. Une mole contient exactement 6,02214076×10²³ particules élémentaires. Cette valeur est numériquement égale à la constante d'Avogadro N A lorsqu'elle est exprimée en moles⁻¹ et est appelée nombre d'Avogadro. Quantité de substance (symbole n) d'un système est une mesure du nombre d'éléments structurels. Un élément structurel peut être un atome, une molécule, un ion, un électron ou n'importe quelle particule ou groupe de particules.
Constante d'Avogadro N A = 6,02214076×10²³ mol⁻¹. Le numéro d'Avogadro est 6,02214076×10²³.
En d'autres termes, une mole est la quantité d'une substance égale en masse à la somme des masses atomiques des atomes et des molécules de la substance, multipliée par le nombre d'Avogadro. La taupe est l'une des sept unités de base du système SI et est désignée par la taupe. Le nom de l'unité et son symbole étant identiques, il convient de noter que le symbole n'est pas fléchi, contrairement au nom de l'unité, qui peut être décliné selon les règles habituelles de la langue russe. Une mole de carbone 12 pur équivaut exactement à 12 grammes.
Masse molaire
La masse molaire est une propriété physique d'une substance, définie comme le rapport de la masse de cette substance à la quantité de substance en moles. En d'autres termes, c'est la masse d'une mole d'une substance. Dans le système SI, l'unité de masse molaire est le kilogramme/mol (kg/mol). Cependant, les chimistes ont l'habitude d'utiliser l'unité g/mol plus pratique.
masse molaire = g/mol

Masse molaire des éléments et composés
Les composés sont des substances composées de différents atomes chimiquement liés les uns aux autres. Par exemple, les substances ci-dessous, que l'on peut trouver dans la cuisine de toute femme au foyer, sont des composés chimiques :
La masse molaire des éléments chimiques en grammes par mole est numériquement la même que la masse des atomes de l'élément, exprimée en unités de masse atomique (ou daltons). La masse molaire des composés est égale à la somme des masses molaires des éléments qui composent le composé, en tenant compte du nombre d'atomes dans le composé. Par exemple, la masse molaire de l'eau (H₂O) est d'environ 1 × 2 + 16 = 18 g/mol.
Masse moléculaire

Le poids moléculaire (l'ancien nom est poids moléculaire) est la masse d'une molécule, calculée comme la somme des masses de chaque atome qui compose la molécule, multipliée par le nombre d'atomes dans cette molécule. Le poids moléculaire est adimensionnelle une quantité physique numériquement égale à la masse molaire. C'est-à-dire que le poids moléculaire diffère de la masse molaire en dimension. Bien que la masse moléculaire soit une quantité sans dimension, elle a toujours une valeur appelée unité de masse atomique (amu) ou dalton (Da), et est approximativement égale à la masse d'un proton ou d'un neutron. L'unité de masse atomique est également numériquement égale à 1 g/mol.
Calcul de la masse molaire
La masse molaire est calculée comme suit :
Par exemple, calculons la masse molaire de l'acide acétique
Cela consiste en:
Notre calculateur fait exactement cela. Vous pouvez y entrer la formule de l'acide acétique et vérifier ce qui se passe.
Trouvez-vous difficile de traduire les unités de mesure d'une langue à l'autre ? Des collègues sont prêts à vous aider. Poser une question à TCTerms et dans quelques minutes vous recevrez une réponse.