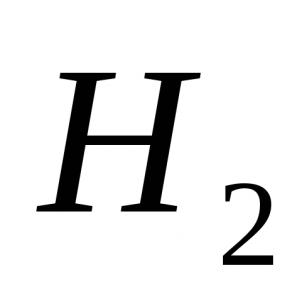Le Co2 à l'état solide est constitué de molécules. Doctrine atomique-moléculaire
La théorie atomique-moléculaire a été développée et appliquée pour la première fois en chimie par le grand scientifique russe M.V. Lomonosov. Les principales dispositions de cette doctrine sont énoncées dans l'ouvrage "Elements of Mathematical Chemistry" (1741) et un certain nombre d'autres. L'essence des enseignements de Lomonossov peut être réduite aux dispositions suivantes.
1. Toutes les substances sont constituées de "corpuscules" (comme Lomonossov appelait les molécules).
2. Les molécules sont constituées d'"éléments" (comme Lomonossov appelait les atomes).
3. Les particules - molécules et atomes - sont en mouvement continu. L'état thermique des corps est le résultat du mouvement de leurs particules.
4. Les molécules de substances simples sont constituées d'atomes identiques, les molécules de substances complexes sont constituées d'atomes différents.
67 ans après Lomonossov, le scientifique anglais John Dalton a appliqué la doctrine atomiste en chimie. Il a décrit les principales dispositions de l'atomisme dans le livre "Le nouveau système de philosophie chimique" (1808). À la base, l'enseignement de Dalton répète les enseignements de Lomonossov. Cependant, Dalton a nié l'existence de molécules dans des substances simples, ce qui, par rapport aux enseignements de Lomonosov, est un pas en arrière. Selon Dalton, les substances simples ne sont constituées que d'atomes et uniquement de substances complexes - d '"atomes complexes" (au sens moderne - molécules). La doctrine atomique-moléculaire en chimie n'a finalement été établie qu'au milieu du XIXe siècle. Au congrès international des chimistes de Karlsruhe en 1860, des définitions des concepts de molécule et d'atome furent adoptées.
Une molécule est la plus petite particule d'une substance donnée qui a ses propriétés chimiques. Les propriétés chimiques d'une molécule sont déterminées par sa composition et sa structure chimique.
Un atome est la plus petite particule d'un élément chimique faisant partie des molécules de substances simples et complexes. Les propriétés chimiques d'un élément sont déterminées par la structure de son atome. De là découle la définition de l'atome, correspondant aux idées modernes :
Un atome est une particule électriquement neutre composée d'un noyau atomique chargé positivement et d'électrons chargés négativement.
Selon les idées modernes, les substances à l'état gazeux et vaporeux sont composées de molécules. A l'état solide, les molécules ne sont constituées que de substances dont le réseau cristallin a une structure moléculaire. La plupart des substances inorganiques solides n'ont pas de structure moléculaire : leur réseau n'est pas constitué de molécules, mais d'autres particules (ions, atomes) ; ils existent sous forme de macrocorps (un cristal de chlorure de sodium, un morceau de cuivre, etc.). Les sels, les oxydes métalliques, le diamant, le silicium, les métaux n'ont pas de structure moléculaire.
Éléments chimiques
La théorie atomique et moléculaire a permis d'expliquer les concepts de base et les lois de la chimie. Du point de vue de la science atomique et moléculaire, chaque type d'atome est appelé un élément chimique. La caractéristique la plus importante d'un atome est la charge positive de son noyau, numériquement égale au nombre ordinal de l'élément. La valeur de la charge du noyau sert de trait distinctif pour différents types d'atomes, ce qui nous permet de donner une définition plus complète du concept d'élément :
Élément chimique Un certain type d'atome avec la même charge nucléaire positive.
107 éléments sont connus. Actuellement, les travaux se poursuivent sur la production artificielle d'éléments chimiques avec des numéros de série plus élevés.
Tous les éléments sont généralement divisés en métaux et non-métaux. Cependant, cette division est conditionnelle. Une caractéristique importante des éléments est leur abondance dans la croûte terrestre, c'est-à-dire dans la couche solide supérieure de la Terre, dont l'épaisseur est conventionnellement supposée égale à 16 km. La répartition des éléments dans la croûte terrestre est étudiée par la géochimie, la science de la chimie de la terre. Le géochimiste A.P. Vinogradov a compilé un tableau de la composition chimique moyenne de la croûte terrestre. Selon ces données, l'élément le plus courant est l'oxygène - 47,2% de la masse de la croûte terrestre, suivi du silicium - 27,6, de l'aluminium - 8,80, du fer -5,10, du calcium - 3,6, du sodium - 2,64, du potassium - 2,6, du magnésium - 2.10, hydrogène - 0,15%.
Liaison chimique covalente, ses variétés et ses mécanismes de formation. Caractéristiques d'une liaison covalente (polarité et énergie de liaison). Liaison ionique. Connexion métallique. liaison hydrogène
La doctrine de la liaison chimique est la base de toute la chimie théorique.
Une liaison chimique est une telle interaction d'atomes qui les lie en molécules, ions, radicaux, cristaux.
Il existe quatre types de liaisons chimiques : ionique, covalente, métallique et hydrogène.
La division des liaisons chimiques en types est conditionnelle, car toutes sont caractérisées par une certaine unité.
Une liaison ionique peut être considérée comme le cas limite d'une liaison polaire covalente.
Une liaison métallique combine l'interaction covalente des atomes à l'aide d'électrons partagés et l'attraction électrostatique entre ces électrons et les ions métalliques.
Dans les substances, il n'y a souvent pas de cas limitatifs de liaisons chimiques (ou de liaisons chimiques pures).
Par exemple, le fluorure de lithium $LiF$ est classé comme composé ionique. En fait, la liaison qu'il contient est $80%$ ionique et $20%$ covalente. Par conséquent, il est évidemment plus correct de parler du degré de polarité (ionicité) d'une liaison chimique.
Dans la série des halogénures d'hydrogène $HF—HCl—HBr—HI—HAt$, le degré de polarité de la liaison diminue, car la différence des valeurs d'électronégativité des atomes d'halogène et d'hydrogène diminue, et dans l'astate la liaison devient presque non polaire $(EO(H) = 2,1 ; EO(At) = 2,2)$.
Différents types de liaisons peuvent être contenus dans les mêmes substances, par exemple :
- dans les bases : entre les atomes d'oxygène et d'hydrogène dans les groupes hydroxo, la liaison est covalente polaire, et entre le métal et le groupe hydroxo est ionique ;
- dans les sels d'acides contenant de l'oxygène : entre l'atome non métallique et l'oxygène du résidu acide - covalent polaire, et entre le métal et le résidu acide - ionique ;
- dans les sels d'ammonium, de méthylammonium, etc. : entre les atomes d'azote et d'hydrogène - polaire covalent, et entre les ions ammonium ou méthylammonium et un résidu acide - ionique ;
- dans les peroxydes métalliques (par exemple, $Na_2O_2$), la liaison entre les atomes d'oxygène est covalente non polaire, et entre le métal et l'oxygène, elle est ionique, et ainsi de suite.
Différents types de connexions peuvent passer les unes dans les autres :
- lors de la dissociation électrolytique dans l'eau de composés covalents, une liaison polaire covalente passe en liaison ionique ;
- lors de l'évaporation des métaux, la liaison métallique se transforme en une liaison covalente non polaire, etc.
La raison de l'unité de tous les types et types de liaisons chimiques est leur nature chimique identique - l'interaction électron-nucléaire. La formation d'une liaison chimique est dans tous les cas le résultat d'une interaction électron-nucléaire d'atomes, accompagnée d'une libération d'énergie.
Méthodes de formation d'une liaison covalente. Caractéristiques d'une liaison covalente : longueur et énergie de la liaison
Une liaison chimique covalente est une liaison qui se produit entre les atomes en raison de la formation de paires d'électrons communes.
Le mécanisme de formation d'une telle liaison peut être échange et donneur-accepteur.
JE. mécanisme d'échange agit lorsque les atomes forment des paires d'électrons communes en combinant des électrons non appariés.
1) $H_2$ - hydrogène :
La liaison est due à la formation d'une paire d'électrons commune par $s$-électrons d'atomes d'hydrogène (chevauchement $s$-orbitales) :

2) $HCl$ - chlorure d'hydrogène :
La liaison est due à la formation d'une paire d'électrons commune de $s-$ et $p-$électrons (chevauchement $s-p-$orbitales) :
3) $Cl_2$ : dans une molécule de chlore, une liaison covalente est formée en raison de $p-$électrons non appariés (chevauchement $p-p-$orbitales) :

4) $N_2$ : trois paires d'électrons communes se forment entre les atomes d'une molécule d'azote :
II. Mécanisme donneur-accepteur Considérons la formation d'une liaison covalente en prenant l'exemple de l'ion ammonium $NH_4^+$.

Le donneur a une paire d'électrons, l'accepteur a une orbitale vide que cette paire peut occuper. Dans l'ion ammonium, les quatre liaisons avec les atomes d'hydrogène sont covalentes: trois ont été formées en raison de la création de paires d'électrons communes par l'atome d'azote et les atomes d'hydrogène par le mécanisme d'échange, une - par le mécanisme donneur-accepteur.
Les liaisons covalentes peuvent être classées par la manière dont les orbitales des électrons se chevauchent, ainsi que par leur déplacement vers l'un des atomes liés.
Les liaisons chimiques formées à la suite du chevauchement des orbitales d'électrons le long de la ligne de liaison sont appelées $σ$ -obligations (obligations sigma). La liaison sigma est très forte.

Les $p-$orbitales peuvent se chevaucher dans deux régions, formant une liaison covalente par chevauchement latéral :

Liaisons chimiques formées à la suite du chevauchement "latéral" des orbitales d'électrons en dehors de la ligne de communication, c'est-à-dire dans deux régions sont appelées $π$ -liaisons (liaisons pi).
Par degré de biais paires d'électrons communs à l'un des atomes qu'ils lient, une liaison covalente peut être polaire et non polaire.
Une liaison chimique covalente formée entre des atomes de même électronégativité est appelée non polaire. Les paires d'électrons ne sont déplacées vers aucun des atomes, car les atomes ont le même ER - la propriété d'attirer les électrons de valence vers eux-mêmes à partir d'autres atomes. Par example:
ceux. par une liaison covalente non polaire, des molécules de substances non métalliques simples se forment. Une liaison chimique covalente entre des atomes d'éléments dont l'électronégativité diffère est appelée polaire.
La longueur et l'énergie d'une liaison covalente.
caractéristique propriétés des liaisons covalentes est sa longueur et son énergie. Longueur du lien est la distance entre les noyaux des atomes. Une liaison chimique est d'autant plus forte que sa longueur est courte. Cependant, la mesure de la force de liaison est énergie de liaison, qui est déterminé par la quantité d'énergie nécessaire pour rompre la liaison. Elle est généralement mesurée en kJ/mol. Ainsi, selon les données expérimentales, les longueurs de liaison des molécules $H_2, Cl_2$ et $N_2$ sont respectivement de $0,074, 0,198$ et $0,109$ nm, et les énergies de liaison sont de $436, 242$ et $946$ kJ/ mol, respectivement.
Ions. Liaison ionique
Imaginez que deux atomes se « rencontrent » : un atome métallique du groupe I et un atome non métallique du groupe VII. Un atome métallique a un seul électron dans son niveau d'énergie externe, tandis qu'un atome non métallique ne manque que d'un électron pour compléter son niveau externe.
Le premier atome donnera facilement au second son électron, qui est éloigné du noyau et faiblement lié à celui-ci, et le second lui donnera une place libre sur son plan électronique externe.
Ensuite, un atome, privé de l'une de ses charges négatives, deviendra une particule chargée positivement, et le second se transformera en une particule chargée négativement en raison de l'électron reçu. De telles particules sont appelées ions.
La liaison chimique qui se produit entre les ions est appelée ionique.
Considérez la formation de cette liaison en utilisant le composé de chlorure de sodium bien connu (sel de table) comme exemple :
Le processus de transformation des atomes en ions est illustré dans le diagramme:

Une telle transformation d'atomes en ions se produit toujours lors de l'interaction d'atomes de métaux typiques et de non-métaux typiques.
Considérez l'algorithme (séquence) de raisonnement lors de l'enregistrement de la formation d'une liaison ionique, par exemple, entre les atomes de calcium et de chlore:

Les nombres indiquant le nombre d'atomes ou de molécules sont appelés coefficients, et les nombres indiquant le nombre d'atomes ou d'ions dans une molécule sont appelés index.
connexion métallique
Faisons connaissance avec la façon dont les atomes d'éléments métalliques interagissent les uns avec les autres. Les métaux n'existent généralement pas sous la forme d'atomes isolés, mais sous la forme d'un morceau, d'un lingot ou d'un produit métallique. Qu'est-ce qui maintient les atomes de métal ensemble?
Les atomes de la plupart des métaux au niveau externe contiennent un petit nombre d'électrons - $1, 2, 3$. Ces électrons se détachent facilement et les atomes sont convertis en ions positifs. Les électrons détachés se déplacent d'un ion à l'autre, les liant en un seul tout. En se connectant avec des ions, ces électrons forment temporairement des atomes, puis se détachent à nouveau et se combinent avec un autre ion, et ainsi de suite. Par conséquent, dans le volume d'un métal, les atomes sont continuellement convertis en ions et inversement.
La liaison dans les métaux entre les ions au moyen d'électrons socialisés est appelée métallique.
La figure montre schématiquement la structure d'un fragment de sodium métallique.

Dans ce cas, un petit nombre d'électrons socialisés lie un grand nombre d'ions et d'atomes.

La liaison métallique présente une certaine ressemblance avec la liaison covalente, car elle est basée sur le partage d'électrons externes. Cependant, dans une liaison covalente, les électrons externes non appariés de seulement deux atomes voisins sont socialisés, tandis que dans une liaison métallique, tous les atomes participent à la socialisation de ces électrons. C'est pourquoi les cristaux à liaison covalente sont cassants, tandis que ceux à liaison métallique sont, en règle générale, ductiles, conducteurs d'électricité et ont un éclat métallique.
La liaison métallique est caractéristique à la fois des métaux purs et des mélanges de divers métaux - alliages à l'état solide et liquide.
liaison hydrogène
Une liaison chimique entre des atomes d'hydrogène polarisés positivement d'une molécule (ou d'une partie de celle-ci) et des atomes polarisés négativement d'éléments fortement électronégatifs ayant des paires d'électrons non partagées ($F, O, N$ et moins souvent $S$ et $Cl$), une autre molécule (ou ses parties) est appelée hydrogène.
Le mécanisme de formation des liaisons hydrogène est en partie électrostatique, en partie donneur-accepteur.
Exemples de liaisons hydrogène intermoléculaires :
En présence d'une telle liaison, même des substances de faible poids moléculaire peuvent, dans des conditions normales, être des liquides (alcool, eau) ou des gaz facilement liquéfiants (ammoniac, fluorure d'hydrogène).
Les substances avec une liaison hydrogène ont des réseaux cristallins moléculaires.
Substances de structure moléculaire et non moléculaire. Type de réseau cristallin. La dépendance des propriétés des substances sur leur composition et leur structure
Structure moléculaire et non moléculaire des substances
Ce ne sont pas des atomes ou des molécules individuels qui entrent dans les interactions chimiques, mais des substances. Une substance, dans des conditions données, peut se trouver dans l'un des trois états d'agrégation : solide, liquide ou gazeux. Les propriétés d'une substance dépendent également de la nature de la liaison chimique entre les particules qui la composent - molécules, atomes ou ions. Selon le type de liaison, on distingue les substances de structure moléculaire et non moléculaire.
Les substances composées de molécules sont appelées substances moléculaires. Les liaisons entre les molécules de ces substances sont très faibles, beaucoup plus faibles qu'entre les atomes à l'intérieur d'une molécule, et déjà à des températures relativement basses, elles se rompent - la substance se transforme en liquide puis en gaz (sublimation de l'iode). Les points de fusion et d'ébullition des substances constituées de molécules augmentent avec l'augmentation du poids moléculaire.
Les substances moléculaires comprennent les substances à structure atomique ($C, Si, Li, Na, K, Cu, Fe, W$), parmi lesquelles il y a des métaux et des non-métaux.
Considérez les propriétés physiques des métaux alcalins. La force de liaison relativement faible entre les atomes entraîne une faible résistance mécanique : les métaux alcalins sont mous et peuvent être facilement coupés avec un couteau.
Les grandes tailles d'atomes conduisent à une faible densité de métaux alcalins : le lithium, le sodium et le potassium sont encore plus légers que l'eau. Dans le groupe des métaux alcalins, les points d'ébullition et de fusion diminuent avec l'augmentation du nombre ordinal de l'élément, car. la taille des atomes augmente et les liaisons s'affaiblissent.
Aux substances non moléculaire les structures comprennent des composés ioniques. La plupart des composés de métaux avec des non-métaux ont cette structure : tous les sels ($NaCl, K_2SO_4$), certains hydrures ($LiH$) et oxydes ($CaO, MgO, FeO$), bases ($NaOH, KOH$). Les substances ioniques (non moléculaires) ont des points de fusion et d'ébullition élevés.
Réseaux cristallins
Une substance, comme on le sait, peut exister sous trois états d'agrégation : gazeux, liquide et solide.
Solides : amorphes et cristallins.
Considérez comment les caractéristiques des liaisons chimiques affectent les propriétés des solides. Les solides sont divisés en cristalline et amorphe.
Les substances amorphes n'ont pas de point de fusion clair - lorsqu'elles sont chauffées, elles se ramollissent progressivement et deviennent fluides. A l'état amorphe, par exemple, sont la pâte à modeler et diverses résines.
Les substances cristallines se caractérisent par la disposition correcte des particules qui les composent: atomes, molécules et ions - à des points strictement définis de l'espace. Lorsque ces points sont reliés par des lignes droites, un cadre spatial se forme, appelé réseau cristallin. Les points où se trouvent les particules de cristal sont appelés nœuds de réseau.
Selon le type de particules situées aux nœuds du réseau cristallin et la nature de la connexion entre elles, on distingue quatre types de réseaux cristallins : ionique, atomique, moléculaire et métal.
Réseaux cristallins ioniques.
Ionique appelés réseaux cristallins, dans les nœuds desquels se trouvent des ions. Ils sont formés de substances à liaison ionique, qui peuvent lier à la fois les ions simples $Na^(+), Cl^(-)$ et les ions complexes $SO_4^(2−), OH^-$. Par conséquent, les sels, certains oxydes et hydroxydes de métaux ont des réseaux cristallins ioniques. Par exemple, un cristal de chlorure de sodium est constitué d'une alternance d'ions positifs $Na^+$ et d'ions négatifs $Cl^-$, formant un réseau en forme de cube. Les liaisons entre les ions dans un tel cristal sont très stables. Par conséquent, les substances à réseau ionique se caractérisent par une dureté et une résistance relativement élevées, elles sont réfractaires et non volatiles.

Réseaux cristallins atomiques.
nucléaire appelés réseaux cristallins, dans les nœuds desquels se trouvent des atomes individuels. Dans de tels réseaux, les atomes sont reliés entre eux par des liaisons covalentes très fortes. Un exemple de substances avec ce type de réseau cristallin est le diamant, l'une des modifications allotropiques du carbone.
La plupart des substances à réseau cristallin atomique ont des points de fusion très élevés (par exemple, pour le diamant, il est supérieur à $3500°C$), elles sont fortes et dures, pratiquement insolubles.

Réseaux cristallins moléculaires.
Moléculaire appelés réseaux cristallins, aux nœuds desquels se trouvent les molécules. Les liaisons chimiques dans ces molécules peuvent être polaires ($HCl, H_2O$) ou non polaires ($N_2, O_2$). Malgré le fait que les atomes à l'intérieur des molécules sont liés par des liaisons covalentes très fortes, il existe de faibles forces d'attraction intermoléculaire entre les molécules elles-mêmes. Par conséquent, les substances avec des réseaux cristallins moléculaires ont une faible dureté, des points de fusion bas et sont volatiles. La plupart des composés organiques solides ont des réseaux cristallins moléculaires (naphtalène, glucose, sucre).

Treillis cristallins métalliques.
Les substances avec une liaison métallique ont des réseaux cristallins métalliques. Aux nœuds de ces réseaux, il y a des atomes et des ions (soit des atomes, soit des ions, dans lesquels les atomes métalliques se transforment facilement, donnant leurs électrons externes «pour un usage courant»). Une telle structure interne des métaux détermine leurs propriétés physiques caractéristiques : malléabilité, plasticité, conductivité électrique et thermique, et un éclat métallique caractéristique.
Structure moléculaire et non moléculaire des substances. La structure de la matière

Ce ne sont pas des atomes ou des molécules individuels qui entrent dans les interactions chimiques, mais des substances. Les substances se distinguent par le type de liaison moléculaire et structure non moléculaire. Les substances composées de molécules sont appelées substances moléculaires. Les liaisons entre les molécules de ces substances sont très faibles, beaucoup plus faibles qu'entre les atomes à l'intérieur d'une molécule, et déjà à des températures relativement basses, elles se rompent - la substance se transforme en liquide puis en gaz (sublimation de l'iode). Les points de fusion et d'ébullition des substances constituées de molécules augmentent avec l'augmentation du poids moléculaire. Pour substances moléculaires comprennent des substances à structure atomique (C, Si, Li, Na, K, Cu, Fe, W), parmi lesquelles des métaux et des non-métaux. Aux substances structure non moléculaire comprennent des composés ioniques. La plupart des composés de métaux avec des non-métaux ont cette structure : tous les sels (NaCl, K 2 SO 4), certains hydrures (LiH) et oxydes (CaO, MgO, FeO), des bases (NaOH, KOH). Substances ioniques (non moléculaires) ont des points de fusion et d'ébullition élevés.

Solides : amorphes et cristallins
Les solides sont divisés en cristallin et amorphe.
Substances amorphes n'ont pas de point de fusion clair - lorsqu'ils sont chauffés, ils se ramollissent progressivement et deviennent fluides. A l'état amorphe, par exemple, sont la pâte à modeler et diverses résines.
Substances cristallines se caractérisent par la disposition correcte des particules qui les composent : atomes, molécules et ions - en des points strictement définis de l'espace. Lorsque ces points sont reliés par des lignes droites, un cadre spatial se forme, appelé réseau cristallin. Les points où se trouvent les particules de cristal sont appelés nœuds de réseau. Selon le type de particules situées aux nœuds du réseau cristallin et la nature de la connexion entre elles, on distingue quatre types de réseaux cristallins : ionique, atomique, moléculaire et métallique.
Les réseaux cristallins sont dits ioniques, aux sites desquels se trouvent des ions. Ils sont formés de substances à liaison ionique, qui peuvent être associées à la fois à des ions simples Na +, Cl - et à des complexes SO 4 2-, OH -. Par conséquent, les sels, certains oxydes et hydroxydes de métaux ont des réseaux cristallins ioniques. Par exemple, un cristal de chlorure de sodium est construit à partir d'une alternance d'ions positifs Na + et négatifs Cl -, formant un réseau en forme de cube. Les liaisons entre les ions dans un tel cristal sont très stables. Par conséquent, les substances à réseau ionique se caractérisent par une dureté et une résistance relativement élevées, elles sont réfractaires et non volatiles.
Réseau cristallin - a) et réseau amorphe - b).
 Réseau cristallin - a) et réseau amorphe - b).
Réseau cristallin - a) et réseau amorphe - b). Réseaux cristallins atomiques
nucléaire appelés réseaux cristallins, dans les nœuds desquels se trouvent des atomes individuels. Dans de tels réseaux, les atomes sont connectés les uns aux autres liaisons covalentes très fortes. Un exemple de substances avec ce type de réseau cristallin est le diamant, l'une des modifications allotropiques du carbone. La plupart des substances à réseau cristallin atomique ont des points de fusion très élevés (par exemple, dans le diamant, il dépasse 3500 ° C), elles sont fortes et dures, pratiquement insolubles.


Réseaux cristallins moléculaires
Moléculaire appelés réseaux cristallins, aux nœuds desquels se trouvent les molécules. Les liaisons chimiques dans ces molécules peuvent être à la fois polaires (HCl, H 2 O) et non polaires (N 2 , O 2). Malgré le fait que les atomes dans les molécules sont liés par des liaisons covalentes très fortes, des forces faibles d'attraction intermoléculaire agissent entre les molécules elles-mêmes. Par conséquent, les substances avec des réseaux cristallins moléculaires ont une faible dureté, des points de fusion bas et sont volatiles. La plupart des composés organiques solides ont des réseaux cristallins moléculaires (naphtalène, glucose, sucre).
 Réseau cristallin moléculaire (dioxyde de carbone)
Réseau cristallin moléculaire (dioxyde de carbone) Treillis cristallins métalliques
Substances avec lien métallique ont des réseaux cristallins métalliques. Aux nœuds de ces réseaux sont atomes et ions(soit des atomes, soit des ions, dans lesquels les atomes métalliques se transforment facilement, donnant leurs électrons externes « pour un usage général »). Une telle structure interne des métaux détermine leurs propriétés physiques caractéristiques : malléabilité, plasticité, conductivité électrique et thermique, et un éclat métallique caractéristique.

feuilles de triche


Une molécule dans laquelle les centres de gravité des sections chargées positivement et négativement ne coïncident pas s'appelle un dipôle. Définissons le concept de "dipôle".
Un dipôle est un ensemble de deux charges électriques égales de grandeurs opposées situées à une certaine distance l'une de l'autre.
La molécule d'hydrogène H 2 n'est pas un dipôle (Fig. 50 un), et la molécule de chlorure d'hydrogène est un dipôle (Fig. 50 b). La molécule d'eau est aussi un dipôle. Les paires d'électrons dans H 2 O sont décalées dans une plus grande mesure des atomes d'hydrogène vers l'atome d'oxygène.
Le centre de gravité de la charge négative est situé près de l'atome d'oxygène et le centre de gravité de la charge positive est situé près des atomes d'hydrogène.
Dans une substance cristalline, les atomes, les ions ou les molécules sont dans un ordre strict.
L'endroit où se trouve une telle particule s'appelle nœud du réseau cristallin. La position des atomes, des ions ou des molécules dans les nœuds du réseau cristallin est illustrée à la fig. 51.
en grammes
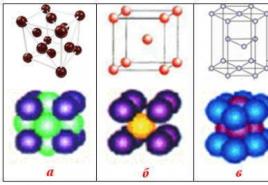
Riz. 51. Modèles de réseaux cristallins (un plan d'un cristal massif est représenté): un) covalent ou atomique (diamant C, silicium Si, quartz SiO 2) ; b) ionique (NaCl); dans) moléculaire (glace, I 2); g) métallique (Li, Fe). Dans le modèle du réseau métallique, les points désignent les électrons
Selon le type de liaison chimique entre les particules, les réseaux cristallins sont divisés en covalent (atomique), ionique et métallique. Il existe un autre type de réseau cristallin - moléculaire. Dans un tel réseau, les molécules individuelles sont maintenues par forces d'attraction intermoléculaire.
Cristaux ioniques(Fig. 51 b) contiennent des ions chargés positivement et négativement aux sites du réseau cristallin. Le réseau cristallin est construit de telle manière que les forces d'attraction électrostatique des ions de charge opposée et les forces de répulsion des ions de même charge soient équilibrées. De tels réseaux cristallins sont caractéristiques de composés tels que LiF, NaCl et bien d'autres.
cristaux moléculaires(Fig. 51 dans) contiennent des molécules dipolaires aux sites du cristal, qui sont maintenues les unes par rapport aux autres par des forces d'attraction électrostatiques comme les ions dans un réseau cristallin ionique. Par exemple, la glace est un réseau cristallin moléculaire formé par des dipôles d'eau. Sur la fig. 51 dans les symboles ne sont pas donnés pour les charges, afin de ne pas surcharger la figure.
métal cristal(Fig. 51 g) contient des ions chargés positivement sur les sites du réseau. Certains des électrons externes se déplacent librement entre les ions. " e-gaz"retient des ions chargés positivement dans les nœuds du réseau cristallin. Lors de l'impact, le métal ne pique pas comme la glace, le quartz ou un cristal de sel, mais change seulement de forme. Les électrons, en raison de leur mobilité, ont le temps de se déplacer en ce moment d'impact et maintiennent les ions dans une nouvelle position.C'est pourquoi forger des métaux et du plastique, se plier sans se casser.
Riz. 52. La structure de l'oxyde de silicium : un) cristallin ; b) amorphe. Les points noirs désignent les atomes de silicium, les cercles vides désignent les atomes d'oxygène. Le plan du cristal est représenté, de sorte que la quatrième liaison au niveau de l'atome de silicium n'est pas indiquée. La ligne pointillée marque l'ordre à courte portée dans le désordre d'une substance amorphe
Dans une substance amorphe, la périodicité tridimensionnelle de la structure, caractéristique de l'état cristallin, est violée (Fig. 52 b).
Liquides et gaz diffèrent des corps cristallins et amorphes par le mouvement aléatoire des atomes et
molécules. Dans les liquides, les forces d'attraction sont capables de maintenir les microparticules les unes par rapport aux autres à des distances proches, proportionnelles aux distances dans un corps solide. Dans les gaz, l'interaction des atomes et des molécules est pratiquement absente, par conséquent, les gaz, contrairement aux liquides, occupent tout le volume qui leur est fourni. Une mole d'eau liquide à 100 0 C occupe un volume de 18,7 cm 3, et une mole de vapeur d'eau saturée 30 000 cm 3 à la même température. 
Riz. 53. Différents types d'interaction des molécules dans les liquides et les gaz : un) dipôle–dipôle ; b) dipôle–non dipôle ; dans) non dipôle – non dipôle
Contrairement aux solides, les molécules des liquides et des gaz se déplacent librement. Du fait du mouvement, ils sont orientés d'une certaine manière. Par exemple, sur la fig. 53 un B. il est montré comment les molécules dipôles interagissent, ainsi que les molécules non polaires avec les molécules dipôles dans les liquides et les gaz.
Lorsqu'un dipôle s'approche d'un dipôle, les molécules tournent sous l'effet de l'attraction et de la répulsion. La partie chargée positivement d'une molécule est située près de la partie chargée négativement d'une autre. C'est ainsi que les dipôles interagissent dans l'eau liquide.
Lorsque deux molécules non polaires (non dipôles) se rapprochent à des distances assez proches, elles s'influencent également mutuellement (Fig. 53 dans). Les molécules sont réunies par des couches d'électrons chargées négativement recouvrant les noyaux. Les coquilles d'électrons sont déformées de telle manière qu'il y a une apparition temporaire de centres positifs et négatifs dans l'une ou l'autre des molécules, et ils sont mutuellement attirés l'un vers l'autre. Il suffit que les molécules se dispersent, car les dipôles temporaires redeviennent des molécules non polaires.
Un exemple est l'interaction entre les molécules d'hydrogène gazeux. (Fig. 53 dans).
3.2. Classification des substances inorganiques. Substances simples et complexes
Au début du 19ème siècle, le chimiste suédois Berzelius a proposé que les substances obtenues à partir d'organismes vivants soient appelées biologique. Les substances caractéristiques de la nature inanimée ont été nommées inorganique ou alors minéral(dérivé de minéraux).
Toutes les substances solides, liquides et gazeuses peuvent être divisées en simples et complexes.
Les substances sont dites simples, constituées d'atomes d'un élément chimique.
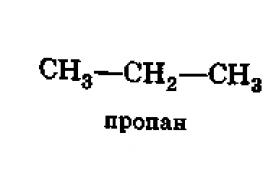
Par exemple, l'hydrogène, le brome et le fer à température ambiante et à pression atmosphérique sont des substances simples qui sont respectivement à l'état gazeux, liquide et solide (Fig. 54 un B C).
L'hydrogène gazeux H 2 (g) et le brome liquide Br 2 (l) sont constitués de molécules diatomiques. Le fer solide Fe(t) existe sous la forme d'un cristal avec un réseau cristallin métallique.
Les substances simples sont divisées en deux groupes : les non-métaux et les métaux.
un) b) dans)
Riz. 54. Substances simples : un) hydrogène gazeux. Il est plus léger que l'air, donc le tube à essai est bouché et retourné; b) brome liquide (généralement stocké dans des ampoules scellées); dans) poudre de fer
Les non-métaux sont des substances simples avec un réseau cristallin covalent (atomique) ou moléculaire à l'état solide.
À température ambiante, un réseau cristallin covalent (atomique) est caractéristique de non-métaux tels que le bore B(t), le carbone C(t), le silicium Si(t). Le réseau cristallin moléculaire contient du phosphore blanc P (t), du soufre S (t), de l'iode I 2 (t). Certains non-métaux ne passent qu'à très basse température dans un état d'agrégation liquide ou solide. Dans des conditions normales, ce sont des gaz. Ces substances comprennent, par exemple, l'hydrogène H 2 (g), l'azote N 2 (g), l'oxygène O 2 (g), le fluor F 2 (g), le chlore Cl 2 (g), l'hélium He (g), le néon Ne (d), argon Ar(d). A température ambiante, le brome moléculaire Br 2 (l) existe sous forme liquide.
Les métaux sont des substances simples avec un réseau cristallin métallique à l'état solide.
Ce sont des substances malléables et ductiles qui ont un éclat métallique et sont capables de conduire la chaleur et l'électricité.
Environ 80% des éléments du système périodique forment des substances simples-métaux. A température ambiante, les métaux sont des solides. Par exemple, Li(t), Fe(t). Seul le mercure, Hg (l) est un liquide qui se solidifie à -38,89 0 С.
Les composés sont des substances composées d'atomes de différents éléments chimiques.
Les atomes des éléments d'une substance complexe sont liés par des relations constantes et bien définies.
Par exemple, l'eau H 2 O est une substance complexe. Sa molécule contient des atomes de deux éléments. L'eau toujours, n'importe où sur Terre contient 11,1% d'hydrogène et 88,9% d'oxygène en masse.
Selon la température et la pression, l'eau peut être à l'état solide, liquide ou gazeux, ce qui est indiqué à droite de la formule chimique de la substance - H 2 O (g), H 2 O (g), H 2 O ( t).
En pratique, nous ne traitons généralement pas de substances pures, mais de leurs mélanges.
Un mélange est un ensemble de composés chimiques de composition et de structure différentes
Représentons des substances simples et complexes, ainsi que leurs mélanges sous forme de schéma :
Simple
non-métaux
émulsions
Fondations
Les substances complexes en chimie inorganique sont divisées en oxydes, bases, acides et sels.
oxydes
Il existe des oxydes de métaux et de non-métaux. Les oxydes métalliques sont des composés avec des liaisons ioniques. A l'état solide, ils forment des réseaux cristallins ioniques.
Oxydes non métalliques- les composés à liaisons chimiques covalentes.
Les oxydes sont des substances complexes constituées d'atomes de deux éléments chimiques, dont l'un est l'oxygène, dont l'état d'oxydation est -2.
Vous trouverez ci-dessous les formules moléculaires et structurelles de certains oxydes de non-métaux et de métaux.
Formule moléculaire Formule développée
CO 2 - monoxyde de carbone (IV) O \u003d C \u003d O
 SO 2 - oxyde de soufre (IV)
SO 2 - oxyde de soufre (IV)
SO 3 - oxyde de soufre (VI)
SiO 2 - oxyde de silicium (IV)
Na 2 O - oxyde de sodium
CaO - oxyde de calcium
K 2 O - oxyde de potassium, Na 2 O - oxyde de sodium, Al 2 O 3 - oxyde d'aluminium. Le potassium, le sodium et l'aluminium forment chacun un oxyde.
Si un élément a plusieurs états d'oxydation, il existe plusieurs de ses oxydes. Dans ce cas, après le nom de l'oxyde, le degré d'oxydation de l'élément est indiqué par un chiffre romain entre parenthèses. Par exemple, FeO est l'oxyde de fer (II), Fe 2 O 3 est l'oxyde de fer (III).
Outre les noms formés selon les règles de la nomenclature internationale, des noms russes traditionnels d'oxydes sont utilisés, par exemple: CO 2 monoxyde de carbone (IV) - gaz carbonique, CO monoxyde de carbone (II) – monoxyde de carbone, CaO oxyde de calcium - chaux vive, Oxyde de silicium SiO 2– quartz, silice, sable.
Il existe trois groupes d'oxydes, qui diffèrent par leurs propriétés chimiques, - basique, acide et amphotère(autre grec , - les deux, duel).
Oxydes basiques formé par des éléments des sous-groupes principaux des groupes I et II du système périodique (l'état d'oxydation des éléments est +1 et +2), ainsi que des éléments de sous-groupes secondaires, dont l'état d'oxydation est également +1 ou + 2. Tous ces éléments sont des métaux, donc les oxydes basiques sont des oxydes métalliques, Par example:
Li 2 O - oxyde de lithium
MgO - oxyde de magnésium
CuO - oxyde de cuivre (II)
Les oxydes basiques correspondent aux bases.
Oxydes acides
formé par des non-métaux et des métaux dont le degré d'oxydation est supérieur à +4, par exemple :
CO 2 - monoxyde de carbone (IV)
SO 2 - oxyde de soufre (IV)
SO 3 - oxyde de soufre (VI)
P 2 O 5 - oxyde de phosphore (V)
Les oxydes d'acide correspondent aux acides.
Oxydes amphotères
formé par des métaux dont le degré d'oxydation est +2, +3, parfois +4, par exemple :
ZnO - oxyde de zinc
Al 2 O 3 - oxyde d'aluminium
Les oxydes amphotères correspondent aux hydroxydes amphotères.
En outre, il existe un petit groupe de soi-disant oxydes indifférents:
N 2 O - monoxyde d'azote (I)
NO - oxyde nitrique (II)
CO - monoxyde de carbone (II)
Il convient de noter que l'un des oxydes les plus importants de notre planète est l'oxyde d'hydrogène, que vous connaissez sous le nom d'eau H 2 O.
Fondations
Dans la rubrique "Oxydes", il a été mentionné que les bases correspondent aux oxydes basiques :
Oxyde de sodium Na 2 O - hydroxyde de sodium NaOH.
Oxyde de calcium CaO - hydroxyde de calcium Ca (OH) 2.
Oxyde de cuivre CuO - hydroxyde de cuivre Cu (OH) 2
Les bases sont des substances complexes constituées d'un atome de métal et d'un ou plusieurs groupes hydroxo -OH.
Les bases sont des solides avec un réseau cristallin ionique.
Une fois dissous dans l'eau, les cristaux de bases solubles ( alcalis) sont détruits par l'action des molécules d'eau polaires, et des ions se forment :
NaOH(t) Na + (solution) + OH - (solution)
Un enregistrement similaire des ions : Na + (solution) ou OH - (solution) signifie que les ions sont en solution.
Le nom de la fondation comprend le mot hydroxyde et le nom russe du métal au génitif. Par exemple, NaOH est l'hydroxyde de sodium, Ca(OH) 2 est l'hydroxyde de calcium.
Si le métal forme plusieurs bases, alors l'état d'oxydation du métal est indiqué dans le nom par un chiffre romain entre parenthèses. Par exemple : Fe (OH) 2 - hydroxyde de fer (II), Fe (OH) 3 - hydroxyde de fer (III).
De plus, il existe des noms traditionnels pour certains terrains :
NaOH- soude caustique, caustique un soda
KOH - potasse caustique
Ca(OH) 2 - chaux éteinte, eau de chaux
R
Les bases hydrosolubles sont appelées alcalis
Distinguer bases solubles et insolubles dans l'eau.
Ce sont des hydroxydes métalliques des principaux sous-groupes des groupes I et II, à l'exception des hydroxydes de Be et Mg.
Les hydroxydes amphotères comprennent,
HCl (g) H + (solution) + Cl - (solution)
Les acides sont appelés substances complexes, qui comprennent des atomes d'hydrogène qui peuvent être remplacés ou échangés contre des atomes de métal, et des résidus acides.
Selon la présence ou l'absence d'atomes d'oxygène dans la molécule, anoxique et contenant de l'oxygène acides.
Pour nommer les acides sans oxygène, une lettre est ajoutée au nom russe d'un non-métal - à propos- et le mot hydrogène :
HF - acide fluorhydrique
HCl - acide chlorhydrique
HBr - acide bromhydrique
HI - acide iodhydrique
H 2 S - acide sulfhydrique
Noms traditionnels de certains acides :
HCl- acide hydrochlorique; HF- acide hydrofluorique
Pour nommer les acides contenant de l'oxygène, des terminaisons sont ajoutées à la racine du nom russe d'un non-métal - non,
-ovaya si le non-métal est à l'état d'oxydation le plus élevé. L'état d'oxydation le plus élevé coïncide avec le numéro du groupe dans lequel se trouve l'élément non métallique :
H 2 SO 4 -ser non acide
HNO 3 - azote non acide
HClO 4 - chlore non acide
HMnO 4 - manganèse Nouveau acide
Si un élément forme des acides dans deux états d'oxydation, alors la terminaison est utilisée pour nommer l'acide correspondant à l'état d'oxydation inférieur de l'élément - vrai:
H 2 SO 3 - chamois vrai acide
HNO 2 - azote vrai acide
Selon le nombre d'atomes d'hydrogène dans une molécule, monobasique(HCl, HNO3), dibasique(H2SO4), tribasique acides (H 3 PO 4).
De nombreux acides contenant de l'oxygène sont formés par l'interaction des oxydes acides correspondants avec l'eau. L'oxyde correspondant à un acide donné est appelé son anhydride :
Anhydride sulfureux SO 2 - acide sulfureux H 2 SO 3
Anhydride sulfurique SO 3 - acide sulfurique H 2 SO 4
Anhydride nitreux N 2 O 3 - acide nitreux HNO 2
Anhydride nitrique N 2 O 5 - acide nitrique HNO 3
Anhydride phosphorique P 2 O 5 - acide phosphorique H 3 PO 4
Notez que les états d'oxydation d'un élément dans l'oxyde et l'acide correspondant sont les mêmes.
Si un élément dans le même état d'oxydation forme plusieurs acides contenant de l'oxygène, le préfixe "" est ajouté au nom de l'acide avec une teneur inférieure en atomes d'oxygène. méta", à haute teneur en oxygène - préfixe " ortho". Par example:
HPO 3 - acide métaphosphorique
H 3 PO 4 - acide orthophosphorique, souvent appelé simplement acide phosphorique
H 2 SiO 3 - acide métasilicique, généralement appelé acide silicique
H 4 SiO 4 - acide orthosilicique.
Les acides siliciques ne sont pas formés par l'interaction de SiO 2 avec de l'eau, ils sont obtenus d'une manière différente.
Avec
Les sels sont des substances complexes constituées d'atomes métalliques et de résidus acides.
oli
NaNO 3 - nitrate de sodium
CuSO 4 - sulfate de cuivre (II)
CaCO 3 - carbonate de calcium
Lorsqu'ils sont dissous dans l'eau, les cristaux de sel sont détruits, des ions se forment:
NaNO 3 (t) Na + (solution) + NO 3 - (solution).
Les sels peuvent être considérés comme des produits de remplacement complet ou partiel d'atomes d'hydrogène dans une molécule d'acide par des atomes métalliques, ou comme des produits de remplacement complet ou partiel de groupes hydroxo basiques par des résidus acides.
Avec le remplacement complet des atomes d'hydrogène, sels moyens : Na2SO4, MgCl2. . Avec substitution partielle, sels acides (hydrosels) NaHSO4 et sels basiques (hydroxosels) MgOHCl.
Selon les règles de la nomenclature internationale, les noms des sels sont formés à partir du nom du résidu acide au nominatif et du nom russe du métal au génitif (tableau 12):
NaNO 3 - nitrate de sodium
CuSO 4 - sulfate de cuivre(II)
CaCO 3 - carbonate de calcium
Ca 3 (RO 4) 2 - orthophosphate de calcium
Na 2 SiO 3 - silicate de sodium
Le nom du résidu acide est dérivé de la racine du nom latin de l'élément acidifiant (par exemple, nitronium - azote, la racine nitr-) et des terminaisons :
-à pour l'état d'oxydation le plus élevé, -ce pour un état d'oxydation inférieur de l'élément acidifiant (tableau 12).
Tableau 12
Noms des acides et des sels
| Nom de l'acide | Formule acide | Le nom des sels | Exemples Soleil |
| Chlorure d'hydrogène (sel) | HCl | chlorures | AgCl chlorure d'argent |
| Sulfure d'hydrogène | H2S | Sulfures | FeS Sulf identifiant fer(II) |
| sulfureux | H2SO3 | Sulfites | Na 2 SO 3 Sulf ce sodium |
| sulfurique | H2SO4 | sulfates | K 2 SO 4 Sulf à potassium |
| azoté | HNO 2 | Nitrite | LiNO 2 Nitre ce lithium |
| Azote | HNO3 | Nitrates | Al(NO 3) 3 Nitr à aluminium |
| orthophosphorique | H3PO4 | Orthophosphates | Ca 3 (PO 4) 2 Orthophosphate de calcium |
| Charbon | H2CO3 | Carbonates | Na 2 CO 3 Carbonate de sodium |
| Silicium | H2SiO3 | silicates | Na 2 SiO 3 Silicate de sodium |
NaHSO 4 - hydrogénosulfate de sodium
NaHS - hydrosulfure de sodium
Les noms des sels basiques sont formés en ajoutant le préfixe " hydroxo" : MgOHCl - chlorhydrate de magnésium.
De plus, de nombreux sels ont des noms traditionnels, tels que :
Na 2 CO 3 - un soda;
NaHCO3 - sodas alimentaires (à boire);
CaCO 3 - craie, marbre, calcaire.