Kovalente Bindung. Molekulare Struktur
6.2.1. Bestimmung der Art der chemischen Bindung durch Differenz
Elektronegativitäten der bindungsbildenden Atome
Die Bildung verschiedener Arten chemischer Bindungen hängt von der Fähigkeit der Atome ab, Elektronen abzugeben oder anzuziehen. Diese Fähigkeit ist durch die Größe der Elektronegativität (EO) gekennzeichnet. Je größer der EO-Wert. desto größer ist die Fähigkeit der Atome, Elektronen anzuziehen. Wenn der Unterschied in EO (ΔEO) zwischen den beiden die Bindung bildenden Atomen null ist (ΔEO = 0), dann ist eine solche Bindung unpolar kovalent. Bei 0< ΔЭО < 2 связь полярная ковалентная. Ионная связь образуется при Δ ЭО > 2.
Beispiel 3. Bestimmen Sie die Art der Bindung in den Verbindungen KC1, H 2, SO 2.
Lösung. Unter Verwendung der EO-Werte für jedes Atom (Anhang, Tabelle A4) finden wir ΔEO.
Am polarsten ist die Na-H-Bindung, da in diesem Fall der ΔEO-Wert am größten ist.
6.2.2. Bestimmung des elektrischen Moments eines Bindungsdipols und eines Moleküls
Um die Polarität der Bindung und des Moleküls abzuschätzen, wird das elektrische Moment des Dipols μ verwendet, das gleich dem Produkt aus Dipollänge und elektrischer Ladung ist Q (Q= 1,602 10 -19 C), d.h. μ = 1 Q... Für polare Bindungen und Moleküle μ> 0, für unpolare μ = 0. Das elektrische Moment eines Dipols - ein System von zwei gleichen und entgegengesetzten elektrischen Ladungen im Vorzeichen - ist eine von einer positiven zu einer negativen Ladung gerichtete Vektorgröße. Maßeinheit μ - Debye ( D): D= 3,33 · 10 –30 Kl · m Das elektrische Moment des Dipols eines zweiatomigen Moleküls ist gleich dem elektrischen Moment des Bindungsdipols. Das elektrische Moment des Dipols eines mehratomigen Moleküls ist gleich der Vektorsumme der elektrischen Momente der Dipole aller Bindungen.
Beispiel 5. Bestimmen Sie das elektrische Moment des Dipols des HF-Moleküls und seine Richtung, wenn μ der Bindung 1.9 . beträgt D(Anhang, Tabelle A5).
Lösung. Das HF-Molekül ist zweiatomig, hat eine lineare Struktur: H – F. Folglich ist das elektrische Moment des Bindungsdipols gleich dem elektrischen Moment des Dipols des Moleküls (1.91 D) und wird von positiv geladenem Wasserstoff zu negativem Fluor geleitet: H®F (EO H = 2.1; EO F = 4.0).
Beispiel 6. Das BeН 2 -Molekül hat eine lineare Struktur. Der Bindungswinkel Н – Ве – Н beträgt 180°. Die Be-H-Bindungen sind polar (EO Be = 1.5; EO H = 2.1). Das Н 2 О-Molekül hat eine eckige Struktur (der Н – О – Н-Bindungswinkel beträgt 104 ° 30 "). Die Н - О-Bindungen sind polar (EO H = 2.1; EO O = 3.5). Sind beide Moleküle polar?
Lösung. Im BeH 2 -Molekül sind die Bindungen polar und der Vektor des elektrischen Moments des Be-H 2 -Bindungsdipols ist von (+) nach (-) gerichtet; von Beryllium mit einem niedrigeren EO zu Wasserstoff mit einem höheren EO, nämlich H. Die Vektorsumme der elektrischen Momente der Bindungsdipole mit gleicher Größe und entgegengesetztem Vorzeichen ist gleich Null. Daher ist das Molekül unpolar (= 0).
Im Н 2 О-Molekül befinden sich die polaren Н-О-Bindungen in einem Winkel von 104° 30 "(Abb. 1). Daher sind ihre elektrischen Momente der Bindungsdipole nicht gegenseitigReis. 1. Elektrisches Moment des Dipols
Moleküle Н 2 О
Lösung. Elektrische Ladung Q= 1,602 · 10 –19 °C. Das elektrische Moment des Dipols des Moleküls ergibt sich aus der Formel
μ = 1 Q= 1,602 · 10 -19 · 3,37 · 10 -11 = 5,4 · 10 -30 C · m (1,63 D).
Antwort: 5,4 · 10 –30 C · m. = (1,63 D).
6.2.3. Erklärung der Struktur von Molekülen nach der Methode der Valenzbindungen (BC)
Die Bildung von Molekülen nach der VS-Methode kann durch einen Austausch- oder Donor-Akzeptor-Mechanismus erfolgen. Die erste basiert auf überlappenden Ein-Elektronen-Atomorbitalen; die zweite ist mit dem Vorhandensein von Donoratomen, die ein Elektronenpaar haben, und Akzeptoratomen, die freie Atomorbitale haben, verbunden.
Beispiel 8. Erklären Sie die Bildung chemischer Bindungen im NH 3 -Molekül und seine Struktur durch den Austauschmechanismus.
Lösung . Um die Bildung chemischer Bindungen im NH 3 -Molekül durch den Austauschmechanismus zu erklären, müssen die elektronischen Formeln von Stickstoff- und Wasserstoffatomen geschrieben werden; bestimmen ihre Valenzelektronen und die Kovalenz jedes Atoms.
Stickstoff 7 N 1 S 2 2S 2 2R 3 – RS 2 2R 3. Die Kovalenz eines Atoms beträgt drei  ... Daher werden drei kovalente Bindungen gebildet.
... Daher werden drei kovalente Bindungen gebildet.
Wasserstoff 1 H 1 S 1 – SS 1 ; Kovalenz ist 1, das Atom bildet eine kovalente Bindung.
Bei der Bildung von drei chemischen Bindungen N – H im NH 3 -Molekül werden drei Einelektronen R-Orbitale des Stickstoffatoms und eines Einelektrons S-Orbital von jedem der drei Wasserstoffatome. Überlappend s-p Orbitale treten in Richtung der größten Elongation auf R-Orbitale im Weltraum in einem Winkel von 90 °. Nach der Überlappung ist die Form des NH 3 -Moleküls eine trigonale Pyramide mit einem H – N – H-Bindungswinkel von 107 ° 20 "(Abb. 2).
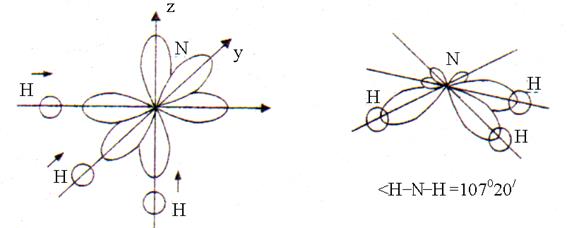
Reis. 2. Die Struktur des Ammoniakmoleküls
Die Abweichung des Winkels von 90° ist darauf zurückzuführen, dass die N-H-Bindung polar ist (EO N = 3,0; EO H = 2,1). Bindende Elektronenpaare sind leicht von Wasserstoffatomen zu Stickstoffatomen verschoben (EO N > EO H). Daher stoßen sich die positiv geladenen Wasserstoffatome sowie die Elektronenpaare der drei N-H-Bindungen gegenseitig ab, was zu einer Vergrößerung des Bindungswinkels auf 107°20" führt.
Beispiel 9. Erklären Sie die Bildung des Ammoniumions NH 4 + aus dem Ammoniakmolekül NH 3 und dem Wasserstoffion H + nach dem Donor-Akzeptor-Mechanismus.
Lösung. Die Bildung von Bindungen im NH 3 -Molekül durch den Austauschmechanismus ist in Beispiel 8 angegeben R-Orbitale des Stickstoffatoms. Aber auch das Stickstoffatom hat eine Zweielektronenvalenz S-Orbital (2 S 2), der in Bezug auf einen Akzeptor ein Donor sein kann - ein Wasserstoffion mit einem freien Orbital. Daher kann das Stickstoffatom durch den Donor-Akzeptor-Mechanismus die vierte kovalente Bindung bilden. Die Bildung der vierten kovalenten Bindung (Donor-Akzeptor) im Ammoniumion NH 4 + lässt sich nach folgendem Schema darstellen:
Spenderakzeptor
Das Ammoniumion hat die Form eines Tetraeders aufgrund von S 1 R 3 -Hybridisierung (siehe Abschnitt 6.2.4).
6.2.4. Bestimmung der Art der Hybridisierung von Atomorbitalen
und die räumliche Konfiguration des Moleküls nach der VS-Methode
Beispiel 10. Bestimmen Sie die Art der Hybridisierung von Atomorbitalen, die räumliche Konfiguration und Polarität des BH 3 -Moleküls.
Lösung.
Bor: 5 V l S 2 2S 2 2P 1 – R-Element; Valenzelektronen 2 S 2 2P 1 ; die Kovalenz eines Atoms im normalen (nicht angeregten) Zustand ist gleich eins  .
.
Wasserstoff 1 H 1 S 1 – S-Element; Valenzelektronen 1 S 1 ; Kovalenz ist gleich eins. Im Normalzustand kann ein Boratom aufgrund eines ungepaarten . nur eine chemische Bindung eingehen R-Elektron. Die Zusammensetzung des BH 3 -Moleküls weist jedoch darauf hin, dass Bor drei chemische Bindungen eingeht, d.h. seine Kovalenz ist drei. Dies ist möglich, wenn ein Atom von einem normalen in einen angeregten Zustand überführt wird (Abb. 3).
Reis. 3. Bildung von Hybridorbitalen des Boratoms
Drei Hybridorbitale stehen symmetrisch im Raum in einem Winkel von 120° zueinander und sind auf die Eckpunkte eines regelmäßigen Dreiecks gerichtet. Drei Hybridorbitale des Boratoms bilden sich mit einem Elektron S-Orbitale von drei Wasserstoffatomen, drei chemische Bindungen im BH 3 -Molekül, das die Form eines regelmäßigen Dreiecks hat (Abb. 4).
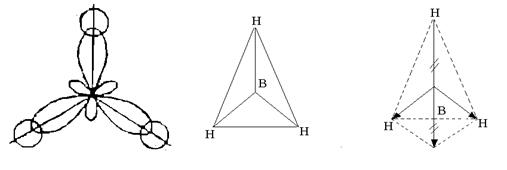
Reis. 4. Die Struktur des BH 3 -Moleküls
Obwohl die B – H-Bindungen polar sind (EO B = 2.0; EO H = 2.1), ist das Molekül unpolar, weil hat einen symmetrischen Aufbau. Die resultierende Vektorsumme der elektrischen Momente der Dipole der drei B-H-Bindungen ist Null (siehe Abb. 4).
Die Hybridisierung von Atomorbitalen bestimmt die räumliche Konfiguration von Molekülen und Ionen (Tabelle 2).
Tabelle 2
Räumliche Strukturen einiger Moleküle und Ionen
6.2.5. Erklärung der Entstehung und Eigenschaften von zweiatomigen Molekülen vom Typ B 2 nach der Methode der Molekülorbitale (MO)
Nach der MO-Methode gibt es keine Atomorbitale (AO) in einem Molekül, aber es gibt bindende und antibindende MOs, die durch Linearkombination (Mischen) von AOs erhalten werden. Beim Kombinieren n AO wird gebildet n MO, von denen die Zahl der Bindungsmittel gleich der Zahl der AO-Energie ist. Die Energie bindender MOs ist geringer als die Energie von AO, und die Energie antibindender MOs ist größer als die Energie von AO. Das Verfahren zum Platzieren von Elektronen auf dem MO ist das gleiche wie im Fall von AO; Zunächst werden niederenergetische MOs (Minimum-Energy-Prinzip) nach dem Pauli-Prinzip und der Gund-Regel gefüllt.
Der einfachste Fall der MO-Bildung tritt auf, wenn das AO zweier Atome desselben Elements (B2) kombiniert wird. Mit einer Kombination aus zwei s-s AO werden zwei MOs gebildet, die als σ (Sigma)-Orbitale bezeichnet werden. Einer von ihnen ist bindend (), der andere löst sich (). Zwei s-MOs werden auch durch eine Kombination von zwei erhalten p x-p x AO(s). Die Kombination aus beiden r y-r y und zwei p z -p z AO wird durch zwei p sv -MO (and) und zwei p mal -MO (and) gebildet.
Die Bildung von MOs aus atomaren und die Änderung ihrer Energie kann in Form eines Energiediagramms dargestellt werden, in dem die Werte der Energie der Orbitale entlang der Vertikalen aufgetragen sind (Abb. 5).
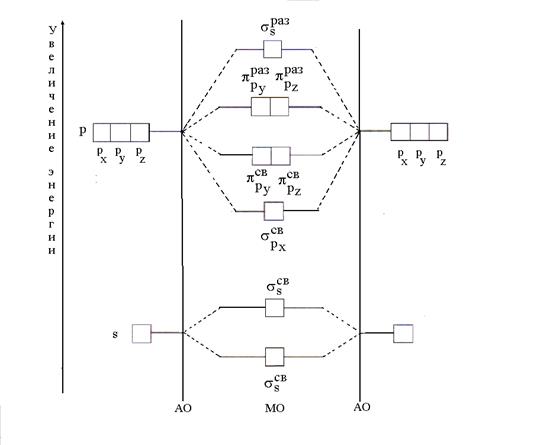
Reis. 5. Energieschema der MO-Bildung mit der Kombination von AO zweier Atome desselben Elements (B2)
Mit der MO-Methode können Sie den Magnetismus eines Moleküls bestimmen. Das Vorhandensein ungepaarter Elektronen in einem Molekül bestimmt also seinen Paramagnetismus, und das Fehlen dieser Elektronen bestimmt den Diamagnetismus. Mit der MO-Methode können Sie die Kommunikationsfrequenz ermitteln. Die Multiplizität w ist gleich der halben Differenz der Elektronenzahl auf der Bindung n sv und lockerung n mal MO:
Wenn die Anzahl der Elektronen auf den bindenden und antibindenden MOs gleich ist, dann ist die Bindungsmultiplizität null. Folglich haben diese Elektronen keinen Einfluss auf die Bildung einer chemischen Bindung.
Die MO-Methode kann auch die Stabilität des Moleküls erklären. Die Stabilität des Moleküls hängt mit der Energiebilanz aller bindenden und antibindenden Elektronen zusammen. Grob können wir annehmen, dass ein antibindendes Elektron die Wirkung eines bindenden Elektrons aufhebt. Je mehr Elektronen auf bindenden MOs und weniger Elektronen auf antibindenden MOs sind, desto stabiler ist das Molekül.
Beispiel 11. Erklären Sie mit der MO-Methode die Bildung des O 2 -Moleküls. Bestimmen Sie die Vielfältigkeit der Verbindung und ihren Magnetismus.
Lösung. Das O 2 -Molekül besteht aus einem Atom des gleichen Elements - Sauerstoff. Seine elektronische Formel lautet wie folgt: 8 O 1 S 2 2S 2 2P 4. Valenzelektronen des Sauerstoffatoms 2 S 2 2P 4 nehmen an der Bildung einer chemischen Bindung teil, d.h. MOs erhält man durch Linearkombination 2 S- und 2 R- AO von zwei Sauerstoffatomen.
Die Verteilung der zwölf Valenzelektronen im Sauerstoffmolekül erfolgt nach dem Prinzip der minimalen Energie. Zunächst werden MOs mit je zwei Elektronen mit antiparallelen Spins gefüllt (Pauli-Prinzip). Dann werden sechs Elektronen auf drei bindende MO (;;) platziert, jeweils zwei Elektronen mit antiparallelen Spins. Die verbleibenden zwei Elektronen besetzen die antibindenden MO(s), je ein Elektron mit parallelen Spins, gemäß der Gund-Regel. Nach dem Aufbringen der Elektronen auf das MO hat das Energiediagramm des Sauerstoffmoleküls folgende Form (Abb. 6).
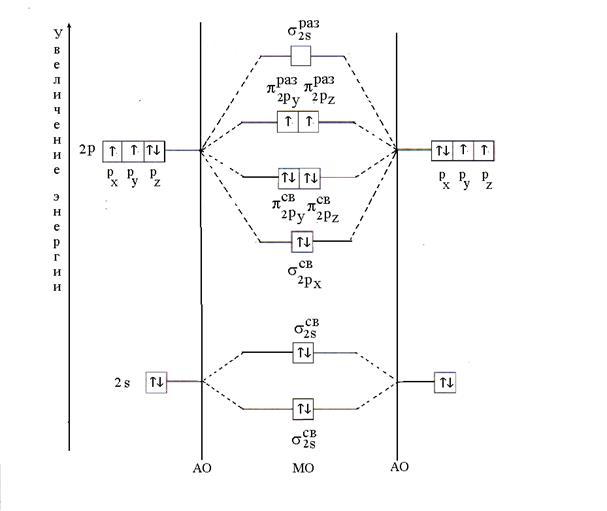
Reis. 6. Energiediagramm des O 2 -Moleküls
Die nach Formel (2) berechnete Multiplizität der Bindung im Sauerstoffmolekül ist gleich zwei. Die Anwesenheit von zwei ungepaarten Elektronen bestimmt den Paragnetismus des Moleküls.
STEUERUNGSAUFGABEN
101. Im Molekül Ethin (Acetylen) C 2 H 2 gibt es eine Dreifachbindung zwischen den Kohlenstoffatomen: eine s- und zwei p-Bindungen. Die Bildung von zwei p-Bindungen erfolgt durch Überlappung r y-r y und zwei p z -p z Atomorbitale. Wie entsteht eine Bindung? Bestimmen Sie die Art der Hybridisierung bei der Bildung der s-Bindung. Zeichnen Sie die Struktur des Ethinmoleküls und berechnen Sie die Bindungsenergie mit den Daten in Tabelle. 3.
Antwort: Δ h= - 245 kJ / mol.
102. Erklären Sie mit Hilfe des Energiediagramms der MO-Methode, warum das Molekül instabil ist, das Ion jedoch stabil. Berechnen Sie die Häufigkeit der Verbindung in beiden Fällen. Wie und warum ändert sich die chemische Bindungsenergie beim Gehen.
103. Erklären Sie die Bildung chemischer Bindungen im H2O-Molekül nach der BC-Methode. Zeichnen Sie die räumliche Konfiguration des Moleküls. Berechnen Sie die Länge der Н-О-Bindung mit den Daten in Tabelle 2. Antwort: 0,97 · 10 -10 m.
104. Erklären Sie die Struktur des CH 4 -Moleküls nach der BC-Methode. Bestimmen Sie die Art der Hybridisierung bei der Bildung chemischer Bindungen. Beweisen Sie mit den Daten in Tabelle 4, dass die Bindungen im Molekül kovalent polar sind. Warum ist das elektrische Moment des Dipols des Moleküls Null? ... Welches Atom fungiert als Donor und welches als Akzeptor?
108. Erklären Sie die Struktur des СCl 4 -Moleküls nach der BC-Methode. Bestimmen Sie die Art der Hybridisierung bei der Bildung chemischer Bindungen. Berechnen Sie die Länge der C-Cl-Bindung in diesem Molekül mit den Daten in Tabelle. 2. Antwort: 1.765 · 10 -10 m.
109. Erklären Sie die Struktur des CO 2 -Moleküls nach der BC-Methode. Zeichnen Sie die räumliche Konfiguration des Moleküls. Bestimmen Sie die Art der Hybridisierung bei der Bildung chemischer Bindungen. Verwenden der Daten in der Tabelle. 4 beweisen, dass die Bindungen kovalent polar sind. Warum ist das CO 2 -Molekül unpolar?
110. Das BF 3 -Molekül hat eine planare Dreieckskonfiguration, während das NF 3 -Molekül eine dreidimensionale (pyramidale) Konfiguration hat. Erklären Sie mit der VS-Methode, was der Grund für den Unterschied in der Struktur dieser Moleküle ist? Welches Molekül ist unpolar und warum? Bestätigen Sie das Ergebnis durch die Werte der elektrischen Momente der Dipole der Moleküle (siehe Tabelle 5).
111. Das CH 4 -Molekül und das Ion haben die gleiche räumliche Konfiguration. Wie lässt sich dies mit der Hybridisierung der Atomorbitale des Zentralatoms erklären? Warum ist das elektrische Moment des Dipols des CH 4 -Moleküls gleich Null?
112. Erklären Sie mit der Methode der Valenzbindungen die Struktur des Ethanmoleküls C 2 H 6 (H 3 C – CH 3). Was ist die Art der chemischen Bindungshybridisierung? Berechnen Sie die Energie der C – C-Bindung, wenn die Standardenthalpie der Bildung von C 2 H 6 aus gasförmigem Kohlenstoff und Wasserstoff – 2798,8 kJ / mol und die Energie der C – H-Bindung – 411,3 kJ / mol beträgt.
Antwort: Δ h= - 331,0 kJ / mol.
113. Erklären Sie mit der BC-Methode, warum die Н 2 О- und Н 2 S-Moleküle eine Winkelstruktur haben, während der Bindungswinkel<(H–O–H) = 104 0 30¢ больше валентного угла <(H–S–H) = 92 0 . На основании данных табл.5 вычислите длины диполей молекул и покажите направления электрических моментов диполей связей в них.
Antwort: 3,83 · 10 –11 und 1,55 · 10 –11 m.
114. Erklären Sie mit Hilfe der BC-Methode die Molekülstruktur von PCl 3 und AlCl 3. Was ist der Unterschied in der geometrischen Konfiguration von Molekülen? Warum ist das PCl 3 -Molekül polar und AlCl 3 hat ein elektrisches Dipolmoment von null?
115. Erklären Sie mit Hilfe der BC-Methode die Struktur des CS 2 -Moleküls. Bestimmen Sie die Art der Hybridisierung. Welche geometrische Konfiguration hat das Molekül? Warum ist das elektrische Moment des Dipols null?
; ... Berechnen Sie die Häufigkeit der Kommunikation und bestimmen Sie, welche die stabilste ist.120. Erstellen Sie mit der MO-Methode Energiediagramme für; ; ... Berechnen Sie die Vielfalt der Bindungen und ihre magnetischen Eigenschaften.







