9.2 Standard-Wasserstoffelektrode. Elektrodenpotential.
Es ist möglich, die EMF eines aus zwei Elektroden bestehenden Stromkreises mit hoher Genauigkeit zu messen. Die absolute Potentialdifferenz an der Grenzfläche Metall-Lösung kann jedoch weder gemessen noch berechnet werden. Für praktische Zwecke reicht es aus, bedingte Werte zu haben, die die Potenziale verschiedener Elektroden charakterisieren, bezogen auf das Potenzial einer bestimmten als Standard ausgewählten Elektrode.
Als bedingt null Kapazität ausgewählt Potenzial einer Standard-Wasserstoffelektrode:
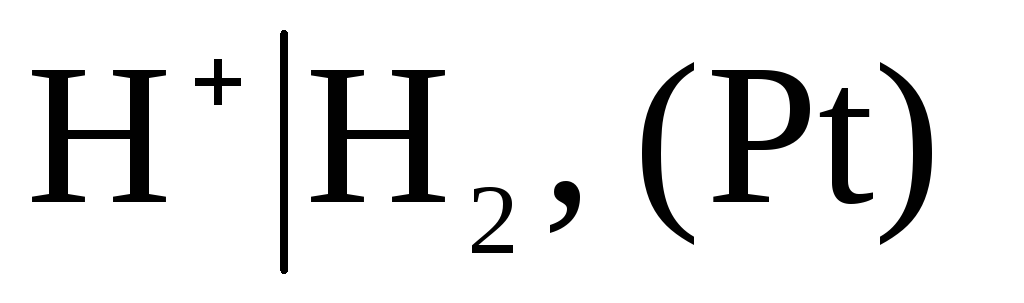 ,
,
wobei der Druck des eingeblasenen Wasserstoffs 1 atm beträgt und die Aktivität der Wasserstoffionen in der Lösung gleich Eins ist (Abb. 1). Bei jeder Temperatur 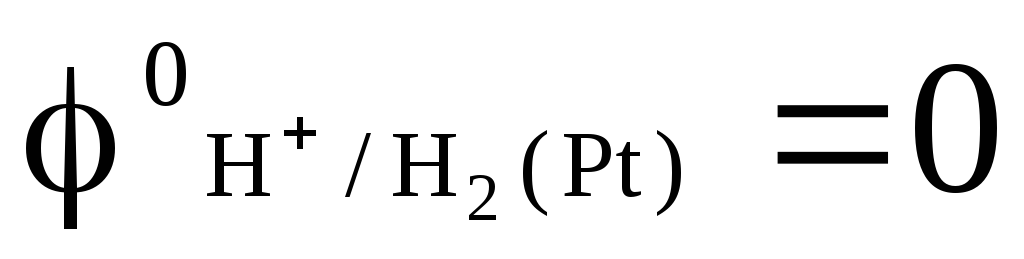 .
.
Die Elektrodenreaktion für eine Wasserstoffelektrode wird wie folgt geschrieben:
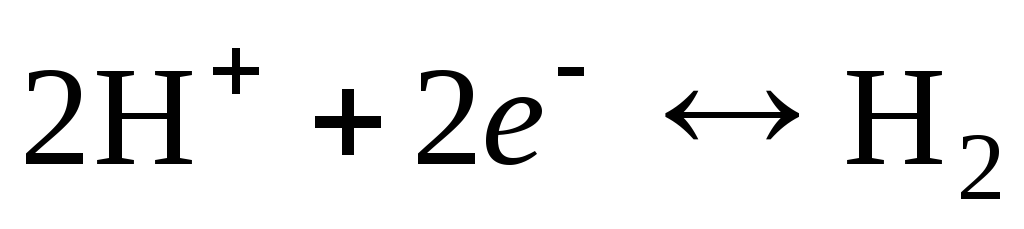 .
.
![]()
Reis. 1. Gesamtansicht der Wasserstoffelektrode.
Für das Elektrodenpotential jeder Elektrode wurde entschieden, die EMF eines Stromkreises zu nehmen, der aus der betreffenden Elektrode und einer Standard-Wasserstoffelektrode besteht. In diesem Fall befindet sich rechts im Stromkreis die betrachtete Elektrode und links eine Standard-Wasserstoffelektrode.
Beispiel 9.1. Erstellen Sie ein GE, um das Standardelektrodenpotential von Cu 2+ / Cu- und Zn 2+ / Zn-Elektroden zu bestimmen.
1). Lassen Sie uns eine galvanische Zelle aus Standard-Wasserstoff- und Kupferelektroden herstellen:
Gesamtpotential-bildende Reaktion: d.h. die Elektronenübertragung im Stromkreis erfolgt von links nach rechts (von der linken Elektrode nach rechts). Unter Standardbedingungen 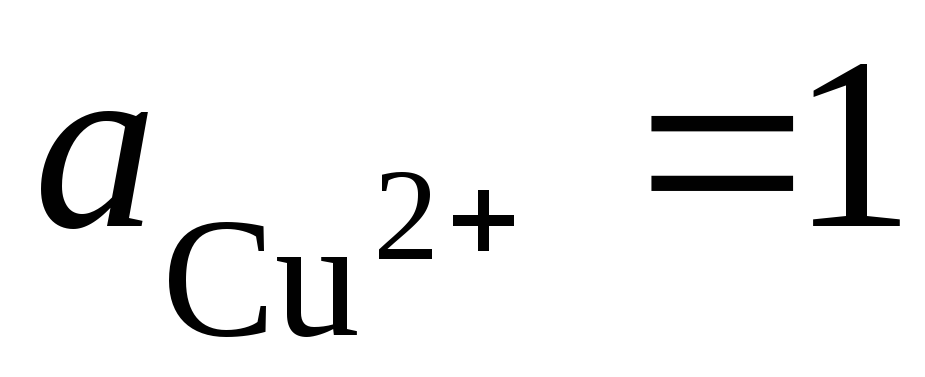 , Die EMF dieses Elements beträgt E = 0,337 V. Daher ist
, Die EMF dieses Elements beträgt E = 0,337 V. Daher ist
![]() .
.
2). Belassen wir auf die gleiche Weise eine galvanische Zelle aus Standard-Wasserstoff- und Zinkelektroden:
Gesamtreaktion: d.h. der Elektronentransfer im Stromkreis erfolgt von rechts nach links. Unter Standardbedingungen 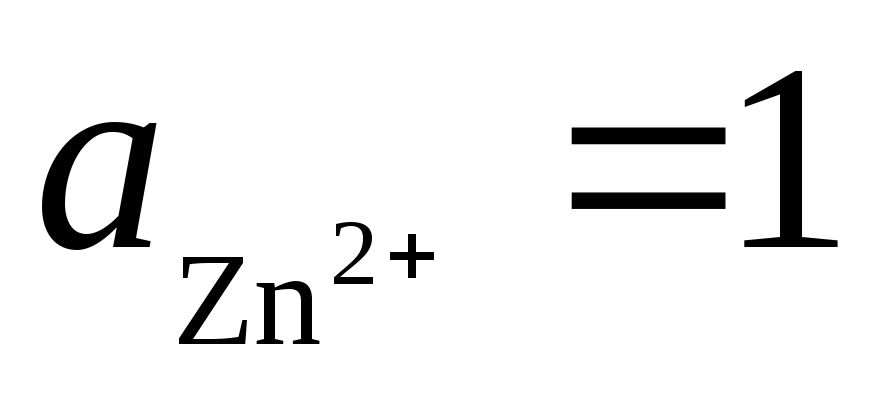
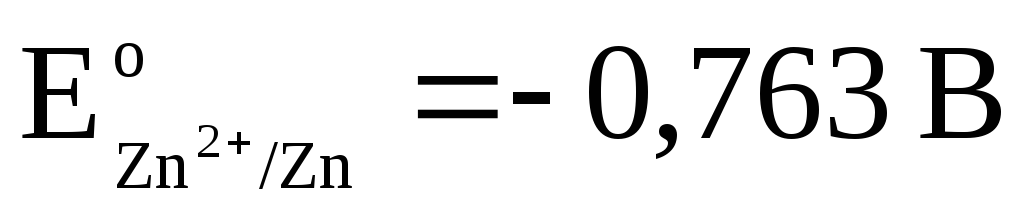 .
.
9.3 Nernst-Gleichung für die elektromotorische Kraft einer galvanischen Zelle.
Die elektrische Eigenschaft der Elektrode ist Elektrodenpotential, und eine galvanische Zelle (elektrochemischer Stromkreis) - elektromotorische Kraft (EMF),
Die EMF eines korrekt geöffneten elektrochemischen Stromkreises ohne Diffusionspotential entspricht der Potentialdifferenz der rechten (positiven) und linken (negativen) Elektrode und ist immer positiv.
EMF einer galvanischen Zelle
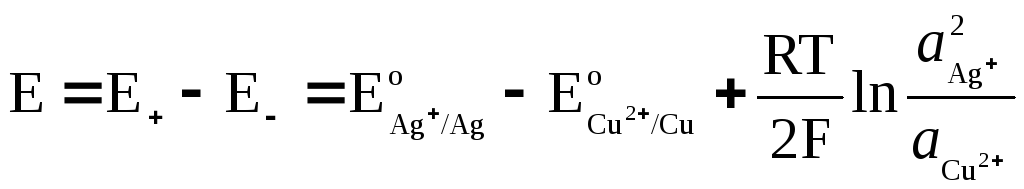
wo 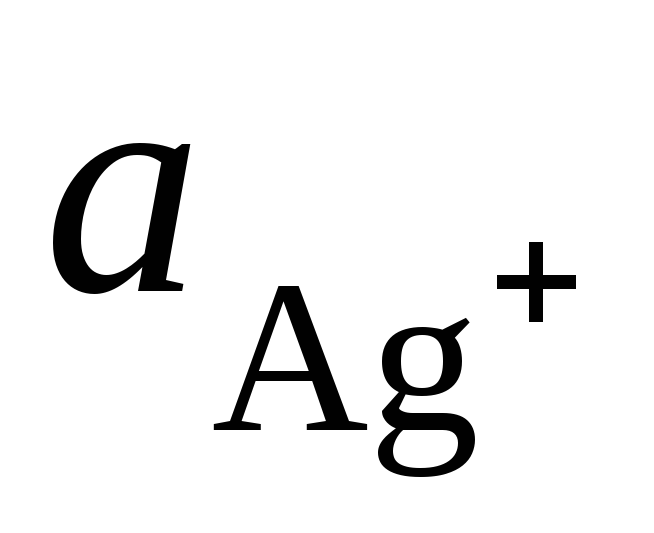 und
und 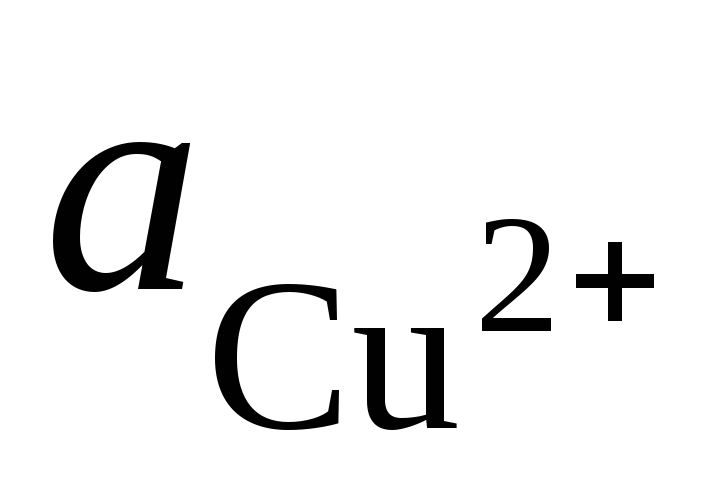 - Aktivität von Ag + und Cu 2+ Ionen in Lösungen ihrer Salze.
- Aktivität von Ag + und Cu 2+ Ionen in Lösungen ihrer Salze.
Wir bezeichnen
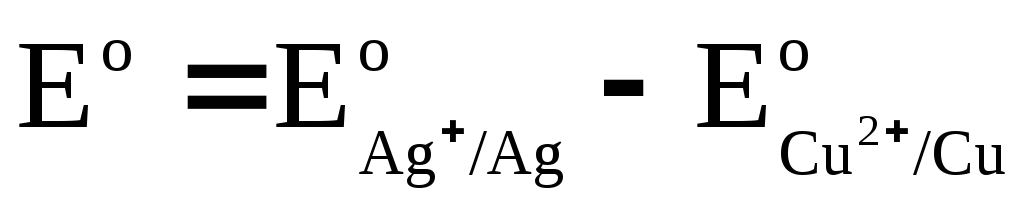 ,
,
wo E o - Standard-EMK einer galvanischen Zelle. Dann
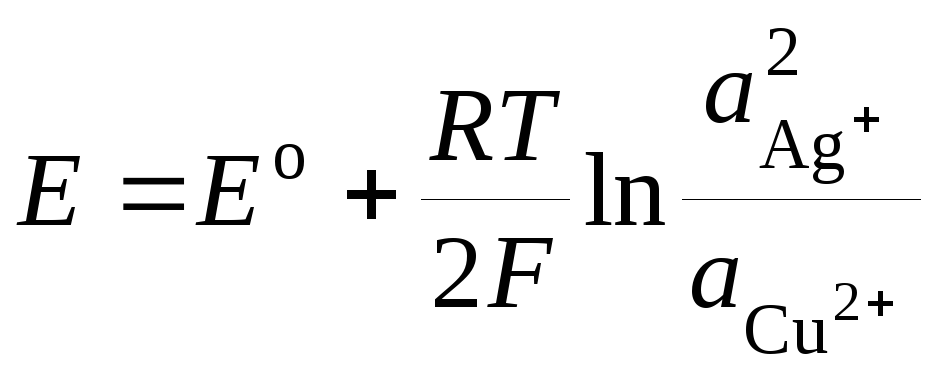 .(3)
.(3)
Gleichung (3) heißt Nernst-Gleichungen für die EMF einer galvanischen Zelle.
Wenn in einer galvanischen Zelle eine reversible chemische Reaktion auftritt
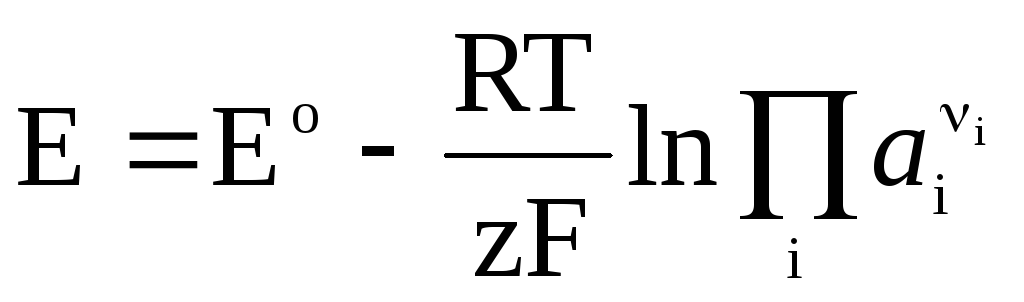 , (4)
, (4)
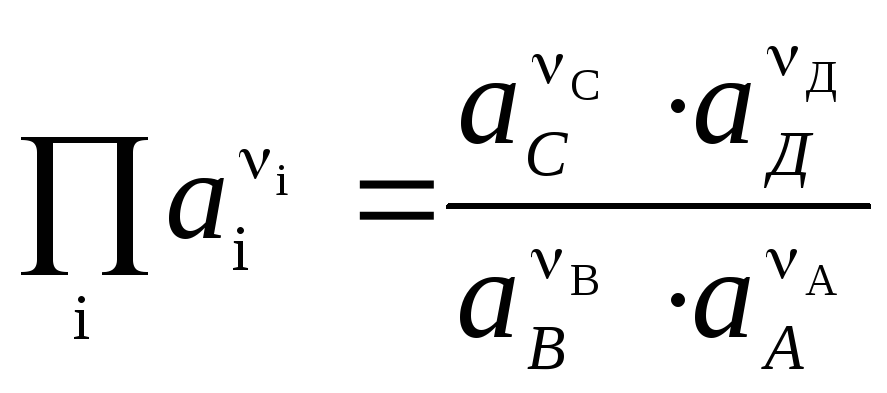
Die Nernst-Gleichung in der Form (4) ist anwendbar, um die EMF jeder galvanischen Zelle (durch die chemische Gesamtreaktion) und das Potential jeder Elektrode (durch die Elektrodenreaktion) zu berechnen. EMF hängt mit den thermodynamischen Eigenschaften der Reaktion zusammen. Es ist bekannt, dass
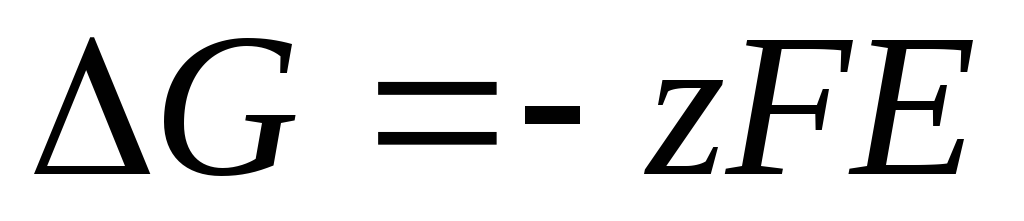 .
.
9.4 Klassifizierung reversibler Elektroden.
Die Klassifizierung von reversiblen Elektroden basiert auf den Eigenschaften von Stoffen, die an potenzialbestimmenden Prozessen beteiligt sind.
1. Elektroden erster Art.
Erstklassige Elektroden Sind Metallelektroden in Bezug auf Kationen (einschließlich Amalgam) reversibel ( 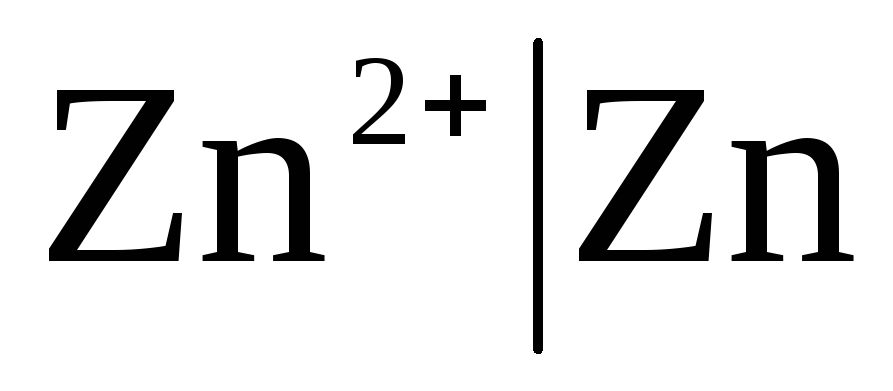 ) und Metalloid, Elektroden sind bezüglich Anionen reversibel (
) und Metalloid, Elektroden sind bezüglich Anionen reversibel ( 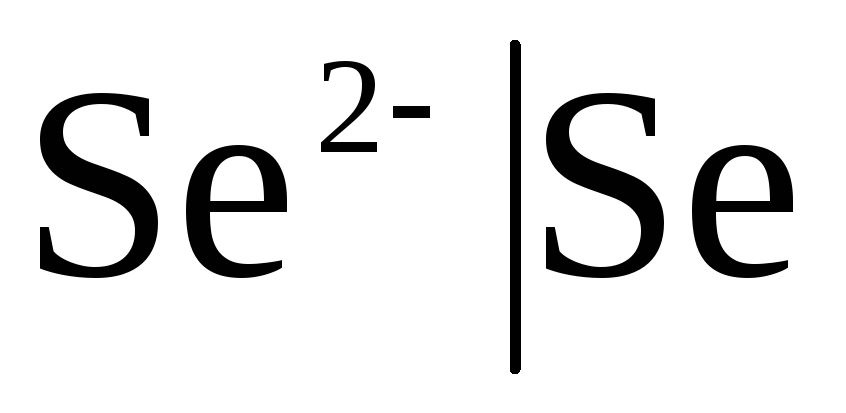 ).
).
Ist die Elektrode bezüglich des Zn 2+ / Zn-Kations reversibel, dann kann man dafür schreiben:
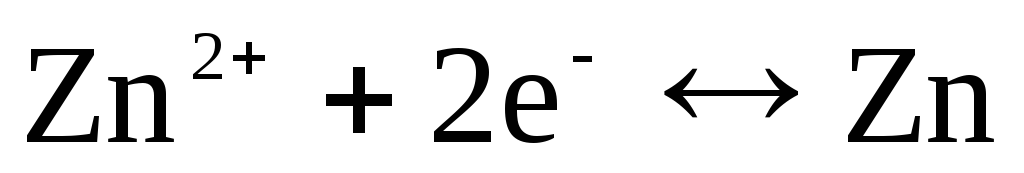 ,
,
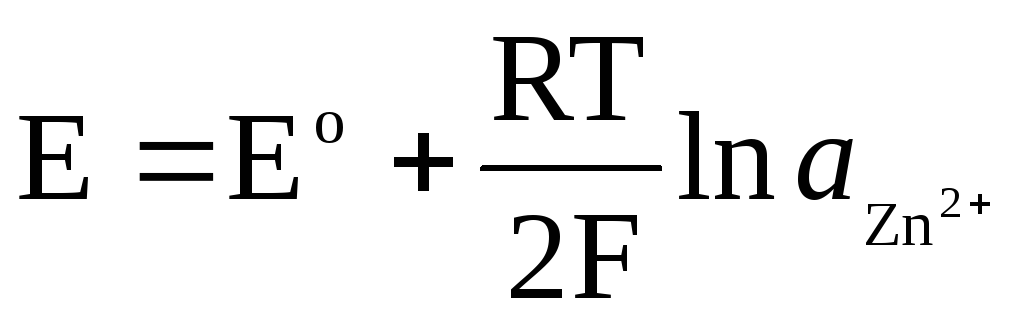
Für Zn 2+ / Zn (Hg) Amalgamelektrode:
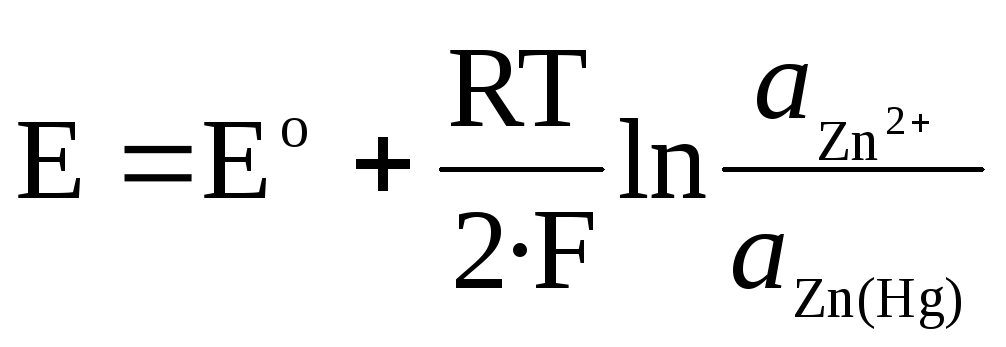 .
.
Ist die Elektrode gegenüber dem Anion reversibel, dann
![]() ,
,
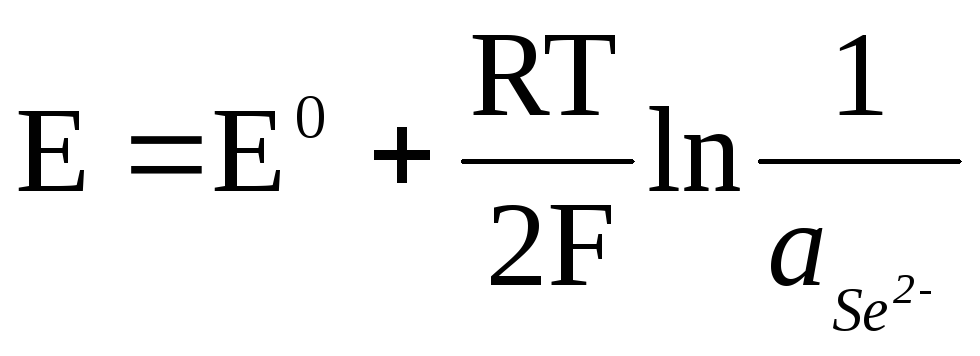 .
.
Zu den Elektroden der ersten Art gehören auch Gas Elektroden (Wasserstoff 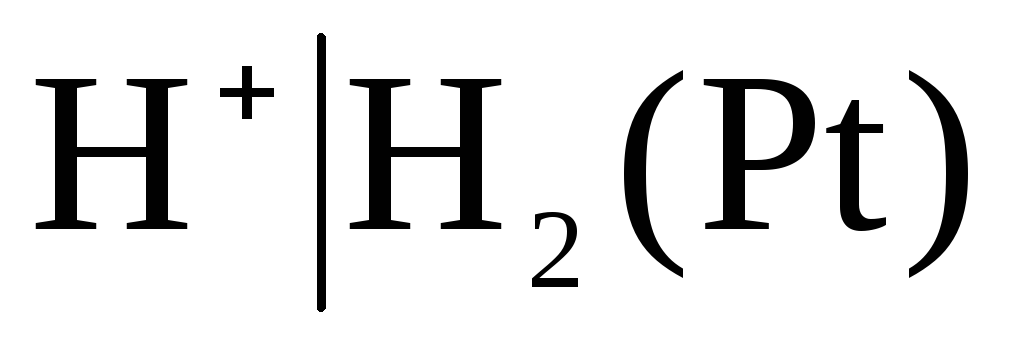 , Chlor
, Chlor 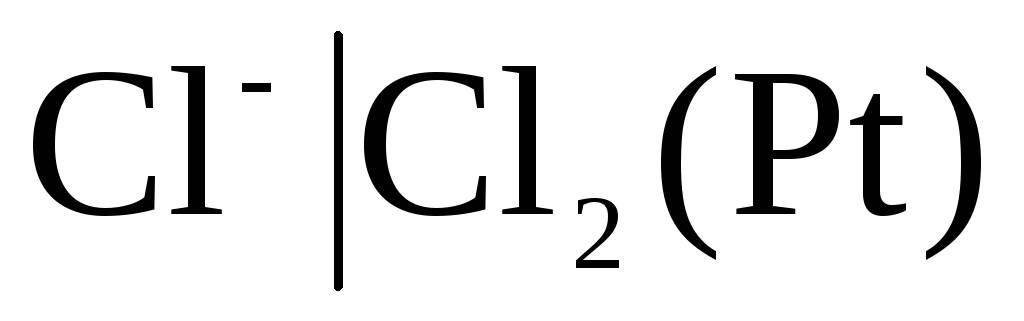 usw.). Sie können bezüglich des Kations (H +) oder Anions (Cl -) reversibel sein. Beispielsweise ist eine Wasserstoffelektrode bezüglich eines Kations reversibel. Die Gleichung des Elektrodenprozesses dafür kann in der Form geschrieben werden:
usw.). Sie können bezüglich des Kations (H +) oder Anions (Cl -) reversibel sein. Beispielsweise ist eine Wasserstoffelektrode bezüglich eines Kations reversibel. Die Gleichung des Elektrodenprozesses dafür kann in der Form geschrieben werden:
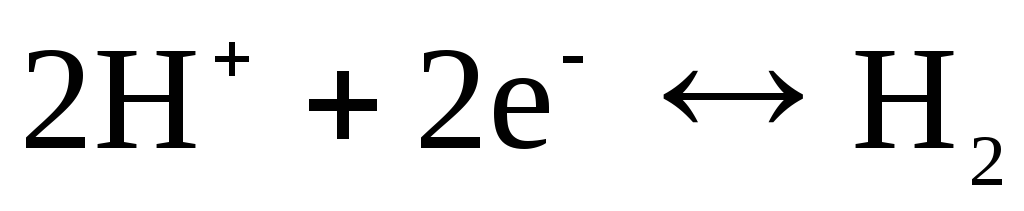 .
.
Das Potential der Wasserstoffelektrode wird bestimmt durch den Ausdruck
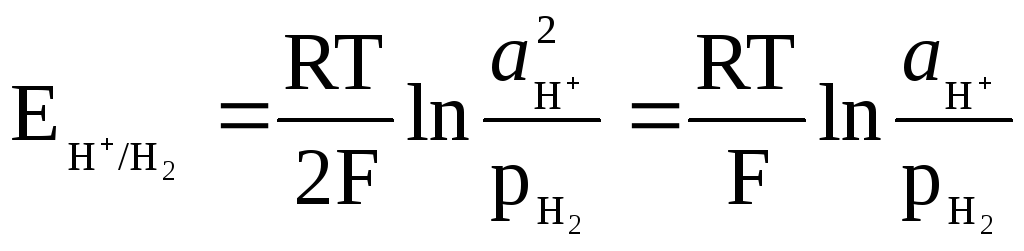 ,
,
und kann auf den pH-Wert der Lösung bezogen werden.
Für Chlorelektrode 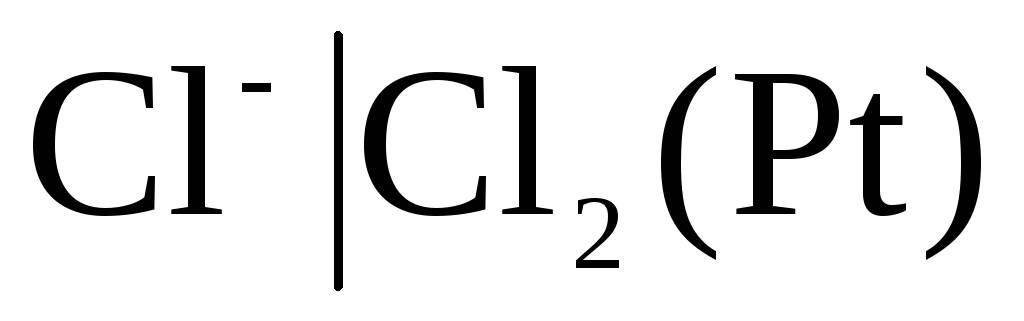 mit potenzialbestimmender Antwort
mit potenzialbestimmender Antwort
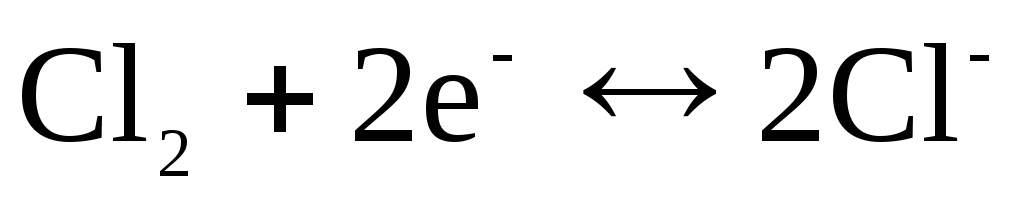 .
.
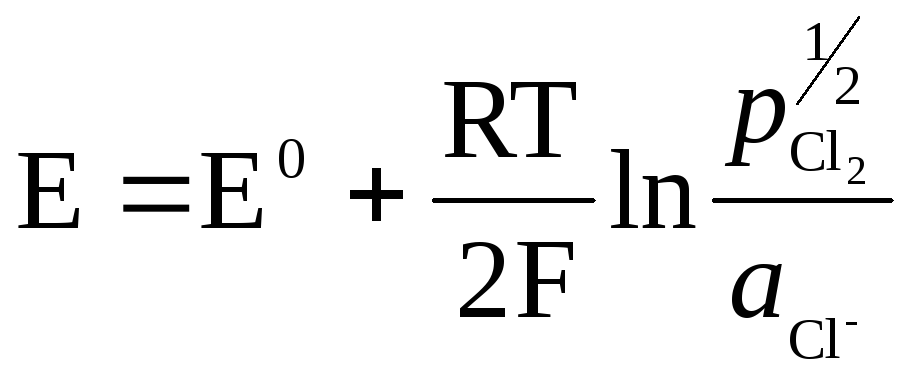
Das Metall (Pt) in Gaselektroden ist notwendig, um den Kontakt zwischen Gas und Lösung herzustellen, muss gegenüber den Stoffen in der Lösung inert sein und kann nur einen potentialbestimmenden Vorgang katalysieren.







