Зависимость скорости реакции от температуры. Правило Вант - Гоффа. Температурный коэффициент скорости реакции и его особенности для биохимических процессов.
Факторы влияющие на протекание реакции
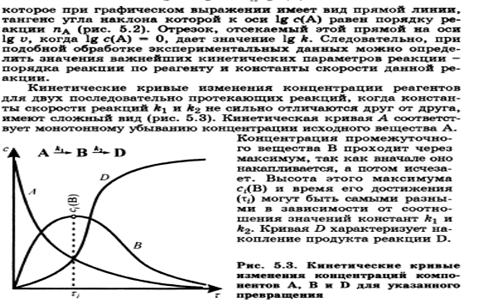
В организме человека протекают тысячи ферментативных реакций, проходящих в живой клетке. Однако в многостадийной цепи процессов достаточно велика разница между скоростями отдельных реакций. Так, синтезу в клетке молекул белка предшествует, по крайней мере, еще две стадии: синтез транспортной РНК и синтез рибосом. Но время, за которое удваивается концентрация молекул т-РНК, составляет 1,7 мин., молекулы белка - 17 мин., а рибосом - 170 мин. Скорость суммарного процесса медленной (лимитирующей) стадии, в нашем примере - скорость синтеза рибосом. Наличие лимитирующей реакции обеспечивает высокую надежность и гибкость управления тысячами реакций, происходящих в клетке. Достаточно держать под наблюдением и регулировать лишь наиболее медленные из них. Такой способ регулирования скорости многостадийного синтеза носит название принципа минимума. Он позволяет существенно упростить и сделать более надежной систему авторегулирования в клетке.
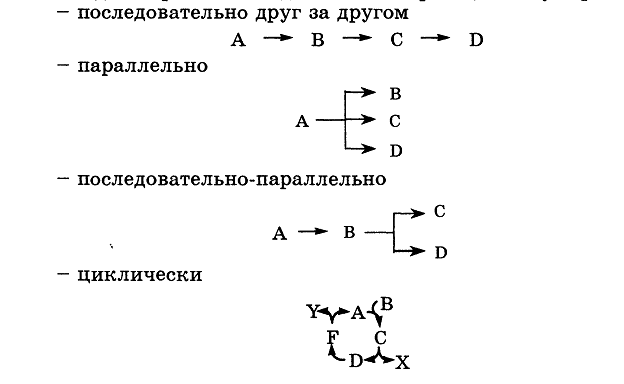
Классификации реакций, применяющиеся в кинетике: реакции, гомогенные, гетерогенные и микрогетерогенные; реакции простые и сложные (параллельные, последовательные, сопряженные, цепные). Молекулярность элементарного акта реакции. Кинетические уравнения. Порядок реакции. Период полупревращения

Микрогетерогенные реакции –

Молекулярность реакции определяется числом молекул, вступающих в химическое взаимодействие в элементарном акте реакции. По этому признаку реакции разделяются на мономолекулярные, бимолекулярные и тримолекулярные.
Тогда реакции типа А ->В будут являться мономолекулярными, например:
а) С 16 Н 34 (t°C) ->C g H 18 + С 8 Н 16 - реакция крекинга углеводородов;
б) CaC0 3 (t°C) ->СаО + С0 2 - термическое разложение карбоната кальция.
Реакции типа А + В -> С или 2А -> С - являются бимолекулярными, например:
а) С + 0 2 -> С0 2 ; б) 2Н 2 0 2 -> 2Н 2 0 + 0 2 и т. д.
Тримолекулярные реакции описываются общими уравнениями типа:
а) А + В + С Д; б) 2А + В Д; в) 3А Д.
Например: а) 2Н 2 + 0 2 2Н 2 0; б) 2NO + Н 2 N 2 0 + Н 2 0.
Скорость реакций в зависимости от молекулярности будет выражаться уравнениями: а) V = к С А - для мономолекулярной реакции; б) V = к С А С в или в) V = к С 2 А - для бимолекулярной реакции; г) V = к С С в С э д) V = к С 2 А С в или е) V = k С 3 А - для тримолекулярной реакции.

Молекулярность-число молекул, реагирующих в в одном элементарном химическом акте.



Нередко молекулярность реакции трудно установить, поэтому используют более формальный признак - порядок химической реакции.
Порядок реакции равен сумме показателей степеней концентраций в уравнении, выражающем зависимость скорости реакции от концентрации реагирующих веществ (кинетическом уравнении).
Порядок реакции чаще всего не совпадает с молекулярностью ввиду того, что механизм реакции, т. е. "элементарный акт" реакции (см. определение признака молекулярности), трудно установить.
Рассмотрим ряд примеров, иллюстрирующих указанное положение.
1.Скорость растворения кристаллов описывается уравнениями кинетики нулевого порядка, несмотря на мономолекулярность реакции: AgCl (TB) ->Ag + + CI", V = k C(AgCl (TB p= k"C(AgCl (ra }) - p - плотности и является постоянной величиной, т. е. скорость растворения не зависит от количества (концентрации) растворяемого вещества.
2.Реакция гидролиза сахарозы: СО + Н 2 0 -> С 6 Н 12 0 6 (глюкоза) + С 6 Н 12 0 6 (фруктоза) является бимолекулярной реакцией, но ее кинетика описывается кинетическим уравнением первого порядка: V=k*C cax , так как в условиях опытов, в том числе и в организме, концентрация воды есть величина постоянная С(Н 2 0) - const.
3.  Реакция разложения водородпероксида, протекающая с участием катализаторов, как неорганических ионов Fe 3+ , Cu 2+ металлической платины, так и биологических - ферментов, например каталазы, имеет общий вид:
Реакция разложения водородпероксида, протекающая с участием катализаторов, как неорганических ионов Fe 3+ , Cu 2+ металлической платины, так и биологических - ферментов, например каталазы, имеет общий вид:
2Н 2 0 2 -> 2Н 2 0 + О э т. е. является бимолекулярной.
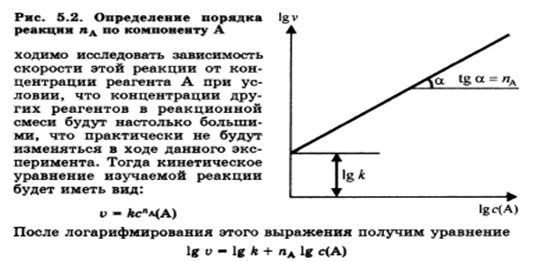
Зависимость скорости реакции от концентрации. Кинетические уравнения реакций первого, второго и нулевого порядков. Экспериментальные методы определения скорости и константы скорости реакций.






Зависимость скорости реакции от температуры. Правило Вант - Гоффа. Температурный коэффициент скорости реакции и его особенности для биохимических процессов.

γ-температурный коэффициент скорости реакции.

Физический смысл величины γ заключается в том, что он показывает, во сколько раз изменяется скорость реакции при изменении температуры на каждые 10 градусов.

 15.Понятие о теории активных соударении. Энергетический профиль реакции; энергия активации; уравнение Аррениуса. Роль стерического фактора. Понятие о теории переходного состояния.
15.Понятие о теории активных соударении. Энергетический профиль реакции; энергия активации; уравнение Аррениуса. Роль стерического фактора. Понятие о теории переходного состояния.




Взаимосвязь константы скорости, энергии активации и температуры описывается уравнением Аррениуса: k T = k 0 *Ae~ E / RT , где к т и к 0 - константы скоростей при температуре Т и Т э е - основание натурального логарифма, А -стерический фактор.
Стерический фактор А определяет вероятность столкновения двух реагирующих частиц в активном центре молекулы. Этот фактор имеет особо важное значение для биохимических реакций с биополимерами. При кислотно-основных реакциях Н + -ион должен вступить в реакцию с концевой карбоксильной группой - СОО". Однако не всякое столкновение Н + -иона с молекулой белка приведет к данной реакции. Эффективны будут только те столкновения, которые непосредственно осуществляются в некоторых точках макромолекул, называемых активными центрами.
Из уравнения Аррениуса следует, что константа скорости тем выше, чем меньше величина энергии активации Е и выше температура Т процесса.








