Поговорим о том, как определить тип гибридизации
Поговорим о том, как определить тип гибридизации, а также рассмотрим геометрическое строение молекулы.
История появления термина
В начале двадцатого века Л. Полинглом была предложена теория геометрии молекул с ковалентной связью. В качестве основы для образования связи было взято перекрывание электронных облаков. Метод стали называть валентными связями. Как определять тип гибридизации атомов в соединениях? Автор теории предлагал учитывать смешивание гибридных орбиталей.
Определение
Для того чтобы понять, как определить тип гибридизации в соединениях, разберем, что обозначает этот термин.
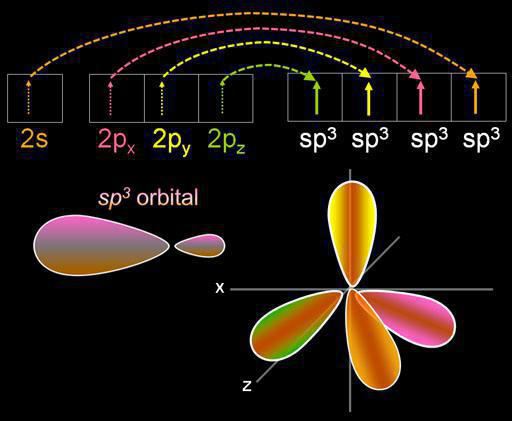
Гибридизация представляет собой смешивание электронных орбиталей. Данный процесс сопровождается распределением в них энергии, изменением их формы. В зависимости от того, в каком количестве будут смешиваться s- и p-орбитали, тип гибридизации может быть различным. В органических соединениях атом углерода может существовать в состоянии sp, sp2, sp3. Есть и более сложные формы, в которых участвуют, помимо sp, d-орбитали.
Правила выявления в молекулах неорганических веществ
Выявить вариант гибридизации можно для соединений с ковалентной химической связью, имеющих тип АВп. А - основной атом, В - лиганд, п - число от двух и выше. В подобной ситуации в гибридизацию будут вступать только валентные орбитали главного атома.
Способы определения
Поговорим подробнее о том, как определить тип гибридизации. В химическом понимании данный термин предполагает изменение энергии и формы орбиталей. Наблюдается подобный процесс в тех случаях, когда для образования связи используют электроны, которые принадлежат различным типам.
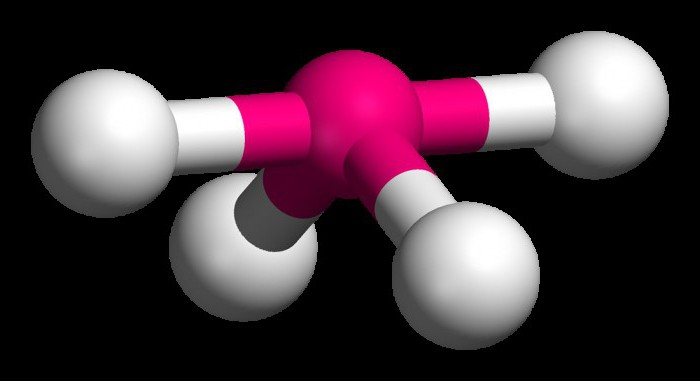
Чтобы понять, как определить тип гибридизации, рассмотрим молекулу метана. Данное вещество является первым представителем гомологического ряда насыщенных (предельных) углеводородов. В пространстве молекула СН4 является тетраэдром. Единственный атом углерода образует с водородами связи, сходные по энергии и длине. Для того чтобы образовались такие гибридные облака, используются три р- и один эс-электрон.
Четыре облака смешиваются, и возникает четыре одинаковых (гибридных) вида, имеющих форму неправильной восьмерки. Называют такой тип гибридизации sp3. Все углеводороды, в составе которых только простые (одинарные) связи, характеризуются именно таким типом гибридизации атома углерода. Валентный угол составляет 109 градусов 28 минут.
Продолжим разговор о том, как определить тип гибридизации. Примеры ряда этилена дают представление о sp2-гибридизации. Например, в молекуле этилена из четырех в образовании химической связи используется только три. Оставшийся негибридный р-электрон уходит на образование двойной связи.
Ацетилен является простейшим представителем класса СпН2п-2. Особенностью этого класса углеводородов является наличие тройной связи. Из четырех валентных электронов углеродного атома только два меняют свою форму и энергию, становясь гибридными. Два оставшихся электрона принимают участие в образовании двух двойных связей, определяя ненасыщенный характер этого класса органических соединений.
Заключение
Рассматривая вопрос, касающийся для органических и для учитывают гибридизацию При этом происходит выравнивание их энергии и формы. Электрон, располагающийся вблизи ядра связанного атома, характеризуется совокупностью орбиталей, которые обладают одинаковым Информация о типе гибридизации дает возможность оценивать химические свойства вещества.







