Razpad purinskih in pirimidinskih nukleotidov. Razpad purinskih in pirimidinskih baz
21. Razpad purinskih nukleotidov. Tvorba sečne kisline. Razpad purinskih nukleotidov se lahko zgodi na različne načine. Prosti adenin in adenin v sestavi nukleotidov se deaminirata, preideta v hipoksantin in nato v ksantin (2,6-dioksipurin), ki se pod delovanjem encima ksantin oksidaze pretvori v sečno kislino. Ksantin nastane tudi med deaminiranjem gvanina. Pri ljudeh in primatih je sečna kislina končni produkt P. o. in se izloča z urinom. Sesalci, razen primatov, izločajo alantoin, produkt oksidacije sečne kisline, in koščene ribe, produkt hidracije alantoina, alantoinsko kislino. Pri dvoživkah in večini rib se hidrolizira do sečnine in glioksilata.
K najpomembnejšim kršitvam P. o. vključujejo prekomerno tvorbo in kopičenje sečne kisline, kot sta protin (protin) in Lesch-Nyhanov sindrom. Slednje temelji na dednem pomanjkanju encima hipoksantin fosfatidiltransferaze, zaradi česar se prosti purini ne uporabijo ponovno, ampak se oksidirajo v sečno kislino. Pri otrocih s sindromom Lesha-Nyhan so opažene vnetne in distrofične spremembe. nastane zaradi odlaganja kristalov sečne kisline v tkivih: za bolezen je značilna zamuda v duševnem in telesnem razvoju. Od ostalih purinskih baz, ki jih najdemo pri ljudeh, je treba omeniti presnovne predhodnike sečne kisline: aminopurine - gvanin, adenin - in oksipurine - hipoksantin, ksantin.
Trenutno so dokazane tri glavne poti za tvorbo sečne kisline v telesu: a) iz purinov, ki se sproščajo med razpadom tkiva; b) iz purinov, ki jih vsebuje hrana; c) iz sintetično oblikovanih purinov.
Pot nastajanja sečne kisline je v osnovi podobna prvi, s to razliko, da so v tem primeru spojine, ki vsebujejo purine, katerih pretvorba daje sečno kislino, prehranske narave. V tem primeru se cepitev proteina iz nukleoproteina začne v želodcu pod delovanjem klorovodikove kisline s pepsinom in se konča v črevesju pod vplivom tripsina. Nastale nukleinske kisline pod vplivom encimov trebušne slinavke in črevesnega soka - ribonukleaze in deoksiribonukleaze - se razgradijo na mononukleotide. Slednji se pod delovanjem nukleotidaze in nukleozidaze črevesnega soka cepijo na nukleozide oziroma dušikove baze. Ti in drugi, pa tudi nekateri mononukleotidi, se absorbirajo v črevesju.
Tretja pot tvorbe sečne kisline v telesu, vzpostavljena s pomočjo izotopov C14 in N15 itd., poteka skozi sintezo purinskih derivatov, v kateri sodelujejo glicin, mravljična in asparaginska kislina, glutamin in ogljikov dioksid. .
22. Razpad pirimidinskih nukleotidov. Razpad pirimidinskih nukleotidov se začne z odcepitvijo ostanka fosforne kisline iz njih, ki ga katalizirajo nukleotidaze. Nastali nukleozidi se nadalje fosforolitično cepijo, da nastanejo (deoksi)riboza fosfati in proste pirimidinske dušikove baze. Citozin se pred nadaljnjo razgradnjo podvrže deaminaciji. Za razgradnjo pirimidinskih baz je značilna redukcijska pot, ki ji sledi odpiranje pirimidinskega obroča. Iz uracila nastane aminokislina β-alanin, iz timina - β-aminoizobutirna kislina, ogljikov dioksid in amoniak. Aminokisline – produkti razgradnje pirimidinov – lahko nato vstopijo v različne presnovne reakcije (glejte Presnova dušika).
Ker je intenzivnost sinteze nukleinske kisline regulirana v fazi sinteze pirimidinskih nukleotidov, P. o. pomembno vpliva na izmenjavo nukleinskih kislin. Eden od načinov za uravnavanje sinteze pirimidinskih nukleotidov je inhibicija s povratnim mehanizmom: presežek CTP, končnega produkta biosintetskih procesov P. o. alosterično zavira encim, ki katalizira sintezo karbamoil aspartata (prva reakcija v biosintezi pirimidinov). Pirimidinski nukleotidi zavirajo tudi sintezo številnih encimov presnove pirimidina.
V hitro rastočih tkivih je aktivnost encimov za razgradnjo pirimidinskih nukleotidov izjemno nizka; aktivnost encimov njihove sinteze (aspartat karbamoiltransferaza itd.) se močno poveča v hitro delijočih se tkivih, na primer v jetrnem tkivu po delni hepatektomiji.
Genetska motnja P. o. je lahko vzrok za dedne bolezni, kot je orotacidurija, pri kateri pride do prekomernega izločanja z urinom produkta razgradnje pirimidinskih baz – orotske kisline. Perniciozno anemijo spremljajo pomembne motnje v presnovi pirimidina (glej Anemija), terapevtski učinek vitamina B12 in folne kisline (glej Vitamini) pri anemiji pa je posledica sodelovanja derivatov teh vitaminov kot koencimov pri sintezi pirimidinskih baz.
Razpad purinskih nukleotidov.
Adenozin in gvanozin, ki nastaneta pri hidrolizi purinskih nukleotidov, sta podvržena encimski razgradnji s tvorbo končnega produkta - sečne kisline, ki se iz telesa izloči z urinom.
Razpad pirimidinskih nukleotidov.
Začetne faze tega procesa katalizirajo specifični encimi. Končni produkti: CO 2 , NH 3 , sečnina, β-alanin, β-aminoizobutirna kislina. β-alanin se uporablja za sintezo mišičnih dipeptidov – karnozina in anserina ali pa se izloča z urinom.

Biosinteza purinskih, pirimidinskih nukleotidov v tkivih.
Biosinteza purinskih mononukleotidov.
Začetna spojina sinteze je D-riboza-5-fosfat, ki je produkt pentozofosfatnega cikla in na katerega se prenese pirofosfatna skupina ATP. Nastali 5-fosforibozil-1-pirofosfat (FRPP) sodeluje z glutaminom, ki je darovalec NH 2 skupine, kar povzroči nastanek β-5-fosforibozil-amina. Ta korak postane ključen pri sintezi purinov. Nato je molekula glicina vezana na prosto NH2 skupino β-5-fosforibozil-amina, da tvori glicin ribonukleotid. Po še nekaj stopnjah nastane prvi purin nukleotid inozin monofosfat (IMP), iz katerega se nato sintetizirajo preostali nukleozidni fosfati.

Biosinteza pirimidinskih nukleotidov
Začetni spojini tega postopka sta karbamoil fosfat in asparaginska kislina. Iz njih po dolgi verigi reakcij nastanejo uridin monofosfat (UMP) in preostali pirimidin nukleotidi.

2.4. Bolezni, povezane z moteno presnovo nukleotidov: protin, Lesch-Nychenov sindrom.
Hiperurikemija je povečanje koncentracije sečne kisline v krvni plazmi. Hiperurikemija lahko povzroči protin.
Protin je bolezen, ki jo povzroča motnja v presnovi nukleinskih kislin. Kristali sečne kisline in urata se odlagajo v hrustancu, kitah, sklepnih vrečah, včasih v ledvicah, koži, mišicah. Okoli teh usedlin nastanejo vnetja in granulacijska gred, ki obdaja odmrlo tkivo, nastanejo pa protin vozlišča - tofi (v sklepih prstov na rokah, nogah, v hrustancu ušesa), ki ga spremljata deformacija in bolečina prizadetih sklepih. Značilni znaki protina so ponavljajoči se napadi akutnega vnetja sklepov (najpogosteje majhnih) - akutni protinski artritis. Običajno so bolniki nagnjeni k aterosklerozi in hipertenziji. V njihovi krvi je visoka koncentracija sečne kisline - hiperurikemija. V nekaj dneh pred napadom protina se poveča izločanje vode in natrijevega klorida z urinom, t.j. ravnotežje vode in soli se premakne. Posledično se poveča koncentracija sečne kisline v krvi in njeno odlaganje v tkivih. Običajno je protin genetsko pogojen in se pojavlja v družinah. Povzročajo ga nenormalnosti v delovanju fosforibozil difosfat (FRDP) sintetaze ali hipoksantingvanin ali adenin fosforiboziltransferaz. Druge značilne manifestacije vključujejo nefropatijo, pri kateri opazimo nastanek uratnih kamnov v sečilih.
Lesch-Nychenov sindrom je huda oblika hiperurikemije, ki se podeduje kot X-vezana recesivna lastnost. Pojavlja se samo pri fantih. Poleg simptomov protina opazimo cerebralno paralizo, motnjo v duševnem razvoju, poskuse zadajanja ran na sebi (ugrizi ustnic, prstov). Bolezen je povezana z okvaro encima hipoksantin-gvanin-fosforiboziltransferaze, ki katalizira pretvorbo hipoksantina in gvanina v gvanin monofosfat (GMP), zato se pretvorita v sečno kislino. V prvih mesecih življenja nevroloških motenj ne zaznamo, na plenicah pa opazimo rožnate lise, ki so posledica prisotnosti kristalov sečne kisline v urinu. Če se ne zdravi, bolniki umrejo pred 10. letom starosti zaradi okvarjenega delovanja ledvic.
Glavno zdravilo za zdravljenje hiperurikemije je alopurinol (strukturni analog hipoksantina).
Razpad purinskih nukleotidov.
Adenozin in gvanozin, ki nastaneta pri hidrolizi purinskih nukleotidov, sta podvržena encimski razgradnji s tvorbo končnega produkta - sečne kisline, ki se iz telesa izloči z urinom.
Razpad pirimidinskih nukleotidov.
Začetne faze tega procesa katalizirajo specifični encimi. Končni produkti: CO2, NH3, sečnina, β-alanin, β-aminoizobutirna kislina. β-alanin se uporablja za sintezo mišičnih dipeptidov – karnozina in anserina ali pa se izloča z urinom.
21. Koencimi: Večina encimov za izkazovanje encimske aktivnosti zahteva organske spojine z nizko molekulsko maso nebeljakovinske narave (koencimi) in/ali kovinske ione (kofaktorji). Termin. "koencim" je bil uveden v začetku 20. stoletja in je označeval del nekaterih encimov, ki se zlahka loči od beljakovinske molekule encima in odstrani skozi polprepustno membrano med dializo. Nekoliko kasneje je bilo ugotovljeno, da je večina encimov sestavljena iz termolabilnega proteinskega dela in termostabilnega neproteinskega faktorja – koencima. Beljakovinski del se imenuje "apoencim", ki v odsotnosti koencima nima katalitične aktivnosti. Koencim z beljakovinsko molekulo (apoencim) tvori holoencimsko molekulo s katalitično aktivnostjo.
Kofaktorji
Več kot 25 % vseh encimov potrebuje kovinske ione za popolno katalitično aktivnost. Razmislimo o vlogi kofaktorjev v encimski katalizi.
1. Vloga kovin pri pritrditvi substrata
na aktivnem mestu encima
Kovinski ioni delujejo kot stabilizatorji molekule substrata, aktivno središče encima in konformacija proteinske molekule encima, in sicer terciarne in kvartarne strukture.
Kovinski ioni - stabilizatorji molekule substrata
Za nekatere encime je substrat kompleks pretvorjene snovi s kovinskim ionom. Na primer, pri večini kinaz eden od substratov ni molekula ATP, temveč kompleks Mg2+-ATP. V tem primeru ion Mg2+ ne sodeluje neposredno z encimom, ampak sodeluje pri stabilizaciji molekule ATP in nevtralizaciji negativnega naboja substrata, kar olajša njegovo pritrditev na aktivno mesto encima.

Shematično lahko vlogo kofaktorja pri interakciji encima in substrata predstavimo kot kompleks E-S-Me, kjer je E encim, S substrat in Me kovinski ion.
Primer je lokacija substratov na aktivnem mestu heksokinaze
Heksokinaza katalizira prenos končnega γ-fosfatnega ostanka molekule ATP na glukozo s tvorbo glukoza-6-fosfata:

Sodelovanje magnezijevih ionov pri dodajanju substrata aktivnemu centru heksokinaze. Aktivno središče heksokinaze ima vezavna mesta za molekulo glukoze in kompleks Mg2+-ATP. Kot rezultat encimske reakcije se končni γ-fosfatni ostanek molekule ATP prenese na glukozo s tvorbo glukoza-6-fosfata.
Ion Mg2+ sodeluje pri pritrditvi in »pravilni« orientaciji molekule ATP v aktivnem središču encima, oslabi fosfoestrsko vez in olajša prenos fosfata na glukozo.
Kovinski ioni - stabilizatorji aktivnega mesta encimov
V nekaterih primerih kovinski ioni služijo kot "most" med encimom in substratom. Delujejo kot stabilizatorji aktivnega mesta, kar olajša pritrditev substrata nanj in nastanek kemične reakcije. V nekaterih primerih lahko kovinski ion prispeva k dodatku koencima. Zgoraj navedene funkcije opravljajo kovine, kot so Mg2+, Mn2+, Zn2+, Co2+, Mo2+. V odsotnosti kovine so ti encimi neaktivni. Takšni encimi se imenujejo "metaloencimi". Shematično lahko ta proces interakcije encima, substrata in kovine predstavimo na naslednji način:
Metaloencimi vključujejo na primer encim piruvat kinazo (slika 2-4), ki katalizira reakcijo:

Prebavni encimi:
2. Želodec
3. Tanko črevo
proteaze:
karboksipeptidaza
Steapsin, ki razgrajuje maščobe.
Encimi tankega črevesa
22. Poliencimski sistem: Vsaka celica v telesu ima svoj poseben nabor encimov. Nekatere od njih najdemo v vseh celicah, druge pa le v nekaterih. V celici delo vsakega encima praviloma ni individualno, ampak je tesno povezano z drugimi encimi, t.j. poliencimski sistemi ali transporterji nastanejo iz posameznih encimov. Substrat je včasih podvržen dolgi verigi reakcij med svojo transformacijo, v katerih sodelujejo številni encimi. Produkt reakcije, ki jo katalizira prvi encim, služi kot substrat za drugi encim itd. Primer je proces glikolize. Vsi encimi glikolize so na voljo v topnem stanju. Številni encimi sodelujejo pri pretvorbi glukoze v mlečno kislino. Položaj vsakega encima v verigi je določen z njegovo afiniteto do substratov (začenši z glukozo), od katerih je vsak produkt reakcije, ki jo katalizira prejšnji encim. To poveča hitrost encimskih reakcij, vmesni produkti pa se v takšni verigi ne kopičijo.
Številni poliencimski ansambli so strukturno povezani s katero koli organelo (mitohondriji, ribosomi, jedro) ali biomembranami in tvorijo visoko organizirane sisteme, ki zagotavljajo vitalne funkcije, na primer tkivno dihanje, t.j. prenos elektronov in protonov s substratov na kisik preko sistema dihalnih encimov, pritrjenih na notranjo membrano mitohondrijev. Nekateri encimi, ki sodelujejo pri reakciji ene verige presnove, se združujejo v večencimske komplekse s specifično funkcijo. Tipičen primer takih supramolekularnih kompleksov je kompleks piruvat dehidrogenaze, ki je sestavljen iz več encimov, ki sodelujejo pri oksidaciji pirovične kisline v acetil-CoA, ali sintetaze maščobnih kislin, ki jo sestavlja sedem strukturno sorodnih encimov, ki opravljajo funkcijo sinteze maščobnih kislin. .
23. Prebava v presnovi: Presnova (iz grščine μεταβολή - "preoblikovanje, sprememba") ali presnova - niz kemičnih reakcij, ki se pojavijo v živem organizmu za vzdrževanje življenja. Ti procesi omogočajo organizmom, da rastejo in se razmnožujejo, vzdržujejo svoje strukture in se odzivajo na okoljske dražljaje.
Prebava: Makromolekule, kot so škrob, celuloza ali beljakovine, je treba razgraditi na manjše enote, preden jih lahko uporabijo celice. Pri razgradnji sodeluje več razredov encimov: proteaze, ki razgrajujejo beljakovine na peptide in aminokisline, glikozidaze, ki razgrajujejo polisaharide na oligo- in monosaharide.
Mikroorganizmi izločajo hidrolitične encime v prostor okoli sebe, kar se razlikuje od živali, ki te encime izločajo le iz specializiranih žleznih celic. Aminokisline in monosaharidi, ki nastanejo kot posledica delovanja zunajceličnih encimov, nato z aktivnim transportom vstopijo v celice
Prebavni encimi: Prebavni encimi, prebavni encimi – encimi, ki razgrajujejo kompleksne sestavine hrane v enostavnejše snovi, ki se nato absorbirajo v telo. V širšem smislu se prebavni encimi nanašajo tudi na vse encime, ki razgrajujejo velike (običajno polimerne) molekule na monomere ali manjše dele. Prebavni encimi se nahajajo v prebavnem sistemu ljudi in živali. Poleg tega lahko takim encimom pripišemo intracelularne encime lizosomov. Glavna mesta delovanja prebavnih encimov pri ljudeh in živalih so ustna votlina, želodec in tanko črevo. Te encime proizvajajo žleze, kot so žleze slinavke, želodčne žleze, trebušna slinavka in žleze v tankem črevesu. Del encimskih funkcij opravlja obvezna črevesna mikroflora. Glede na specifičnost substrata so prebavni encimi razdeljeni v več glavnih skupin:
proteaze (peptidaze) razgradijo beljakovine v kratke peptide ali aminokisline
lipaze razgradijo lipide v maščobne kisline in glicerol
ogljikove hidrate hidrolizirajo ogljikove hidrate, kot so škrob ali sladkorji, v enostavne sladkorje, kot je glukoza
Nukleaze razgradijo nukleinske kisline v nukleotide.
1. Ustna votlina - Žleze slinavke v ustno votlino izločajo alfa-amilazo (ptyalin), ki razgradi visokomolekularni škrob na krajše drobce in na posamezne topne sladkorje (dekstrine, maltozo, maltriozo).
2. Želodec
Encimi, ki jih izloča želodec, se imenujejo želodčni encimi.
Pepsin je glavni želodčni encim. Razgradi beljakovine v peptide.
Želatinaza razgrajuje želatino in kolagen, glavna proteoglikana v mesu.
3. Tanko črevo
encimi trebušne slinavke
Trebušna slinavka je glavna žleza v prebavnem sistemu. Izloča encime v lumen dvanajstnika.
proteaze:
Tripsin je proteaza, podobna želodčnemu pepsinu.
Kimotripsin je tudi proteaza, ki razgrajuje beljakovine hrane.
karboksipeptidaza
Več različnih elastaz, ki razgrajujejo elastin in nekatere druge beljakovine.
Nukleaze, ki cepijo nukleinske kisline DNK in RNA.
Steapsin, ki razgrajuje maščobe.
Amilaza, ki razgrajuje škrob in glikogen ter druge ogljikove hidrate.
Lipaza trebušne slinavke je bistven encim pri prebavi maščob. Deluje na maščobe (trigliceride), ki so jih predhodno emulgirali žolč, ki ga jetra izločajo v črevesni lumen.
Encimi tankega črevesa
Več peptidaz, vključno z:
enteropeptidaza - pretvori tripsinogen v tripsin;
alanin aminopeptidaza - cepi peptide, ki nastanejo iz beljakovin po delovanju proteaz želodca in trebušne slinavke.
Encimi, ki razgrajujejo disaharide v monosaharide:
saharoza razgrajuje saharozo na glukozo in fruktozo;
maltaza razgradi maltozo v glukozo;
izomaltaza razgradi maltozo in izomaltozo v glukozo;
laktaza razgradi laktozo na glukozo in galaktozo.
Črevesna lipaza razgrajuje maščobne kisline.
Erepsin, encim, ki razgrajuje beljakovine.
24. Tkivno dihanje. Celično ali tkivno dihanje je niz biokemičnih reakcij, ki se pojavljajo v celicah živih organizmov, med katerimi se ogljikovi hidrati, lipidi in aminokisline oksidirajo v ogljikov dioksid in vodo. Sproščena energija je shranjena v kemičnih vezi makroergičnih spojin (ATP itd.) in se lahko po potrebi uporabi. Vključeno v skupino procesov katabolizma. O fizioloških procesih prenosa kisika v celice večceličnih organizmov in odstranjevanja ogljikovega dioksida iz njih glej članek Dihanje.
Prvič je bistvo dihanja razložil A.-L. Lavoisierja (1743-1794), ki je opozoril na podobnosti med izgorevanjem organskih snovi zunaj telesa in dihanjem živali. Postopoma so postale jasne temeljne razlike med tema dvema procesoma: v telesu poteka oksidacija pri sorazmerno nizki temperaturi v prisotnosti vode, njeno hitrost pa uravnava metabolizem. Trenutno je biološka oksidacija opredeljena kot niz reakcij oksidacije substrata v živih celicah, katerih glavna funkcija je oskrba z energijo presnove. Pri razvoju konceptov biološke oksidacije v XX stoletju. najpomembnejši prispevek je prispeval A.N. Bach, O. Warburg, G. Kreps, W.A. Engelhardt, V.I. Palladin, V.A. Belitzer, S.E. Severin, V.P. Skulačev.
BIOLOŠKA OKSIDACIJA- niz encimskih redoks reakcij, ki se pojavljajo v živih celicah. V procesu biološke oksidacije pride do razgradnje hranilnih snovi, sproščena energija pa se v tem primeru shrani v obliki, ki je primerna za uporabo celicam, t.i. energijsko bogate spojine - adenozin trifosfati itd. Te spojine se nato uporabljajo za zagotavljanje vseh vitalnih procesov; del energije se razprši kot toplota. Pomemben del bioloških oksidacijskih reakcij poteka v mitohondrijih
Anaerobna oksidacija amonija, anammox - biokemični proces oksidacije amonijevih ionov z anionom nitrita v anaerobnih pogojih. Služi kot vir energije za fiksacijo ogljikovega dioksida. Opisano v naslednjih bakterijskih rodovih: Brocadia, Kuenenia, Anammoxoglobus, Jettenia, Scalindua. Vsi spadajo med planktomicete.
Postopek se je začel leta 1986. Zdaj je bila ustvarjena nova tehnologija za čiščenje odpadne vode iz dušikovih spojin s pomočjo bakterij, ki izvajajo anaerobno oksidacijo amonija. V Rotterdamu (Nizozemska) je bila zgrajena in zagnana prva čistilna naprava na njeni osnovi. Pomembne prednosti te tehnologije so zmanjšanje emisij CO2 v ozračje za 85-90 % v primerjavi s tradicionalnimi metodami ter relativna pocenitev.
Splošna reakcijska enačba za anaerobno amonijevo oksidacijo:
NH4+ + NO2− → N2 + 2H2O.
Anaerobna oksidacija metana- proces oksidacije metana v ogljikov dioksid, ki ga proizvajajo nekulturne (VBNC) arheje iz skupin ANME-1, ANME-2 in ANME-3, ki so blizu Methanosarcinales, v povezavi s sulfat-reducirajočimi in denitrifikacijskimi bakterijami v odsotnost molekularnega kisika v mediju. Biokemija in razširjenost procesa v naravi še nista dovolj raziskana.
26. Piruvat, ki nastane v reakcijah glikolize (v citoplazmi), je treba transportirati v mitohondrije. Prevoz se izvaja po posebnem sistemu "shuttle". V mitohondrijskem matriksu, pritrjenem na njegovo notranjo membrano, je kompleksen poliencimski kompleks - piruvat dehidrogenaza.
Piruvat dehidrogenaza je sestavljena iz 60 polipeptidnih verig, ki jih lahko razdelimo na 3 glavne encime: E1 - sama piruvat dehidrogenaza (sestavljena je iz 24 podenot); E2, dihidrolipoiltransacetilaza (tudi 24 podenot); E3 - dihidrolipoil dehidrogenaza (12 podenot).
Zaporedje reakcij je prikazano na sliki 5.12. E1 katalizira dekarboksilacijo PVC s sodelovanjem koencima tiamin pirofosfata (TPP). Nastali reakcijski produkt (hidroksietil derivat TPP) s sodelovanjem E2 reagira z oksidirano lipoično kislino (LA). Lipoična kislina - spojina z nizko molekulsko maso, ki vsebuje dušik - je koencim E2.
CH2 CH - (CH2) 4 - COOH
Lipoična kislina
Disulfidna skupina LA je sposobna reducirati in acetilirati. V reakciji, ki jo katalizira dihidrolipoil transacetilaza (E2), nastane acetil lipoična kislina. Poleg tega ta spojina reagira s koencimom A (CoA-SH ni lasten koencim E2) - to tvori reducirano obliko LA (dihidrolipoične kisline) in acetil-CoA.
Končno začne delovati E3, katerega koencim je FAD: koencim oksidira dihidrolipojsko kislino in se hkrati reducira (FADH2). Zmanjšani koencim flavin reagira z mitohondrijskim NAD+ in ga nato reducira (NADH H+).
Tako so trije encimi, ki sestavljajo en sam kompleks piruvat dehidrogenaze, in 5 koencimov dejansko vključeni v oksidativno dekarboksilacijo PVA: TPP, LA in FAD so lastni koencimi kompleksa; CoA-SH in NAD+ sta zunanji, prihajata "od zunaj". ” Nastali acetil-CoA se nato oksidira v Krebsovem ciklu in vodik z NADH H+ vstopi v mitohondrijsko dihalno verigo.

Mehanizem delovanja kompleksa piruvat dehidrogenaze
Piruvat dehidrogenazo odlikuje velik negativni redoks potencial, ki lahko zagotovi ne samo redukcijo NAD +, ampak tudi spodbuja nastanek visokoenergijske tioetrske vezi v acetil-CoA (CH3-CO ~ ScoA).
Z nezadostno vsebnostjo v prehrani vitaminov, ki so del piruvat dehidrogenaze, predvsem tiamina, se aktivnost encima zmanjša. To vodi do kopičenja piruvata in laktata v krvi in tkivih ter do razvoja metabolne acidoze. Ob izrazitem pomanjkanju tiamina se razvije nekompenzirana acidoza, ki, če se ne zdravi, vodi v smrt.
^ Regulacija aktivnosti piruvat dehidrogenaze
Kompleks piruvat dehidrogenaze lahko obstaja v aktivni in neaktivni obliki. Prehod iz ene oblike v drugo poteka z reverzibilno fosforilacijo s sodelovanjem kinaze in defosforilacijo s sodelovanjem fosfataze. Fosforilirana oblika je neaktivna, medtem ko je defosforilirana oblika aktivna.
Pri nizki koncentraciji inzulina in visoki ravni oskrbe z energijo celice (ATP, acetil-CoA in NADH H+) je ta kompleks v neaktivnem stanju. Aktivacijo kompleksa piruvat dehidrogenaze inducirajo insulin, CoA-SH, piruvat, ADP in magnezijevi ioni.
28. Dihanje tkiv in biološka oksidacija. Razgradnjo organskih spojin v živih tkivih, ki jo spremlja poraba molekularnega kisika in vodi do sproščanja ogljikovega dioksida in vode ter nastajanja bioloških oblik energije, imenujemo tkivno dihanje. Tkivno dihanje je predstavljeno kot končna faza transformacije monosaharidov (predvsem glukoze) v navedene končne produkte, ki na različnih stopnjah vključujejo druge sladkorje in njihove derivate ter vmesne produkte razgradnje lipidov (maščobnih kislin), beljakovin. (aminokisline) in nukleinske baze. Končna reakcija tkivnega dihanja bo videti tako:
С6Н12О6 + 6O2 = 6СO2 + 6Н2O + 2780 kJ/mol. (ena)
Poraba kisika v tkivih je odvisna od intenzivnosti reakcij tkivnega dihanja. Za najvišjo stopnjo tkivnega dihanja so značilne ledvice, možgani, jetra, najnižja - koža, mišično tkivo (v mirovanju). Enačba (2) opisuje celoten rezultat večstopenjskega procesa, ki vodi do tvorbe mlečne kisline (glej poglavje 10) in poteka brez sodelovanja kisika:
C6H12Ob \u003d 2C3H6O3 + 65 kJ / mol. (2)
Ta pot očitno odraža energijsko oskrbo najpreprostejših oblik življenja, ki so delovale v anoksičnih razmerah. Sodobni anaerobni mikroorganizmi (izvajajo mlečnokislinsko, alkoholno in ocetnokislinsko fermentacijo) prejemajo energijo za življenje, proizvedeno v procesu glikolize ali njenih modifikacij.
Uporaba kisika v celicah odpira možnosti za popolnejšo oksidacijo substratov. V aerobnih pogojih oksidacijski produkti brez kisika postanejo substrati cikla trikarboksilne kisline (glej poglavje 10), med katerim nastanejo reducirani respiratorni transporterji NADPH, NADH in koencimi flavina. Sposobnost NAD+ in NADP+, da igrata vlogo vmesnega vodikovega nosilca, je povezana s prisotnostjo amida nikotinske kisline v njuni strukturi. Ko ti kofaktorji medsebojno delujejo z vodikovimi atomi, pride do reverzibilne hidrogenacije (dodajanje vodikovih atomov):


V tem primeru sta v molekulo NAD+ (NADP+) vključena 2 elektrona in en proton, drugi proton pa ostane v mediju.
Pri flavinskih koencimih (FAD ali FMN), katerih aktivni del molekul je izoaloksazinski obroč, se zaradi redukcije najpogosteje opazi dodatek 2 protonov in 2 elektronov hkrati:


Reducirane oblike teh kofaktorjev so sposobne prenašati vodik in elektrone v dihalno verigo mitohondrijev ali drugih membran, ki povezujejo energijo.

Sečna kislina pri ljudeh in številnih živalih (primati, ptice in nekateri plazilci) je končni produkt razgradnje purinskih baz in se izloča iz telesa. Tvorba sečne kisline se pojavlja predvsem v jetrih. Sečna kislina je glavni produkt razgradnje nukleotidov pri ljudeh. Telo dnevno proizvede 0,5-1 g sečne kisline, ki se izloči skozi ledvice. Kri zdravega človeka vsebuje 3-7 mg/dL sečne kisline. Kronično povečanje koncentracije sečne kisline (hiperurikemija) pogosto vodi do razvoja protina - odlaganja slabo topne sečne kisline (in njenih uratnih soli) v obliki kristalov v krvi in tkivih. Ta bolezen je dedna in je povezana z okvaro encima, ki katalizira pretvorbo hipoksantina in gvanina v inozno kislino - IMP (glejte poglavje 12.3 "Biosinteza nukleotidov") in GMP. Posledično se hipoksantin in gvanin ne uporabita ponovno za sintezo nukleotidov, temveč se popolnoma pretvorita v sečno kislino, kar vodi v hiperurikemijo.
Večina živali in rastlin ima encime, ki povzročajo nadaljnjo razgradnjo sečne kisline v sečnino (1) in glioksalno kislino (2):

β-izomaslena kislina
H 2 N-COOH → NH 3 + CO 2.
Produkti razpada nukleinskih kislin se praviloma izločajo iz telesa. Nukleozidi se pretežno absorbirajo in v tej obliki se del dušikovih baz lahko uporabi za sintezo nukleinskih kislin telesa. Če pride do razgradnje nukleozidov na proste baze, se gvanin ne uporablja za sintetične namene, ostalo pa lahko v majhnih količinah sodeluje pri sintezi nukleinskih kislin.
Biosinteza nukleotidov
Sintezo nukleinskih kislin določa hitrost sinteze mononukleotidov, medtem ko je sinteza slednjih odvisna od prisotnosti vseh treh njihovih komponent. Pentoze so produkti presnove glukoze, fosforna kislina se v zadostnih količinah oskrbuje s hrano. Omejevalni dejavnik je biosinteza dušikovih baz.
Povezane informacije:
- S kislinskimi in bazičnimi raztopinami ravnajte previdno. Če raztopina pride v stik s kožo, se nemudoma posvetujte z učiteljem.
B. Rezervne poti za sintezo pirimidinskih nukleotidov
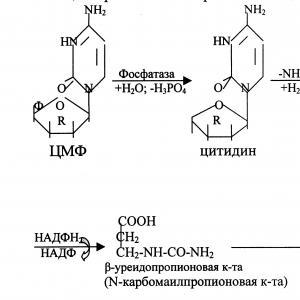
Uporaba pirimidinskih baz in nukleozidov v reakcijah ponovne uporabe preprečuje katabolizem teh spojin do končnih produktov z cepljenjem pirimidinskega obroča. Nekateri encimi katabolizma nukleotidov so vključeni v resintezo pirimidinov. Tako lahko uridin fosforilaza v reverzibilni reakciji ribozilira uracil v tvorbo uridina.
Uracil + riboza-1-fosfat → Uridin + H 3 RO 4.
Pretvorbo nukleozidov v nukleotide katalizira uridin citidin kinaza.
Del CMP se lahko z delovanjem citidin deaminaze pretvori v UMP in napolni zaloge uridil nukleotidov.
CMF + H 2 O → UMF + NH 3.
B. Regulacija sinteze pirimidinskih nukleotidov
Regulacijski encim pri sintezi pirimidinskih nukleotidov je polifunkcionalen CAD encim. UMP in purinski nukleotidi alosterično zavirajo, FRDP pa aktivira njegovo karbamoil sintetazno aktivnost, medtem ko aktivnost domene aspartat transkarbamoilaze zavira CTP, vendar aktivira ATP (sl. 10-15).
Ta način regulacije omogoča preprečevanje prekomerne sinteze ne samo UMP, ampak tudi vseh drugih pirimidinskih nukleotidov in zagotavlja uravnoteženo tvorbo vseh štirih glavnih purinskih in pirimidinskih nukleotidov, potrebnih za sintezo RNA.
orotacidurija
To je edina kršitev sinteze pirimidinov de novo. Povzroča ga zmanjšanje aktivnosti UMP sintaze, ki katalizira tvorbo in dekarboksilacijo OMF. Ker v embriogenezi iz tvorbe pirimidinov de novo odvisno od zagotavljanja sinteze DNK s substrati, potem je življenje ploda nemogoče v popolni odsotnosti aktivnosti tega encima. Dejansko imajo vsi bolniki z orotacidurijo izrazito, čeprav zelo nizko aktivnost UMF sintaze. Ugotovljeno je bilo, da vsebnost orotske kisline v urinu bolnikov (1 g/dan ali več) znatno presega količino orotata, ki se običajno sintetizira na dan (približno 600 mg/dan). Zmanjšanje sinteze pirimidinskih nukleotidov, opaženo pri tej patologiji, moti regulacijo encima CAD z mehanizmom retroinhibicije, kar povzroči hiperprodukcijo orotata.
Klinično je najbolj značilna posledica orotacidurije megaloblastna anemija, ki jo povzroča nezmožnost telesa, da zagotovi normalno hitrost delitve eritrocitnih celic. Pri otrocih se diagnosticira na podlagi tega, da se ne odziva na zdravljenje s pripravki folne kisline.
Nezadostna sinteza pirimidinskih nukleotidov vpliva na intelektualni razvoj, motorične sposobnosti in jo spremljajo motnje srca in prebavil. Oblikovanje imunskega sistema je moteno, povečana je občutljivost na različne okužbe.
Hiperizločanje orotske kisline spremljajo motnje urinarnega sistema in tvorba kamnov. Če se ne zdravi, bolniki običajno umrejo v prvih letih življenja. Hkrati orotska kislina nima toksičnega učinka. Številne motnje v delovanju različnih telesnih sistemov povzroča "pirimidinska lakota".
Za zdravljenje te bolezni se uporablja uridin (od 0,5 do 1 g / dan), ki se po "rezervni" poti spremeni v UMF.
Uridin + ATP → UMF + ADP.
Nalaganje z uridinom odpravi "pirimidinsko lakoto", in ker se iz UMP lahko sintetizirajo vsi drugi nukleotidi pirimidinske serije, se sproščanje orotske kisline zmanjša zaradi obnove mehanizma retroinhibicije encima CAD. Pri bolnikih z orotacidurijo se zdravljenje z uridinom nadaljuje vse življenje in ta nukleozid postane zanje nepogrešljiv prehranski dejavnik.
Poleg genetsko pogojenih vzrokov lahko opazimo orotacidurijo:
s hiperamonemijo, ki je posledica okvare katerega koli od encimov ornitinskega cikla,
z izjemo karbamoil fosfat sintetaze I. V tem primeru karbamoil fosfat, sintetiziran v mitohondrijih, vstopi v citosol celic in se začne uporabljati za tvorbo pirimidinskih nukleotidov. Poveča se koncentracija vseh metabolitov, vključno z orotno kislino. Najpomembnejše izločanje orotata opazimo pri insuficienci ornitinkarbamoiltransferaze (drugi encim ornitinskega cikla);
pri zdravljenju protina z alopurinolom, ki se pretvori v oksipurinol mononukleotid in postane močan zaviralec UMF sintaze. To vodi do kopičenja orotske kisline v tkivih in krvi.
3. Struktura, sinteza in izločanje insulina. Uravnavanje sinteze in izločanja insulina. Mehanizem delovanja insulina. Vloga inzulina in kontranzularnih hormonov (adrenalina in glukagona) pri uravnavanju presnove. Spremembe hormonskega statusa in presnove pri sladkorni bolezni. diabetična koma.
Insulin je polipeptid, sestavljen iz dveh polipeptidnih verig. Veriga A vsebuje 21 aminokislinskih ostankov, veriga B - 30 aminokislinskih ostankov. Obe verigi sta med seboj povezani z dvema disulfidnima mostovčkoma (slika 1). Insulin lahko obstaja v več oblikah: monomer, dimer in heksamer. Heksamerno strukturo insulina stabilizirajo cinkovi ioni, ki jih vežejo His ostanki na položaju 10 verige B vseh 6 podenot.
Inzulinska molekula vsebuje tudi intramolekularni disulfidni most, ki povezuje šesti in enajsti ostanki v verigi A. Inzulini nekaterih živali so po primarni strukturi precej podobni humanemu insulinu.
V obeh verigah se pojavljajo substitucije v številnih položajih, ki ne vplivajo na biološko aktivnost hormona. Najpogosteje se te substitucije nahajajo na položajih 8, 9 in 10 verige A.
Hkrati so zelo redke substitucije v položajih disulfidnih vezi, hidrofobnih aminokislinskih ostankov v C-terminalnih predelih B-verige ter C- in N-terminalnih ostankov A-verige, kar kaže na pomembnost te regije za manifestacijo biološke aktivnosti insulina. Uporaba kemičnih modifikacij in substitucij aminokislin v teh regijah je omogočila vzpostavitev strukture aktivnega centra insulina, ki nastane s sodelovanjem fenilalaninskih ostankov verige B na položajih 24 in 25 ter N- in C-terminalni ostanki verige A.
biosinteza insulina vključuje tvorbo dveh neaktivnih prekurzorjev, preproinzulina in proinzulina, ki se zaradi zaporedne proteolize pretvorita v aktivni hormon. Biosinteza preproinzulina se začne s tvorbo signalnega peptida na poliribosomih, povezanih z ER. Signalni peptid prodre v lumen ER in usmerja vstop rastoče polipeptidne verige v lumen ER. Po končani sintezi preproinzulina se signalni peptid, ki vključuje 24 aminokislinskih ostankov, odcepi (slika 2).
sl.1. Struktura človeškega insulina. A. Primarna struktura insulina. B. Model terciarne strukture insulina (monomer): 1 - A-veriga; 2 - B-veriga; 3 - receptorsko vezavno mesto.
Proinsulin (86 aminokislinskih ostankov) vstopi v Golgijev aparat, kjer se pod delovanjem specifičnih proteaz na več mestih razcepi, da nastane insulin (51 aminokislinskih ostankov) in C-peptid, sestavljen iz 31 aminokislinskih ostankov.
Inzulin in C-peptid sta vključena v sekretorne granule v ekvimolarnih količinah. V granulah se insulin združi s cinkom in tvori dimerje in heksamerje. Zrela zrnca se zlijejo s plazemsko membrano in insulin in C-peptid se izločata v zunajcelično tekočino z eksocitozo. Po izločanju v kri se inzulinski oligomeri razgradijo. T 1/2 insulina v krvni plazmi je 3-10 minut, C-peptida - približno 30 minut. Uničenje inzulina poteka pod delovanjem encima insulinaze predvsem v jetrih in v manjši meri v ledvicah.
Uravnavanje sinteze in izločanja insulina. Glukoza je glavni regulator izločanja inzulina, β-celice pa so najpomembnejše za glukozo občutljive celice v telesu. Glukoza uravnava izražanje insulinskega gena, pa tudi genov drugih beljakovin, ki sodelujejo pri presnovi glavnih nosilcev energije. Učinek glukoze na hitrost izražanja genov je lahko neposreden, ko glukoza neposredno sodeluje s transkripcijskimi faktorji, ali sekundarni, preko svojega učinka na izločanje inzulina in glukagona. Pri stimulaciji z glukozo se insulin hitro sprosti iz sekretornih zrnc, kar spremlja aktivacija transkripcije insulinske mRNA.

riž. 2. Shema biosinteze insulina v β celice Langerhansovih otočkov. ER - endoplazmatski retikulum. 1 - tvorba signalnega peptida; 2 - sinteza preproinzulina; 3 - cepitev signalnega peptida; 4 - transport proinzulina v Golgijev aparat; 5 - pretvorba proinzulina v inzulin in C-peptid ter vgradnja insulina in C-peptida v sekretorne granule; 6 - izločanje insulina in C-peptida.
Sinteza in izločanje insulina nista strogo povezana procesa. Sintezo hormona spodbuja glukoza, njegovo izločanje pa je proces, odvisen od Ca 2+, v primeru pomanjkanja Ca 2+ pa se zmanjša tudi v pogojih visoke koncentracije glukoze, ki spodbuja sintezo inzulina.
Poraba glukoze v β-celicah poteka predvsem s sodelovanjem GLUT-1 in GLUT-2, koncentracija glukoze v celicah pa se hitro izenači s koncentracijo glukoze v krvi. V β-celicah se glukoza pretvori v glukozo-6-fosfat z glukokinazo, ki ima visoko K m , zaradi česar je hitrost njene fosforilacije skoraj linearno odvisna od koncentracije glukoze v krvi. Encim glukokinaza je ena najpomembnejših sestavin za glukozo občutljivega aparata β-celic, ki poleg glukoze verjetno vključuje vmesne produkte presnove glukoze, citratni cikel in morda ATP. Mutacije v glukokinazi vodijo v razvoj neke oblike sladkorne bolezni.