Alkan kalijev permanganat v kislem mediju. Oksidacija različnih razredov organskih spojin
Državni tehnološki inštitut v Sankt Peterburgu
(Tehnična univerza)
Oddelek organska kemija Fakulteta 4
Skupina 476
Tečajna naloga
Oksidacija alkenov
Študent………………………………………………………Rytina A.I.
Učitelj …………………………………... Piterskaya Yu.L.
Saint Petersburg
Uvod
1.Epoksidacija (reakcija N.A. Priležajeva, 1909)
2. Hidroksilacija
2.1proti- Hidroksilacija
2.2sin- Hidroksilacija
3. Oksidativna cepitev alkenov
4.Ozonoliza
5. Oksidacija alkenov v prisotnosti paladijevih soli
Zaključek
Seznam uporabljenih virov
Uvod
Oksidacija je ena najpomembnejših in pogostih transformacij organskih spojin.
Oksidacija v organski kemiji se nanaša na procese, ki vodijo do osiromašenja spojine z vodikom ali njene obogatitve s kisikom. V tem primeru se elektroni odvzamejo molekuli. V skladu s tem redukcija pomeni ločitev molekule kisika od organske molekule ali dodatek vodika k njej.
Pri redoks reakcijah so oksidanti spojine, ki imajo visoko afiniteto za elektrone (elektrofili), redukcijska sredstva pa spojine, ki so nagnjene k oddajanju elektronov (nukleofili). Enostavnost oksidacije spojine se poveča z njeno nukleofilnostjo.
Pri oksidaciji organskih spojin praviloma ne pride do popolnega prenosa elektronov in s tem do spremembe valence ogljikovih atomov. Zato je koncept oksidacijskega stanja - pogojnega naboja atoma v molekuli, izračunanega na podlagi predpostavke, da je molekula sestavljena samo iz ionov - le pogojne, formalne narave.
Pri sestavljanju enačb za redoks reakcije je potrebno določiti redukcijsko sredstvo, oksidacijsko sredstvo ter število oddanih in sprejetih elektronov. Praviloma se koeficienti izberejo z metodo ravnotežja elektronov (metoda polovične reakcije).
Ta metoda obravnava prenos elektronov z enega atoma ali iona na drugega, pri čemer upošteva naravo medija (kisel, alkalni ali nevtralen), v katerem pride do reakcije. Za izenačitev števila kisikovih in vodikovih atomov se vnesejo bodisi molekule vode in protoni (če je medij kisel) bodisi molekule vode in hidroksidni ioni (če je medij bazičen).
Tako je treba pri pisanju redukcijskih in oksidacijskih polreakcij izhajati iz sestave ionov, ki so dejansko prisotni v raztopini. Snovi, ki slabo disociirajo, so slabo topne ali se sproščajo v obliki plina, zapišite v molekulski obliki.
Kot primer upoštevajte postopek oksidacije etilena z razredčeno vodno raztopino kalijevega permanganata (Wagnerjeva reakcija). Med to reakcijo se etilen oksidira v etilen glikol, kalijev permanganat pa reducira v manganov dioksid. Na mestu dvojne vezi sta dodana dva hidroksila 1:
3C 2 H 4 + 2KMnO 4 +4H 2 O→ 3C 2 H 6 O 2 + 2MnO 2 +2KOH
Polreakcija redukcije: MnO 4 ¯ + 2H 2 O + 3 e → MnO 2 + 4OH ¯ 2
Polreakcija oksidacije: C 2 H 4 + 2OH − − 2 e → C2H6O23
Končno imamo v ionski obliki:
2MnO 4 ¯ + 4H 2 O + 3C 2 H 4 + 6OH ¯ → 2MnO 2 + 8OH ¯ + 3C 2 H 6 O 2
Po potrebni redukciji podobnih členov zapišemo enačbo v molekularni obliki:
3C 2 H 4 + 2KMnO 4 + 4 H 2 O = 3C 2 H 6 O 2 + 2MnO 2 + 2KOH.
Značilnosti nekaterih oksidantov
kisik
Kisik iz zraka se pogosto uporablja v tehnoloških procesih, saj je najcenejši oksidant. Toda oksidacija z atmosferskim kisikom je polna težav, povezanih z nadzorom procesa, ki se odvija v različnih smereh. Oksidacija se običajno izvaja pri visoki temperaturi v prisotnosti katalizatorjev.
Ozon
Ozon O 3 se uporablja za proizvodnjo aldehidov in ketonov, če jih je težko dobiti drugače. Najpogosteje se ozon uporablja za določanje strukture nenasičenih spojin. Ozon nastane z delovanjem tihe električne razelektritve na kisik. Ena od pomembnih prednosti ozoniranja v primerjavi s kloriranjem je odsotnost toksinov po obdelavi 2.
Kalijev permanganat
Kalijev permanganat je najpogosteje uporabljeno oksidacijsko sredstvo. Reagent je topen v vodi (6,0% pri 20ºС), pa tudi v metanolu, acetonu in ocetni kislini. Za oksidacijo se uporabljajo vodne (včasih acetonske) raztopine KMnO 4 v nevtralnem, kislem ali alkalnem okolju. Pri izvajanju postopka v nevtralnem okolju reakcijski masi dodamo magnezijeve in aluminijeve soli ali prepustimo ogljikov dioksid, da nevtraliziramo med reakcijo sproščen kalijev hidroksid. Reakcija oksidacije KMnO 4 v kislem okolju najpogosteje poteka v prisotnosti žveplove kisline. Alkalno okolje med oksidacijo ustvari KOH, ki nastane med reakcijo, ali pa se ga na začetku doda reakcijski masi. V rahlo alkalnem in nevtralnem okolju KMnO 4 oksidira po enačbi:
KMnO4+ 3 e+ 2H 2 O = K + + MnO 2 + 4OH ¯
v kislem okolju:
KMnO4+ 5 e+ 8H + = K + + Mn 2+ + 4H 2 O 3
Kalijev permanganat se uporablja za pridobivanje 1,2-diolov iz alkenov, pri oksidaciji primarnih alkoholov, aldehidov in alkilarenov v karboksilne kisline, kot tudi za oksidativno cepitev ogljikovega skeleta na več vezeh.
V praksi se običajno uporablja precej velik presežek (več kot 100 %) KMnO 4. To je razloženo z dejstvom, da KMnO 4 v normalnih pogojih delno razpade v manganov dioksid s sproščanjem O 2 . Eksplozivno razpade s koncentrirano H 2 SO 4 pri segrevanju v prisotnosti reduktivnih sredstev; eksplozivne so tudi mešanice kalijevega permanganata z organskimi snovmi 4.
Perkisline
Perocetno in performin kislino pripravimo z reakcijo 25-90 % vodikovega peroksida z ustrezno karboksilno kislino po naslednji reakciji:
RCOOH + H 2 O 2 = RCOOOH + H 2 O
Pri ocetni kislini se to ravnovesje vzpostavi razmeroma počasi, za pospešitev tvorbe perkisline pa običajno dodamo žveplovo kislino kot katalizator. Mravljinčna kislina je sama po sebi dovolj močna, da zagotovi hitro ravnovesje.
Pertrifluoroocetna kislina, pridobljena v zmesi s trifluoroocetno kislino z reakcijo anhidrida trifluoroocetne kisline z 90 % vodikovim peroksidom, je še močnejši oksidant. Perocetno kislino lahko pripravimo na podoben način iz anhidrida ocetne kisline in vodikovega peroksida.
Še posebej priljubljena je težka m-kloroperbenzojska kislina, ker je razmeroma varna za rokovanje, je precej stabilna in jo je mogoče hraniti dolgo časa.
Oksidacija nastane zaradi sproščanja atoma kisika:
RCOOOH = RCOOH + [O]
Perkisline se uporabljajo za pridobivanje epoksidov iz alkenov, pa tudi laktonov iz alicikličnih ketonov.
Vodikov peroksid
Vodikov peroksid je brezbarvna tekočina, ki se zmeša z vodo, etanolom in dietil etrom. 30% raztopino H 2 O 2 imenujemo perhidrol. Visoko koncentrirano zdravilo lahko eksplozivno reagira z organskimi snovmi. Med skladiščenjem razpade na kisik in vodo. Stabilnost vodikovega peroksida se poveča z redčenjem. Za oksidacijo se uporabljajo vodne raztopine različnih koncentracij (od 3 do 90%) v nevtralnem, kislem ali alkalnem mediju.
H 2 O 2 = H 2 O + [O]
Z delovanjem tega reagenta na α,β-nenasičene karbonilne spojine v alkalnem mediju dobimo ustrezne epoksi aldehide in ketone, perkisline pa sintetiziramo z oksidacijo karboksilnih kislin v kislem mediju. 30 % raztopina H 2 O 2 v ocetni kislini oksidira alkene v 1,2-diole. Vodikov peroksid se uporablja: za proizvodnjo organskih in anorganskih peroksidov, perborata in Na perkarbonata; kot oksidant v raketnih gorivih; pri proizvodnji epoksidov, hidrokinona, pirokatehina, etilen glikola, glicerina, pospeševalnikov vulkanizacije tiuramske skupine itd.; za beljenje olj, maščob, krzna, usnja, tekstilnih materialov, papirja; za čiščenje germanija in silicijevih polprevodniških materialov; kot dezinfekcijsko sredstvo za nevtralizacijo gospodinjskih in industrijskih odpadnih voda; v medicini; kot vir O 2 v podmornicah; H 2 O 2 je del Fentonovega reagenta (Fe 2 + + H 2 O 2), ki se uporablja kot vir prostih radikalov OH v organski sintezi 5 .
Rutenijev in osmijev tetroksid
Osmijev tetroksid OsO 4 je bel do bledo rumen prah s tal. 40,6ºС; t. bala 131,2ºС. Sublimira že pri sobni temperaturi, topen v vodi (7,47 g v 100 ml pri 25ºС), CCl 4 (250 g v 100 g topila pri 20ºС). V prisotnosti organskih spojin počrni zaradi redukcije v OsO 2 6 .
RuO 4 je zlato-rumena prizma z mp. 25,4ºС, opazno sublimira pri sobni temperaturi. Zmerno topen v vodi (2,03 g v 100 ml pri 20ºС), zelo topen v CCl 4. Močnejši oksidant kot OsO4. Nad 100ºС eksplodira. Tako kot osmijev tetroksid je zelo strupen in drag.
Ti oksidanti se uporabljajo za oksidacijo alkenov v α-glikole v blagih pogojih.
Dioksirani
Najpogosteje uporabljena sta dimetildioksiran in metil(trifluorometil)dioksiran.

Najpogosteje se pridobivajo dioksirani v situ iz ustreznih ketonov in KHSO 5 (ali K 2 SO 4 KHSO 4 2KHSO 5 (okson)) v rahlo alkalnem mediju 7:
Za dioksirane je značilna visoka reaktivnost v kombinaciji z dobro selektivnostjo in se uporabljajo za oksidacijo neaktiviranih C–H vezi v alkanih, pri pripravi epoksidov iz alkenov, za oksidacijo aminov, oksimov, sulfidov, sulfoksidov itd. .
Oksidacija alkenov lahko poteka v več smereh:
1) z ohranitvijo ogljikovega skeleta molekule; Tako potekata epoksidacija in hidroksilacija dvojne vezi, kar vodi do tvorbe vicinalnih trans- ali cis-glikolov.
2) z razpadom dvojne vezi; Tako poteka ozonoliza in izčrpna oksidacija alkenov, kar vodi do nastanka različnih vrst karbonilnih spojin in karboksilnih kislin.
Glede na vrsto oksidacije se uporabljajo različna oksidacijska sredstva
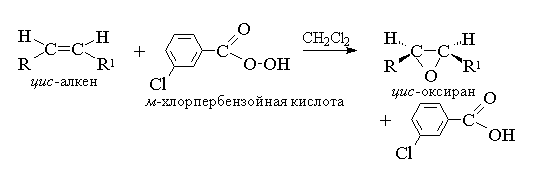
1. Epoksidacija(reakcija N.A. Priležajeva, 1909)
Aciklični in ciklični alkeni pri reakciji s perkislinami (perkislinami) RCOOOH v nepolarnem, indiferentnem okolju tvorijo epokside (oksirane), zato se sama reakcija imenuje reakcija epoksidacije.

Po sodobni nomenklaturi IUPAC- tričlenski obroč z enim atomom kisika imenujemo oksiran.
Epoksidacijo alkenov je treba obravnavati kot sinhron, usklajen proces, v katerem ionski intermediati, kot je hidroksil kation OH+, ne sodelujejo. Z drugimi besedami, epoksidacija alkenov je proces sin- vezava enega atoma kisika na dvojno vez s popolno ohranitvijo konfiguracije substituentov na dvojni vezi. 8

Za epoksidacijo je bil predlagan mehanizem, značilen za usklajene procese.

Ker je napad dvojne vezi s kisikovim atomom perkisline enako verjeten na obeh straneh ravnine dvojne vezi, so nastali oksirani bodisi meso-oblike ali zmesi enantiomerov. Kot epoksidanti se uporabljajo naslednje perkisline: perbenzojska, m-kloroperbenzojsko, monoperftalno, perocetno, trifluoroperocetno in performinsko. Perkisline aromatskega niza se uporabljajo v obliki posameznih reagentov, medtem ko perkisline alifatskega niza - CH 3 CO 3 H, CF 3 CO 3 H in HCO 3 H niso izolirane v individualni obrazec, in se uporabljajo po njihovem nastanku z interakcijo 30% ali 90% vodikovega peroksida in ustrezne karboksilne kisline. Perbenzoin in m-kloroperbenzojsko kislino dobimo z oksidacijo benzojske in m-klorobenzojske kisline s 70% vodikovim peroksidom v raztopini metansulfonske kisline ali iz kislinskih kloridov teh kislin in vodikovega peroksida.


Monoperftalno kislino pridobivajo po podobni metodi iz anhidrida ftalne kisline in 30% vodikovega peroksida.

Trenutno se široko uporablja monoperoksiftalna kislina v obliki Mg soli.Ta reagent se lahko uporablja v mešanicah organskih topil z vodo 9 .
Sprva so za pridobivanje oksiranov (epoksidov) uporabljali perbenzojsko ali monoperftalno kislino 10:

Trenutno se za epoksidacijo najpogosteje uporablja m- kloroperbenzojska kislina. Za razliko od drugih perkislin je dolgotrajno stabilen (do 1 leta) in je popolnoma varen za uporabo. Dobitki oksiranov, dobljenih z oksidacijo acikličnih in cikličnih alkenov m-kloroperbenzojske kisline v raztopini metilen klorida, kloroforma ali dioksana so običajno precej visoke 11.



Perkisline pogosto nastanejo neposredno v reakcijski mešanici 90 % vodikovega peroksida in karboksilne kisline v metilen kloridu.

Alkeni z dvojno vezjo, konjugirano na karbonilno skupino ali drug akceptorski substituent, so neaktivni in je za njihovo oksidacijo bolje uporabiti močnejša oksidanta, kot je trifluoroperocetna kislina, pridobljena iz anhidrida trifluoroocetne kisline in 90 % vodikovega peroksida v metilen kloridu. Peroksikarboksimidne kisline RC(NH)OOH so nestabilni vmesni produkti, ki nastanejo pri reakcijah nitrilov z alkalnimi raztopinami vodikovega peroksida 12:
Najenostavnejši oksiran, etilen oksid, se industrijsko proizvaja z oksidacijo etilena s kisikom v prisotnosti srebra kot katalizatorja 13.

2. Hidroksilacija
Znanih je vrsta oksidacijskih reagentov, s pomočjo katerih je možno v blagih pogojih alkenom dodati dve hidroksilni skupini.
Reakcija hidroksilacije alkenov, ki se pojavi pod vplivom hladne raztopine kalijevega permanganata in jo spremlja razbarvanje, je znana kot Wagnerjeva reakcija (1888). Trenutno ima malo sintetične uporabe, saj ga spremlja tvorba znatnega števila stranskih produktov. Vendar se lahko ta reakcija uporabi pri preučevanju strukture organske spojine kot kvalitativni test za dvojno vez. Hidroksilacijo cikloheksena z delovanjem vodne raztopine kalijevega permanganata na hladnem je prvi izvedel V.V. Markovnikov. Trenutno se za hidroksilacijo alkenov najpogosteje uporablja osmijev(VIII) oksid (Krigejeva reakcija, 1936) 14.
Osmijev tetroksid OsO 4 je brezbarvna kristalna snov, ki se tali pri 40 o C in je lahko topna v etru. Ko cikloheksen oksidiramo z etrsko raztopino tega reagenta, se sprosti črna oborina, ki je ciklični ester osminske kisline I 15:
Eter nastane s hkratnim odpiranjem dvojne vezi ogljik-ogljik alkena in dveh dvojnih vezi kovinskega oksida. Ta ester nato hidroliziramo z uporabo natrijevega sulfita kot katalizatorja. Produkt hidrolize je cis-cikloheksandiol-1,2(II), katerega hidroksili se nahajajo v β-regiji, tj. spredaj, vodiki pa v α-območju, tj. zadaj.
2.1 proti- Hidroksilacija
Tričlenski obroč oksiranov se zlahka odpre pod vplivom najrazličnejših nukleofilnih reagentov. Hidrolizo oksiranov katalizirajo tako kisline kot baze. V obeh primerih nastanejo vicinalni dioli, tj. glikoli. Pri kislinski katalizi se v prvi stopnji oksiranski atom kisika protonira, da nastane ciklični oksonijev kation, ki se odpre kot posledica nukleofilnega napada molekule vode 16:

Ključni korak pri odpiranju obroča, ki določa hitrost celotnega procesa, je nukleofilni napad vode na protonirano obliko oksirana. Mehansko gledano je ta proces podoben odprtju bromonijevega iona po nukleofilnem napadu bromidnega iona ali drugega nukleofilnega sredstva. S teh položajev bi moral biti stereokemični rezultat tvorba trans-glikoli med razpadom cikličnih epoksidov. Dejansko se med kislinsko katalizirano hidrolizo cikloheksen oksida ali ciklopenten oksida izključno trans-1,2-dioli.
Tako dvostopenjski proces epoksidacije alkena, ki mu sledi kislinska hidroliza epoksida na splošno ustreza reakciji proti- hidroksilacija alkenov.
Obe stopnji proti-hidroksilacijo alkenov lahko kombiniramo, če alken obdelamo z vodnim 30-70% vodikovim peroksidom v mravljični ali trifluoroocetni kislini. Obe kislini sta dovolj močni, da povzročita odprtje oksiranskega obroča.

Bazično katalizirano odpiranje oksiranskega obroča vodi tudi do tvorbe cikličnega trans- glikoli.
Zato je dvostopenjski proces epoksidacije alkenov, ki mu sledi alkalna hidroliza epoksidov, tudi reakcija proti- hidroksilacija alkenov.
2.2 sin- Hidroksilacija
Nekatere soli in oksidi prehodnih kovin v višjih oksidacijskih stopnjah so učinkoviti reagenti sin-hidroksilacija dvojne vezi alkena, ko sta obe hidroksilni skupini dodani na isto stran dvojne vezi. Oksidacija alkenov s kalijevim permanganatom je ena najstarejših metod sin- hidroksilacija dvojne vezi se še naprej pogosto uporablja kljub inherentnim omejitvam. Cis-1,2-cikloheksandiol je prvi pridobil V.V. Markovnikov leta 1878 s hidroksilacijo cikloheksena z vodno raztopino kalijevega permanganata pri 0 0 C.

Ta metoda je bila kasneje razvita v delih ruskega znanstvenika E.E. Wagner torej sin-hidroksilacijo alkenov pod delovanjem vodne raztopine kalijevega permanganata imenujemo Wagnerjeva reakcija. Kalijev permanganat je močno oksidacijsko sredstvo, ki lahko ne le hidroksilira dvojno vez, ampak tudi cepi nastali vicinalni diol. Da bi se čim bolj izognili nadaljnji razgradnji glikolov, je treba reakcijske pogoje skrbno nadzorovati. Dobitki glikolov so običajno nizki (30-60%). Najboljši rezultati dosežemo s hidroksilacijo alkenov v šibko alkalnem mediju (pH ~ 8 9) pri 0-5 0 C z razredčeno 1% vodno raztopino KMnO 4 17.


Na začetku pri oksidaciji alkenov s kalijevim permanganatom nastane ciklični ester manganove kisline, ki se takoj hidrolizira v sosednji diol.

Cikličnega estra manganove kisline kot intermediata nismo izolirali, vendar njegov nastanek izhaja iz poskusov z označenim 18 O kalijevim permanganatom: oba atoma kisika v glikolu se izkažeta za označena med oksidacijo alkena KMn 18 O 4. To pomeni, da se oba atoma kisika preneseta iz oksidanta in ne iz topila - vode, kar se dobro ujema s predlaganim mehanizmom.
Druga metoda sin-hidroksilacijo alkenov pod vplivom osmijevega (VIII) oksida OsO 4 je leta 1936 predlagal R. Kriege. Osmijev tetroksid je brezbarvna, hlapna, kristalinična snov, dobro topna v etru, dioksanu, piridinu in drugih organskih topilih. Pri reakciji osmijevega tetroksida z alkeni v etru ali dioksanu nastane črna oborina estra ciklične osmske kisline - osmata, ki jo zlahka izoliramo v posamezni obliki. Adicija OsO 4 na dvojno vez se opazno pospeši v raztopini v piridinu. Razpad osmatov v vicinalne glikole dosežemo z delovanjem vodne raztopine natrijevega hidrosulfita ali vodikovega sulfida.

Izkoristek izdelka sin-hidroksilacija alkenov pri tej metodi je bistveno večja kot pri uporabi permanganata kot oksidanta. Pomembna prednost metode Krige je odsotnost produktov oksidativne cepitve alkenov, kar je značilno za oksidacijo permanganata 18.
 19
19

Osmijev tetroksid je zelo drag in težko dostopen reagent, poleg tega pa je toksičen. Zato se osmijev (VIII) oksid uporablja pri sintezi majhnih količin težko dostopnih snovi, da bi dobili največji izkoristek diola. Da poenostavim sin-hidroksilacija alkenov pod vplivom OsO 4, je bila razvita tehnika, ki omogoča uporabo samo katalitskih količin tega reagenta. Hidroksilacija alkenov se izvaja z vodikovim peroksidom v prisotnosti OsO 4, na primer:

Na koncu stereokemična razmerja med alkenom cis- ali trans-konfiguracija in konfiguracija nastalega vicinalnega diola, ki se lahko cis- ali trans- izomer, eritro- ali trio- oblika, meso- ali D,L-oblika glede na substituente v alkenu 20:

Podobna stereokemična razmerja opazimo pri drugih reakcijah sin- ali proti- adicija pri večkratnih vezeh vodika, vodikovih halogenidov, vode, halogenov, borovih hidridov in drugih reagentov.
3. Oksidativna cepitev alkeni
Pri oksidaciji alkenov z alkalno vodno raztopino kalijevega permanganata pri segrevanju ali z raztopino KMnO 4 v vodni žveplovi kislini, kakor tudi pri oksidaciji alkenov z raztopino kromovega (VI) oksida CrO 3 v ocetni kislini oz. kalijevega dikromata in žveplove kisline je prvotno nastali glikol podvržen oksidativni razgradnji. Končni rezultat je cepitev ogljikovega skeleta na mestu dvojne vezi in tvorba ketonov in/ali karboksilnih kislin kot končnih produktov, odvisno od substituentov na dvojni vezi. Če oba ogljikova atoma pri dvojni vezi vsebujeta samo eno alkilno skupino, bo končni produkt popolne oksidacije zmes karboksilnih kislin; alken, tetrasubstituiran pri dvojni vezi, oksidira v dva ketona. Monosubstituirani alkeni s končno dvojno vezjo se cepijo na karboksilno kislino in ogljikov dioksid 21.

 22
22
Zaradi nizkih izkoristkov karboksilnih kislin in ketonov reakcije izčrpne oksidacije alkenov v klasični različici niso našle široke uporabe in so se prej uporabljale predvsem za določanje strukture izhodnega alkena iz produktov destruktivne oksidacije. Trenutno se oksidacija alkenov (R-CH=CH-R in R-CH=CH 2) v karboksilne kisline (RCOOH) z uporabo kalijevega permanganata ali dikromata izvaja s katalizo faznega prenosa. Dobitki karboksilnih kislin presegajo 90 %.

4. Ozonoliza alkenov
Reakcija alkenov z ozonom je najpomembnejša metoda za oksidativno cepitev alkenov pri dvojni vezi. Dolga desetletja je ta reakcija služila kot glavna metoda za določanje strukture izhodnega ogljikovodika in je bila uporabljena tudi pri sintezi različnih karbonilnih spojin. Reakcijo alkena z ozonom izvedemo s prepuščanjem toka ~5 % mešanice ozona in kisika v raztopino alkena v metilen kloridu ali etil acetatu pri -80 0 -100 0 C. Zaključek reakcije je kontrolirano s testom za prosti ozon s kalijevim jodidom. Mehanizem te svojevrstne in zapletene reakcije je bil ugotovljen predvsem zahvaljujoč delu Krige. Prvi produkt 1,3-dipolarne cikloadicije na dvojno vez je tako imenovani molozonid (1,2,3-trioksolan). Ta produkt je nestabilen in se nadalje spontano razgradi z odprtjem obroča in nastankom normalnega ozonida (1,2,4-trioksolana) 23 kot končnega produkta.
 24
24
Zdaj je splošno sprejeto, da pretvorba molozonida v navadni ozonid poteka z mehanizmom cepitve - rekombinacije. Pri molozonidu pride do spontanega odpiranja nestabilnega 1,2,3-trioksolanskega obroča, da nastaneta karbonilna spojina in bipolarni ion, ki nato medsebojno reagirata prav tako po shemi 1,3-dipolarne cikloadicije.

Zgornjo shemo za preureditev molozonida v normalni ozonid potrjuje dejstvo, da če je pred popolno tvorbo ozonida v reakcijski mešanici prisotna druga karbonilna spojina kot "prestreznik" bipolarnega iona, potem nastane imenovan "mešani ozonid". Na primer z ozonilizacijo cis-stilbena v prisotnosti benzaldehida, označenega z izotopom 18 O, je oznaka del etra in ne peroksidnega mostu ozonida:
Ta rezultat se dobro ujema s tvorbo mešanega ozonida pri rekombinaciji bipolarnega iona z označenim benzaldehidom:

Ozonidi so zelo nestabilne spojine, ki eksplozivno razpadejo. Niso izolirani posamično, ampak se razgradijo z delovanjem najrazličnejših regentov. Treba je razlikovati med reduktivnim in oksidativnim cepitvijo. Med hidrolizo ozonidi počasi razpadejo na karbonilne spojine in vodikov peroksid. Vodikov peroksid oksidira aldehide v karboksilne kisline. To je tako imenovana oksidativna razgradnja ozonidov:

Tako se med oksidativnim razkrojem ozonidov karboksilne kisline in (ali) ketoni, odvisno od strukture izhodnega alkena. Kot oksidacijska sredstva lahko uporabimo zračni kisik, vodikov peroksid, perkisline ali srebrov hidroksid. Najpogosteje se v sintetični praksi za ta namen uporablja vodikov peroksid v ocetni ali mravljični kislini, pa tudi vodikov peroksid v alkalnem mediju.


V praksi se metoda oksidativne razgradnje ozonidov uporablja predvsem za pridobivanje karboksilnih kislin.
Bolj pomembna je redukcijska cepitev ozonidov. Najpogosteje uporabljeni reducenti so cink in ocetna kislina, trifenilfosfin ali dimetil sulfid. V tem primeru so končni produkti ozonolize aldehidi ali ketoni, odvisno od strukture prvotnega alkena.


 25
25
Iz zgornjih primerov je razvidno, da alken, tetrasubstituiran pri dvojni vezi med ozonolizo in kasnejšo redukcijsko razgradnjo ozonida, tvori dva ketona, medtem ko trisubstituiran alken daje keton in aldehid. Disubstituiran simetrični alken med ozonolizo proizvede dva aldehida, alkeni s terminalno vezjo pa tvorijo aldehid in formaldehid.
Zanimiva modifikacija ozonolize je metoda, kjer kot ozonidni reducent uporabimo natrijev borohidrid, pri čemer so končni reakcijski produkti primarni oziroma sekundarni alkoholi, ki nastanejo pri redukciji aldehidov oziroma ktonov 26 .


Ozonoliza alkenov je kompleksen, delovno intenziven in eksploziven proces, ki zahteva uporabo posebne opreme. Zaradi tega so bile razvite druge metode za oksidativno cepitev alkenov na karbonilne spojine in karboksilne kisline, ki v sintezni praksi uspešno nadomeščajo reakcijo ozonolize.
Eno od sodobnih preparativnih metod za oksidativno uničenje alkenov je leta 1955 predlagal R. Lemieux. Ta metoda temelji na hidroksilaciji alkenov s kalijevim permanganatom, čemur sledi cepitev vicinalnega glikola z natrijevim periodatom NaIO 4 pri pH ~ 7 8. Perjodat sam ne reagira z alkenom. Produkti te dvostopenjske oksidativne cepitve so ketoni ali karboksilne kisline, saj se pod temi pogoji tudi aldehidi oksidirajo v karboksilne kisline. Pri Lemieuxovi metodi ne nastane zamuden problem ločevanja enega od reakcijskih produktov, manganovega dioksida, saj tako dioksid kot manganat ponovno oksidirata perjodat v permanganatni ion. To omogoča uporabo le katalitskih količin kalijevega permanganata. Spodaj je nekaj tipičnih primerov oksidativne cepitve alkenov z uporabo Lemieuxove metode.

Citronelol, alkohol, ki ga najdemo v rožnem olju, olju geranije in limoninem olju, se oksidira z mešanico kalijevega permanganata in natrijevega perjodata v vodnem acetonu pri 5-10 0 C v 6-hidroksi-4-metilheksankarboksilno kislino s kvantitativnim izkoristkom.

V drugi različici te metode se namesto kalijevega permanganata uporabljajo katalitične količine osmijevega tetroksida (Lemieux in Johnson 1956). Posebna prednost kombinacije OsO 4 in NaIO 4 je, da vam omogoča zaustavitev oksidacije na stopnji aldehida. Osmijev tetroksid doda dvojno vez alkena, da nastane osmat, ki ga natrijev perjodat oksidira v karbonilne spojine, da se regenerira osmijev tetroksid.

Namesto osmijevega tetroksida lahko uporabimo tudi rutenijev tetroksid RuO 4. Oksidativna destrukcija alkenov po Lemieux-Johnsonu vodi do istih produktov kot ozonoliza z reduktivno cepitvijo ozonidov.

V smislu sodobne organske kemije to pomeni, da je kombinacija OsO 4 -NaIO 4 sintetični ekvivalent reakcije ozonolize alkenov, ki ji sledi reduktivna cepitev. Prav tako je oksidacija alkenov z mešanico permanganata in perjodata sintetični ekvivalent ozonolize z oksidativnim razpadom ozonidov.
Oksidacija alkenov torej ni le skupek preparativnih metod za pripravo alkoholov, epoksidov, diolov, aldehidov, ketonov in karboksilnih kislin, je tudi eden od možnih načinov za ugotavljanje strukture izvornega alkena. Tako lahko glede na rezultat oksidativne destrukcije alkena določimo položaj dvojne vezi v molekuli, medtem ko stereokemični rezultat sin- oz proti- hidroksilacija alkena nam omogoča sklepanje o njegovi geometriji.
5. Oksidacija alkenov v prisotnosti paladijevih soli
Veliko raziskav je bilo posvečenih oksidaciji alkenov v karbonilne spojine z uporabo paladijevega klorida, predvsem zaradi industrijskega pomena reakcije, ki proizvaja acetaldehid iz etilena (Wackerjev postopek). Med oksidacijo se paladijev klorid reducira v paladij, proces, ki bi bil omejenega pomena, če ne bi bilo dejstva, da se drag paladijev klorid lahko uporablja v katalitskih količinah v prisotnosti drugega oksidacijskega sredstva, najpogosteje bakrovega (II) klorida. , ki oksidira paladij v paladij (II), sam pa se reducira v baker (I). Ponovno oksidacijo bakra (I) v baker (II) lahko izvedemo z atmosferskim kisikom, zato je celoten postopek zelo privlačen kot metoda industrijske oksidacije 27.
Etilen zlahka oksidira v acetaldehid 28:
Predlagani mehanizem 29:
Reakcija poteka v kislem okolju, ne spremlja je sprememba števila ogljikovih atomov v molekuli etilena in je trenutno glavni vir acetaldehida v industriji.
Oksidacija homologov etilena pod enakimi pogoji poteka pri najmanj hidrogeniranem ogljikovem atomu dvojne vezi s tvorbo ketonov. Zlasti pri oksidaciji propena nastane aceton, pri oksidaciji cikloheksena pa cikloheksanon.
Zaključek
Reakcija oksidacije je pomembna skupina reakcij dvojne vezi. Na splošno zavzemajo oksidacijske reakcije posebno mesto v organski kemiji. Pri obravnavanju teh reakcij je treba upoštevati ne samo naravo organske spojine, ki se oksidira, ampak tudi naravo oksidacijskega sredstva, prisotnost ali odsotnost katalizatorja, okolje, v katerem poteka reakcija itd.
Zato se morate zelo pogosto spominjati oksidantov in pogojev za njihovo uporabo, da dobite želeni produkt oksidacije. Na primer, reakcija oksidacije alkenov z razredčeno raztopino kalijevega permanganata povzroči nastanek diolov (glikolov), medtem ko koncentrirana raztopina kalijevega permanganata razbije molekulo alkena na dvojni vezi s tvorbo produktov, ki vsebujejo kisik. Tako daje isti oksidant v različnih okoljih različne produkte oksidacije.
Med reakcijami oksidacije velja za najpomembnejšo reakcijo ozoniranja, ki nam omogoča, da iz končnih produktov določimo strukturo prvotnega alkena. V tem delu so bile obravnavane glavne reakcije oksidacije alkenov in katalizatorji, ki se uporabljajo med oksidacijskimi procesi.
Seznam uporabljenih virov:
1) Reutov O. A. Organska kemija. V 4 delih. Del. 1.-M.:BINOM. Laboratorij znanja, 2004.-567 str.
2) Remy G. Tečaj anorganske kemije. T. 1. M.: Založba za tujo književnost, 1963. – 920 str.
3) Kazakov D.V., Voloshin A.I., Kazakov V.P., Shereshchovets V.V., Kabalnova N.N. Kemija in kemiluminiscenca dioksiranov. M.: Nauka, 1999
4) Traven V.F . Organska kemija: Učbenik za univerze: 2 zvezka / V. F. Traven. - M.: ICC "Akademkniga", 2004. - T. 1
5) Haynes A. Metode oksidacije organskih spojin. Alkani, alkeni, alkini in areni. M.: Mir, 1988.
6) Morrison R., Boyd R. "Organska kemija" M.: Mir, 1974
7) Shabarov Yu.S. "Organska kemija" 1. del M.: Kemija 1994
8) Petrov A.A., Balyan H.V., Troščenko A.T. Organska kemija: Učbenik za univerze.-5. izd., revidirano. In dodatno - Sankt Peterburg: "Ivan Fedorov", 2002.-624 str.
9) L. Fizer, M. Fizer Organska kemija. Napredni tečaj. Zvezek 1-M., “Kemija”, 1969, 688 str.
10) Plotnikov V.F., Piterskaya Yu.L. Alkeni Učbenik - Sankt Peterburg: SPbGTI (TU) - 2003. - 20 str.
11) Neyland O. Ya. Poglavje II. Alkeni // Organska kemija: Učbenik. za kem. univerze - M.: "Višja šola", 1990.
12) Marec D. Organska kemija: V 4 zvezkih/Prev. iz angleščine – M.: Mir, 1987. – T. 4. 470 str.
13) Terney A. Sodobna organska kemija: V 2 zvezkih - M.: Mir, 1981.
14) Hauptmann Z., Graefe Y., Remane H. “Organska kemija” M.: Kemija, 1979
15) Dryuk V.G., Malinovsky M.S. "Tečaj organske kemije" Kijev: Vishcha School 1987
16) http://www.chemistry.ssu.samara.ru/chem2/u442.htm
17) http://www.xumuk.ru/
1 Petrov A.A., Balyan H.V., Troščenko A.T. Organska kemija: Učbenik za univerze, str.85
26 26 Traven Povzetek >> Kemija
CH2 + 3O2 2CO2 + 2H2O b) Kdaj oksidacijo alkeni razredčena raztopina kalijevega permanganata nastanejo... na dvojni vezi. c) Ko je težko oksidacijo alkeni vrelo raztopino kalijevega permanganata v kisli...
Teorija splošne kemije z elementi učnih metod
Varalka >> KemijaMetoda za pridobivanje karbonilnih spojin - oksidacijo alkoholi Kot oksidant ... izkoristek ~90%) 5. Oksidacija alkeni. Dobijo se aldehidi in ketoni oksidacijo ogljikovodiki etilenske serije... ne hidrirajo. 7. Reakcije oksidacijo. Aldehidi in ketoni...
Oksirani (epoksidi)
Povzetek >> Kemija...) 3,4-epoksi-1-buten Metode za pripravo oksiranov Oksidacija alkeni perkisline Najbolj razširjena metoda... 1,2-epoksiciklo-m-klorobenzojska kislina heksanska kislina Oksidacija alkeni organske perkisline spremlja dodatek kisika...
Splošne informacije o alkoholih. Polioli
Povzetek >> Kemija...) je mogoče dobiti oksidacijo alkeni kalijev permanganat ali tetrooksid... . Opišite reakcijski mehanizem Oksidacija polioli Oksidacija etilen glikol poteka drugače, ... mehanizmi: (m 21) Periodat oksidacijo glicerol povzroči nastanek formaldehida...
To gradivo je težko obvladati sam zaradi velike količine informacij, številnih odtenkov in vseh vrst AMPAK in ČE. Preberite natančno!
O čem točno bomo govorili?
Za nekatere razrede organskih spojin so poleg popolne oksidacije (zgorevanja) značilne nepopolne oksidacijske reakcije, pri katerih se pretvorijo v druge razrede.
Za vsak razred obstajajo posebna oksidacijska sredstva: CuO (za alkohole), Cu(OH) 2 in OH (za aldehide) in drugi.
Obstajata pa dva klasična oksidanta, ki sta tako rekoč univerzalna za številne razrede.
To je kalijev permanganat - KMnO 4. In kalijev bikromat (dikromat) – K 2 Cr 2 O 7 . Te snovi so močni oksidanti zaradi mangana v oksidacijskem stanju +7 oziroma kroma v oksidacijskem stanju +6.
Reakcije s temi oksidanti se pojavljajo precej pogosto, vendar nikjer ni izčrpnega vodnika, po kakšnem principu izbrati produkte takih reakcij.
V praksi je veliko dejavnikov, ki vplivajo na potek reakcije (temperatura, okolje, koncentracija reagentov itd.). Pogosto je rezultat mešanica izdelkov. Zato je skoraj nemogoče predvideti izdelek, ki bo nastal.
Toda to ni primerno za enotni državni izpit: tam ne morete napisati "morda to, ali to, ali ono ali mešanica izdelkov." Treba je imeti posebnosti.
Pisci nalog so postavili neko logiko, neko načelo, po katerem naj bo določen izdelek napisan. Žal tega niso delili z nikomer.
Temu vprašanju se v večini priročnikov izogibamo: dve ali tri reakcije so podane kot primer.
V tem članku predstavljam tako imenovane rezultate raziskave-analize nalog enotnega državnega izpita. Logika in načela sestavljanja oksidacijskih reakcij s permanganatom in dikromatom so bila rešena precej natančno (v skladu s standardi enotnega državnega izpita). Najprej najprej.
Določanje oksidacijskega stanja.
Prvič, ko imamo opravka z redoks reakcijami, vedno obstajata oksidant in reducent.
Oksidacijsko sredstvo je mangan v permanganatu ali krom v dikromatu, redukcijsko sredstvo so atomi v organski snovi (in sicer ogljikovi atomi).
Ni dovolj določiti produkte, reakcijo je treba izenačiti. Za izravnavo se tradicionalno uporablja metoda elektronske tehtnice. Za uporabo te metode je treba določiti oksidacijska stanja reduktivnih sredstev in oksidantov pred in po reakciji.
nimam organska snov Iz 9. razreda poznamo oksidacijska stanja:
Ampak verjetno niso hodili k organskemu pouku v 9. razredu. Zato se morate, preden se naučite pisati OVR v organski kemiji, naučiti določiti oksidacijsko stanje ogljika v organskih snoveh. To se dela malo drugače, drugače kot v anorganski kemiji.
Ogljik ima največjo oksidacijsko stopnjo +4 in najmanjšo -4. In lahko kaže katero koli stopnjo oksidacije te vrzeli: -4, -3, -2, -1, 0, +1, +2, +3, +4.
Najprej se morate spomniti, kaj je oksidacijsko stanje.
Oksidacijsko stanje je konvencionalni naboj, ki se pojavi na atomu, ob predpostavki, da so elektronski pari v celoti premaknjeni proti bolj elektronegativnemu atomu.
Zato je stopnja oksidacije določena s številom premaknjenih elektronskih parov: če je premaknjena proti danemu atomu, potem pridobi presežek minus (-) naboja, če iz atoma, potem pridobi presežek plus (+) napolniti. Načeloma je to vsa teorija, ki jo morate poznati za določitev oksidacijskega stanja ogljikovega atoma.
Za določitev oksidacijskega stanja določenega atoma ogljika v spojini moramo upoštevati VSAKO njegovo vez in videti, v katero smer se bo premaknil elektronski par in kakšen presežni naboj (+ ali -) bo iz tega nastal na atomu ogljika.
Poglejmo konkretne primere:
Pri karbonu tri vezi z vodikom. Ogljik in vodik - kateri je bolj elektronegativen? Ogljik, kar pomeni, da se bo po teh treh vezeh elektronski par premaknil proti ogljiku. Ogljik vzame en negativni naboj od vsakega vodika: izkaže se -3
Četrta povezava je s klorom. Ogljik in klor - kateri je bolj elektronegativen? Klor, kar pomeni, da se bo po tej vezi elektronski par premaknil proti kloru. Ogljik pridobi en pozitivni naboj +1.
Nato morate samo dodati: -3 + 1 = -2. Oksidacijsko stanje tega ogljikovega atoma je -2.

Določimo oksidacijsko stopnjo vsakega ogljikovega atoma:

Ogljik ima tri vezi z vodikom. Ogljik in vodik - kateri je bolj elektronegativen? Ogljik, kar pomeni, da se bo po teh treh vezeh elektronski par premaknil proti ogljiku. Ogljik vzame en negativni naboj od vsakega vodika: izkaže se -3
In še ena povezava z drugim ogljikom. Ogljik in drug ogljik - njuna elektronegativnost je enaka, zato ne pride do premika elektronskega para (vez ni polarna). 

Ta atom ima dve vezi z enim atomom kisika in drugo vez z drugim atomom kisika (kot del skupine OH). Več elektronegativnih atomov kisika v treh vezeh pritegne elektronski par iz ogljika in ogljik pridobi naboj +3.
S četrto vezjo je ogljik povezan z drugim ogljikom, kot smo že povedali, vzdolž te vezi se elektronski par ne premika.


Ogljik je z vodikovimi atomi povezan z dvema vezema. Ogljik, ki je bolj elektronegativen, odvzame en par elektronov za vsako vez z vodikom in pridobi naboj -2.
Ogljikova dvojna vez je povezana z atomom kisika. Bolj elektronegativen kisik pritegne en elektronski par k sebi vzdolž vsake vezi. Skupaj se izkaže, da ima ogljik dva elektronska para. Ogljik pridobi naboj +2.
Skupaj dobimo +2 -2 = 0.

Določimo oksidacijsko stopnjo tega ogljikovega atoma:
Trojna vez z bolj elektronegativnim dušikom daje ogljiku naboj +3; vez z ogljikom ne premakne elektronskega para.

Oksidacija s permanganatom.
Kaj se bo zgodilo s permanganatom?
Redoks reakcija s permanganatom se lahko pojavi v različnih okoljih (nevtralno, alkalno, kislo). In od okolja je odvisno, kako bo reakcija potekala in kakšni produkti bodo nastali.
Zato gre lahko v tri smeri:

Permanganat, ki je oksidant, se zmanjša. Tukaj so izdelki njegove obnove:
- Kislo okolje.
Medij nakisamo z žveplovo kislino (H 2 SO 4). Mangan se reducira do oksidacijskega stanja +2. In obnovitveni izdelki bodo:
KMnO 4 + H 2 SO 4 → MnSO 4 + K 2 SO 4 + H 2 O
- Alkalno okolje.
Za ustvarjanje alkalnega okolja se doda precej koncentrirana alkalija (KOH). Mangan se reducira do oksidacijske stopnje +6. Izdelki za obnovitev
KMnO 4 + KOH → K 2 MnO 4 + H 2 O
- Nevtralno okolje(in rahlo alkalno).
V nevtralnem okolju poleg permanganata reagira tudi voda (kar zapišemo na levi strani enačbe), mangan se bo reduciral na +4 (MnO 2), redukcijski produkti bodo:
KMnO 4 + H 2 O → MnO 2 + KOH
In v rahlo alkalnem okolju (v prisotnosti raztopine KOH z nizko koncentracijo):
KMnO 4 + KOH → MnO 2 + H 2 O

Kaj se bo zgodilo z organskimi snovmi?
Prva stvar, ki jo morate razumeti, je, da se vse začne z alkoholom! To je začetna stopnja oksidacije. Ogljik, na katerega je vezana hidroksilna skupina, je podvržen oksidaciji.
Pri oksidaciji ogljikov atom »pridobi« vez s kisikom. Zato pri pisanju sheme oksidacijske reakcije napišite [O] nad puščico:
Primarni alkohol najprej oksidira v aldehid, nato v karboksilno kislino:

Oksidacija sekundarni alkohol odpade na drugi stopnji. Ker je ogljik v sredini, nastane keton in ne aldehid (ogljikov atom v ketonski skupini ne more več fizično tvoriti vezi s hidroksilno skupino):

Ketoni, terciarni alkoholi in karboksilne kisline ne oksidira več:

Postopek oksidacije poteka stopenjsko – dokler je prostor za oksidacijo in so za to zagotovljeni vsi pogoji, se reakcija nadaljuje. Vse se konča z produktom, ki v danih pogojih ne oksidira: terciarni alkohol, keton ali kislina.
Omeniti velja stopnje oksidacije metanola. Najprej se oksidira v ustrezen aldehid, nato v ustrezno kislino:

Posebnost tega produkta (mravljinčna kislina) je v tem, da je ogljik v karboksilni skupini vezan na vodik in če natančno pogledate, opazite, da to ni nič drugega kot aldehidna skupina:

In aldehidna skupina, kot smo ugotovili prej, se nadalje oksidira v karboksilno skupino:

Ste prepoznali nastalo snov? Njegova bruto formula je H 2 CO 3. to ogljikova kislina, ki razpade na ogljikov dioksid in vodo:
H 2 CO 3 → H 2 O + CO 2
Zato metanol, formikaldehid in mravljinčna kislina(zaradi aldehidne skupine) oksidirajo v ogljikov dioksid.
Blaga oksidacija.
Blaga oksidacija je oksidacija brez močnega segrevanja v nevtralnem ali rahlo alkalnem okolju (nad reakcijo napišite 0 ° ali 20 °) .
Pomembno si je zapomniti, da alkoholi v blagih pogojih ne oksidirajo. Če torej nastanejo, se oksidacija na njih ustavi. Katere snovi bodo podvržene blagi oksidacijski reakciji?
- Vsebuje dvojno vez C=C (Wagnerjeva reakcija).
V tem primeru se π-vez pretrga in hidroksilna skupina "sedi" na sproščene vezi. Rezultat je dihidrični alkohol:

Zapišimo reakcijo blage oksidacije etilena (etena). Zapišimo izhodne snovi in napovejmo produkte. Hkrati še ne pišemo H 2 O in KOH: lahko se pojavita na desni strani enačbe ali na levi. In takoj določimo stopnje oksidacije snovi, ki sodelujejo v redoks reakciji:

Naredimo elektronsko tehtnico (mislimo, da sta reducenta dva - dva ogljikova atoma, oksidirata ločeno):

Določimo koeficiente:

Na koncu morate dodati manjkajoča produkta (H 2 O in KOH). Na desni ni dovolj kalija, kar pomeni, da bo na desni alkalija. Pred njo postavimo koeficient. Na levi ni dovolj vodika, zato je na levi voda. Pred njim postavimo koeficient:

Naredimo enako s propilenom (propenom):


Cikloalken pogosto zdrsne. Naj vas ne moti. Je navaden ogljikovodik z dvojno vezjo:

Kjerkoli je ta dvojna vez, bo oksidacija potekala na enak način:

- Vsebuje aldehidno skupino.
Aldehidna skupina je bolj reaktivna (lažje reagira) kot alkoholna skupina. Zato bo aldehid oksidiral. Pred kislino:

Poglejmo si primer acetaldehida (etanala). Zapišimo reaktante in produkte ter uredimo oksidacijska stanja. Naredimo tehtnico in postavimo koeficient pred redukcijsko sredstvo in oksidant:

V nevtralnem in šibko alkalnem okolju bo potek reakcije nekoliko drugačen.
V nevtralnem okolju, kot se spomnimo, na levo stran enačbe zapišemo vodo, na desno stran enačbe pa alkalijo (ki nastane med reakcijo):

V tem primeru se kislina in alkalija pojavita druga poleg druge v eni mešanici. Pride do nevtralizacije.

Ne morejo obstajati drug ob drugem in reagirati, nastane sol:
Poleg tega, če pogledamo koeficiente v enačbi, bomo razumeli, da obstajajo 3 mol kisline in 2 mol alkalije. 2 mola alkalije lahko nevtralizirata le 2 mola kisline (nastaneta 2 mola soli). In en mol kisline ostane. Zato bo končna enačba:

V rahlo alkalnem okolju je alkalija v presežku – dodana je pred reakcijo, zato je vsa kislina nevtralizirana:

Podobna situacija nastane pri oksidaciji metanala. Kot se spomnimo, se oksidira v ogljikov dioksid:

Upoštevati je treba, da je ogljikov monoksid (IV) CO 2 kisel. In reagiral bo z alkalijami. In ker je ogljikova kislina dvobazična, lahko nastaneta tako kisla sol kot srednja sol. Odvisno je od razmerja med alkalijo in ogljikovim dioksidom:
Če ima alkalija razmerje z ogljikovim dioksidom 2:1, potem bo povprečna sol:
Lahko pa je bistveno več alkalij (več kot dvakrat). Če se več kot podvoji, ostane preostanek alkalije:
3KOH + CO 2 → K 2 CO 3 + H 2 O + KOH
To se bo zgodilo v alkalnem okolju (kjer je alkalije v presežku, saj jo dodamo reakcijski zmesi pred reakcijo) ali v nevtralnem okolju, ko nastane veliko alkalije.
Če pa se alkalija nanaša na ogljikov dioksid kot 1:1, potem bo kisla sol:
KOH + CO 2 → KHCO 3
Če je ogljikovega dioksida več, kot je potrebno, ostane v presežku:
KOH + 2CO 2 → KHCO 3 + CO 2
To se zgodi v nevtralnem okolju, če nastane malo alkalij.
Zapišimo izhodne snovi, produkte, sestavimo tehtnico, postavimo oksidacijska stanja pred oksidant, reducent in produkte, ki iz njih nastanejo:

V nevtralnem okolju bo na desni nastala alkalija (4KOH):

Zdaj moramo razumeti, kaj bo nastalo med interakcijo treh molov CO 2 in štirih molov alkalije.
3CO 2 + 4KOH → 3KHCO 3 + KOH
KHCO 3 + KOH → K 2 CO 3 + H 2 O
Torej se izkaže takole:
3CO 2 + 4KOH → 2KHCO 3 + K 2 CO 3 + H 2 O
Zato na desno stran enačbe zapišemo dva mola bikarbonata in en mol karbonata:

Toda v šibko alkalnem okolju takšnih težav ni: zaradi presežka alkalij bo nastala povprečna sol:

Enako se bo zgodilo med oksidacijo aldehida oksalne kisline:

Tako kot v prejšnjem primeru nastane dibazična kislina, po enačbi pa bi morali dobiti 4 mole alkalije (od 4 molov permanganata).
V nevtralnem okolju spet vse alkalije niso dovolj, da bi popolnoma nevtralizirale vso kislino.
Trije moli alkalije gredo v tvorbo kisle soli, en mol alkalije ostane:
3HOOC–COOH + 4KOH → 3KOOC–COOH + KOH
In ta en mol alkalije gre v interakcijo z enim molom kisle soli:
KOOC–COOH + KOH → KOOC–COOK + H 2 O
Izkazalo se je takole:
3HOOC–COOH + 4KOH → 2KOOC–COOH + KOOC–COOK + H 2 O
Končna enačba:

V rahlo alkalnem okolju nastane srednja sol zaradi presežka alkalij:

- Vsebuje trojno vezC≡ C.
Se spomnite, kaj se je zgodilo med blago oksidacijo spojin z dvojno vezjo? Če se ne spomnite, se pomaknite nazaj in se spomnite.
Vez π se prekine in hidroksilna skupina se veže na ogljikove atome. Tukaj je isti princip. Ne pozabite le, da ima trojna vez dve π vezi. Najprej se to zgodi vzdolž prve vezi π:
Nato prek druge π-vezi:

Struktura, v kateri ima en ogljikov atom dve hidroksilni skupini, je izjemno nestabilna. Ko je v kemiji nekaj nestabilno, se nagiba k temu, da nekaj »odpade«. Voda odpade takole:

Posledica tega je karbonilna skupina.
Poglejmo si primere:
Etin (acetilen). Razmislimo o stopnjah oksidacije te snovi:

Izločanje vode:




Kot v prejšnjem primeru sta v eni reakcijski zmesi kislina in alkalija. Pride do nevtralizacije in nastane sol. Kot lahko vidite iz koeficienta alkalijskega permanganata, bo 8 molov, to je povsem dovolj za nevtralizacijo kisline. Končna enačba:

Razmislite o oksidaciji butina-2:

Izločanje vode:

Pri tem ne nastane kislina, zato se ni treba ukvarjati z nevtralizacijo.
Enačba reakcije:

Te razlike (med oksidacijo ogljika na robu in v sredini verige) so jasno prikazane na primeru pentina:

Izločanje vode:

Rezultat je snov z zanimivo strukturo:

Aldehidna skupina nadaljuje z oksidacijo:
Zapišimo izhodne snovi, produkte, določimo oksidacijska stanja, sestavimo bilanco, postavimo koeficienta pred oksidantom in reducentom:

Nastati morata 2 mola alkalije (ker je koeficient pred permanganatom 2), zato je vsa kislina nevtralizirana:

Huda oksidacija.
Trda oksidacija je oksidacija v kislo, visoko alkalna okolju. In tudi v nevtralen (ali rahlo alkalni), vendar pri segrevanju.
V kislem okolju se včasih tudi segrejejo. Da pa pride do hude oksidacije v nekislem okolju, je predpogoj segrevanje.
Katere snovi bodo močno oksidirale? (Najprej bomo analizirali le v kislem okolju – nato pa bomo dodali nianse, ki nastanejo pri oksidaciji v močno alkalnem in nevtralnem ali šibko alkalnem (pri segrevanju) okolju).
Pri hudi oksidaciji gre proces do maksimuma. Dokler obstaja nekaj za oksidacijo, se oksidacija nadaljuje.
- Alkoholi. Aldehidi.
Oglejmo si oksidacijo etanola. Postopoma oksidira v kislino:

Zapišimo enačbo. Zapišemo izhodne snovi, produkte redoks reakcije, vpišemo oksidacijska stanja in sestavimo bilanco. Izenačimo reakcijo:

Če se reakcija izvaja pri vrelišču aldehida, bo ta, ko nastane, izhlapel (odletel) iz reakcijske mešanice, ne da bi imel čas za nadaljnjo oksidacijo. Enak učinek je mogoče doseči v zelo nežnih pogojih (nizka toplota). V tem primeru zapišemo aldehid kot produkt:

Oglejmo si oksidacijo sekundarnega alkohola na primeru 2-propanola. Kot že omenjeno, se oksidacija konča na drugi stopnji (tvorba karbonilne spojine). Ker nastane keton, ki ne oksidira. Enačba reakcije:

Oglejmo si oksidacijo aldehidov z uporabo etanala. Prav tako oksidira v kislino:

Enačba reakcije:

Metanal in metanol, kot smo že omenili, se oksidirata v ogljikov dioksid:

Metal:

- Vsebuje več vezi.
V tem primeru se veriga prekine na večkratni vezi. In atomi, ki so ga tvorili, so podvrženi oksidaciji (pridobijo vez s kisikom). Čim bolj oksidirajte.
Ko se dvojna vez prekine, nastanejo iz fragmentov karbonilne spojine (na spodnjem diagramu: iz enega fragmenta - aldehid, iz drugega - keton)

![]()
Poglejmo oksidacijo pentena-2:

Oksidacija "ostankov":

Izkazalo se je, da nastaneta dve kislini. Zapišimo izhodne snovi in izdelke. Določimo oksidacijsko stanje atomov, ki ga spreminjajo, sestavimo ravnovesje in izenačimo reakcijo: 
Pri sestavljanju elektronske bilance mislimo, da obstajata dva reducenta - dva atoma ogljika, ki se oksidirata ločeno:

Kislina ne bo vedno nastala. Oglejmo si na primer oksidacijo 2-metilbutena:

Enačba reakcije:

Popolnoma enak princip za oksidacijo spojin s trojno vezjo (samo oksidacija se pojavi takoj s tvorbo kisline, brez vmesne tvorbe aldehida):

Enačba reakcije:

Ko se večkratna vez nahaja točno na sredini, rezultat nista dva produkta, ampak en. Ker so "ostanki" enaki in so oksidirani v iste produkte:

Enačba reakcije:

- Dvojno okronana kislina.
Obstaja ena kislina, v kateri so karboksilne skupine (krone) povezane med seboj:
To je oksalna kislina. Dvema kronama težko stojita drug ob drugem. Zagotovo je stabilen v normalnih pogojih. Toda ker ima dve skupini karboksilnih kislin, ki sta povezani druga z drugo, je manj stabilen kot druge karboksilne kisline.
In zato se lahko v posebej težkih pogojih oksidira. Obstaja prekinitev povezave med "dvema kronama":

Enačba reakcije:

- Homologi benzena (in njihovi derivati).
Benzen sam po sebi ne oksidira, zaradi aromatičnosti je ta struktura zelo stabilna 
Toda njegovi homologi so oksidirani. V tem primeru se tokokrog tudi prekine, glavna stvar je vedeti, kje točno. Velja nekaj načel:
- Sam benzenov obroč se ne sesede in ostane nedotaknjen do konca, pretrganje vezi se zgodi v radikalu.
- Atom, neposredno vezan na benzenski obroč, se oksidira. Če se po njem veriga ogljika v radikalu nadaljuje, potem pride do prekinitve po njem.


Poglejmo si oksidacijo metilbenzena. Tam je en ogljikov atom v radikalu oksidiran: 
Enačba reakcije:

Poglejmo oksidacijo izobutilbenzena:

Enačba reakcije:

Poglejmo oksidacijo sek-butilbenzena:

Enačba reakcije:

Ko homologe benzena (in derivate homologov) oksidiramo z več radikali, nastaneta dve, tri ali več bazičnih aromatskih kislin. Na primer, oksidacija 1,2-dimetilbenzena:

Derivati homologov benzena (v katerih ima benzenov obroč neogljikovodikove radikale) se oksidirajo na enak način. Druga funkcionalna skupina na benzenovem obroču ne moti:


Vmesni seštevek. Algoritem "kako napisati reakcijo trde oksidacije s permanganatom v kislem mediju":
- Zapišite izhodne snovi (organske + KMnO 4 + H 2 SO 4).
- Zapišite produkte organske oksidacije (oksidirale bodo spojine, ki vsebujejo alkohol, aldehidne skupine, večkratne vezi, pa tudi homologi benzena).
- Zapišite produkt redukcije permanganata (MnSO 4 + K 2 SO 4 + H 2 O).
- Določite stopnjo oksidacije pri udeležencih OVR. Naredite bilanco stanja. Vpiši koeficienta za oksidant in reducent ter za snovi, ki iz njiju nastanejo.
- Nato je priporočljivo izračunati, koliko sulfatnih anionov je na desni strani enačbe, in temu primerno postaviti koeficient pred žveplovo kislino na levi.
- Na koncu postavite koeficient pred vodo.
Močna oksidacija v močno alkalnem okolju in nevtralnem ali rahlo alkalnem (pri segrevanju) okolju.
Te reakcije so veliko manj pogoste. Lahko rečemo, da so takšne reakcije eksotika. In kot se za eksotične odzive spodobi, so se ti izkazali za najbolj kontroverzne.
Trda oksidacija je tudi v Afriki težka, zato organske snovi oksidirajo enako kot v kislem okolju.
Reakcij ne bomo analizirali za vsak razred posebej, saj je bilo splošno načelo navedeno že prej. Poglejmo le nianse.
Visoko alkalno okolje :
V močno alkalnem okolju se permanganat reducira do oksidacijskega stanja +6 (kalijev manganat):
KMnO 4 + KOH → K 2 MnO 4 .
V močno alkalnem okolju je alkalija vedno v presežku, zato pride do popolne nevtralizacije: če nastane ogljikov dioksid, bo karbonat, če bo kislina, bo sol (če je kislina večbazična, bo srednja sol).
Na primer, oksidacija propena:

Oksidacija etilbenzena:

Rahlo alkalno ali nevtralno okolje pri segrevanju :
Tudi tu je vedno treba upoštevati možnost nevtralizacije.
Če pride do oksidacije v nevtralnem okolju in nastane kisla spojina (kislina ali ogljikov dioksid), bo nastala alkalija nevtralizirala to kislo spojino. Vendar ni vedno dovolj alkalije za popolno nevtralizacijo kisline.
Pri oksidaciji aldehidov, na primer, ni dovolj (oksidacija bo potekala enako kot v blagih pogojih - temperatura bo preprosto pospešila reakcijo). Zato nastaneta sol in kislina (ki, grobo rečeno, ostane v presežku).
O tem smo razpravljali, ko smo gledali blago oksidacijo aldehidov.
Torej, če tvorite kislino v nevtralnem okolju, morate skrbno preveriti, ali je dovolj, da nevtralizirate vso kislino. Posebno pozornost je treba nameniti nevtralizaciji polibazičnih kislin.
V šibko alkalnem okolju zaradi zadostne količine alkalij nastajajo le srednje soli, saj je alkalij v presežku.
Za oksidacijo v nevtralnem okolju praviloma zadostuje alkalija. Reakcijska enačba tako v nevtralnem kot v šibko alkalnem mediju bo enaka.
Na primer, poglejmo oksidacijo etilbenzena:


Alkalija je povsem dovolj za popolno nevtralizacijo nastalih kislih spojin, tudi presežek bo ostal:

Porabljeni so 3 mol alkalije - 1 ostane.
Končna enačba:

Ta reakcija v nevtralnem in šibko alkalnem okolju bo potekala enako (v šibko alkalnem okolju na levi alkalije ni, vendar to ne pomeni, da je ni, le ne reagira).
Redoks reakcije, ki vključujejo kalijev dikromat (dikromat).
Dihromat nima tako široke palete reakcij organske oksidacije v enotnem državnem izpitu.
Oksidacija z dikromatom se običajno izvaja le v kislem okolju. V tem primeru se krom povrne na +3. Izdelki za obnovitev:
Oksidacija bo huda. Reakcija bo zelo podobna oksidaciji s permanganatom. Iste snovi, ki jih oksidira permanganat v kislem okolju, bodo oksidirale in nastali bodo enaki produkti.
Poglejmo nekaj reakcij.
Razmislimo o oksidaciji alkohola. Če se oksidacija izvaja pri vrelišču aldehida, bo ta zapustil reakcijsko zmes, ne da bi bil podvržen oksidaciji:

V nasprotnem primeru lahko alkohol neposredno oksidira v kislino.
Aldehid, proizveden v prejšnji reakciji, je mogoče "ujeti" in prisiliti, da oksidira v kislino:

Oksidacija cikloheksanola. Cikloheksanol je sekundarni alkohol, zato nastane keton:

Če je s to formulo težko določiti oksidacijska stanja ogljikovih atomov, lahko na osnutek napišete:

Enačba reakcije:

Oglejmo si oksidacijo ciklopentena.
Dvojna vez se zlomi (cikel se odpre), atomi, ki so jo tvorili, se maksimalno oksidirajo (v tem primeru do karboksilne skupine):


Nekatere značilnosti oksidacije v Enotnem državnem izpitu, s katerimi se ne strinjamo povsem.
Menimo, da tista "pravila", načela in reakcije, o katerih bomo razpravljali v tem razdelku, niso povsem pravilni. Niso v nasprotju le z realnim stanjem (kemija kot znanost), temveč tudi z notranjo logiko šolski kurikulum in še posebej enotni državni izpit.
Toda kljub temu smo prisiljeni zagotoviti to gradivo točno v obliki, ki jo zahteva enotni državni izpit.
Govorimo konkretno o TRDI oksidaciji.
Se spomnite, kako se homologi benzena in njihovi derivati oksidirajo v težkih pogojih? Vsi radikali so zaključeni in nastanejo karboksilne skupine. Ostanki oksidirajo »sami«:

Če se torej v radikalu nenadoma pojavi hidroksilna skupina ali večkratna vez, morate pozabiti, da je tam benzenov obroč. Reakcija bo potekala SAMO preko te funkcionalne skupine (ali večkratne vezi).
Funkcionalna skupina in večkratna vez sta pomembnejši od benzenskega obroča.

Oglejmo si oksidacijo vsake snovi:
Prva snov:

Zanemariti morate dejstvo, da obstaja benzenski obroč. Z vidika Enotnega državnega izpita je to le sekundarni alkohol. Sekundarni alkoholi se oksidirajo v ketone, vendar se ketoni ne oksidirajo naprej:

Naj se ta snov oksidira z dikromatom:

Druga snov:

Ta snov se oksidira preprosto kot spojina z dvojno vezjo (ne posvečamo pozornosti benzenskemu obroču):

Pri segrevanju naj oksidira v nevtralnem permanganatu:

Nastala alkalija je dovolj za popolno nevtralizacijo ogljikovega dioksida:
2KOH + CO 2 → K 2 CO 3 + H 2 O
Končna enačba:

Oksidacija tretje snovi:

Pustimo, da oksidacija poteka s kalijevim permanganatom v kislem okolju:

Oksidacija četrte snovi:

Pustite, da oksidira v visoko alkalnem okolju. Enačba reakcije bo:

In končno, tako se oksidira vinilbenzen:

In oksidira v benzojsko kislino, ne pozabite, da po logiki Enotnega državnega izpita oksidira na ta način ne zato, ker je derivat benzena. Ampak ker vsebuje dvojno vez.
Zaključek.
To je vse, kar morate vedeti o redoks reakcijah, ki vključujejo permanganat in dikromat v organski snovi.
Ne bodite presenečeni, če boste nekatere točke, opisane v tem članku, slišali prvič. Kot že rečeno, je ta tema zelo obsežna in kontroverzna. In kljub temu je iz neznanega razloga deležen zelo malo pozornosti.
Kot ste morda videli, dve ali tri reakcije ne morejo pojasniti vseh vzorcev teh reakcij. To zahteva celovit pristop in podrobno razlago vseh točk. Na žalost v učbenikih in na spletnih virih tema ni v celoti zajeta ali pa sploh ni zajeta.
Poskušal sem odpraviti te pomanjkljivosti in pomanjkljivosti ter obravnavati to temo kot celoto in ne delno. Upam da mi je uspelo.
Hvala za vašo pozornost, vse dobro vam! Vso srečo pri obvladovanju kemijska znanost in opravljanje izpitov!
Kot že omenjeno, je oksidacija organske snovi vnos kisika v njeno sestavo in (ali) izločanje vodika. Redukcija je obraten proces (vnos vodika in izločanje kisika). Glede na sestavo alkanov (СnH2n+2) lahko sklepamo, da niso sposobni sodelovati v reakcijah redukcije, lahko pa sodelujejo v reakcijah oksidacije.
Alkani so spojine z nizkimi stopnjami oksidacije ogljika in glede na reakcijske pogoje se lahko oksidirajo v različne spojine.
Pri običajnih temperaturah alkani ne reagirajo niti z močnimi oksidanti (H2Cr2O7, KMnO4 itd.). Pri vnosu v odprt ogenj alkani gorijo. V tem primeru v presežku kisika pride do njihove popolne oksidacije v CO2, kjer ima ogljik najvišja stopnja oksidacija +4, in voda. Zgorevanje ogljikovodikov vodi do zloma vseh C-C povezave in C-H in ga spremlja sproščanje velike količine toplote (eksotermna reakcija).
Splošno sprejeto je, da mehanizem oksidacije alkanov vključuje radikalno verižni proces, saj je kisik sam po sebi slabo reaktiven; da bi odvzeli atom vodika iz alkana, je potreben delec, ki bo sprožil tvorbo alkilnega radikala, ki bo reagiral s kisikom in dal peroksi radikal. Peroksi radikal lahko nato odvzame vodikov atom iz druge molekule alkana, da tvori alkil hidroperoksid in radikal.

Alkane lahko oksidiramo z atmosferskim kisikom pri 100-150 ° C v prisotnosti katalizatorja - manganovega acetata; ta reakcija se uporablja v industriji. Do oksidacije pride, ko skozi staljeni parafin, ki vsebuje manganovo sol, piha zračni tok.
Ker Kot rezultat reakcije nastane mešanica kislin, ki se ločijo od nezreagiranega parafina z raztapljanjem v vodni alkaliji in nato nevtralizirajo z mineralno kislino.
Neposredno v industriji se ta metoda uporablja za pridobivanje ocetne kisline iz n-butana:
Oksidacija alkenov
Oksidacijske reakcije alkenov delimo v dve skupini: 1) reakcije, pri katerih se ohrani ogljikov skelet, 2) reakcije oksidativnega uničenja ogljikovega ogrodja molekule pri dvojni vezi.
Oksidacijske reakcije alkenov z ohranitvijo ogljikovega skeleta
1. Epoksidacija (reakcija Priležajeva)
Aciklični in ciklični alkeni pri reakciji s perkislinami v nepolarnem okolju tvorijo epokside (oksirane).
Oksirane lahko dobimo tudi z oksidacijo alkenov s hidroperoksidi v prisotnosti katalizatorjev, ki vsebujejo molibden, volfram in vanadij:

Najenostavnejši oksiran, etilen oksid, se industrijsko proizvaja z oksidacijo etilena s kisikom v prisotnosti srebra ali srebrovega oksida kot katalizatorja.

2. anti-hidroksilacija (hidroliza epoksidov)
Kisla (ali alkalna) hidroliza epoksidov vodi do odprtja oksidnega obroča s tvorbo transdiolov.

V prvi fazi se kisikov atom epoksida protonira, da nastane ciklični oksonijev kation, ki se odpre kot posledica nukleofilnega napada molekule vode.
Bazično katalizirano odpiranje epoksi obroča vodi tudi do tvorbe trans-glikolov.

3. sin-hidroksilacija
Ena najstarejših metod za oksidacijo alkenov je Wagnerjeva reakcija (oksidacija s kalijevim permanganatom). Na začetku oksidacija proizvede ciklični ester manganove kisline, ki hidrolizira v sosednji diol:

Poleg Wagnerjeve reakcije obstaja še ena metoda za sinhidroksilacijo alkenov pod delovanjem osmijevega (VIII) oksida, ki jo je predlagal Krige. Ko osmijev tetroksid reagira z alkenom v etru ali dioksanu, nastane črna oborina estra ciklične osmske kisline, osmat. Vendar pa je dodajanje OsO4 na večkratno vez opazno pospešeno v piridinu. Nastala črna osmatna oborina se zlahka razgradi z delovanjem vodne raztopine natrijevega hidrosulfita:

Kalijev permanganat ali osmijev (VIII) oksid oksidira alken v cis-1,2-diol.
Oksidativna cepitev alkenov
Oksidativna cepitev alkenov vključuje reakcije njihove interakcije s kalijevim permanganatom v alkalni ali žveplovi kislini, pa tudi oksidacijo z raztopino kromovega trioksida v ocetni kislini ali kalijevem dikromatu in žveplovi kislini. Končni rezultat takih transformacij je cepitev ogljikovega skeleta na mestu dvojne vezi in nastanek karboksilnih kislin ali ketonov.
Monosubstituirani alkeni s končno dvojno vezjo se cepijo na karboksilno kislino in ogljikov dioksid:

Če oba ogljikova atoma pri dvojni vezi vsebujeta samo eno alkilno skupino, potem nastane zmes karboksilnih kislin:

Če pa je alken tetrasubstituiran pri dvojni vezi keton:

Veliko večji preparativni pomen ima reakcija ozonolize alkenov. Dolga desetletja je ta reakcija služila kot glavna metoda za določanje strukture matičnega alkena. To reakcijo izvedemo s prehajanjem toka raztopine ozona v kisiku, raztopine alkena v metilen kloridu ali etil acetatu pri -80 ... -100 ° C. Mehanizem te reakcije je ugotovil Krige:


Ozonidi so nestabilne spojine, ki eksplozivno razpadejo. Obstajata dva načina razgradnje ozonida - oksidativni in reduktivni.
Med hidrolizo se ozonidi razgradijo na karbonilne spojine in vodikov peroksid. Vodikov peroksid oksidira aldehide v karboksilne kisline - to je oksidativna razgradnja:

Veliko bolj pomembna je redukcijska cepitev ozonidov. Produkti ozonolize so aldehidi ali ketoni, odvisno od strukture izhodnega alkena:
Poleg zgornjih metod obstaja še ena metoda, ki jo je leta 1955 predlagal Lemieux:
Pri Lemieuxovi metodi ni delovno intenzivnih postopkov za ločevanje manganovega dioksida, ker dioksid in manganat ponovno oksidirata perjodat v permanganatni ion. To omogoča uporabo le katalitskih količin kalijevega permanganata.
4.5. Oksidacija alkenov
Oksidacijske reakcije alkenov je priporočljivo razdeliti v dve veliki skupini: reakcije, pri katerih se ohrani ogljikov skelet, in reakcije oksidativnega uničenja ogljikovega skeleta molekule pri dvojni vezi. Prva skupina reakcij vključuje epoksidacijo in hidroksilacijo, ki vodi do tvorbe vicinalnih diolov (glikolov). V primeru cikličnih alkenov hidroksilacija proizvaja vicinal trans- ali cis-dioli. Druga skupina vključuje ozonolizo in reakcije izčrpne oksidacije alkenov, ki vodijo do nastanka različnih vrst karbonilnih spojin in karboksilnih kislin.
4.5.a. Oksidacijske reakcije alkenov z ohranitvijo ogljikovega skeleta
1. Epoksidacija (reakcija N.A. Priležajeva, 1909)
Aciklični in ciklični alkeni pri reakciji s perkislinami (perkislinami) RCOOOH v nepolarnem, indiferentnem okolju tvorijo epokside (oksirane), zato se sama reakcija imenuje reakcija epoksidacije.
Po sodobni nomenklaturi IUPAC- tričlenski obroč z enim atomom kisika imenujemo oksiran.
Epoksidacijo alkenov je treba obravnavati kot sinhron, usklajen proces, v katerem ionski intermediati, kot je hidroksil kation OH+, ne sodelujejo. Z drugimi besedami, epoksidacija alkenov je proces sin- vezava enega atoma kisika na dvojno vez s popolno ohranitvijo konfiguracije substituentov na dvojni vezi.

Za epoksidacijo je bil predlagan mehanizem, značilen za usklajene procese.

Ker je napad dvojne vezi s kisikovim atomom perkisline enako verjeten na obeh straneh ravnine dvojne vezi, so nastali oksirani bodisi meso-oblike ali zmesi enantiomerov. Kot epoksidanti se uporabljajo naslednje perkisline: perbenzojska, m-kloroperbenzojsko, monoperftalno, perocetno, trifluoroperocetno in performinsko. Perkisline aromatskega niza uporabljamo v obliki posameznih reagentov, medtem ko perkisline alifatskega niza - CH 3 CO 3 H, CF 3 CO 3 H in HCO 3 H ne izoliramo v samostojni obliki, ampak jih uporabljamo po nastanku v interakcija 30% ali 90% vodikovega peroksida in ustrezne karboksilne kisline. Perbenzoin in m-kloroperbenzojsko kislino dobimo z oksidacijo benzojske in m-klorobenzojske kisline s 70% vodikovim peroksidom v raztopini metansulfonske kisline ali iz kislinskih kloridov teh kislin in vodikovega peroksida.


Monoperftalno kislino pridobivajo po podobni metodi iz anhidrida ftalne kisline in 30% vodikovega peroksida.

Sprva so za pridobivanje oksiranov (epoksidov) uporabljali perbenzojsko ali monoperftalno kislino:

Trenutno se za epoksidacijo najpogosteje uporablja m- kloroperbenzojska kislina. Za razliko od drugih perkislin je dolgotrajno stabilen (do 1 leta) in je popolnoma varen za uporabo. Dobitki oksiranov, dobljenih z oksidacijo acikličnih in cikličnih alkenov m-kloroperbenzojske kisline v raztopini metilen klorida, kloroforma ali dioksana so običajno precej visoke.



Perkisline pogosto nastanejo neposredno v reakcijski mešanici 90 % vodikovega peroksida in karboksilne kisline v metilen kloridu.


Alkeni z dvojno vezjo, konjugirano na karbonilno skupino ali drug akceptorski substituent, so neaktivni in je za njihovo oksidacijo bolje uporabiti močnejša oksidanta, kot je trifluoroperocetna kislina, pridobljena iz anhidrida trifluoroocetne kisline in 90 % vodikovega peroksida v metilen kloridu. Najenostavnejši oksiran, etilen oksid, se industrijsko proizvaja z oksidacijo etilena s kisikom v prisotnosti srebra kot katalizatorja.

2. proti- Hidroksilacija
Tričlenski obroč oksiranov se zlahka odpre pod vplivom najrazličnejših nukleofilnih reagentov. Te reakcije bodo podrobno obravnavane v poglavju o acikličnih in cikličnih etrih. Tu bo obravnavana le hidroliza oksiranov. Hidrolizo oksiranov katalizirajo tako kisline kot baze. V obeh primerih nastanejo vicinalni dioli, tj. glikoli. Pri kislinski katalizi se v prvi stopnji oksiranski atom kisika protonira, da nastane ciklični oksonijev kation, ki se odpre kot posledica nukleofilnega napada molekule vode:

Ključni korak pri odpiranju obroča, ki določa hitrost celotnega procesa, je nukleofilni napad vode na protonirano obliko oksirana. Mehansko gledano je ta proces podoben odprtju bromonijevega iona po nukleofilnem napadu bromidnega iona ali drugega nukleofilnega sredstva. S teh položajev bi moral biti stereokemični rezultat tvorba trans-glikoli med razpadom cikličnih epoksidov. Dejansko se med kislinsko katalizirano hidrolizo cikloheksen oksida ali ciklopenten oksida izključno trans-1,2-dioli.

Tako dvostopenjski proces epoksidacije alkena, ki mu sledi kislinska hidroliza epoksida na splošno ustreza reakciji proti- hidroksilacija alkenov.
Obe stopnji proti-hidroksilacijo alkenov lahko kombiniramo, če alken obdelamo z vodnim 30-70% vodikovim peroksidom v mravljični ali trifluoroocetni kislini. Obe kislini sta dovolj močni, da povzročita odprtje oksiranskega obroča.

Bazično katalizirano odpiranje oksiranskega obroča vodi tudi do tvorbe cikličnega trans- glikoli.

Zato je dvostopenjski proces epoksidacije alkenov, ki mu sledi alkalna hidroliza epoksidov, tudi reakcija proti- hidroksilacija alkenov.
3. sin- Hidroksilacija
Nekatere soli in oksidi prehodnih kovin v višjih oksidacijskih stopnjah so učinkoviti reagenti sin-hidroksilacija dvojne vezi alkena, ko sta obe hidroksilni skupini dodani na isto stran dvojne vezi. Oksidacija alkenov s kalijevim permanganatom je ena najstarejših metod sin- hidroksilacija dvojne vezi se še naprej pogosto uporablja kljub inherentnim omejitvam. Cis-1,2-cikloheksandiol je prvi pridobil V.V. Markovnikov leta 1878 s hidroksilacijo cikloheksena z vodno raztopino kalijevega permanganata pri 0 0 C.

Ta metoda je bila kasneje razvita v delih ruskega znanstvenika E.E. Wagner torej sin-hidroksilacijo alkenov pod delovanjem vodne raztopine kalijevega permanganata imenujemo Wagnerjeva reakcija. Kalijev permanganat je močno oksidacijsko sredstvo, ki lahko ne le hidroksilira dvojno vez, ampak tudi cepi nastali vicinalni diol. Da bi se čim bolj izognili nadaljnji razgradnji glikolov, je treba reakcijske pogoje skrbno nadzorovati. Dobitki glikolov so običajno nizki (30-60%). Najboljše rezultate dosežemo s hidroksilacijo alkenov v rahlo alkalnem okolju (pH ~ 8 9) pri 0-5 0 C z razredčeno 1% vodno raztopino KMnO 4.


Na začetku pri oksidaciji alkenov s kalijevim permanganatom nastane ciklični ester manganove kisline, ki se takoj hidrolizira v sosednji diol.

Cikličnega estra manganove kisline kot intermediata nismo izolirali, vendar njegov nastanek izhaja iz poskusov z označenim 18 O kalijevim permanganatom: oba atoma kisika v glikolu se izkažeta za označena med oksidacijo alkena KMn 18 O 4. To pomeni, da se oba atoma kisika preneseta iz oksidanta in ne iz topila - vode, kar se dobro ujema s predlaganim mehanizmom.
Druga metoda sin-hidroksilacijo alkenov pod vplivom osmijevega (VIII) oksida OsO 4 je leta 1936 predlagal R. Kriege. Osmijev tetroksid je brezbarvna, hlapna, kristalinična snov, dobro topna v etru, dioksanu, piridinu in drugih organskih topilih. Pri reakciji osmijevega tetroksida z alkeni v etru ali dioksanu nastane črna oborina estra ciklične osmske kisline - osmata, ki jo zlahka izoliramo v posamezni obliki. Adicija OsO 4 na dvojno vez se opazno pospeši v raztopini v piridinu. Razpad osmatov v vicinalne glikole dosežemo z delovanjem vodne raztopine natrijevega hidrosulfita ali vodikovega sulfida.

Izkoristek izdelka sin-hidroksilacija alkenov pri tej metodi je bistveno večja kot pri uporabi permanganata kot oksidanta. Pomembna prednost metode Krige je odsotnost produktov oksidativne cepitve alkenov, kar je značilno za oksidacijo permanganata.


Osmijev tetroksid je zelo drag in težko dostopen reagent, poleg tega pa je toksičen. Zato se osmijev (VIII) oksid uporablja pri sintezi majhnih količin težko dostopnih snovi, da bi dobili največji izkoristek diola. Da poenostavim sin-hidroksilacija alkenov pod vplivom OsO 4, je bila razvita tehnika, ki omogoča uporabo samo katalitskih količin tega reagenta. Hidroksilacija alkenov se izvaja z vodikovim peroksidom v prisotnosti OsO 4, na primer:

Za zaključek tega razdelka predstavljamo stereokemične odnose med alkenom cis- ali trans-konfiguracija in konfiguracija nastalega vicinalnega diola, ki se lahko cis- ali trans- izomer, eritro- ali trio- oblika, meso- ali D,L-oblika glede na substituente v alkenu:

Podobna stereokemična razmerja opazimo pri drugih reakcijah sin- ali proti- adicija pri večkratnih vezeh vodika, vodikovih halogenidov, vode, halogenov, borovih hidridov in drugih reagentov.
Sestavljanje enačb redoks reakcij z organskimi snovmi
IN zaradi uvoda kot edine oblike končno spričevalo diplomanti Srednja šola samski državni izpit(UPORABA) in prehod Srednja šola Za specializirano usposabljanje postaja vse bolj pomembna priprava srednješolcev za opravljanje najbolj »dragih« točkovalnih nalog dela »C«. Preizkus enotnega državnega izpita v kemiji. Čeprav pet nalog v delu C velja za različne: kemijske lastnosti anorganske snovi, verige transformacij organskih spojin, računski problemi - vsi so tako ali drugače povezani posebej z redoks reakcijami (ORR). Če ste obvladali osnovno znanje teorije ODD, potem lahko pravilno opravite prvo in drugo nalogo v celoti, tretjo pa delno. Prav v tem je po našem mnenju pomemben del uspeha opravljenega dela “C”. Izkušnje kažejo, da če se dijaki pri študiju anorganske kemije precej dobro spopadejo z nalogami pisanja OVR enačb, jim podobne naloge pri organski kemiji povzročajo velike težave. Zato skozi celoten tečaj organske kemije v specializiranih razredih skušamo pri srednješolcih razvijati veščine sestavljanja OVR enačb.
Pri študiju primerjalne značilnosti anorganskih in organskih spojin študente seznanimo z uporabo oksidacijskega stanja (s.o.) (v organski kemiji predvsem ogljik) in metodami za njegovo določanje:
1) izračun povprečne s.o. ogljik v molekuli organske snovi;
2) opredelitev s.o. vsak atom ogljika.
Naj pojasnimo, v katerih primerih je bolje uporabiti eno ali drugo metodo.
Članek je bil objavljen ob podpori podjetja GEO-Engineering, ki na trgu zastopa izdelke pod blagovno znamko ProfKresla. Področje delovanja podjetja je proizvodnja, prodaja in montaža foteljev in stolov za različne dvorane. Visoka strokovnost naših zaposlenih in lastne proizvodne zmogljivosti nam omogočajo hitro in učinkovito izvedbo projektov katere koli kompleksnosti. Vsi izdelki blagovne znamke ProfKresla, pa naj gre za gledališke stole, čakalnice ali stole za izobraževalne ustanove, odlikuje sodoben in ergonomski dizajn ter visoka odpornost proti obrabi, vzdržljivost in udobje. Iz široke palete izdelkov, predstavljenih v katalogu na spletnem mestu profkresla.ru, lahko vedno izberete modele, ki najbolj ustrezajo slogu podjetja, sprejetemu v vašem podjetju. Če imate še vedno težave z izbiro, so strokovnjaki podjetja vedno pripravljeni svetovati, vam pomagati pri odločitvi za model, nato pripraviti projekt in izvesti vse potrebne meritve in montažo na mestu.
p Pri preučevanju teme "Alkani" pokažemo, da procesi oksidacije, zgorevanja, halogeniranja, nitracije, dehidrogenacije in razgradnje spadajo med redoks procese. Pri pisanju enačb za reakcije gorenja in razgradnje organskih snovi je bolje uporabiti povprečno vrednost d.o. ogljik. Na primer:
Pozorni smo na prvo polovico ravnotežja elektronov: ogljikov atom ima delno d.o. imenovalec je 4, zato izračunamo prenos elektronov s tem koeficientom.
V drugih primerih pri preučevanju teme "Alkani" določimo vrednosti d.o. vsak atom ogljika v spojini, pri tem pa učence opozoriti na zaporedje zamenjave vodikovih atomov pri primarnih, sekundarnih, terciarnih atomih ogljika:


Tako učence pripeljemo do zaključka, da najprej pride do procesa substitucije na terciarnih atomih ogljika, nato na sekundarnih atomih ogljika in nazadnje na primarnih atomih ogljika.
p Pri preučevanju teme "Alkeni" upoštevamo oksidacijske procese glede na strukturo alkena in reakcijsko okolje.
Ko alkene oksidiramo s koncentrirano raztopino kalijevega permanganata KMnO 4 v kislem okolju (trda oksidacija), se - in - vezi prekinejo, da nastanejo karboksilne kisline, ketoni in ogljikov monoksid (IV). Ta reakcija se uporablja za določanje položaja dvojne vezi.
Če je dvojna vez na koncu molekule (na primer v butenu-1), potem je eden od produktov oksidacije mravljinčna kislina, ki se zlahka oksidira v ogljikov dioksid in vodo:

Poudarjamo, da če v molekuli alkena atom ogljika pri dvojni vezi vsebuje dva substituenta ogljika (na primer v molekuli 2-metilbuten-2 ), potem med njegovo oksidacijo nastane keton, saj preoblikovanje takega atoma v atom karboksilne skupine je nemogoče brez prekinitve vezi C–C, relativno stabilne pod temi pogoji:

Pojasnjujemo, da če je molekula alkena simetrična in je dvojna vez v sredini molekule, potem med oksidacijo nastane samo ena kislina:

Obveščamo vas, da je značilnost oksidacije alkenov, pri kateri ogljikovi atomi na dvojni vezi vsebujejo dva ogljikova radikala, nastanek dveh ketonov:


Pri obravnavi oksidacije alkenov v nevtralnih ali rahlo alkalnih medijih srednješolce opozorimo na dejstvo, da v takšnih pogojih oksidacijo spremlja tvorba diolov (dihidričnih alkoholov), tem ogljikovim atomom pa se dodajo hidroksilne skupine. med katerima je bila dvojna vez:

IN Na podoben način obravnavamo oksidacijo acetilena in njegovih homologov, odvisno od okolja, v katerem proces poteka. Torej, pojasnjujemo, da v kislem okolju proces oksidacije spremlja tvorba karboksilnih kislin:

Reakcija se uporablja za določanje strukture alkinov na podlagi njihovih oksidacijskih produktov:

V nevtralnih in rahlo alkalnih okoljih oksidacijo acetilena spremlja tvorba ustreznih oksalatov (soli oksalne kisline), oksidacijo homologov pa spremlja pretrganje trojne vezi in tvorba soli karboksilne kisline:

IN Vsa pravila se izvajajo s študenti na konkretnih primerih, kar vodi k boljši asimilaciji teoretičnega gradiva. Zato lahko dijaki pri proučevanju oksidacije arenov v različnih okoljih samostojno sklepajo, da je v kislem okolju pričakovati nastanek kislin, v alkalnem pa soli. Učitelj bo moral le pojasniti, kateri reakcijski produkti nastanejo glede na strukturo ustrezne arene.
S primeri pokažemo, da homologi benzena z eno stransko verigo (ne glede na njeno dolžino) oksidirajo z močnim oksidantom v benzojsko kislino pri -ogljikovem atomu. Pri segrevanju se homologi benzena oksidirajo s kalijevim permanganatom v nevtralnem okolju, da nastanejo kalijeve soli aromatskih kislin.
5C 6 H 5 –CH 3 + 6KMnO 4 + 9H 2 SO 4 = 5C 6 H 5 COOH + 6MnSO 4 + 3K 2 SO 4 + 14H 2 O,
5C 6 H 5 –C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 = 5C 6 H 5 COOH + 5CO 2 + 12MnSO 4 + 6K 2 SO 4 + 28H 2 O,
C 6 H 5 –CH 3 + 2KMnO 4 = C 6 H 5 COOK + 2MnO 2 + KOH + H 2 O.
Poudarjamo, da če je v molekuli arena več stranskih verig, se v kislem okolju vsaka od njih oksidira na a-ogljikovem atomu v karboksilno skupino, kar povzroči nastanek polibazičnih aromatskih kislin:

p Pridobljene veščine pri sestavljanju enačb ORR za ogljikovodike omogočajo njihovo uporabo pri preučevanju razdelka »Spojine, ki vsebujejo kisik«.
Tako študentje pri preučevanju teme "Alkoholi" samostojno sestavijo enačbe za oksidacijo alkoholov po naslednjih pravilih:
1) primarni alkoholi se oksidirajo v aldehide
3CH 3 –CH 2 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 = 3CH 3 –CHO + K 2 SO 4 + Cr 2 (SO 4) 3 + 7H 2 O;
2) sekundarni alkoholi se oksidirajo v ketone

3) reakcija oksidacije ni značilna za terciarne alkohole.
Da bi se pripravili na Enotni državni izpit za učitelja O teh nepremičninah je priporočljivo navesti dodatne informacije, ki bodo nedvomno koristne za študente.
Ko metanol oksidiramo z nakisano raztopino kalijevega permanganata ali kalijevega dikromata, nastane CO 2; primarni alkoholi med oksidacijo lahko, odvisno od reakcijskih pogojev, tvorijo ne le aldehide, ampak tudi kisline. Na primer, oksidacija etanola s kalijevim dikromatom na hladnem se konča s tvorbo ocetne kisline in pri segrevanju acetaldehida:
3CH 3 –CH 2 OH + 2K 2 Cr 2 O 7 + 8H 2 SO 4 = 3CH 3 –COOH + 2K 2 SO 4 + 2Cr 2 (SO 4) 3 + 11H 2 O,
3CH 3 –CH 2 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 3CH 3 –CHO + K 2 SO 4 + Cr 2 (SO 4) 3 + 7H 2 O.
Ponovno spomnimo učence na vpliv okolja na produkte reakcij oksidacije alkohola, in sicer: vroča nevtralna raztopina KMnO 4 oksidira metanol v kalijev karbonat, preostale alkohole pa v soli ustreznih karboksilnih kislin:

Pri preučevanju teme "Aldehidi in ketoni" študente osredotočamo na dejstvo, da se aldehidi lažje oksidirajo kot alkoholi v ustrezne karboksilne kisline ne le pod vplivom močnih oksidantov (kisik v zraku, nakisane raztopine KMnO 4 in K 2 Cr 2 O 7), vendar in pod vplivom šibkega (amoniakova raztopina srebrovega oksida ali bakrovega (II) hidroksida):
5CH 3 –CHO + 2KMnO 4 + 3H 2 SO 4 = 5CH 3 –COOH + 2MnSO 4 + K 2 SO 4 + 3H 2 O,
3CH 3 –CHO + K 2 Cr 2 O 7 + 4H 2 SO 4 = 3CH 3 –COOH + Cr 2 (SO 4) 3 + K 2 SO 4 + 4H 2 O,
CH 3 –CHO + 2OH CH 3 –COONH 4 + 2Ag + 3NH 3 + H 2 O.
Posebno pozornost namenjamo oksidaciji metanala z amonijevo raztopino srebrovega oksida, ker v tem primeru nastane amonijev karbonat in ne mravljinčna kislina:
HCHO + 4OH = (NH 4) 2 CO 3 + 4Ag + 6NH 3 + 2H 2 O.
Kot kažejo naše dolgoletne izkušnje, predlagana metodologija za poučevanje srednješolcev o sestavljanju enačb ORR z organskimi snovmi povečuje njihovo končno Rezultat enotnega državnega izpita pri kemiji za nekaj točk.







