공유 결합. 분자의 구조
6.2.1. 차이에 의한 화학 결합의 유형 결정
결합을 형성하는 원자의 전기 음성도
다양한 유형의 화학 결합의 형성은 원자가 전자를 제공하거나 끌어 당기는 능력에 달려 있습니다. 이 능력은 전기 음성도(EO) 값이 특징입니다. EO가 높을수록. 전자를 끌어당기는 원자의 능력이 더 커집니다. 결합을 형성하는 두 원자 사이의 EO 차이(ΔEO)가 0이면(ΔEO = 0), 그러한 결합은 비극성 공유결합입니다. 0시< ΔЭО < 2 связь полярная ковалентная. Ионная связь образуется при Δ ЭО > 2.
실시예 3 화합물 KC1, H 2, SO 2에 어떤 유형의 결합이 있는지 결정하십시오.
해결책. 각 원자에 대한 EO 값(부록, 표 A4)을 사용하여 ΔEO를 찾습니다.
이 경우 ΔEO 값이 가장 크기 때문에 Na-H 결합이 가장 극성입니다.
6.2.2. 결합 쌍극자와 분자의 전기 모멘트 찾기
결합과 분자의 극성을 평가하기 위해 쌍극자의 전기 모멘트 μ가 사용되며, 이는 쌍극자의 길이와 전하의 곱과 같습니다. 큐 (큐\u003d 1.602 10 -19 C), 즉 μ = 1 큐. 극성 결합과 분자의 경우 μ > 0, 비극성 분자의 경우 μ = 0. 쌍극자의 전기 모멘트 - 부호가 같고 반대인 두 전하의 시스템 -은 양전하에서 음전하로 향하는 벡터 양입니다. μ의 단위는 Debye( 디): 디= 3.33 · 10 -30 Kl · m 이원자 분자의 쌍극자의 전기 모멘트는 결합 쌍극자의 전기 모멘트와 같습니다. 다원자 분자의 쌍극자의 전기 모멘트는 모든 결합의 쌍극자의 전기 모멘트의 벡터 합과 같습니다.
실시예 5 결합 μ가 1.9인 경우 HF 분자 쌍극자의 전기 모멘트와 그 방향을 결정하십시오. 디(부록, 표 P5).
해결책. HF 분자는 이원자이며 선형 구조를 가지고 있습니다: H–F. 따라서 결합 쌍극자의 전기 모멘트는 분자 쌍극자의 전기 모멘트(1.91 디) 양전하를 가진 수소에서 음의 불소(H®F)(EO H = 2.1, EO F = 4.0)로 향합니다.
실시예 6 BeH 2 분자는 선형 구조를 가지고 있습니다. 결합각 H–Be–H는 180°입니다. Be-H 결합은 극성입니다(EO Be = 1.5, EO H = 2.1). H 2 O 분자는 각진 구조를 가지고 있습니다(H-O-H 결합 각도는 104°30"). H-O 결합은 극성입니다(EO H = 2.1; EO O = 3.5). 두 분자 모두 극성이 될까요?
해결책. BeH 2 분자에서 결합은 극성이고 Be–H 2 결합 쌍극자의 전기 모멘트 벡터는 (+)에서 (-), 즉 EO가 낮은 베릴륨에서 EO가 높은 수소, 즉 H. 크기가 같고 부호가 반대인 결합 쌍극자의 전기적 모멘트의 벡터 합은 0입니다. 따라서 분자는 비극성(= 0)입니다.
H 2 O 분자에서 극성 H-O 결합은 104°30"의 각도에 위치합니다(그림 1). 따라서 결합 쌍극자의 전기 모멘트는 서로쌀. 1. 쌍극자의 전기적 모멘트
H 2 O 분자
해결책. 전하 큐\u003d 1.602 10-19C. 분자 쌍극자의 전기 모멘트는 다음 공식으로 구할 수 있습니다.
μ = 1 큐\u003d 1.602 10-19 3.37 10-11 \u003d 5.4 10-30Cm (1.63 디).
답: 5.4 10 -30 C m. = (1.63 디).
6.2.3. 원자가 결합 방법에 의한 분자 구조 설명(BC)
VS 방법에 의한 분자의 형성은 교환 또는 공여체-수용체 메커니즘에 따라 발생할 수 있습니다. 첫 번째는 1전자 원자 궤도의 중첩을 기반으로 합니다. 두 번째는 전자쌍을 가진 도너 원자와 자유 원자 궤도를 가진 억셉터 원자의 존재와 관련이 있습니다.
실시예 8 NH 3 분자의 화학 결합 형성과 교환 메커니즘에 따른 구조를 설명하십시오.
해결책 . 교환 메커니즘에 의한 NH 3 분자의 화학 결합 형성을 설명하려면 질소와 수소 원자의 전자식을 작성할 필요가 있습니다. 원자가 전자와 각 원자의 공유 원자가를 결정합니다.
질소 7 N 1 에스 2 2에스 2 2아르 자형 3 – 아르 자형에스 2 2아르 자형삼 . 원자의 공유 원자수는 3이다.  . 따라서 3개의 공유 결합이 형성됩니다.
. 따라서 3개의 공유 결합이 형성됩니다.
수소 1시간 1 에스 1 – 에스에스하나 ; 공유 원자가 1이면 원자는 하나의 공유 결합을 형성합니다.
세 개의 단일 전자 아르 자형- 질소 원자와 하나의 전자의 궤도 에스는 세 개의 수소 원자 각각의 궤도입니다. 겹침 s-p오비탈은 가장 큰 신장 방향으로 발생합니다. 아르 자형- 90°의 각도로 위치한 우주의 궤도. 겹친 후 NH3 분자의 모양은 107°20"의 H–N–H 결합 각도를 갖는 삼각 피라미드입니다(그림 2).
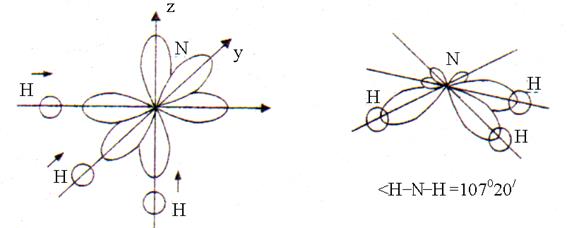
쌀. 2. 암모니아 분자의 구조
90°에서 각도의 편차는 NH 결합이 극성이라는 사실 때문입니다(EO N = 3.0, EO H = 2.1). 결합 전자쌍은 수소 원자에서 질소 원자로 약간 이동합니다(EO N > EO H). 따라서 양전하를 띤 수소 원자와 3개의 NH 결합의 전자쌍은 서로 반발하여 결합각이 107°20"로 증가합니다.
실시예 9 도너-수용체 메커니즘에 의해 암모니아 분자 NH 3 와 수소 이온 H + 로부터 암모늄 이온 NH 4 +의 형성을 설명하십시오.
해결책. 교환 메커니즘에 의한 NH 3 분자의 결합 형성은 실시예 8에 주어진다. 설명에서 다음과 같이 3가 1전자로 인해 교환 메커니즘에 의해 3개의 공유 결합이 형성된다 아르 자형- 질소 원자의 궤도. 그러나 또한 질소 원자는 원자가 2 전자도 가지고 있습니다. 에스-궤도(2 에스 2) 억셉터에 대해 도너가 될 수 있는 자유 궤도를 갖는 수소 이온. 따라서 질소 원자는 공여체-수용체 메커니즘에 의해 네 번째 공유 결합을 형성할 수 있습니다. 암모늄 이온 NH 4 +에서 네 번째 공유 결합(공여체-수용체)의 형성은 다음 반응식으로 나타낼 수 있습니다.
기증자 수락자
암모늄 이온은 사면체 모양을 하고 있기 때문에 에스 1 아르 자형 3 혼성화(섹션 6.2.4 참조).
6.2.4. 원자 궤도의 혼성화 유형 결정
VS 방법에 따른 분자의 공간적 구성
실시예 10 원자 궤도의 혼성화 유형, BH 3 분자의 공간 구성 및 극성을 결정하십시오.
해결책.
보르: 5Vl 에스 2 2에스 2 2피 1 – 아르 자형-요소; 원자가 전자 2 에스 2 2피하나 ; 정상(여기되지 않은) 상태에서 원자의 공유 원자수는 1과 같습니다.  .
.
수소 1시간 1 에스 1 – 에스-요소; 원자가 전자 1 에스하나 ; 짝수는 1과 같습니다. 정상 상태에서 붕소 원자는 짝을 이루지 않은 하나의 화학 결합으로 인해 하나의 화학 결합만 형성할 수 있습니다. 아르 자형-전자. 그러나 ВН 3 분자의 구성은 붕소가 3개의 화학 결합을 형성함을 나타냅니다. 그것의 covalence는 3입니다. 이것은 원자가 정상 상태에서 여기 상태로 이동할 때 가능합니다(그림 3).
쌀. 3. 붕소 원자의 하이브리드 오비탈 형성
3개의 하이브리드 오비탈이 공간에서 서로 120°의 각도로 대칭적으로 배열되고 정삼각형의 꼭짓점을 향합니다. 붕소 원자의 3개의 하이브리드 오비탈이 전자 한 개와 함께 형성 에스-3개의 수소 원자의 궤도는 정삼각형 모양을 갖는 ВН 3 분자의 3개의 화학 결합입니다(그림 4).
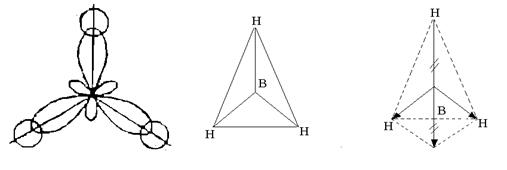
쌀. 4. ВН 3 분자의 구조
B-H 결합이 극성이라는 사실에도 불구하고(EO B = 2.0; EO H = 2.1), 분자는 비극성입니다. 대칭적인 구조를 가지고 있습니다. 3개의 B-H 결합 쌍극자의 전기적 모멘트의 결과 벡터 합은 0과 같습니다(그림 4 참조).
원자 궤도의 혼성화는 분자와 이온의 공간 구성을 결정합니다(표 2).
표 2
일부 분자 및 이온의 공간 구조
6.2.5. 분자 궤도법(MO)에 의한 B2형 이원자 분자의 형성 및 특성 설명
MO 방법에 따르면 분자에는 원자 궤도(AO)가 없지만 AO의 선형 결합(혼합)에 의해 얻어지는 결합 및 느슨한 MO가 있습니다. 조합으로 N AO가 형성된다 N MO, 바인더의 수는 AO 에너지의 수와 같습니다. 결합하는 MO의 에너지는 AO의 에너지보다 작고, 느슨한 MO의 에너지는 AO의 에너지보다 큽니다. MO에 전자를 배치하는 순서는 AO의 경우와 동일합니다. 우선 파울리의 원리와 훈트의 법칙에 따라 저에너지의 MO를 채워넣는다(최소에너지 원리).
MO 형성의 가장 간단한 경우는 동일한 원소(B 2 )의 두 원자의 AO가 결합될 때 발생합니다. 두가지 조합으로 봄 여름 시즌 AO, σ(시그마) 오비탈이라고 하는 두 개의 MO가 형성됩니다. 그 중 하나는 바인딩()이고 다른 하나는 느슨해짐()입니다. 두 개의 s-MO도 두 가지를 결합하여 얻습니다. 피 x - 피 x AO( 및 ). 둘의 조합 r y - r y그리고 두 피 z - 피 z AO, 두 개의 p st -MO( 및 ) 및 두 개의 p 곱하기 -MO( 및 )가 형성됩니다.
원자로부터 MO의 형성과 그 에너지의 변화는 에너지 다이어그램으로 나타낼 수 있으며, 여기서 궤도의 에너지 값은 수직선을 따라 표시됩니다(그림 5).
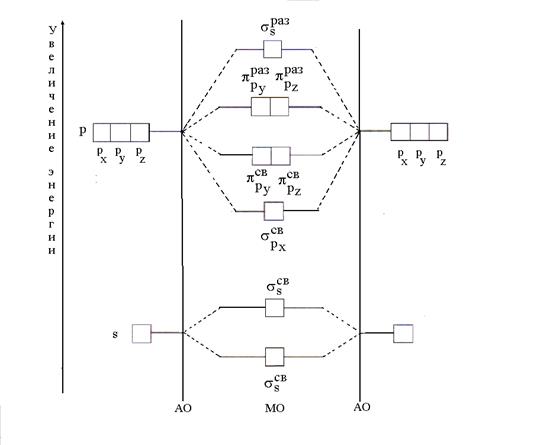
쌀. 도 4 5. 동일한 원소의 두 원자의 AO 조합에서 MO 형성을 위한 에너지 계획(B 2)
MO 방법을 사용하면 분자의 자기를 결정할 수 있습니다. 따라서 분자에 짝을 이루지 않은 전자가 있으면 상자성이 결정되고 이러한 전자가 없으면 반자성을 유발합니다. MO 방법을 사용하여 연결의 다중성을 찾을 수 있습니다. 다중도 w는 결합에 있는 전자 수의 반차와 같습니다. N sv 및 풀기 N시간 모:
결합 및 이완 MO의 전자 수가 같으면 결합 다중도는 0입니다. 따라서 이러한 전자는 화학 결합의 형성에 영향을 미치지 않습니다.
MO 방법은 또한 분자의 안정성을 설명할 수 있습니다. 분자의 안정성은 모든 결합 및 느슨한 전자의 에너지 균형과 관련이 있습니다. 잠정적으로 하나의 이완 전자는 하나의 결합 전자의 작용을 무효화하는 것으로 간주될 수 있습니다. 따라서 결합 MO에 더 많은 전자가 있고 느슨한 MO에 전자가 적을수록 분자가 더 안정적입니다.
예 11. MO법을 사용하여 O 2 분자의 형성을 설명하십시오. 결합의 다중도와 자기력을 결정하십시오.
해결책. O 2 분자는 동일한 원소인 산소 원자로 구성됩니다. 전자식은 다음과 같습니다. 8 O 1 에스 2 2에스 2 2피네 . 산소 원자 2의 원자가 전자 에스 2 2피 4 화학 결합의 형성에 참여합니다. MO는 2의 선형 조합으로 얻습니다. 에스- 그리고 2 아르 자형- 2개의 산소 원자의 AO.
산소 분자에서 12개의 원자가 전자의 분포는 최소 에너지의 원리에 따라 발생합니다. 첫째, MO는 각각 역평행 스핀을 가진 두 개의 전자로 채워져 있습니다(Pauli 원리). 그런 다음 6개의 전자가 각각 역평행 스핀을 갖는 2개의 전자와 함께 3개의 결합 MO( ; ; )에 배치됩니다. 나머지 2개의 전자는 Hund의 법칙에 따라 평행한 스핀을 갖는 반결합 MO( 및 )를 각각 차지할 것입니다. MO에 전자를 배치한 후 산소 분자의 에너지 다이어그램은 다음과 같은 형태를 갖습니다(그림 6).
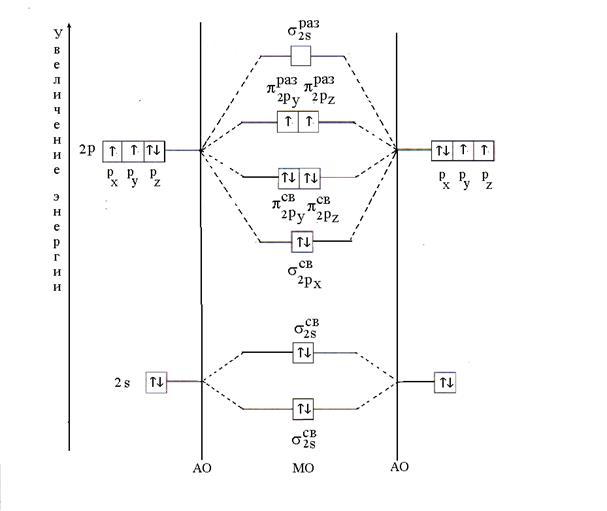
쌀. 6. O 2 분자의 에너지 다이어그램
화학식 2로 계산된 산소 분자의 결합 다중도는 2와 같습니다. 두 개의 짝을 이루지 않은 전자의 존재는 분자의 상자성을 결정합니다.
제어 작업
101. 에틴(아세틸렌) C 2 H 2 분자에는 탄소 원자 사이에 삼중 결합이 있습니다: 1개의 s 결합과 2개의 p 결합. 중첩으로 인해 두 개의 p 결합이 형성됩니다. r y - r y그리고 두 피 z - 피 z원자 궤도. s 본드는 어떻게 발생합니까? s 결합이 형성되는 동안 혼성화의 유형을 결정하십시오. ethine 분자의 구조를 그리고 표의 데이터를 사용하여 결합 에너지를 계산하십시오. 삼.
답: Δ 시간= – 245kJ/mol.
102. MO 에너지 도표를 사용하여 분자가 불안정하고 이온이 안정적인 이유를 설명하십시오. 두 경우 모두에서 관계의 다중도를 계산합니다. 로 갈 때 화학 결합의 에너지가 어떻게 그리고 왜 변합니까?
103. BC법을 사용하여 H 2 O 분자의 화학 결합 형성을 설명하십시오. 분자의 공간 구성을 그립니다. 표 2의 데이터를 사용하여 H-O 결합 길이를 계산합니다. 답: 0.97 10 -10 m.
104. BC법에 따른 CH 4 분자의 구조를 설명하십시오. 화학 결합 형성의 혼성화 유형을 결정하십시오. 표 4의 데이터를 사용하여 분자의 결합이 공유 극성임을 증명하십시오. 분자 쌍극자의 전기 모멘트가 0인 이유는 무엇입니까? . 어떤 원자가 도너 역할을 하고 어떤 원자가 억셉터 역할을 합니까?
108. BC법에 따른 CCl 4 분자의 구조를 설명하십시오. 화학 결합 형성의 혼성화 유형을 결정하십시오. 표 1의 데이터를 사용하여 이 분자의 C–Cl 결합 길이를 계산합니다. 2. 답: 1.765 10 -10 m.
109. BC법에 따른 CO 2 분자의 구조를 설명하십시오. 분자의 공간 구성을 그립니다. 화학 결합 형성의 혼성화 유형을 결정하십시오. 표의 데이터를 사용합니다. 4, 공유 결합이 극성임을 증명하십시오. CO 2 분자가 비극성인 이유는 무엇입니까?
110. BF 3 분자는 평면 삼각형 배열을 갖고 NF 3은 벌크(피라미드) 배열을 갖는다. BC법을 이용하여 이들 분자의 구조가 다른 이유를 설명하시오. 어떤 분자가 비극성이며 그 이유는 무엇입니까? 분자 쌍극자의 전기 모멘트 값으로 결과를 확인하십시오(표 5 참조).
111. CH 4 분자와 이온은 동일한 공간 배열을 갖는다. 이것은 중심 원자의 원자 궤도의 혼성화의 관점에서 어떻게 설명될 수 있습니까? CH 4 분자의 쌍극자의 전기 모멘트가 0인 이유는 무엇입니까?
112. 원자가 결합 방법을 사용하여 에탄 분자 C 2 H 6 (H 3 C-CH 3)의 구조를 설명하십시오. 화학 결합 혼성화의 유형은 무엇입니까? 기체 탄소와 수소로부터 C 2 H 6 형성의 표준 엔탈피가 -2798.8 kJ/mol이고 C-H 결합 에너지가 -411.3 kJ/mol이면 C-C 결합 에너지를 계산하십시오.
답: Δ 시간= - 331.0kJ/mol.
113. BC 방법을 사용하여 H 2 O 및 H 2 S 분자가 각진 구조를 갖는 반면 결합각은 왜 있는지 설명하십시오.<(H–O–H) = 104 0 30¢ больше валентного угла <(H–S–H) = 92 0 . На основании данных табл.5 вычислите длины диполей молекул и покажите направления электрических моментов диполей связей в них.
답: 3.83 10 -11 및 1.55 10 -11 m.
114. BC법을 사용하여 PCl 3 와 AlCl 3 분자의 구조를 설명하십시오. 분자의 기하학적 구성의 차이점은 무엇입니까? PCl 3 분자는 극성이고 AlCl 3 는 전기 쌍극자 모멘트가 0인 이유는 무엇입니까?
115. BC법을 사용하여 CS 2 분자의 구조를 설명하십시오. 교잡 유형을 결정하십시오. 분자의 기하학적 구성은 무엇입니까? 쌍극자의 전기 모멘트가 0인 이유는 무엇입니까?
; . 관계의 다양성을 계산하고 그 중 어느 것이 가장 안정적인지 결정하십시오.120. MO 방법에 따라 에너지 다이어그램을 구성하십시오. ; . 결합 다중도와 자기 특성을 계산합니다.







