9.2 표준 수소 전극. 전극 전위.
2개의 전극으로 구성된 회로의 EMF를 고정밀도로 측정할 수 있습니다. 그러나 금속-용액 계면에서 절대 전위차를 측정하거나 계산하는 것은 불가능합니다. 실용적인 목적을 위해 표준 전극으로 선택된 특정 전극의 전위를 지칭하는 다양한 전극의 전위를 특성화하는 조건부 값을 갖는 것으로 충분합니다.
같이 조건부 0 선택한 용량 표준 수소 전극의 전위:
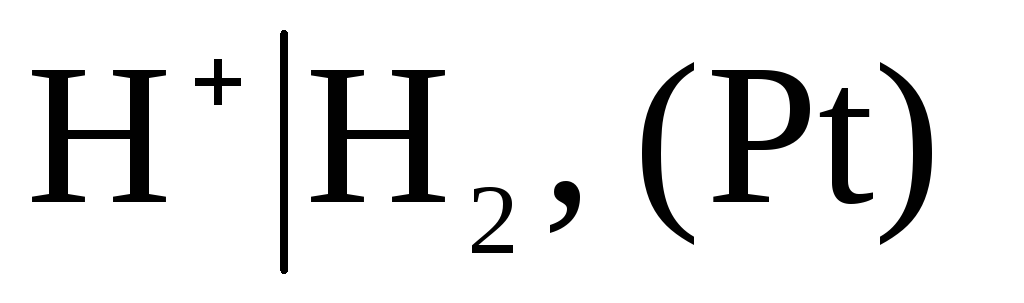 ,
,
취입된 수소의 압력은 1기압이고 용액에서 수소 이온의 활성은 1과 같습니다(그림 1). 어떤 온도에서도 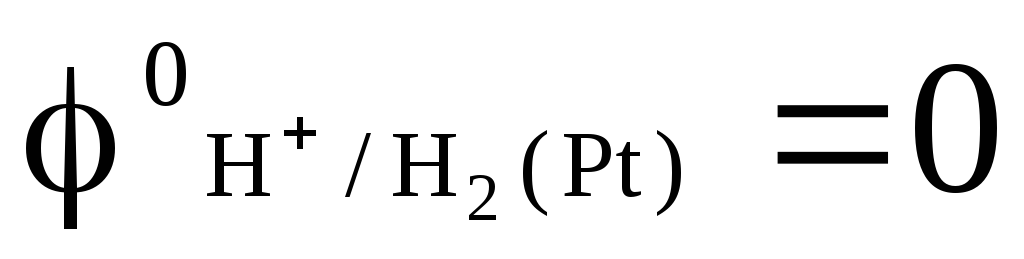 .
.
수소 전극에 대한 전극 반응은 다음과 같이 작성됩니다.
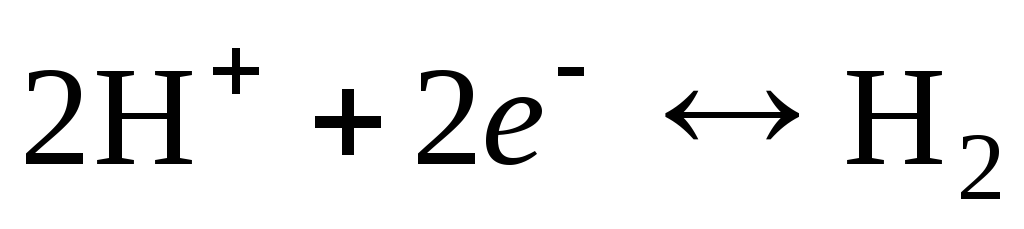 .
.
![]()
쌀. 1. 수소전극의 전체적인 모습.
모든 전극의 전극 전위에 대해 고려된 전극과 표준 수소 전극으로 구성된 회로의 EMF를 취하기로 결정했습니다. 이 경우 고려중인 전극은 회로의 오른쪽에 위치하고 표준 수소 전극은 왼쪽에 있습니다.
예시 9.1. Cu 2+ / Cu 및 Zn 2+ / Zn 전극의 표준 전극 전위를 결정하기 위해 GE를 구성합니다.
1). 표준 수소 및 구리 전극으로 갈바니 전지를 구성해 보겠습니다.
총 전위 형성 반응: 즉. 회로에서 전자의 이동은 왼쪽에서 오른쪽으로(왼쪽 전극에서 오른쪽으로) 발생합니다. 표준 조건에서 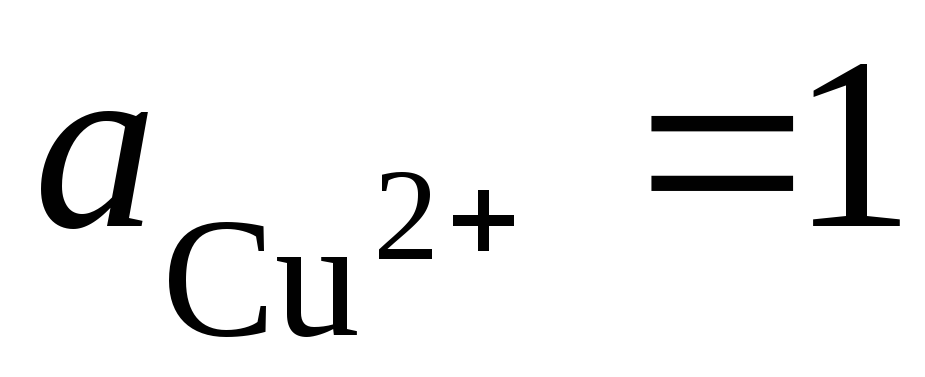 , 이 요소의 EMF는 E = 0.337V가 됩니다. 따라서,
, 이 요소의 EMF는 E = 0.337V가 됩니다. 따라서,
![]() .
.
2). 비슷한 방식으로 표준 수소 및 아연 전극으로 만든 갈바니 전지를 남겨 둡니다.
총 반응: 즉 회로에서 전자의 이동은 오른쪽에서 왼쪽으로 발생합니다. 표준 조건에서 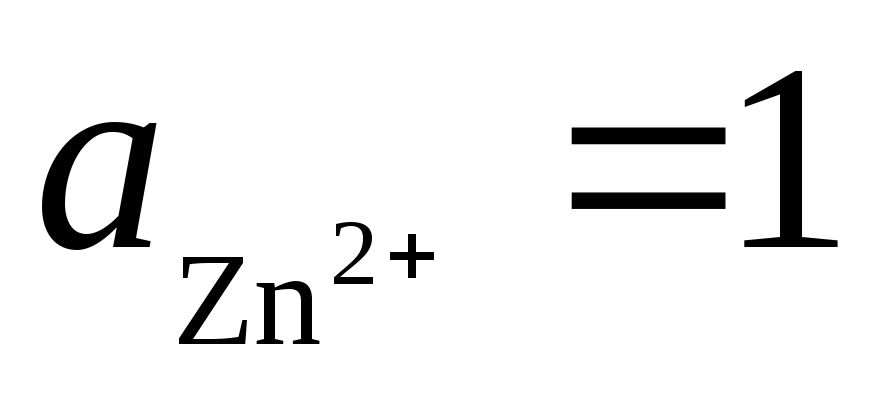
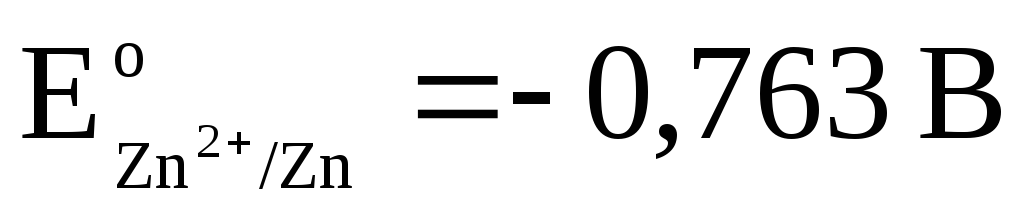 .
.
9.3 갈바니 전지의 기전력에 대한 Nernst 방정식.
전극의 전기적 특성은 전극 전위, 및 갈바니 전지(전기화학 회로) - 기전력(EMF),
확산 전위가 없는 상태에서 올바르게 열린 전기화학 회로의 EMF는 오른쪽(양) 전극과 왼쪽(음) 전극 사이의 전위차에 해당하며 항상 양입니다.
갈바니 전지의 EMF
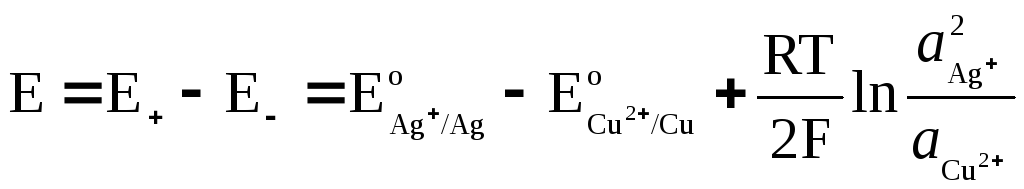
어디 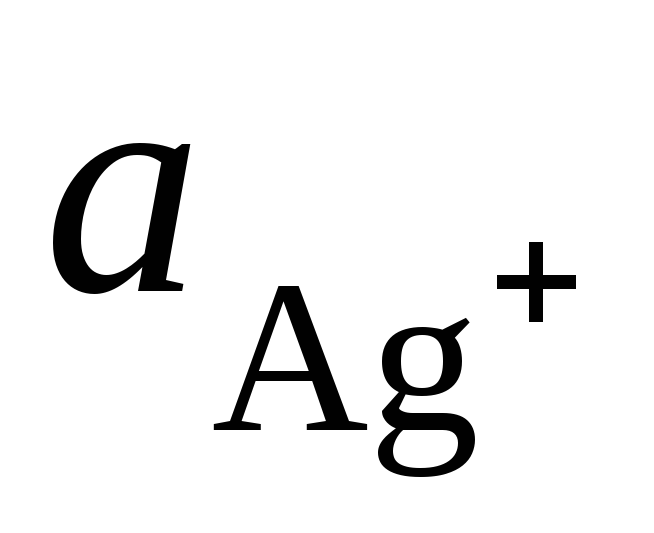 그리고
그리고 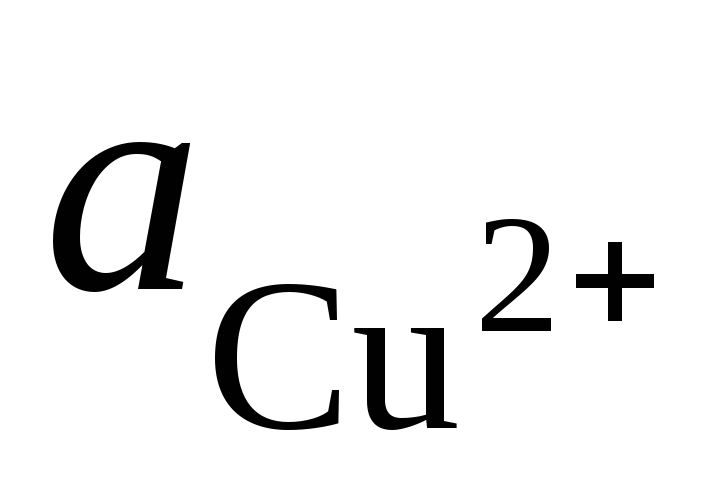 - 그들의 염 용액에서 Ag + 및 Cu 2+ 이온의 활성.
- 그들의 염 용액에서 Ag + 및 Cu 2+ 이온의 활성.
우리는 나타냅니다
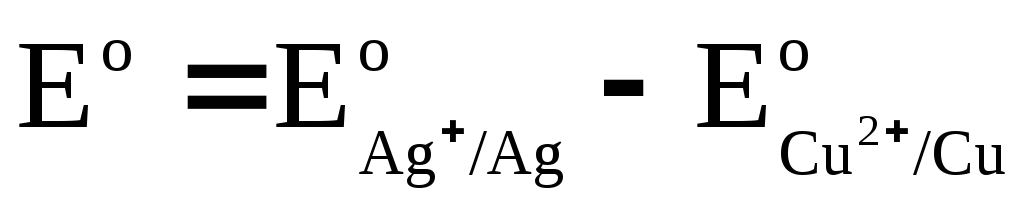 ,
,
어디 이자형 o - 갈바니 전지의 표준 EMF. 그 다음에
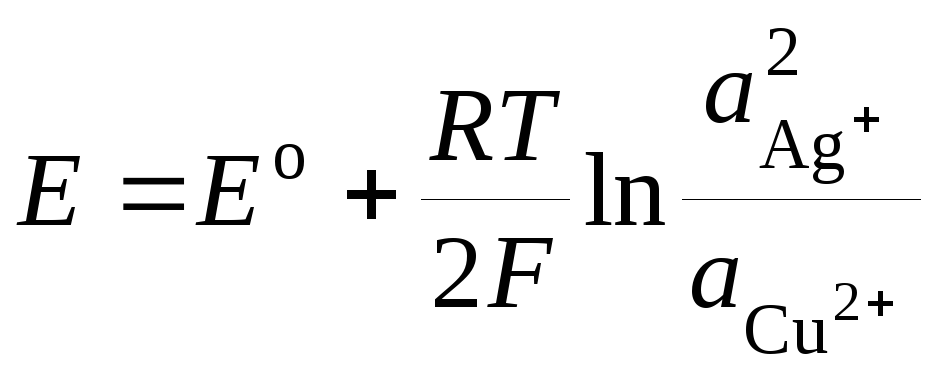 .(3)
.(3)
식 (3)은 갈바니 전지의 EMF에 대한 Nernst 방정식.
갈바니 전지에서 가역적인 화학 반응이 일어나는 경우
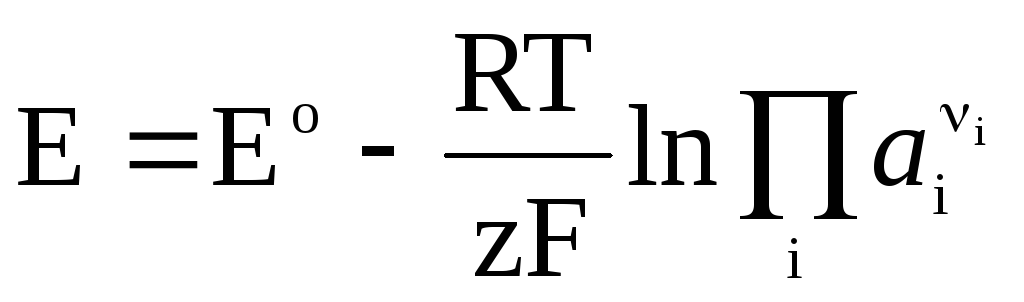 , (4)
, (4)
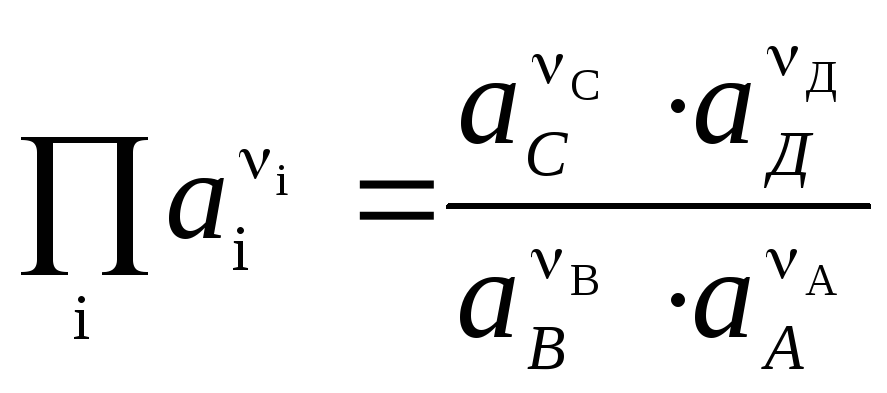
형식 (4)의 Nernst 방정식은 모든 갈바니 전지의 EMF(총 화학 반응에 의한)와 모든 전극의 전위(전극 반응에 의한)를 계산하는 데 적용할 수 있습니다. EMF는 반응의 열역학적 특성과 관련이 있습니다. 그것은 알려져있다
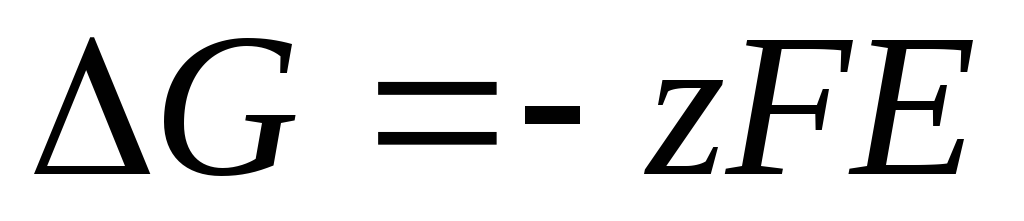 .
.
9.4 가역 전극의 분류.
가역 전극의 분류는 전위 결정 과정과 관련된 물질의 특성을 기반으로 합니다.
1. 첫 번째 종류의 전극.
일류 전극금속 전극은 양이온(아말감 포함)에 대해 가역적입니까? 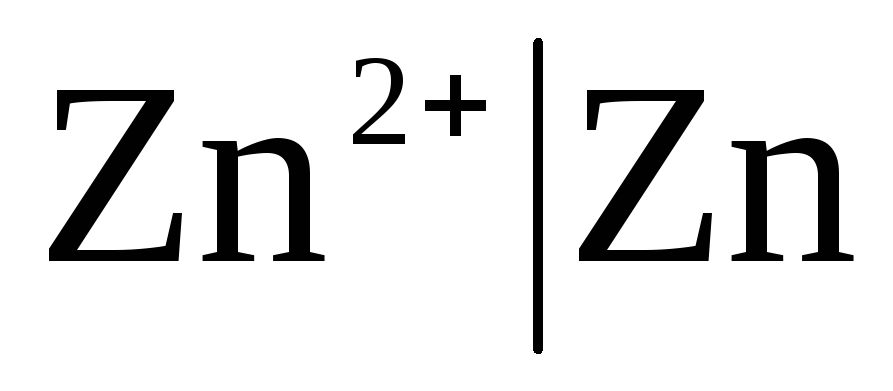 ) 및 준금속, 전극은 음이온(
) 및 준금속, 전극은 음이온( 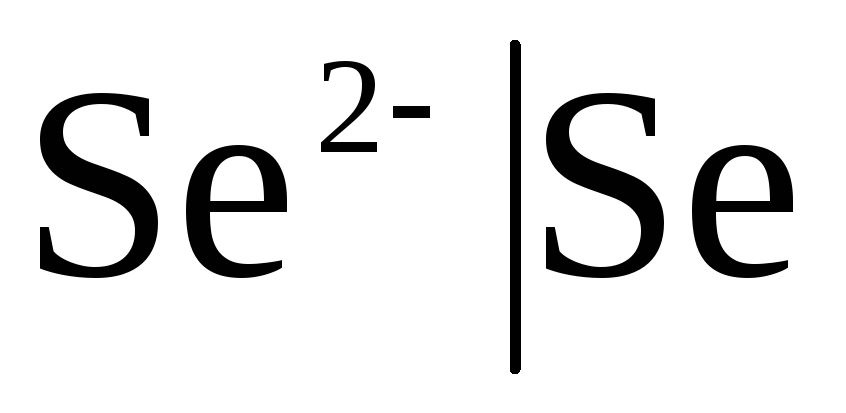 ).
).
전극이 Zn 2+ / Zn 양이온에 대해 가역적이라면 다음과 같이 쓸 수 있습니다.
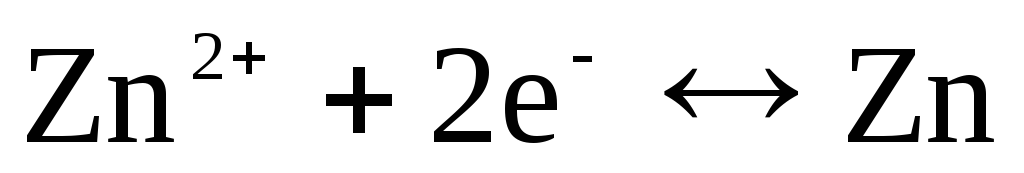 ,
,
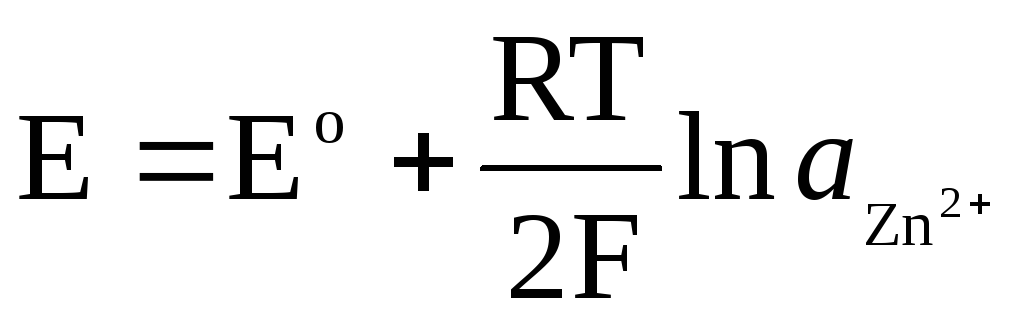
Zn 2+ / Zn(Hg) 아말감 전극의 경우:
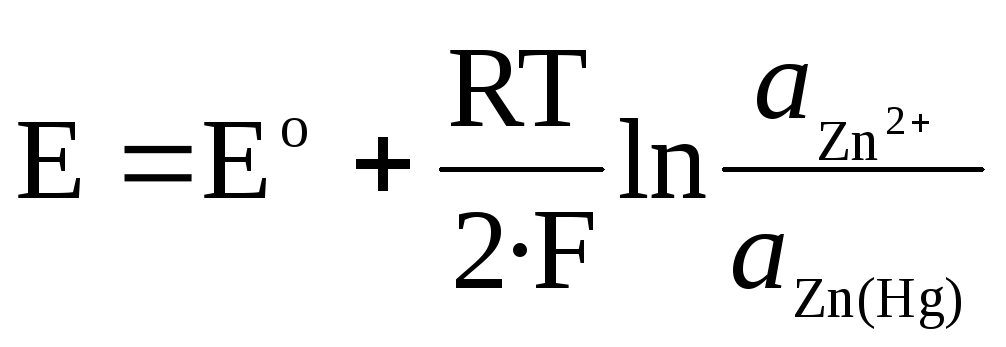 .
.
전극이 음이온에 대해 가역적이라면,
![]() ,
,
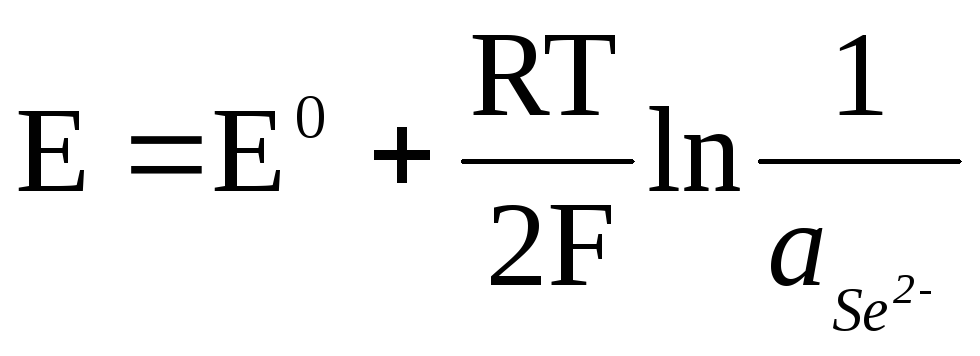 .
.
첫 번째 종류의 전극은 다음을 포함합니다. 가스전극(수소 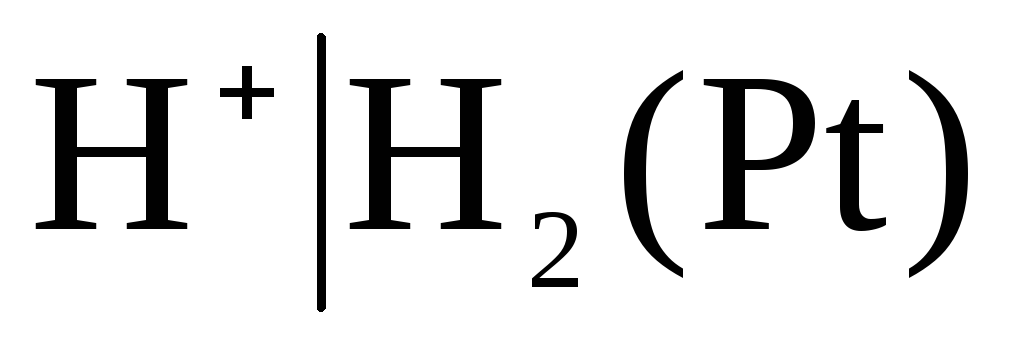 , 염소
, 염소 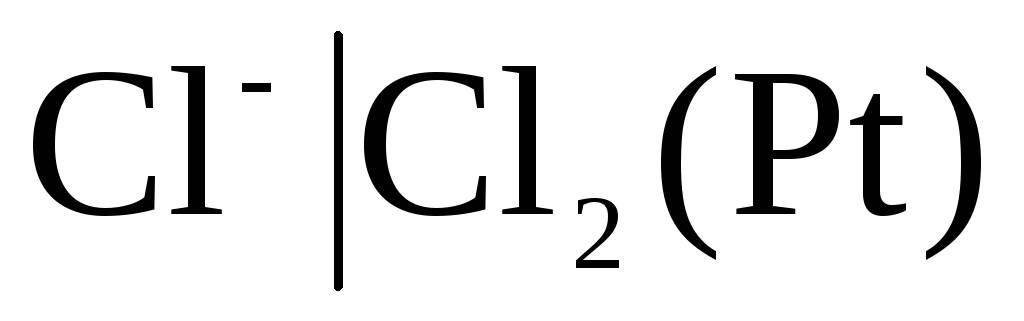 등). 양이온(H +) 또는 음이온(Cl -)에 대해 가역적일 수 있습니다. 예를 들어, 수소 전극은 양이온에 대해 가역적입니다. 전극 공정의 방정식은 다음과 같은 형식으로 작성할 수 있습니다.
등). 양이온(H +) 또는 음이온(Cl -)에 대해 가역적일 수 있습니다. 예를 들어, 수소 전극은 양이온에 대해 가역적입니다. 전극 공정의 방정식은 다음과 같은 형식으로 작성할 수 있습니다.
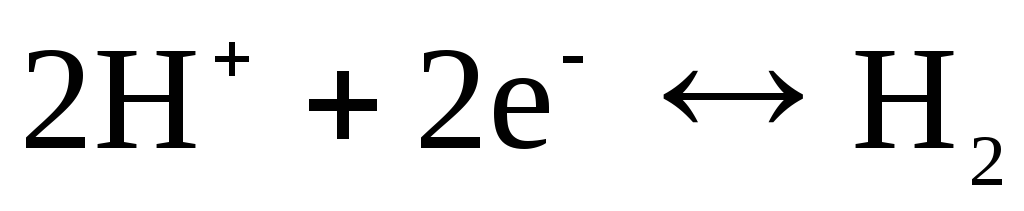 .
.
수소 전극의 전위는 다음 식에 의해 결정됩니다.
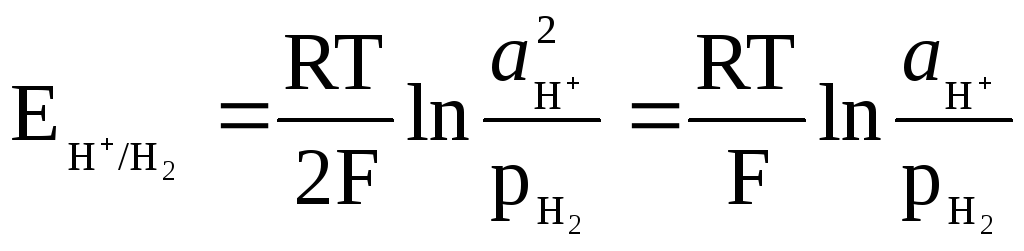 ,
,
용액의 pH와 관련될 수 있습니다.
염소 전극용 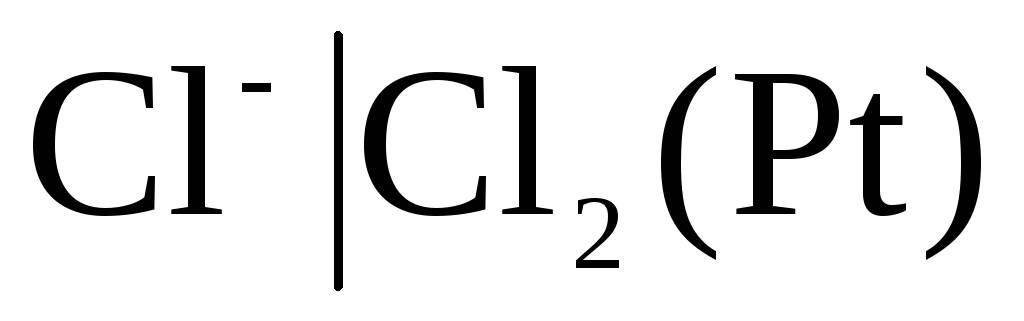 잠재적으로 결정적인 반응으로
잠재적으로 결정적인 반응으로
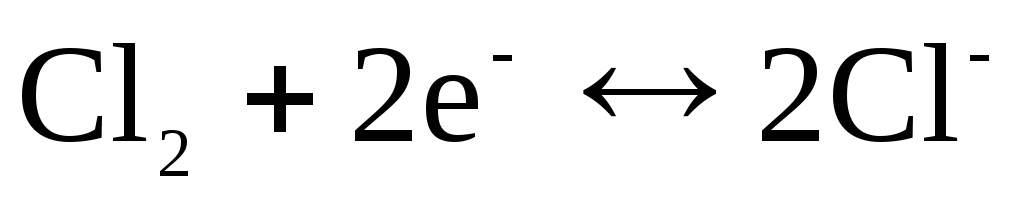 .
.
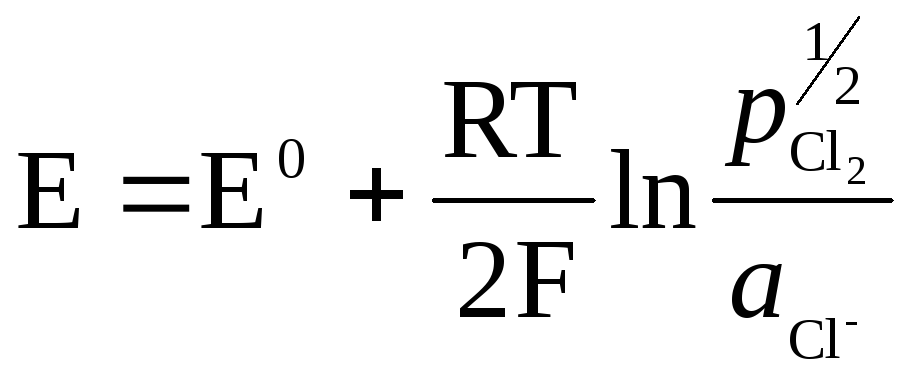
가스 전극의 금속(Pt)은 가스와 용액 사이의 접촉을 생성하는 데 필요하고 용액의 물질에 대해 불활성이어야 하며 단 하나의 전위 결정 과정을 촉매할 수 있습니다.







