4. 화학 반응 속도에 대한 온도의 영향
정성적 고려에서, 반응 속도는 온도가 증가함에 따라 증가해야 한다는 것이 분명합니다. 이것은 충돌하는 입자의 에너지를 증가시키고 충돌이 화학적 변형을 초래할 가능성을 높입니다. 화학 역학에서 온도 효과에 대한 정량적 설명을 위해 Van't Hoff 규칙과 Arrhenius 방정식의 두 가지 기본 관계가 사용됩니다.
반트 호프의 법칙약 섭씨 10도까지 가열하면 대부분의 화학 반응 속도가 2~4배 증가한다는 사실에 있습니다. 수학적으로 이것은 반응 속도가 멱법칙 방식으로 온도에 의존한다는 것을 의미합니다.
![]() , (4.1)
, (4.1)
여기서 속도의 온도 계수(= 24)입니다. Van't Hoff의 법칙은 매우 거칠고 매우 제한된 온도 범위에서만 적용됩니다.
훨씬 더 정확한 것은 아레니우스 방정식속도 상수의 온도 의존성 설명:
![]() , (4.2)
, (4.2)
어디 아르 자형- 보편적인 기체 상수; ㅏ- 온도에 의존하지 않고 반응 유형에 의해서만 결정되는 사전 지수 인자; 에이 - 활성화 에너지, 특정 임계 에너지로 특징지을 수 있습니다. 대략적으로 말하자면, 충돌하는 입자의 에너지가 더 적은 경우 에이, 충돌 시 에너지가 초과하면 반응이 일어나지 않습니다. 에이, 반응이 일어날 것입니다. 활성화 에너지는 온도와 무관합니다.
그래픽 중독 케이(티) 다음과 같이:
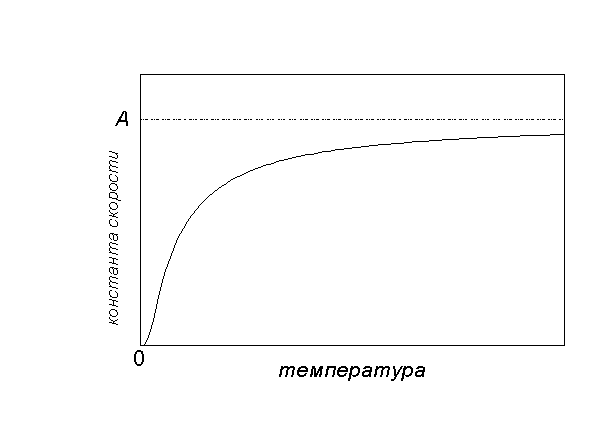
저온에서는 화학 반응이 거의 발생하지 않습니다. 케이(티) 0. 매우 높은 온도에서 속도 상수는 다음과 같은 한계값에 도달하는 경향이 있습니다. 케이(티)ㅏ... 이것은 모든 분자가 반응성이고 각 충돌이 반응을 일으킨다는 사실에 해당합니다.
활성화 에너지는 두 온도에서 속도 상수를 측정하여 결정할 수 있습니다. 식 (4.2)는 다음을 의미합니다.
![]() . (4.3)
. (4.3)
보다 정확하게는 활성화 에너지는 여러 온도에서 속도 상수 값에서 결정됩니다. 이를 위해 Arrhenius 방정식(4.2)은 로그 형식으로 작성됩니다.
![]()
좌표 ln에 실험 데이터 쓰기 케이 - 1/티... 결과 직선의 경사각의 접선은 - 에이 / 아르 자형.
일부 반응의 경우 전지수 인자는 온도에 약하게 의존합니다. 이 경우 이른바 실험적 활성화 에너지:
![]() . (4.4)
. (4.4)
전지수 인자가 일정하면 실험적 활성화 에너지는 Arrhenius 활성화 에너지와 같습니다. 이자형 op = 에이.
예 4-1. Arrhenius 방정식을 사용하여 Van't Hoff 규칙이 유효한 온도와 활성화 에너지를 추정합니다.
해결책. Van't Hoff 규칙(4.1)을 비율 상수의 거듭제곱 법칙 종속성으로 나타냅니다.
![]() ,
,
어디 비- 상수 값. ~의 값을 취하여 이 식을 Arrhenius 방정식(4.2)과 비교합시다. 이자형 = 2.718:
![]() .
.
이 근사 평등의 양변에 자연 로그를 취하십시오.
![]() .
.
얻어진 비율을 온도에 대해 미분하면 활성화 에너지와 온도 사이에 원하는 관계를 찾을 수 있습니다.
활성화 에너지와 온도가 이 비율을 거의 만족한다면 반호프 법칙을 사용하여 온도가 반응 속도에 미치는 영향을 추정할 수 있습니다.
예 4-2. 70 ° C의 온도에서 1 차 반응은 60 분 안에 40 %로 완료됩니다. 활성화 에너지가 60kJ/mol인 경우 120분 동안 반응이 80% 완료되는 온도는 몇 도입니까?
해결책. 1차 반응의 경우 속도 상수는 다음과 같이 전환율로 표현됩니다.
![]() ,
,
여기서 a = 엑스/ㅏ- 전환 정도. Arrhenius 방정식을 고려하여 두 가지 온도에서 이 방정식을 작성합니다.
어디 에이= 60kJ/몰, 티 1 = 343K, 티 1 = 60분, a 1 = 0.4, 티 2 = 120분, a 2 = 0.8. 한 방정식을 다른 방정식과 로그로 나눕니다.
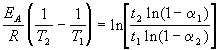
위의 값을 이 표현식에 대입하면 티 2 = 333K = 60℃
예 4-3. -1.1 o C의 온도에서 +2.2 o C의 온도로 갈 때 물고기 근육의 박테리아 가수분해 속도는 두 배가 됩니다. 이 반응의 활성화 에너지를 추정하십시오.
해결책. 가수분해 속도의 2배 증가는 속도 상수의 증가로 인한 것입니다. 케이 2 = 2케이하나 . 두 온도에서 속도 상수의 비율에 대한 활성화 에너지는 식 (4.3)에서 다음과 같이 결정될 수 있습니다. 티 1 = 티 1 + 273.15 = 272.05K, 티 2 = 티 2 + 273.15 = 275.35K:
![]() 130800J/mol = 130.8kJ/mol.
130800J/mol = 130.8kJ/mol.
4-1. Van't Hoff 규칙을 사용하여 20 ° C에서 2 시간이 걸리는 경우 반응이 15 분 후에 끝나는 온도를 계산하십시오. 속도의 온도 계수는 3입니다. (답)
4-2. 323K에서 물질의 반감기는 100분이고 353K에서는 15분입니다. 속도의 온도 계수를 결정하십시오.(답)
4-3. 300 K에서 온도가 10 0 С a) 증가할 때 반응 속도가 3배 증가하기 위한 활성화 에너지는 얼마입니까? b) 1000K에서? (답변)
4-4. 1차 반응은 25kcal/mol의 활성화 에너지와 5의 사전 지수 인자를 갖습니다. 10 13초 -1. 이 반응의 반감기는 어떤 온도에서: a) 1분; b) 30일? (답)
4-5. 0 o C에서 10 o C로 가열하거나 10 o C에서 20 o C로 가열할 때 두 가지 경우 중 반응 속도 상수가 더 많이 증가하는 경우는 어느 것입니까? Arrhenius 방정식을 사용하여 답을 정당화합니다.(답)
4-6. 어떤 반응의 활성화 에너지는 다른 반응의 활성화 에너지보다 1.5배 더 높습니다. 에서 가열될 때 티 1 ~ 티 2 두 번째 반응의 속도 상수는 다음과 같이 증가했습니다. ㅏ한번. 에서 가열했을 때 첫 번째 반응의 속도 상수는 몇 배 증가했습니까? 티 1 ~ 티 2? (대답)
4-7. 복합 반응의 속도 상수는 다음과 같이 기본 단계의 속도 상수로 표현됩니다.
복잡한 반응의 활성화 에너지와 전지수 인자를 기본 단계에 해당하는 양으로 표현하십시오. (답)
4-8. 125℃에서 20분 동안의 비가역적 1차 반응에서 출발 물질의 전환율은 60%였고, 145℃에서 5.5분 내에 동일한 전환율이 달성되었다. 이 반응의 속도상수와 활성화 에너지를 구하라.(대답)
4-9. 25 ° C의 온도에서 1 차 반응은 30 분 안에 30 %로 완료됩니다. 활성화 에너지가 30kJ/mol인 경우 40분 동안 60% 반응이 완료되는 온도는 몇 도입니까? (답)
4-10. 25 ° C의 온도에서 1 차 반응은 15 분 안에 70 %로 완료됩니다. 활성화 에너지가 50kJ/mol이면 몇 도에서 15분 동안 50% 반응이 완료됩니까? (답)
4-11. 1차 반응 속도 상수는 4.02입니다. 393K 및 1.98에서 10 -4초 -1. 10 -3 s -1 at 413 K. 이 반응에 대한 사전 지수 인자를 계산하십시오.(답)
4-12. 반응 H 2 + I 2 2HI의 경우, 683K의 온도에서 속도 상수는 0.0659L/(mol min)이고 716K - 0.375L/(mol min)의 온도에서입니다. 이 반응의 활성화 에너지와 700K의 온도에서 속도 상수를 구하십시오. (답)
4-13. 2N 2 O 2N 2 + O 2 반응의 경우 986K의 온도에서 속도 상수는 6.72L/(mol min)이고 1165K - 977.0L/(mol min)의 온도에서 속도 상수입니다. 이 반응의 활성화 에너지와 1053.0 K의 온도에서 속도 상수를 구하십시오. (답)
4-14. H +를 포함하는 이온화 용매의 트리클로로아세테이트 이온은 방정식에 따라 분해됩니다.
H + + CCl 3 COO - CO 2 + CHCl 3
반응 속도를 결정하는 단계는 트리클로로아세테이트 이온에서 C-C 결합의 단분자 절단입니다. 반응은 1차에 따라 진행되며 속도상수는 다음과 같은 의미를 갖는다. 케이= 3.11. 90 о С에서 10 -4 초 -1, 케이= 7.62. 80 o C에서 10 -5 s -1. a) 활성화 에너지, b) 60 o C에서 속도 상수를 계산합니다. (답)
4-15. 반응 CH 3 COOC 2 H 5 + NaOH * CH 3 COONa + C 2 H 5 OH의 경우 282.6K에서 속도 상수는 2.307L/(mol/min)이고 318.1K에서 21.65L/(mol/min)입니다. 이 반응의 활성화 에너지와 343K의 온도에서 속도 상수를 구하십시오. (답)
4-16. C 12 H 22 O 11 + H 2 OC 6 H 12 O 6 + C 6 H 12 O 6 반응의 경우, 298.2K의 온도에서 속도 상수는 0.765L/(mol.min)이고, 328.2K - 35.5L/(몰/분). 이 반응의 활성화 에너지와 313.2K의 온도에서 속도 상수를 구하십시오. (답)
4-17. 물질은 속도 상수를 사용하여 두 개의 평행 경로로 분해됩니다. 케이 1 및 케이 2. 10 o C에서 이 두 반응의 활성화 에너지의 차이는 얼마입니까? 케이 1 /케이 2 = 10, 40 o C에서 케이 1 /케이 2 = 0.1? (답변)
4-18. 같은 차수의 두 반응에서 활성화 에너지의 차이는 다음과 같습니다. 이자형 2 - 이자형 1 = 40kJ/몰. 293K의 온도에서 속도 상수의 비율은 다음과 같습니다. 케이 1 /케이 2 = 2. 속도 상수는 어떤 온도에서 같습니까? (답변)
4-19. 수용액에서 아세톤 디카르복실산의 분해는 1차 반응입니다. 이 반응의 속도 상수는 다양한 온도에서 측정되었습니다.
활성화 에너지와 사전 지수 인자를 계산합니다. 25 ° C에서 반감기는 얼마입니까?







