une liaison covalente. La structure des molécules
6.2.1. Détermination du type de liaison chimique par différence
électronégativité des atomes formant une liaison
La formation de divers types de liaisons chimiques dépend de la capacité des atomes à donner ou à attirer des électrons. Cette capacité est caractérisée par la valeur de l'électronégativité (EO). Plus l'OE est élevé. plus la capacité des atomes à attirer les électrons est grande. Si la différence EO (ΔEO) entre deux atomes formant une liaison est nulle (ΔEO = 0), alors une telle liaison est covalente non polaire. À 0< ΔЭО < 2 связь полярная ковалентная. Ионная связь образуется при Δ ЭО > 2.
Exemple 3 Déterminez quel type de liaison se trouve dans les composés KC1, H 2, SO 2.
Solution. En utilisant les valeurs de EO pour chaque atome (annexe, tableau A4), nous trouvons ΔEO.
La liaison Na – H est la plus polaire, puisque dans ce cas la valeur ΔEO est la plus grande.
6.2.2. Trouver le moment électrique d'un dipôle de liaison et d'une molécule
Pour évaluer la polarité de la liaison et de la molécule, on utilise le moment électrique du dipôle μ, qui est égal au produit de la longueur du dipôle et de la charge électrique q (q\u003d 1,602 10 -19 C), c'est-à-dire µ = 1 q. Pour les liaisons polaires et les molécules μ > 0, pour les non polaires μ = 0. Le moment électrique d'un dipôle - un système de deux charges électriques de signe égal et opposé - est une quantité vectorielle dirigée d'une charge positive vers une charge négative. L'unité de μ est Debye ( ré): ré= 3,33 · 10 –30 Kl · M. Le moment électrique du dipôle d'une molécule diatomique est égal au moment électrique du dipôle de la liaison. Le moment électrique du dipôle d'une molécule polyatomique est égal à la somme vectorielle des moments électriques des dipôles de toutes les liaisons.
Exemple 5 Déterminer le moment électrique du dipôle de la molécule HF et sa direction si la liaison μ est égale à 1,9 ré(Annexe, Tableau P5).
Solution. La molécule HF est diatomique et a une structure linéaire : H–F. Par conséquent, le moment électrique du dipôle de la liaison est égal au moment électrique du dipôle de la molécule (1,91 ré) et est dirigé de l'hydrogène, qui a une charge positive, vers le fluor négatif : H®F (EO H = 2,1 ; EO F = 4,0).
Exemple 6 La molécule BeH 2 a une structure linéaire. L'angle de liaison H–Be–H est de 180°. Les liaisons Be–H sont polaires (EO Be = 1,5 ; EO H = 2,1). La molécule H 2 O a une structure angulaire (l'angle de la liaison H-O-H est de 104°30"). Les liaisons H-O sont polaires (EO H = 2,1 ; EO O = 3,5). Les deux molécules seront-elles polaires ?
Solution. Dans la molécule BeH 2 , les liaisons sont polaires et le vecteur moment électrique du dipôle de la liaison Be–H 2 est dirigé de (+) vers (–), c'est-à-dire du béryllium avec un EO inférieur à l'hydrogène avec un EO supérieur, à savoir H. La somme vectorielle des moments électriques des dipôles de liaison, qui sont égaux en amplitude et opposés en signe, est égale à zéro. Par conséquent, la molécule est non polaire (= 0).
Dans la molécule H 2 O, les liaisons polaires H – O sont situées à un angle de 104 ° 30 "(Fig. 1). Par conséquent, leurs moments électriques des dipôles des liaisons ne se font pas mutuellementRiz. 1. Moment électrique du dipôle
Molécules H2O
Solution. Charge électrique q\u003d 1.602 10 -19 C. Le moment électrique du dipôle de la molécule est trouvé par la formule
µ = 1 q\u003d 1,602 10 -19 3,37 10 -11 \u003d 5,4 10 -30 C m (1,63 ré).
Réponse : 5,4 10 -30 C m. = (1,63 ré).
6.2.3. Explication de la structure des molécules par la méthode des liaisons de valence (BC)
La formation de molécules par la méthode VS peut se faire selon le mécanisme d'échange ou donneur-accepteur. La première est basée sur le chevauchement des orbitales atomiques à un électron ; le second est associé à la présence d'atomes donneurs qui ont une paire d'électrons et d'atomes accepteurs qui ont des orbitales atomiques libres.
Exemple 8 Expliquer la formation des liaisons chimiques dans la molécule NH 3 et sa structure selon le mécanisme d'échange.
Solution . Pour expliquer la formation de liaisons chimiques dans la molécule NH 3 par le mécanisme d'échange, il est nécessaire d'écrire les formules électroniques des atomes d'azote et d'hydrogène ; déterminer leurs électrons de valence et la covalence de chaque atome.
Azote 7 N 1 s 2 2s 2 2R 3 – Rs 2 2R 3 . La covalence d'un atome est de trois 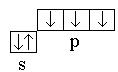 . Par conséquent, trois liaisons covalentes sont formées.
. Par conséquent, trois liaisons covalentes sont formées.
Hydrogène 1 H 1 s 1 – ss un ; covalence vaut 1, l'atome forme une liaison covalente.
Trois à un électron R-orbitales de l'atome d'azote et d'un électron s est l'orbite de chacun des trois atomes d'hydrogène. Chevauchement s-p les orbitales se produisent dans la direction du plus grand allongement R-orbitales dans l'espace situées à un angle de 90°. Après chevauchement, la forme de la molécule NH3 est une pyramide trigonale avec un angle de liaison H–N–H de 107°20" (Fig. 2).
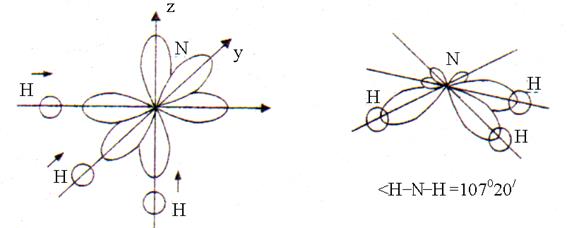
Riz. 2. La structure de la molécule d'ammoniac
La déviation de l'angle par rapport à 90° est due au fait que la liaison N–H est polaire (EO N = 3,0 ; EO H = 2,1). Les paires d'électrons de liaison sont légèrement décalées des atomes d'hydrogène vers les atomes d'azote (EO N > EO H). Par conséquent, les atomes d'hydrogène chargés positivement, ainsi que les paires d'électrons des trois liaisons N–H, se repoussent, ce qui conduit à une augmentation de l'angle de liaison à 107°20".
Exemple 9 Expliquez la formation de l'ion ammonium NH 4 + à partir de la molécule d'ammoniac NH 3 et de l'ion hydrogène H + par le mécanisme donneur-accepteur.
Solution. La formation de liaisons dans la molécule NH 3 par le mécanisme d'échange est donnée dans l'exemple 8. Comme il ressort des explications, trois liaisons covalentes sont formées par le mécanisme d'échange dû à trois valences à un électron R-orbitales de l'atome d'azote. Mais, en plus, l'atome d'azote a aussi une valence à deux électrons s-orbitale (2 s 2), qui peut être un donneur par rapport à un accepteur, un ion hydrogène avec une orbitale libre. Par conséquent, l'atome d'azote peut former une quatrième liaison covalente par le mécanisme donneur-accepteur. La formation de la quatrième liaison covalente (donneur-accepteur) dans l'ion ammonium NH 4 + peut être représentée par le schéma :
Donateur Accepteur
L'ion ammonium a la forme d'un tétraèdre en raison de s 1 R 3 hybridations (voir section 6.2.4).
6.2.4. Détermination du type d'hybridation des orbitales atomiques
et configuration spatiale de la molécule selon la méthode VS
Exemple 10 Déterminer le type d'hybridation des orbitales atomiques, la configuration spatiale et la polarité de la molécule BH 3.
Solution.
Bor : 5V l s 2 2s 2 2p 1 – R-élément; électrons de valence 2 s 2 2p un ; la covalence d'un atome à l'état normal (non excité) est égale à un 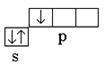 .
.
Hydrogène 1 H 1 s 1 – s-élément; électrons de valence 1 s un ; la covalence est égale à un. A l'état normal, un atome de bore ne peut former qu'une seule liaison chimique en raison d'une liaison non appariée. R-électron. Cependant, la composition de la molécule ВН 3 indique que le bore forme trois liaisons chimiques, c'est-à-dire sa covalence est de trois. Ceci est possible lorsque l'atome est transféré de l'état normal à l'état excité (Fig. 3).
Riz. 3. Formation d'orbitales hybrides de l'atome de bore
Trois orbitales hybrides sont disposées symétriquement dans l'espace à un angle de 120° entre elles et dirigées vers les sommets d'un triangle régulier. Trois orbitales hybrides de l'atome de bore se forment avec un électron s-les orbitales de trois atomes d'hydrogène sont trois liaisons chimiques dans la molécule ВН 3, qui a la forme d'un triangle régulier (Fig. 4).
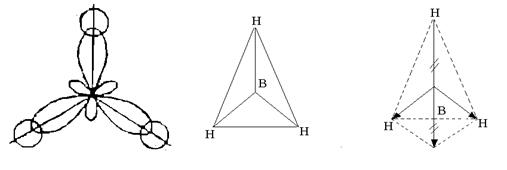
Riz. 4. Structure de la molécule ВН 3
Malgré le fait que les liaisons B–H soient polaires (EO B = 2,0 ; EO H = 2,1), la molécule est non polaire, car a une structure symétrique. La somme vectorielle résultante des moments électriques des dipôles de trois liaisons B – H est égale à zéro (voir Fig. 4).
L'hybridation des orbitales atomiques détermine la configuration spatiale des molécules et des ions (tableau 2).
Tableau 2
Structures spatiales de certaines molécules et ions
6.2.5. Explication de la formation et des propriétés des molécules diatomiques de type B 2 par la méthode des orbitales moléculaires (MO)
Selon la méthode MO, il n'y a pas d'orbitales atomiques (AO) dans la molécule, mais il y a des MO de liaison et de relâchement obtenus par une combinaison linéaire (mélange) d'AO. Avec une combinaison n AO est formé n MO, dont le nombre de liants est égal au nombre d'énergie AO. L'énergie de liaison des MO est inférieure à l'énergie des AO, et l'énergie de relâchement des MO est supérieure à l'énergie des AO. L'ordre de placement des électrons sur MO est le même que dans le cas de AO ; tout d'abord, les MO à faible énergie sont remplis (principe d'énergie minimale) conformément au principe de Pauli et à la règle de Hund.
Le cas le plus simple de formation de MO se produit lorsque l'AO de deux atomes du même élément (B 2) est combiné. Avec une combinaison de deux s-s AO, deux MO sont formés, appelés orbitales σ (sigma). L'un d'eux est contraignant (), l'autre est desserrant (). Deux s-MO sont également obtenus en combinant deux p x -p x AO ( et ). Une combinaison de deux r y - r y et deux p z -p z AO, deux p st -MO ( et ) et deux p fois -MO ( et ) sont formés.
La formation de MO à partir d'atomes et la variation de leur énergie peuvent être représentées sous la forme d'un diagramme d'énergie, où les valeurs d'énergie des orbitales sont tracées verticalement (Fig. 5).
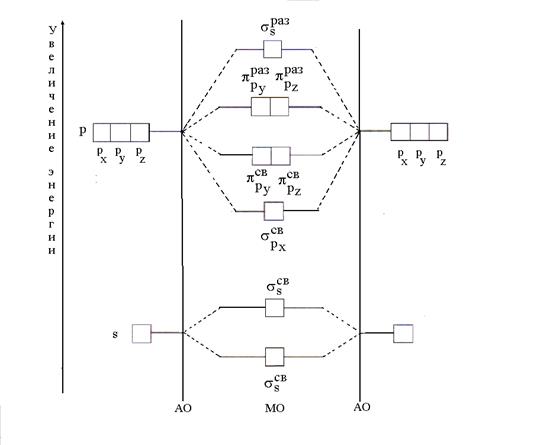
Riz. Fig. 5. Schéma énergétique pour la formation de MO dans la combinaison de AO de deux atomes du même élément (B 2)
La méthode MO permet de déterminer le magnétisme d'une molécule. Ainsi, la présence d'électrons non appariés dans une molécule détermine son paramagnétisme, et l'absence de tels électrons provoque le diamagnétisme. En utilisant la méthode MO, vous pouvez trouver la multiplicité de la connexion. La multiplicité w est égale à la demi-différence du nombre d'électrons sur la liaison n sv et relâchement n fois mois :
Si le nombre d'électrons sur les MO de liaison et de relâchement est égal, alors la multiplicité de liaison est nulle. Par conséquent, ces électrons n'influencent pas la formation d'une liaison chimique.
La méthode MO peut également expliquer la stabilité de la molécule. La stabilité d'une molécule est liée au bilan énergétique de tous les électrons de liaison et de relâchement. Provisoirement, un électron de relâchement peut être considéré comme annulant l'action d'un électron de liaison. Ainsi, plus il y a d'électrons sur les MO de liaison et moins il y en a sur les MO de relâchement, plus la molécule est stable.
Exemple 11. Expliquer la formation de la molécule O 2 en utilisant la méthode MO. Déterminer la multiplicité de la liaison et son magnétisme.
Solution. La molécule O 2 est constituée d'un atome du même élément - l'oxygène. Sa formule électronique est la suivante : 8 O 1 s 2 2s 2 2p 4 . Électrons de valence de l'atome d'oxygène 2 s 2 2p 4 participent à la formation d'une liaison chimique, c'est-à-dire MO sont obtenus par une combinaison linéaire de 2 s- et 2 R- AO de deux atomes d'oxygène.
La distribution de douze électrons de valence dans une molécule d'oxygène se produit conformément au principe de l'énergie minimale. Tout d'abord, les MO sont remplis de deux électrons chacun avec des spins antiparallèles (principe de Pauli). Ensuite, six électrons seront placés sur trois MO de liaison ( ; ; ) avec deux électrons chacun avec des spins antiparallèles. Les deux électrons restants occuperont les MO antiliants ( et ) un électron chacun avec des spins parallèles selon la règle de Hund. Après avoir placé les électrons sur le MO, le diagramme d'énergie de la molécule d'oxygène aura la forme suivante (Fig. 6).
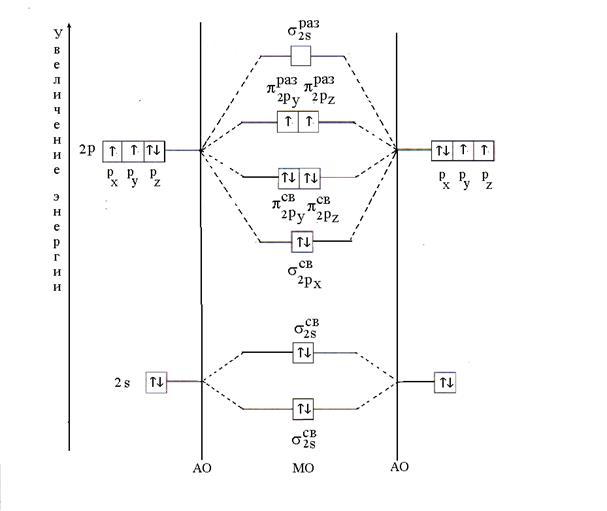
Riz. 6. Diagramme d'énergie de la molécule O 2
La multiplicité des liaisons dans une molécule d'oxygène, calculée par la formule (2), est égale à deux. La présence de deux électrons non appariés détermine le paragnétisme de la molécule.
TÂCHES DE CONTRÔLE
101. Dans la molécule d'éthine (acétylène) C 2 H 2, il existe une triple liaison entre les atomes de carbone : une liaison s et deux liaisons p. La formation de deux liaisons p se produit en raison du chevauchement r y - r y et deux p z -p z orbitales atomiques. Comment la liaison s apparaît-elle ? Déterminer le type d'hybridation lors de la formation d'une liaison s. Dessinez la structure de la molécule d'éthine et calculez l'énergie de liaison à l'aide des données du tableau. 3.
Réponse : Δ H= – 245 kJ/mol.
102. À l'aide du diagramme d'énergie MO, expliquez pourquoi la molécule est instable et l'ion est stable. Calculer la multiplicité de la relation dans les deux cas. Comment et pourquoi l'énergie d'une liaison chimique change-t-elle lorsque l'on passe à .
103. Expliquez la formation de liaisons chimiques dans la molécule H 2 O en utilisant la méthode BC. Dessinez la configuration spatiale de la molécule. Calculez la longueur de la liaison H – O en utilisant les données du tableau 2. Réponse : 0,97 10 -10 m.
104. Expliquez la structure de la molécule CH 4 selon la méthode BC. Déterminer le type d'hybridation dans la formation des liaisons chimiques. En utilisant les données du tableau 4, prouvez que les liaisons de la molécule sont polaires de manière covalente. Pourquoi le moment électrique du dipôle d'une molécule est-il égal à zéro ? . Quel atome agit comme donneur et quel atome agit comme accepteur ?
108. Expliquez la structure de la molécule CCl 4 selon la méthode BC. Déterminer le type d'hybridation dans la formation des liaisons chimiques. Calculez la longueur de la liaison C-Cl dans cette molécule en utilisant les données du tableau 1. 2. Réponse : 1,765 10 -10 m.
109. Expliquez la structure de la molécule de CO 2 selon la méthode BC. Dessinez la configuration spatiale de la molécule. Déterminer le type d'hybridation dans la formation des liaisons chimiques. En utilisant les données du tableau. 4, prouver que les liaisons covalentes sont polaires. Pourquoi la molécule de CO 2 est-elle non polaire ?
110. La molécule BF 3 a une configuration triangulaire plane et NF 3 a une configuration massive (pyramidale). À l'aide de la méthode BC, expliquez quelle est la raison de la différence de structure de ces molécules ? Quelle molécule est non polaire et pourquoi ? Confirmez le résultat par les valeurs des moments électriques des dipôles des molécules (voir tableau 5).
111. La molécule CH 4 et l'ion ont la même configuration spatiale. Comment expliquer cela en termes d'hybridation des orbitales atomiques de l'atome central ? Pourquoi le moment électrique du dipôle de la molécule CH 4 est-il égal à zéro ?
112. En utilisant la méthode des liaisons de valence, expliquez la structure de la molécule d'éthane C 2 H 6 (H 3 C-CH 3). Quel est le type d'hybridation par liaison chimique ? Calculez l'énergie de la liaison C–C si l'enthalpie standard de formation de C 2 H 6 à partir du carbone gazeux et de l'hydrogène est de – 2798,8 kJ/mol, et l'énergie de la liaison C–H est de –411,3 kJ/mol.
Réponse : Δ H= - 331,0 kJ/mol.
113. À l'aide de la méthode BC, expliquez pourquoi les molécules H 2 O et H 2 S ont une structure angulaire, alors que l'angle de liaison<(H–O–H) = 104 0 30¢ больше валентного угла <(H–S–H) = 92 0 . На основании данных табл.5 вычислите длины диполей молекул и покажите направления электрических моментов диполей связей в них.
Réponse : 3,83 10 -11 et 1,55 10 -11 m.
114. À l'aide de la méthode BC, expliquez la structure des molécules PCl 3 et AlCl 3 . Quelle est la différence dans les configurations géométriques des molécules ? Pourquoi la molécule PCl 3 est-elle polaire, alors que AlCl 3 a un moment dipolaire électrique égal à zéro ?
115. À l'aide de la méthode BC, expliquez la structure de la molécule CS 2 . Déterminer le type d'hybridation. Quelle est la configuration géométrique d'une molécule ? Pourquoi le moment électrique d'un dipôle est-il nul ?
; . Calculer la multiplicité de la relation et déterminer laquelle d'entre elles sera la plus stable ?120. Selon la méthode MO, construisez des diagrammes d'énergie pour; ; . Calculer la multiplicité des liaisons et leurs propriétés magnétiques.







