9.2 Electrode à hydrogène standard. Le potentiel de l'électrode.
Il est possible de mesurer la FEM d'un circuit composé de deux électrodes avec une grande précision. Cependant, il est impossible de mesurer ou de calculer la différence de potentiel absolue à l'interface métal-solution. À des fins pratiques, il suffit d'avoir des valeurs conditionnelles caractérisant les potentiels de différentes électrodes, par rapport au potentiel d'une certaine électrode, choisie comme standard.
Comme conditionnellement zéro capacité sélectionnée potentiel d'une électrode à hydrogène standard :
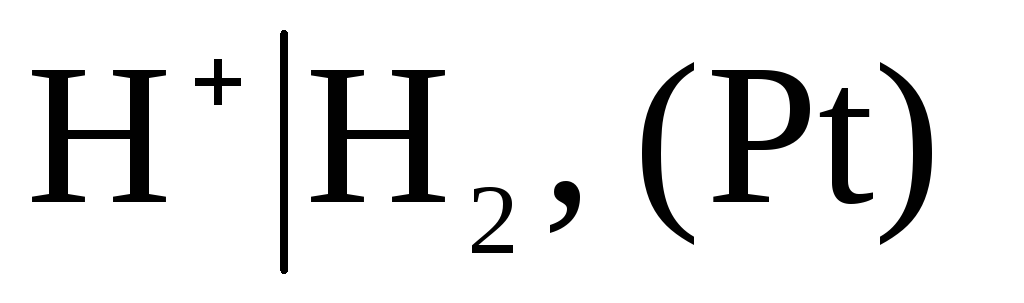 ,
,
dans lequel la pression de l'hydrogène soufflé est de 1 atm et l'activité des ions hydrogène dans la solution est égale à l'unité (Fig. 1). A n'importe quelle température 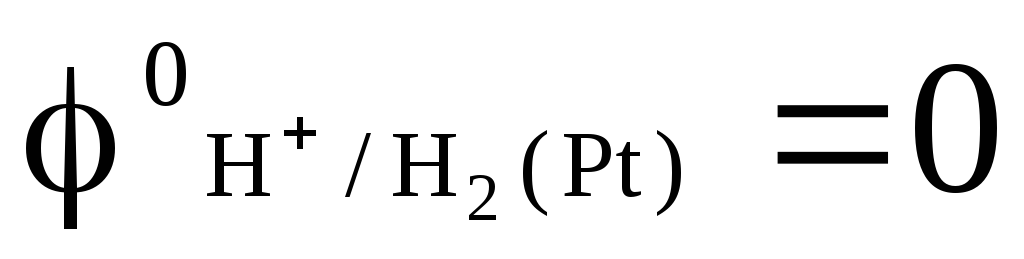 .
.
La réaction d'électrode pour une électrode à hydrogène s'écrit comme suit :
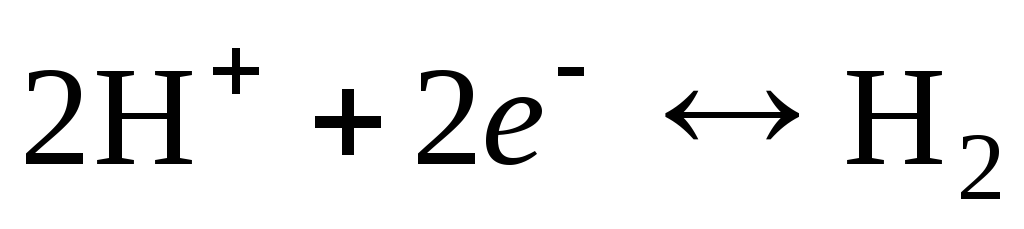 .
.
![]()
Riz. 1. Vue générale de l'électrode à hydrogène.
Pour le potentiel d'électrode de n'importe quelle électrode, il a été décidé de prendre la FEM du circuit composé de l'électrode en question et de l'électrode à hydrogène standard. Dans ce cas, l'électrode considérée est située à droite dans le circuit et l'électrode à hydrogène standard est située à gauche.
Exemple 9.1. Compiler un GE pour déterminer le potentiel d'électrode standard des électrodes Cu 2+ /Cu et Zn 2+ /Zn.
un). Faisons une cellule galvanique à partir d'électrodes standard d'hydrogène et de cuivre :
Réaction totale de formation de potentiel : , c'est-à-dire le transfert d'électrons dans le circuit se fait de gauche à droite (de l'électrode gauche vers la droite). Dans des conditions normales 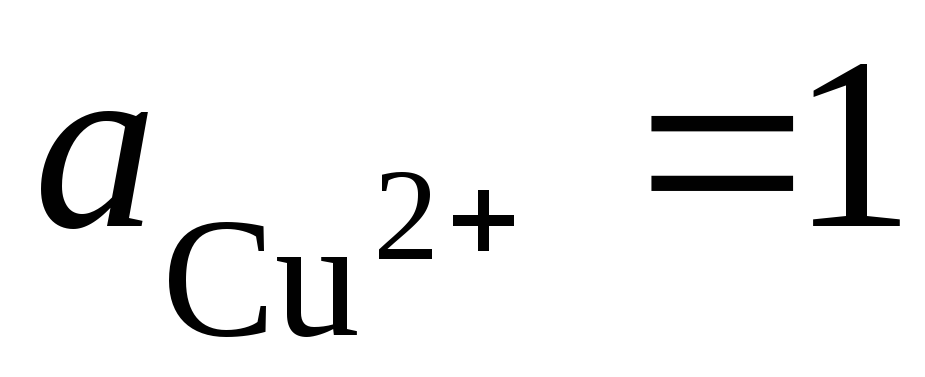 , la FEM de cet élément sera E \u003d 0,337 V. Par conséquent,
, la FEM de cet élément sera E \u003d 0,337 V. Par conséquent,
![]() .
.
2). De même, partons d'une cellule galvanique à partir d'électrodes standard à hydrogène et zinc :
Réaction totale : , c'est-à-dire le transfert d'électrons dans la chaîne se fait de droite à gauche. Dans des conditions normales 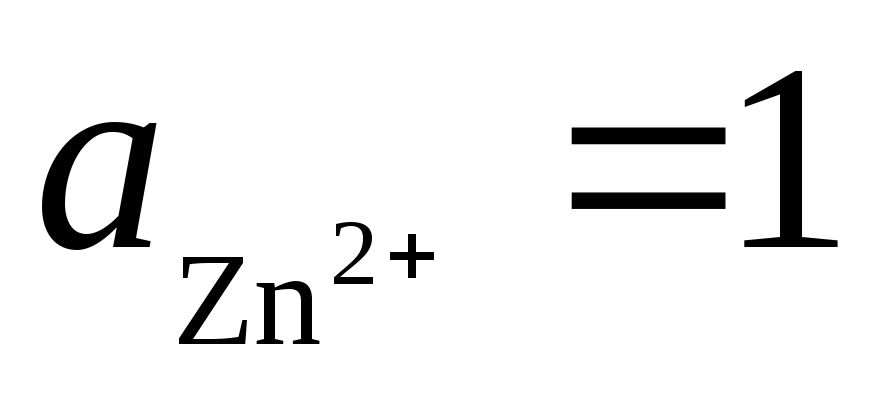
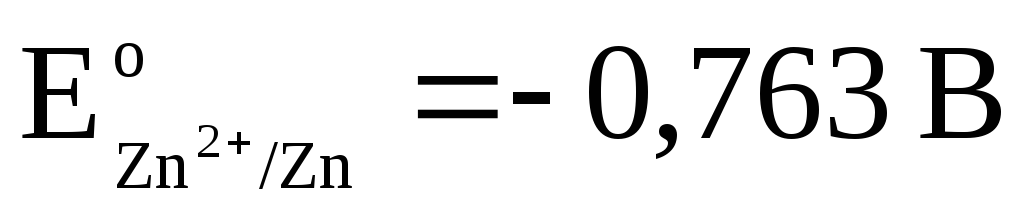 .
.
9.3 Équation de Nernst pour la force électromotrice d'une cellule galvanique.
La caractéristique électrique de l'électrode est le potentiel de l'électrode, et une cellule galvanique (circuit électrochimique) - force électromotrice (EMF),
La FEM d'un circuit électrochimique correctement ouvert en l'absence de potentiel de diffusion correspond à la différence de potentiel entre les électrodes droite (positive) et gauche (négative) et est toujours positive.
EMF d'une cellule galvanique
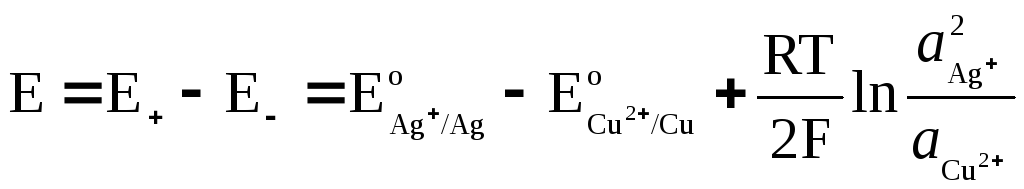
où 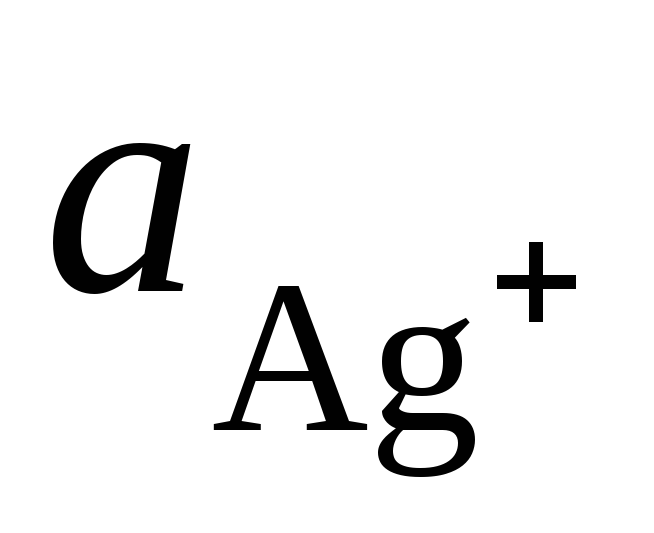 et
et 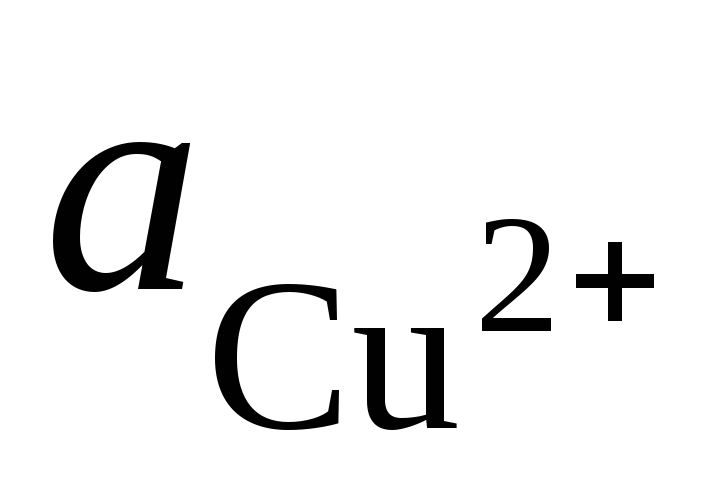 – activités des ions Ag + et Cu 2+ dans les solutions de leurs sels.
– activités des ions Ag + et Cu 2+ dans les solutions de leurs sels.
Dénoter
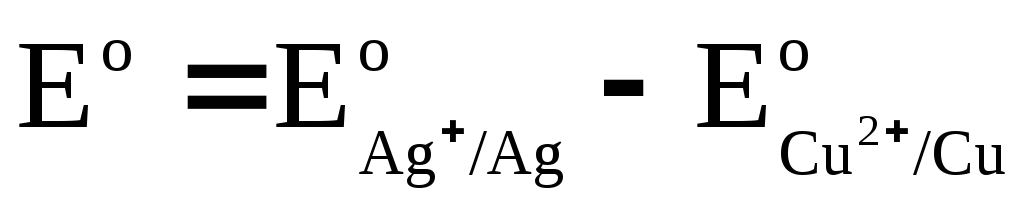 ,
,
où E o - EMF standard d'une cellule galvanique. Puis
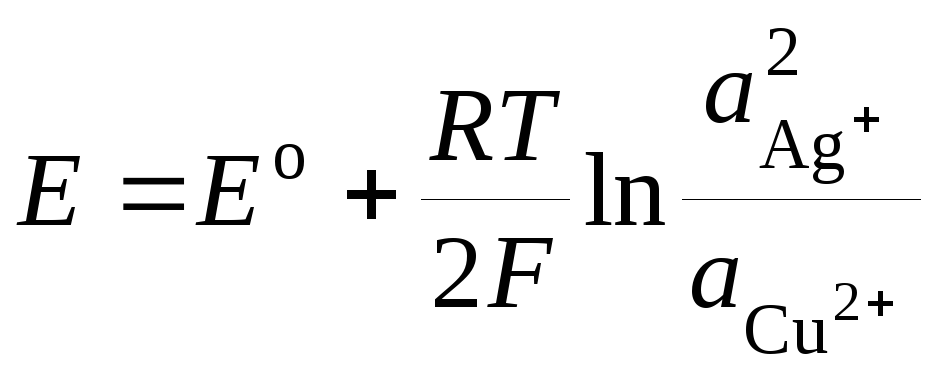 .(3)
.(3)
L'équation (3) est appelée Équations de Nernst pour la FEM d'une cellule galvanique.
Si une réaction chimique réversible se produit dans une cellule galvanique
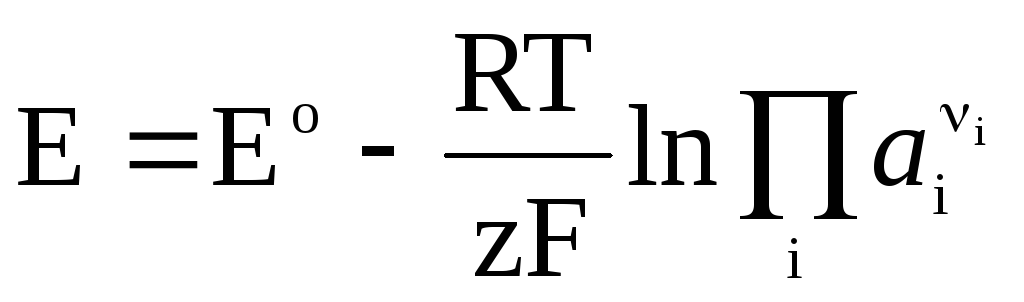 , (4)
, (4)
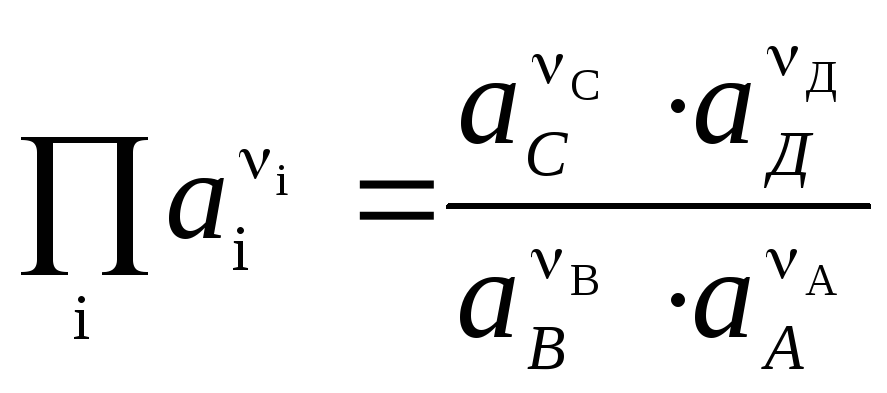
L'équation de Nernst sous la forme (4) est applicable pour calculer la FEM de toute cellule galvanique (en fonction de la réaction chimique totale) et le potentiel de toute électrode (en fonction de la réaction d'électrode). EMF est lié aux caractéristiques thermodynamiques de la réaction. Il est connu que
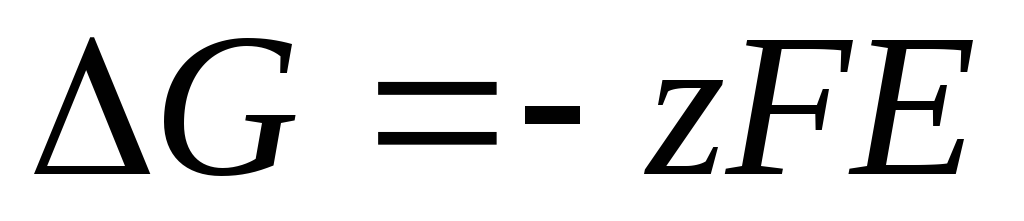 .
.
9.4 Classification des électrodes réversibles.
La classification des électrodes réversibles est basée sur les propriétés des substances impliquées dans les processus de détermination du potentiel.
1. Électrodes du premier type.
Électrodes du premier type- ce sont des électrodes métalliques réversibles vis-à-vis des cations (dont l'amalgame) ( 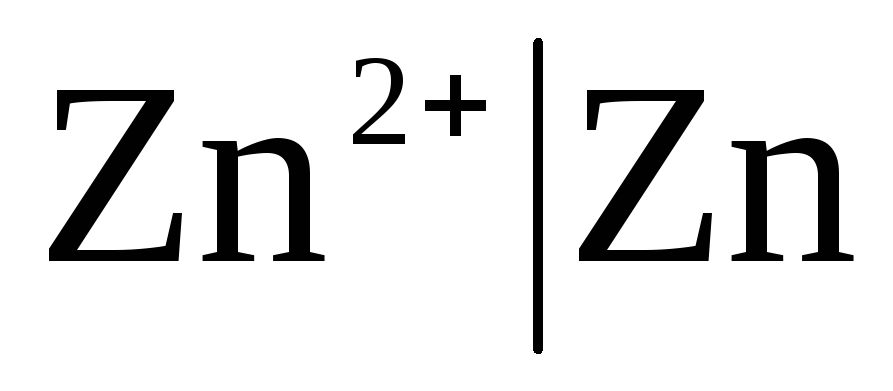 ) et métalloïde, électrodes réversibles vis-à-vis des anions (
) et métalloïde, électrodes réversibles vis-à-vis des anions ( 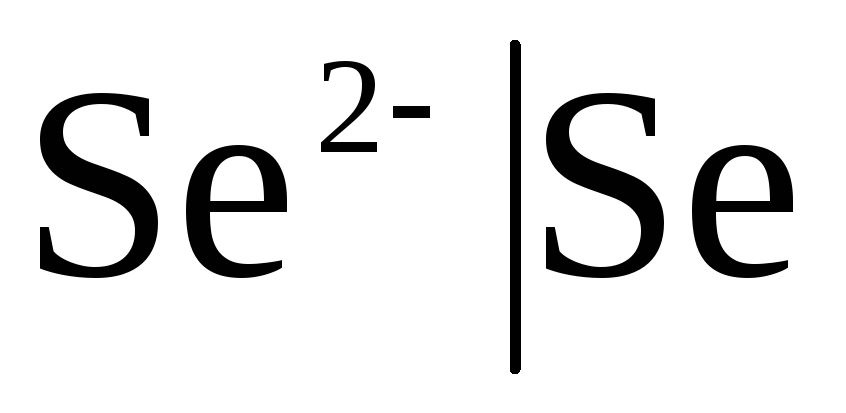 ).
).
Si l'électrode est réversible par rapport au cation Zn 2+ /Zn, alors on peut écrire :
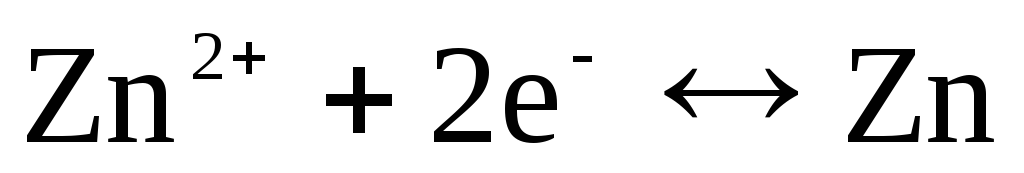 ,
,
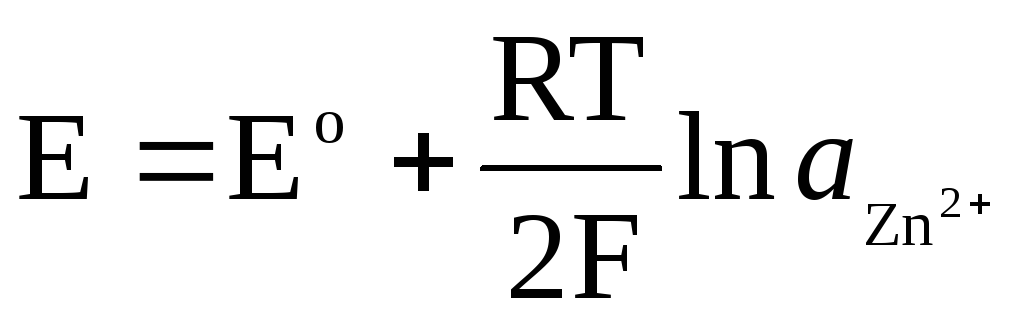
Pour l'électrode d'amalgame Zn 2+ /Zn(Hg) :
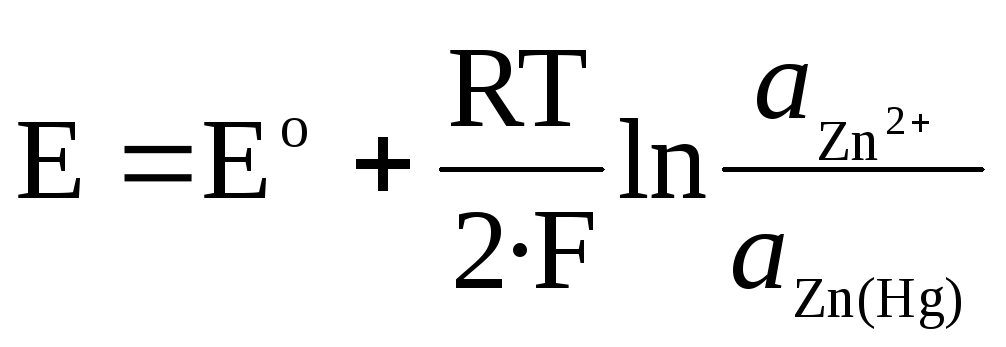 .
.
Si l'électrode est réversible par rapport à l'anion, alors
![]() ,
,
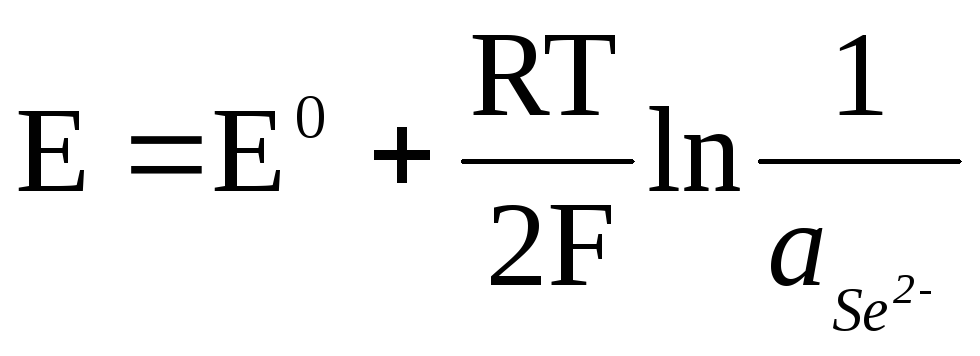 .
.
Les électrodes du premier type comprennent également gazélectrodes (hydrogène 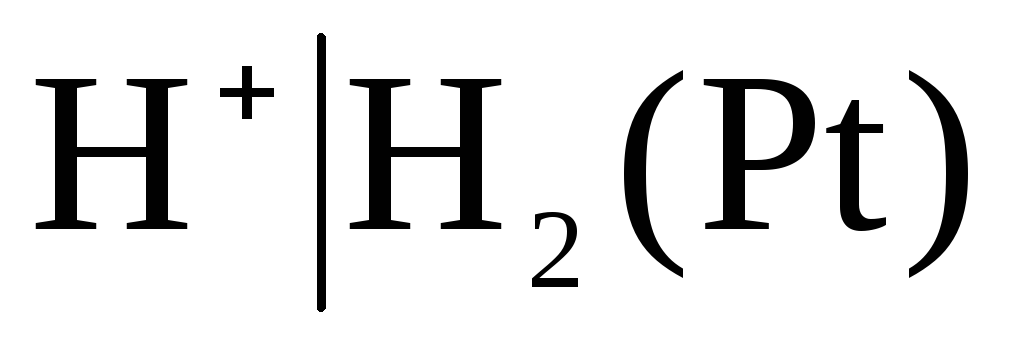 , chlorure
, chlorure 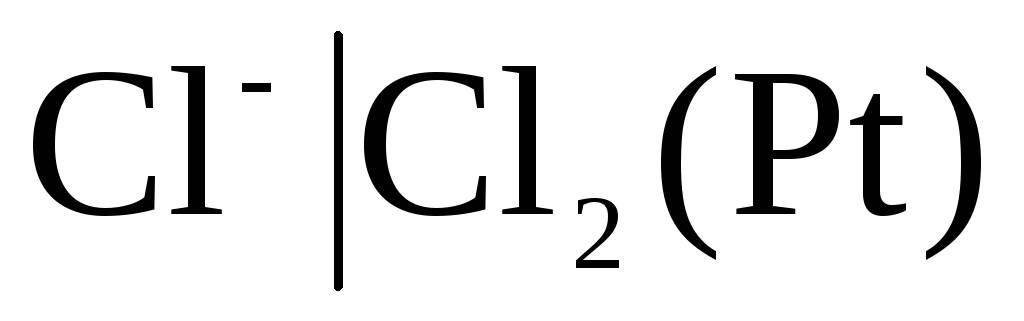 et etc.). Ils peuvent être réversibles vis-à-vis du cation (H+) ou de l'anion (Cl-). Par exemple, l'électrode à hydrogène est réversible vis-à-vis du cation. L'équation du processus d'électrode pour cela peut être écrite comme suit :
et etc.). Ils peuvent être réversibles vis-à-vis du cation (H+) ou de l'anion (Cl-). Par exemple, l'électrode à hydrogène est réversible vis-à-vis du cation. L'équation du processus d'électrode pour cela peut être écrite comme suit :
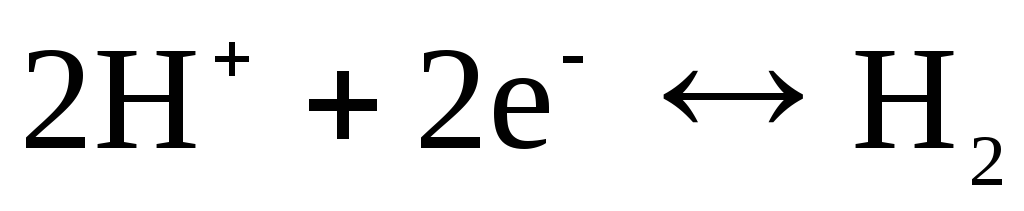 .
.
Le potentiel de l'électrode à hydrogène est déterminé par l'expression
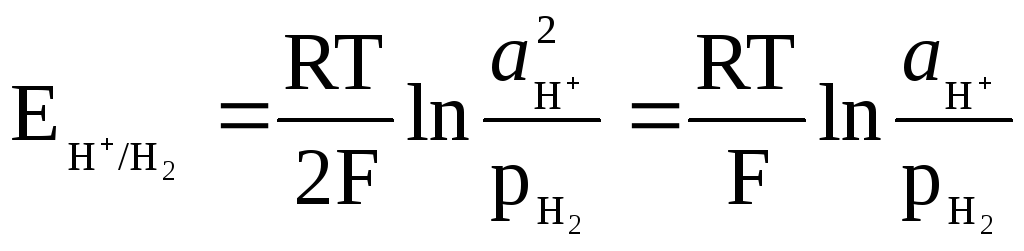 ,
,
et peut être lié au pH de la solution.
Pour électrode chlore 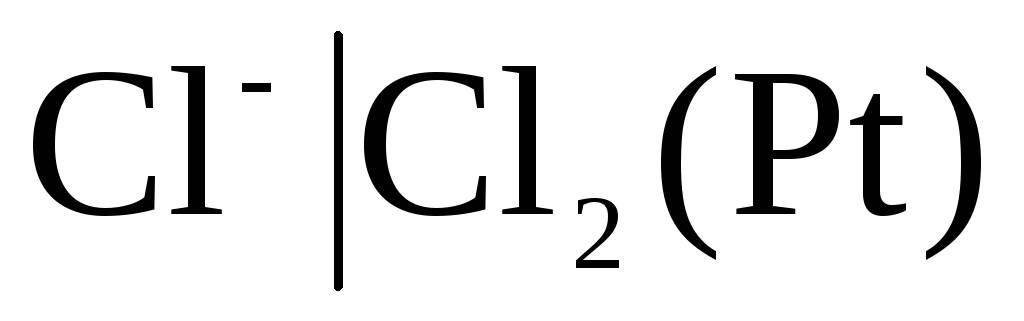 avec réaction déterminant le potentiel
avec réaction déterminant le potentiel
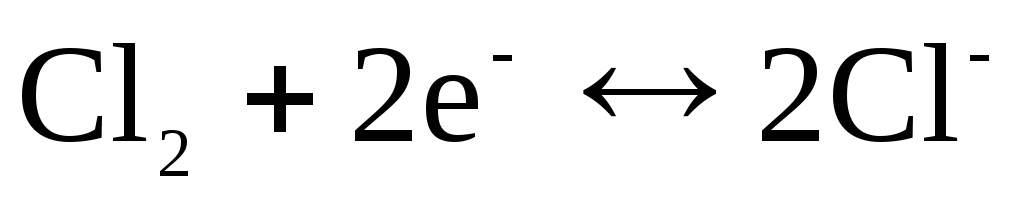 .
.
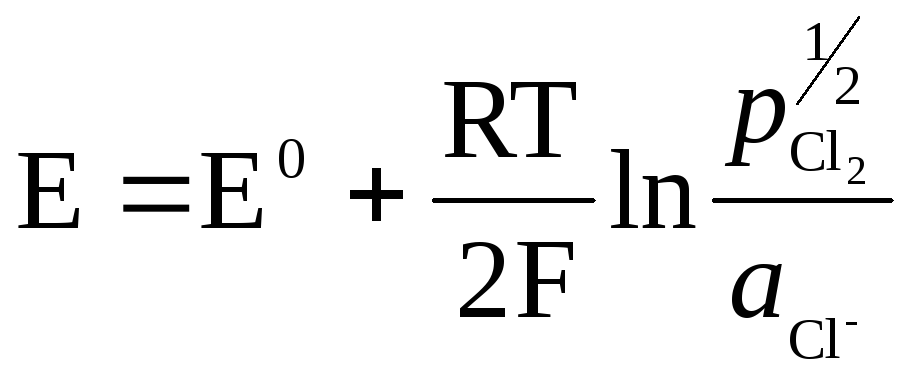
Le métal (Pt) dans les électrodes à gaz est nécessaire pour créer le contact entre le gaz et la solution, doit être inerte vis-à-vis des substances présentes dans la solution et est capable de catalyser un seul processus déterminant le potentiel.







