3.2. Pressions partielles dans le mélange gazeux. La loi de Dalton
Le mélange gazeux est dans un état d'équilibre si les concentrations des composants et ses paramètres d'état dans tout le volume ont les mêmes valeurs. Dans ce cas, la température de tous les gaz entrant dans le mélange est la même et égale à la température du mélange T cm.
Dans un état d'équilibre, les molécules de chaque gaz sont dispersées uniformément dans tout le volume du mélange, c'est-à-dire qu'elles ont leur propre concentration spécifique et, par conséquent, leur propre pression R je, Pa, qui s'appelle partiel ... Il est défini comme suit.
La pression partielle est égale à la pression d'un composant donné, à condition qu'il occupe à lui seul tout le volume destiné au mélange à la température de mélange T cm .
Selon la loi du chimiste et physicien anglais Dalton, formulée en 1801, la pression d'un mélange de gaz parfaits p cm est égal à la somme des pressions partielles de ses composants p je :
où m- le nombre de composants.
L'expression (2) est aussi appelée la loi des pressions partielles.
3.3. Le volume réduit du composant du mélange gazeux. La loi d'Amag
Par définition, le volume réduit jeème composant du mélange gazeux V je, m 3, est le volume que ce composant pourrait occuper, à condition que sa pression et sa température soient égales à la pression et à la température de l'ensemble du mélange gazeux.
La loi du physicien français Amag, formulée vers 1870, stipule : la somme des volumes réduits de tous les composants du mélange est égale au volume du mélangeV cm :
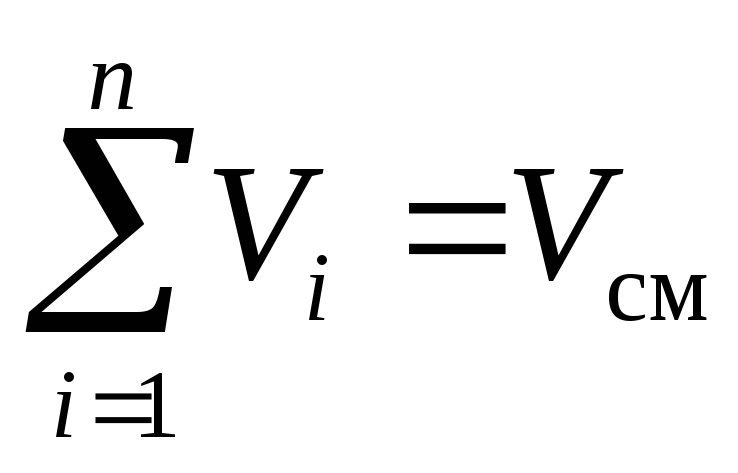 , m 3. (3)
, m 3. (3)
3.4. La composition chimique du mélange gazeux
La composition chimique du mélange gazeux peut être réglée trois différents façons.
Considérons un mélange gazeux constitué de n composants. Le mélange prend du volume V cm, m 3, a une masse M cm, kg, pression R cm, Pa et température T cm, K. De plus, le nombre de moles du mélange est N cm, taupe. De plus, la masse d'un je e composant m je, kg, et le nombre de moles de ce composant ν je, Môle.
Il est évident que:
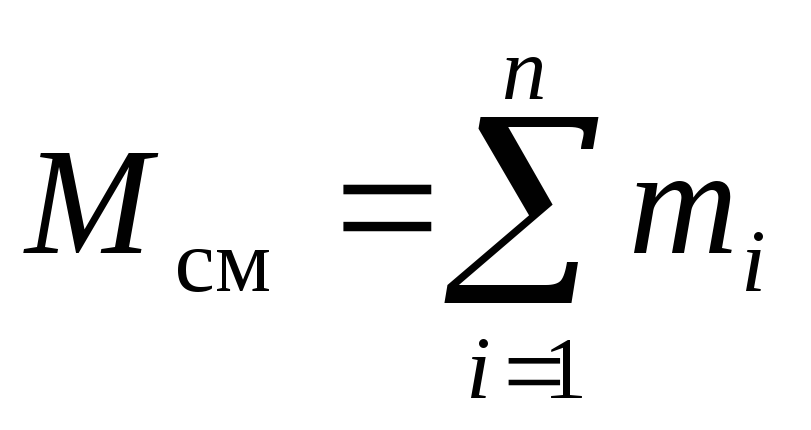 , (4)
, (4)
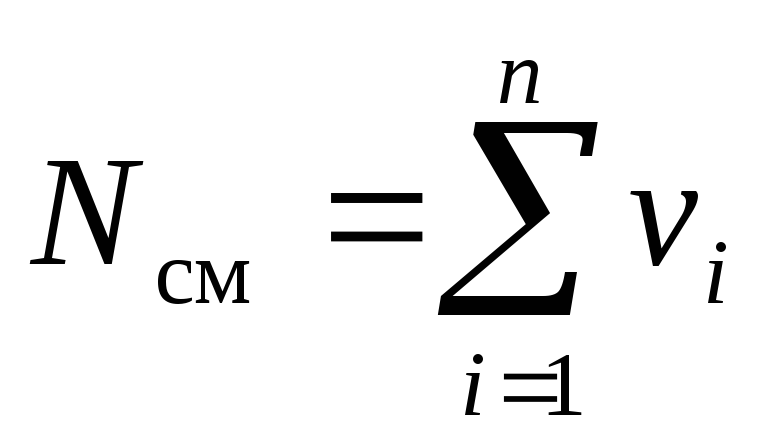 . (5)
. (5)
En utilisant la loi de Dalton (2) et la loi d'Amag (3) pour le mélange considéré, on peut écrire :
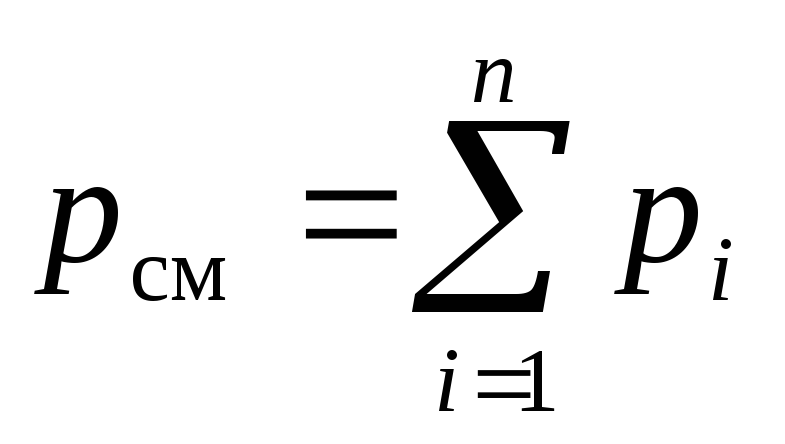 , (6)
, (6)
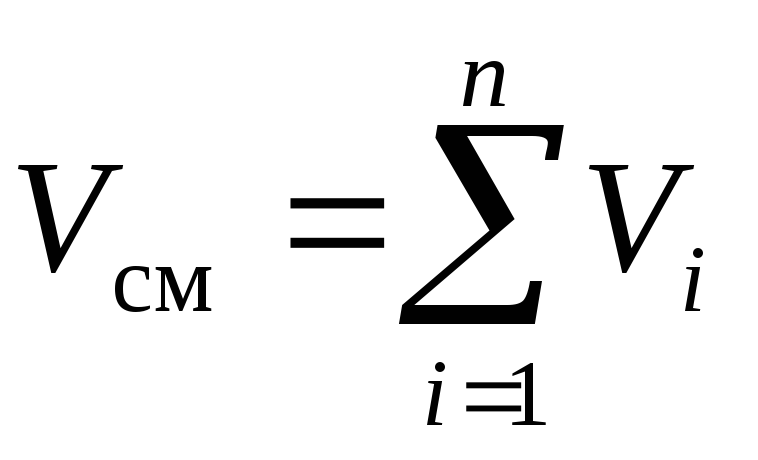 , (7)
, (7)
où R je- pression partielle je e composant, Pa; V je- volume réduit jeème composante, m 3.
La composition chimique du mélange gazeux peut être définie sans ambiguïté soit par les fractions massiques, molaires ou volumiques de ses composants :
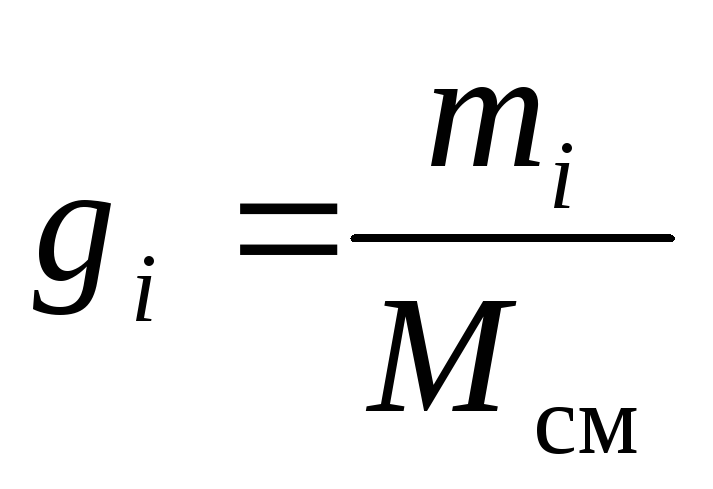 , (8)
, (8)
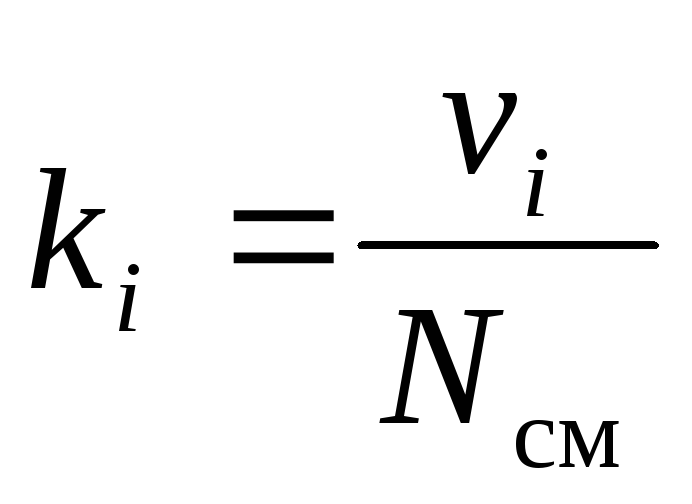 , (9)
, (9)
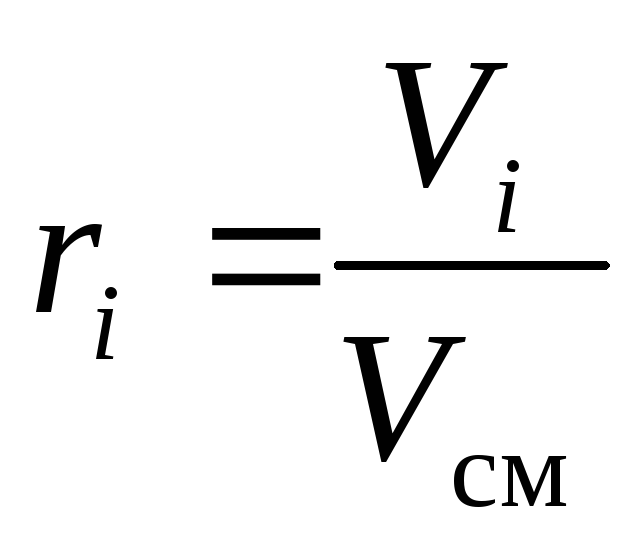 , (10)
, (10)
où g je , k je et r je- fraction massique, molaire et volumique jeème composant du mélange, respectivement (quantités sans dimension).
Il est évident que:
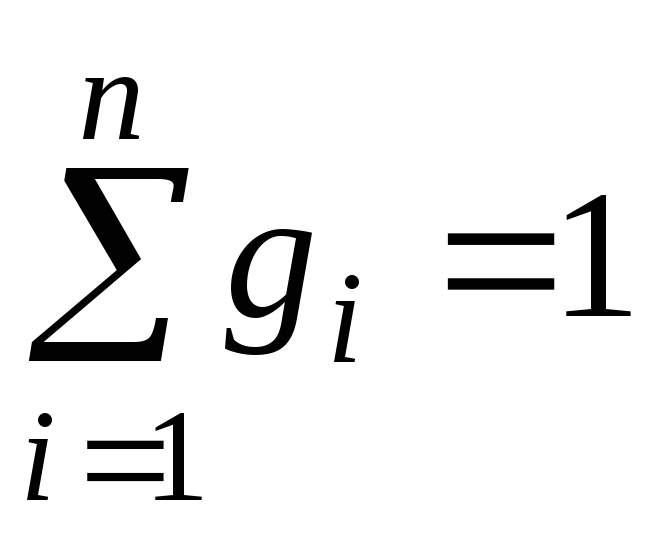 ,
,
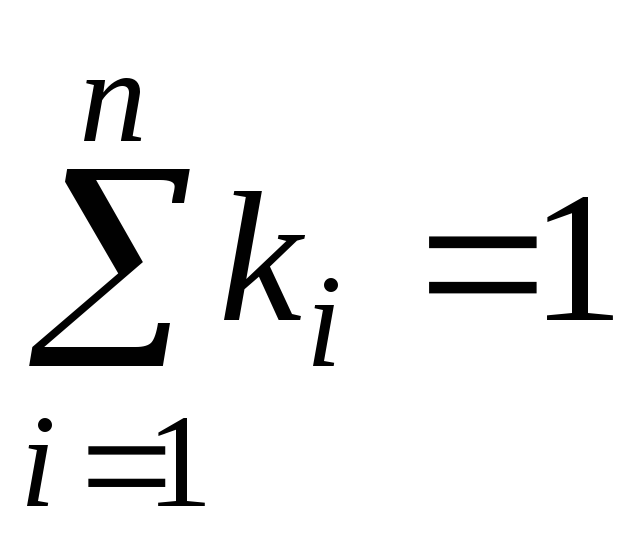 ,
,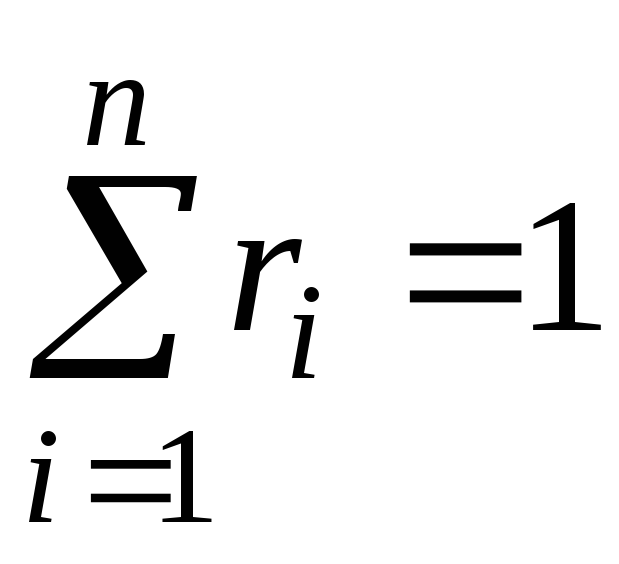 . (11)
. (11)
Souvent, en pratique, la composition chimique du mélange n'est pas définie en fractions je e composant et son pourcentage.
Par exemple, en génie thermique, on suppose grossièrement que l'air sec se compose de 79 pour cent en volume d'azote et de 21 pour cent en volume d'oxygène.
Pour cent je Le e composant du mélange est calculé en multipliant sa fraction par 100.
Pour un exemple avec de l'air sec, on aura :
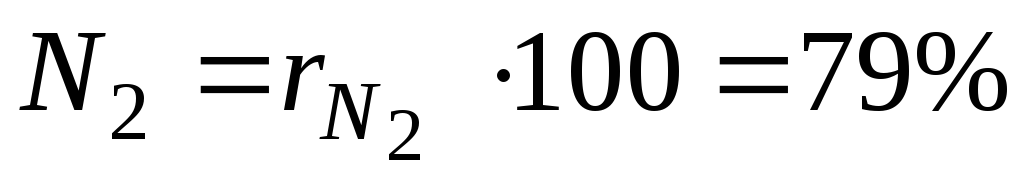 ,
,
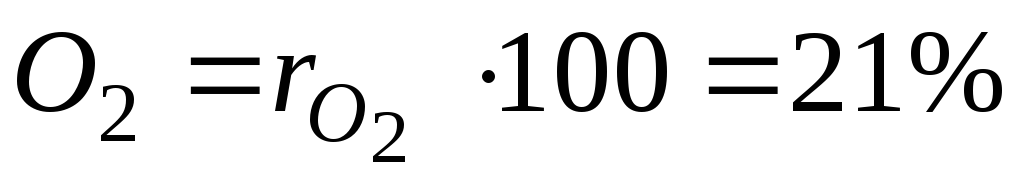 . (12)
. (12)
où 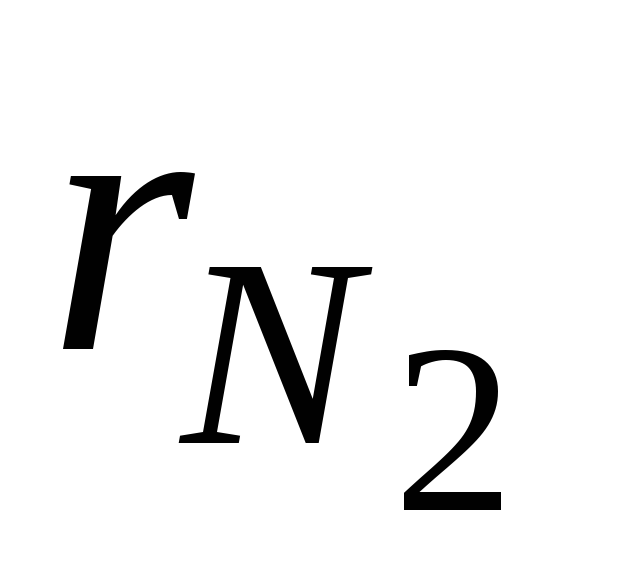 et
et 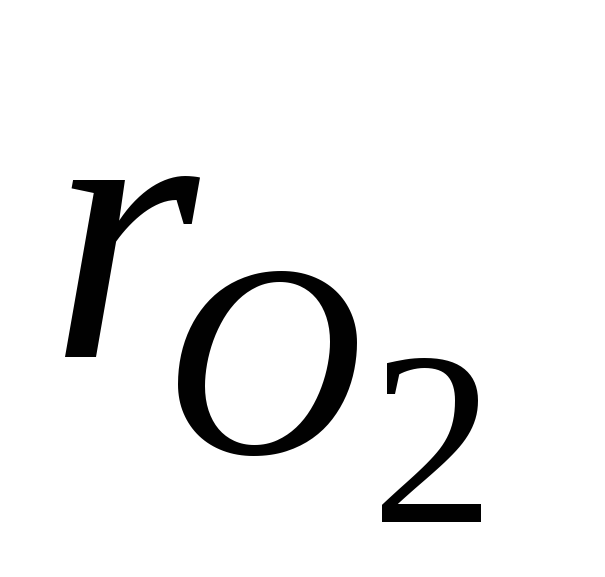 - fractions volumiques d'azote et d'oxygène dans l'air sec ; N 2 et O 2 - désignation du pourcentage en volume d'azote et d'oxygène, respectivement, % (vol.).
- fractions volumiques d'azote et d'oxygène dans l'air sec ; N 2 et O 2 - désignation du pourcentage en volume d'azote et d'oxygène, respectivement, % (vol.).
Noter:
1)Les fractions molaires d'un mélange idéal sont numériquement égales aux fractions volumiques :k je = r je ... Prouvons-le.
Utilisation de la définition de la fraction volumique(10)et la loi d'Amag (3) on peut écrire :
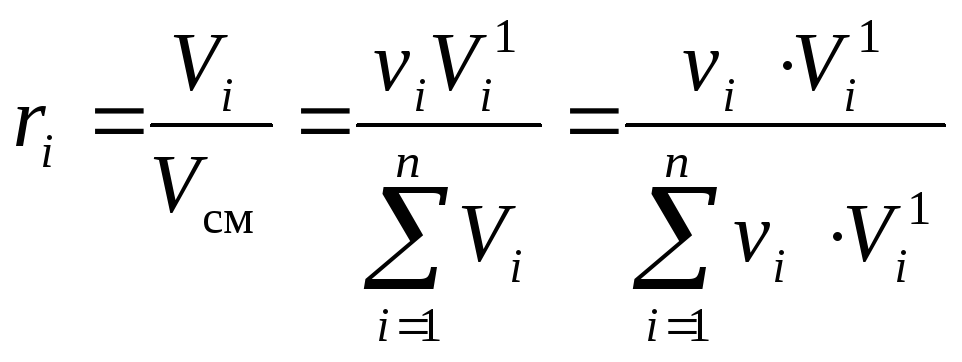 ,
(13)
,
(13)
oùV je - volume réduitjee composant, m 3
;
ν
je - nombre de molesjee composant, mol;
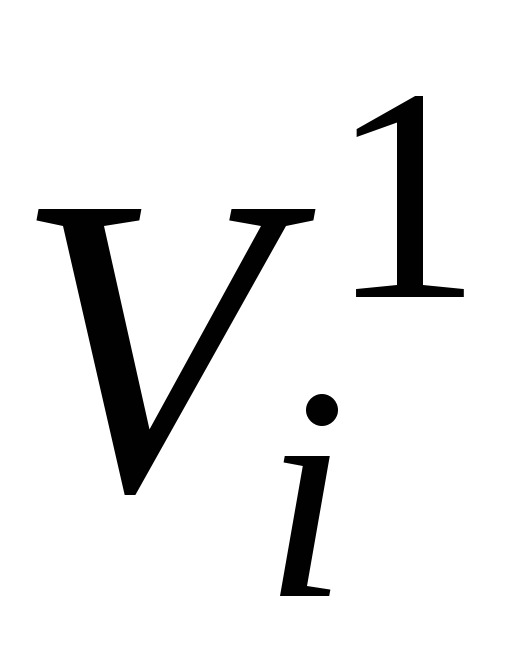 - le volume d'une moleje-ième composant à la pression de mélange p cm et la température de mélange T cm , m 3
/ mol.
- le volume d'une moleje-ième composant à la pression de mélange p cm et la température de mélange T cm , m 3
/ mol.
De la loi d'Avogadro (voir p. 2.3 de cette annexe) il s'ensuit qu'à la même température et pression, une mole de n'importe quel gaz (composant du mélange) occupe le même volume. En particulier, à T cm et P cm ce sera un peu de volumeV 1 , m 3 .
Ce qui précède nous permet d'écrire l'égalité :
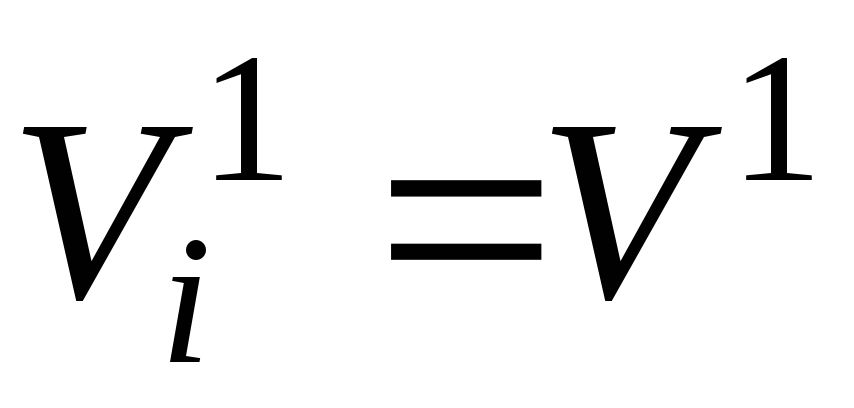 .
(14)
.
(14)
Substitution(14)v(13)nous obtenons le requis:
![]() .
(15)
.
(15)
2)Les fractions volumiques des composants du mélange gazeux peuvent être calculées en connaissant leurs pressions partielles. Montrons-le.
Envisagerje-ième composant d'un mélange de gaz parfait dans deux états différents : lorsqu'il est à sa pression partielle p je ; quand il prend son volume réduitV je .
L'équation d'état d'un gaz parfait est valable pour n'importe lequel de ses états, en particulier pour les deux nommés ci-dessus.
Conformément à cela, et compte tenu de la définition du volume spécifique, nous pouvons noter :
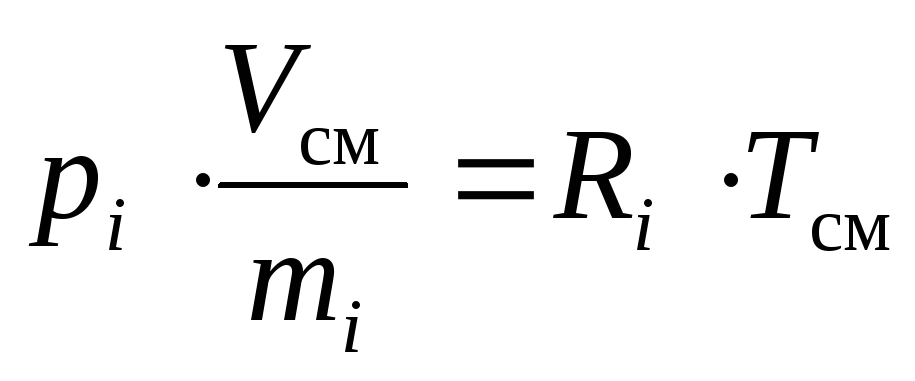 ,
(16)
,
(16)
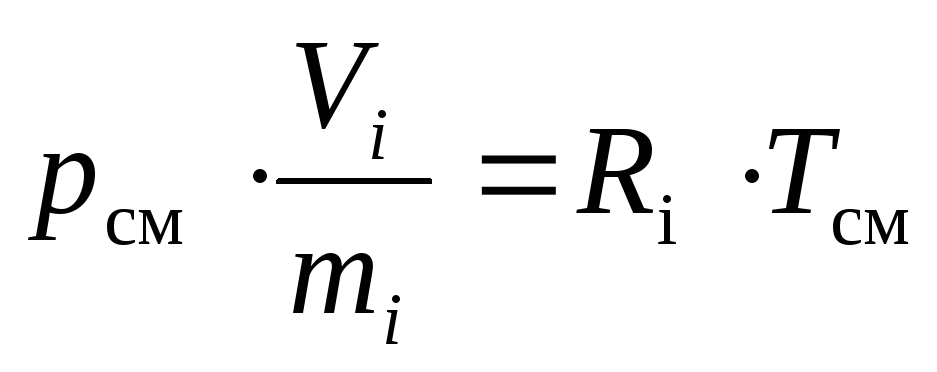 ,
(17)
,
(17)
oùR je - constante de gazjee composant du mélange, J / (kg · K).
Après avoir divisé les deux parties(16)et(17)les uns sur les autres, nous obtenons les éléments requis :
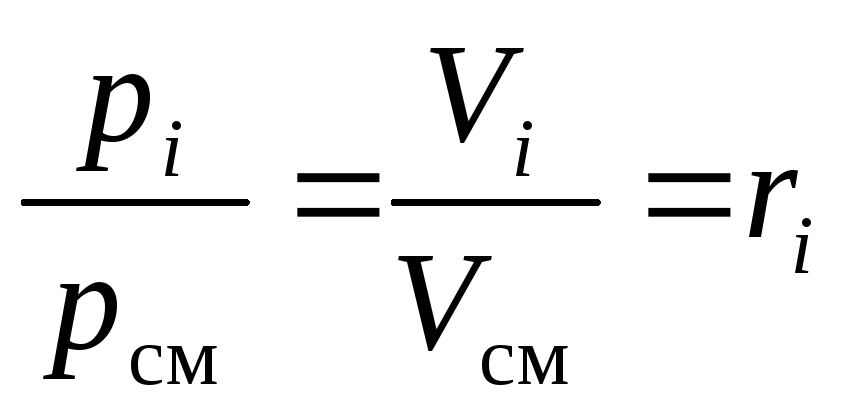 .
(18)
.
(18)
De(18)on peut voir que les pressions partielles des composants du mélange peuvent être calculées à partir de sa composition chimique, à une pression totale connue du mélange p cm :
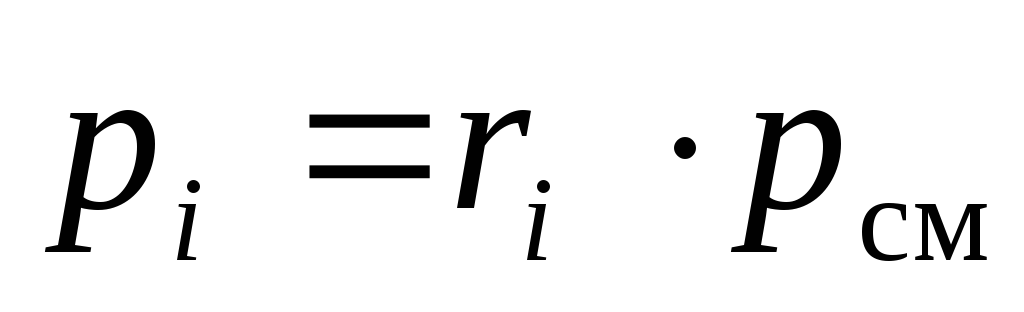 .
(19)
.
(19)







