Скачать краткое сообщение на тему аллотропия серы. Физические и химические свойства серы
Сера - довольно распространенный в природе химический элемент (шестнадцатый по содержанию в земной коре и шестой - в природных водах). Встречаются как самородная сера (свободное состояние элемента) так и ее соединения.
Сера в природе
В числе важнейших природных можно назвать железный колчедан, сфалерит, галенит, киноварь, антимонит. В Мировом океане содержится в основном в виде магния и натрия, обуславливающих жесткость природных вод.
Как получают серу?
Добыча серных руд производится разными методами. Основным способом получения серы является ее выплавка непосредственно в местах залегания.

Открытый способ добычи предусматривает использование экскаваторов, снимающих породные пласты, которые покрывают серную руду. После дробления пластов руды взрывами их направляют на сероплавильный завод.
В промышленности серу получают как побочный продукт процессов в печах для плавки, при нефтепереработке. В больших количествах она присутствует в природном газе (в виде сернистого ангидрида или сероводорода), при добыче которого откладывается на стенках применяемого оборудования. Уловленную из газа мелкодисперсную серу используют в химической промышленности в качестве сырья для производства различной продукции.
Данное вещество можно получать и из природного сернистого газа. Для этого используется метод Клауса. Он заключается в применении «серных ям», в которых происходит дегазация серы. Результатом является модифицированная сера, широко использующаяся в производстве асфальта.
Основные аллотропические модификации серы
Сере присуща аллотропия. Известно большое количество аллотропических модификаций. Наиболее известными являются ромбическая (кристаллическая), моноклинная (игольчатая) и пластическая сера. Первые две модификации являются устойчивыми, третья при затвердевании превращается в ромбическую.

Физические свойства, характеризующие серу
Молекулы ромбической (α-S) и моноклинной (β-S) модификаций содержат по 8 атомов серы, которые соединены в замкнутый цикл одинарными ковалентными связями.

В обычных условиях сера имеет ромбическую модификацию. Представляет собой желтое твердое кристаллическое вещество с плотностью 2,07 г/см 3 . Плавится при 113 °C. Плотность моноклинной серы составляет 1,96 г/см 3 , температура ее плавления равна 119,3 °C.
При плавлении сера увеличивается в объеме и становится желтой жидкостью, которая буреет при температуре 160 °C и превращается в вязкую темно-коричневую массу при достижении около 190 °C. При температурах, превышающих это значение, вязкость серы уменьшается. При около 300 °C она снова переходит в жидкое текучее состояние. Это объясняется тем, что в процессе нагревания сера полимеризуется, с повышением температуры увеличивая длину цепочки. А при достижении температурного значения свыше 190 °C наблюдается разрушение полимерных звеньев.

При охлаждении расплава серы естественным путем в цилиндрических тиглях образуется так называемая комовая сера - ромбические кристаллы крупных размеров, имеющие искаженную форму в виде октаэдров с частично «срезанными» гранями или углами.
Если расплавленное вещество подвергнуть резкому охлаждению (к примеру, при помощи холодной воды), то можно получить пластическую серу, представляющую собой упругую каучукоподобную массу коричневатого или темно-красного цвета с плотностью 2,046 г/см 3 . Данная модификация, в отличие от ромбической и моноклинной, является неустойчивой. Постепенно (в течение нескольких часов) она меняет окраску на желтую, становится хрупкой и превращается в ромбическую.
При замораживании паров серы (сильно нагретых) жидким азотом образуется ее пурпурная модификация, которая является устойчивой при температурах ниже минус 80 °C.
В водной среде сера практически не растворяется. Однако характеризуется хорошей растворимостью в органических растворителях. Плохо проводит электричество и тепло.
Температура кипения серы равна 444,6 °C. Процесс кипения сопровождается выделением оранжево-желтых паров, состоящих преимущественно из молекул S 8 , которые при последующем нагревании диссоциируют, в результате чего образуются равновесные формы S 6 , S 4 и S 2 . Далее при нагревании происходит распад крупных молекул, и при температуре выше 900 градусов пары состоят практически только из молекул S 2, диссоциирующих на атомы при 1500 °С.
Какими химическими свойствами обладает сера?
Сера является типичным неметаллом. Химически активна. Окислительно- восстановительные свойства серы проявляются по отношению к множеству элементов. При нагревании легко соединяется практически со всеми элементами, что объясняет ее обязательное присутствие в металлических рудах. Исключение составляют Pt, Au, I 2 , N 2 и инертные газы. Степени окисления, которые проявляет сера в соединениях, -2, +4, +6.
Свойства серы и кислорода обуславливают горение ее на воздухе. Результатом такого взаимодействия является образование сернистого (SO 2) и серного (SO 3) ангидридов, использующихся для получения сернистой и серной кислот.
При комнатной температуре восстановительные свойства серы проявляются только в отношении фтора, в реакции с которым образуется :
- S + 3F 2 = SF 6 .
При нагревании (в виде расплава) взаимодействует с хлором, фосфором, кремнием, углеродом. В результате реакций с водородом кроме сернистого водорода образует сульфаны, объединенные общей формулой H 2 S Х.
Окислительные свойства серы наблюдаются при взаимодействии с металлами. В некоторых случаях можно наблюдать довольно бурные реакции. В результате взаимодействия с металлами образуются соединения) и полисульфиды (многосернистые металлы).
При длительном нагревании вступает в реакции с концентрированными кислотами-окислителями, окисляясь при этом.
Диоксид серы
Оксид серы (IV), называемый также диоксидом серы и ангидридом сернистым, представляет собой газ (бесцветный) с резким удушающим запахом. Имеет свойство сжижаться под давлением при комнатной температуре. SO 2 является кислотным оксидом. Характеризуется хорошей растворимостью в воде. При этом образуется слабая, неустойчивая сернистая кислота, существующая только в водном растворе. В результате взаимодействия сернистого ангидрида со щелочами образуются сульфиты.
Отличается довольно высокой химической активностью. Наиболее ярко выраженными являются восстановительные химические свойства оксида серы (IV). Такие реакции сопровождаются повышением степени окисления серы.
Окислительные химические свойства оксида серы проявляются в присутствии сильных восстановителей (например, оксида углерода).
Триоксид серы
Триоксид серы (ангидрид серный) - серы (VI). В обычных условиях представляет собой бесцветную легколетучую жидкость, характеризующуюся удушающим запахом. Имеет свойство застывать при температурных значениях ниже 16,9 градуса. При этом образуется смесь разных кристаллических модификаций твердого триоксида серы. Высокие гигроскопические свойства оксида серы обуславливают его "дымление" в условиях влажного воздуха. В результате образуются капельки серной кислоты.
Сероводород
Сероводород является бинарным химическим соединением водорода и серы. H 2 S - это ядовитый бесцветный газ, характерными особенностями которого являются сладковатый вкус и запах протухших яиц. Плавится при температуре минус 86 °С, кипит при минус 60 °С. Неустойчив термически. При температурных значениях выше 400 °С происходит разложение сернистого водорода на S и H 2 . Характеризуется хорошей растворимостью в этаноле. В воде растворяется плохо. В результате растворения в воде образуется слабая сероводородная кислота. Сероводород является сильным восстановителем.

Огнеопасен. При его горении в воздухе можно наблюдать синее пламя. В больших концентрациях способен вступать в реакции со многими металлами.
Серная кислота
Серная кислота (H 2 SO 4) может быть разной концентрации и чистоты. В безводном состоянии является бесцветной маслянистой жидкостью, не имеющей запаха.
Значение температуры, при котором вещество плавится, составляет 10 °С. Температура кипения равна 296 °С. В воде растворяется хорошо. При растворении серной кислоты образуются гидраты, при этом выделяется большое количество теплоты. Температура кипения всех водных растворов при давлении 760 мм рт. ст. превышает 100 °С. Повышение точки кипения происходит с увеличением концентрации кислоты.

Кислотные свойства вещества проявляются при взаимодействии с и основаниями. H 2 SO 4 является двухосновной кислотой, за счет чего может образовывать как сульфаты (средние соли), так и гидросульфаты (кислые соли), большинство из которых растворимы в воде.
Наиболее ярко свойства серной кислоты проявляются в окислительно-восстановительных реакциях. Это объясняется тем, что в составе H 2 SO 4 у серы высшая степень окисления (+6). В качестве примера проявления окислительных свойств серной кислоты можно привести реакцию с медью:
- Cu + 2H 2 SO 4 = CuSO 4 + 2H 2 O + SO 2 .
Сера: полезные свойства
Сера является микроэлементом, необходимым для живых организмов. Является составной частью аминокислот (метионина и цистеина), ферментов и витаминов. Данный элемент принимает участие в образовании третичной структуры белка. Количество химически связанной серы, содержащейся в белках, составляет по массе от 0,8 до 2,4%. Содержание элемента в организме человека составляет около 2 граммов на 1 кг веса (то есть примерно 0,2% составляет сера).
Полезные свойства микроэлемента трудно переоценить. Защищая протоплазму крови, сера является активным помощником организма в борьбе с вредными бактериями. От ее количества зависит свертываемость крови, то есть элемент помогает поддерживать ее достаточный уровень. Также сера играет не последнюю роль в поддержании нормальных значений концентрации желчи, вырабатываемой организмом.
Часто ее называют «минералом красоты», поскольку она просто необходима для сохранения здоровья кожи, ногтей и волос. Сере присуща способность предохранять организм от различных видов негативного воздействия окружающей среды. Это способствует замедлению процессов старения. Сера очищает организм от токсинов и защищает от радиации, что особенно актуально в настоящее время, учитывая современную экологическую обстановку.
Недостаточное количество микроэлемента в организме может привести к плохому выведению шлаков, снижению иммунитета и жизненного тонуса.
Сера - участница бактериального фотосинтеза. Она является составляющей бактериохлорофилла, а сернистый водород - источником водорода.
Сера: свойства и применение в промышленности
Наиболее широко сера используется для Также свойства данного вещества позволяют применять его для вулканизации каучука, в качестве фунгицида в сельском хозяйстве и даже лекарственного препарата (коллоидная сера). Кроме того, серу используют для производства спичек и она входит в состав серобитумных композиций для изготовления сероасфальта.
Аллотропия (от др.-греч. αλλος «другой», τροπος «поворот, свойство») существование одного и того же химического элемента в виде двух и более простых веществ, различных по строению и свойствам: так называемых аллотропических модификаций или аллотропических форм.

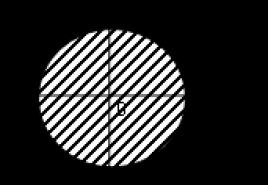
Сера имеет три аллотропных модификации Ромбическа я Ромбическа я Пластическая Моноклинная При комнатной температуре устойчива ромбическая сера. При нагревании она плавится, превращаясь в желтую легкоподвижную жидкость, при дальнейшем нагревании жидкость загустевает, так как в ней образуются длинные полимерные цепочки. При медленном охлаждении расплава образуются темно- желтые игольчатые кристаллы моноклинной серы, а если вылить расплавленную серу в холодную воду, получится пластическая сера – резиноподобная структура, состоящая из полимерных цепочек. Пластическая и моноклинная сера неустойчивы и самопроизвольно превращаются в ромбическую.


Ромбическая модификация серы Молекула S 8 имеет форму короны, длины всех связей – S – S – равны 0,206 нм и углы близки к тетраэдрическим 108°. В ромбической сере наименьший элементарный объем имеет форму прямоугольного параллелепипеда. Ромбическая сера - жёлтого цвета. Кристалл ромбической серы


Моноклинная модификация серы Моноклинная сера плавится при 119, 3 С. Расплавленная сера состоит главным образом из циклических молекул S8 и представляет собой подвижную желтую жидкость. При нагревании расплава до температур выше 160 С циклы S8 размыкаются, образуя длинные многоатомные цепи, расплав постепенно теряет текучесть и меняет цвет: из желтого становится темно-коричневым. При температурах выше 187 С цепи разрываются и укорачиваются, вязкость расплавленной серы уменьшается. Моноклиническая сера- бледно-жёлтого цвета.


Пластическая модификация серы Если расплавленную серу вылить в холодную воду, образуется похожая на резину коричневая масса. Это третья аллотропная модификация серы - пластическая сера. Она состоит из нерегулярно расположенных зигзагообразных цепочек S n, где n достигает нескольких тысяч. Она неустойчива и через некоторое время станет хрупкой, приобретёт жёлтый цвет, т.е. постепенно будет превращаться в ромбическую.

Сера - одно из немногих веществ, которое было известно с древнейших времен, её использовали первые химики. Одна из причин известности серы - распространенность самородной серы в странах древнейших цивилизаций. Её разрабатывали греки и римляне, производство серы значительно увеличилось после изобретения пороха.
Сера расположена в 16 группе Периодической системы химических элементов Менделеева .
На внешнем энергетическом уровне атома серы содержится 6 электронов, которые имеют электронную конфигурацию 3s 2 3p 4 . В соединениях с металлами сера проявляет отрицательную степень окисления элементов -2, в соединениях с кислородом и другими активными неметаллами - положительные +2, +4, +6. Сера - типичный неметалл, в зависимости от типа превращения может быть окислителем и восстановителем.
Сера довольно широко распространена в природе. Её содержание в земной коре составляет 0,0048 %. Значительная часть серы встречается в самородном состоянии.
Также сера встречается в форме сульфидов : пирит, халькопирит и сульфатов: гипс, целестин и барит.
Много соединений серы содержится в нефти (тиофен C 4 H 4 S, органические сульфиды) и нефтяных газах (сероводород).
Существование аллотропных модификаций серы связано с её способностью образовывать устойчивые гомоцепи - S - S -. Устойчивость цепей объясняется тем, что связи - S - S - оказываются прочнее, чем связь в молекуле S 2 . Гомоцепи серы имеют зигзагообразную форму, поскольку в их образовании принимают участие электроны взаимно перпендикулярных р-орбиталей.
Существует три аллотропные модификации серы: ромбическая, моноклинная и пластическая. Ромбическая и моноклинная модификации построены из циклических молекул S 8 , размещенных по узлам ромбической и моноклинной решеток.
Молекула S 8 имеет форму короны, длины всех связей - S - S - равны 0,206 нм и углы близки к тетраэдрическим 108°.
В ромбической сере наименьший элементарный объем имеет форму прямоугольного параллелепипеда, а в случае моноклинной серы элементарный объем выделяется в виде скошенного параллелепипеда.
Кристалл ромбической серы. Кристалл моноклинной серы
Пластическая модификация серы образована спиральными цепями из атомов серы с левой и правой осями вращения. Эти цепочки скручены и вытянуты в одном направлении.
При комнатной температуре устойчива ромбическая сера. При нагревании она плавится, превращаясь в желтую легкоподвижную жидкость, при дальнейшем нагревании жидкость загустевает, так как в ней образуются длинные полимерные цепочки. При медленном охлаждении расплава образуются темно-желтые игольчатые кристаллы моноклинной серы, а если вылить расплавленную серу в холодную воду, получится пластическая сера - резиноподобная структура, состоящая из полимерных цепочек. Пластическая и моноклинная сера неустойчивы и самопроизвольно превращаются в ромбическую.
Конспект урока по теме: «Сера. Аллотропия серы. Свойства и применение»,
9 класс. УМК Г.Е. Рудзитис и Ф.Г. Фельдман.
Учитель химии Муниципального казенного общеобразовательного учреждения «Средняя общеобразовательная школа №85 имени Героя Советского Союза Н.Д. Пахотищева г. Тайшета» Никитюк Любовь Федоровна.
Цель урока: рассмотреть строение атома серы на основании положения в таблице Менделеева, физические и химические свойства, аллотропию и применение серы.
Задачи урока:
Образовательные:
Рассмотреть строение атома серы, на основании ее положения в периодической системе химических элементов Д.И. Менделеева, аллотропные модификации серы.
Изучить физические и химические свойства серы, ее окислительно-восстановительную двойственность, нахождение в природе, области применения.
Продолжить формирование умений учащихся работать с периодической системой химических элементов Д.И. Менделеева.
Совершенствовать умения составлять уравнения химических реакций, проводить эксперимент.
Развивающие:
Развивать память и внимание учащихся.
Формировать положительную мотивацию на изучение предмета.
Учить применять имеющиеся знания в новой ситуации.
Воспитательные:
Формировать коммуникативные умения через работу учащихся в парах.
Показать значимость химических знаний для современного человека.
Продолжить формирование таких качеств личности как ответственное отношение к порученному делу, умение оценивать результаты своего труда.
Понятийный аппарат: самородная сера, сульфидная, сульфатная, аллотропия, демеркуризация.
Оборудование: ПСХЭ, компьютер, коллекция «Минералы», компьютерная презентация в программе Power Point ; сера; спиртовка; спички; держатель; штатив с пробирками, вода.
Для лабораторных опытов учащихся: коллекция «Минералы», образец серы, вода в стаканчике, стеклянная палочка.
Тип урока: комбинированный. Урок изучения нового материала.
Формы организации учебной деятельности:
Самостоятельная работа с текстом учебника;
Фронтальная;
Работа в парах;
Лабораторная работа,
Сообщения учащихся.
Методы и методические приемы:
Частично-поисковый.
Словесный (эвристическая беседа);
Наглядный;
Выполнение лабораторного опыта;
Заслушивание сообщений;
Практические (демонстрационный – химический эксперимент, лабораторный опыт)
Выполнение физкультминутки.
Педагогические приемы:
Учебно-организационные (определение цели и задачи урока, создание благоприятных условий деятельности);
Учебно-информационные (беседа, постановка проблемы, ее обсуждение, работа с учебником, наблюдение);
Учебно-интеллектуальные (восприятие, осмысление, запоминание информации, решение проблемных задач, мотивация деятельности).
Ход урока
Этапы урока, время
Формы взаимодействия
Методы и приемы
Деятельность учителя
Планируемая деятельность ученика
Слайд №
Организационный момент
1 мин.
Фронтальная
Беседа
Приветствую учащихся, спрашиваю о наличие всех в классе, настраиваю на урок.
Приветствуют учителя.
Актуализация знаний
5 мин.
Фронтальная
Создание проблемной ситуации
Ребята, отгадайте загадку.
Вещество золотистого цвета:
Виноград опыляют им летом.
Можно видеть такую картину:
Каучук превращает в резину.
«Сера» - тема нашего урока.
Какие вопросы мы должны рассмотреть сегодня на уроке?
Заслушивают и отгадывают загадку. Это сера.
Записывают тему в тетрадь.
Приводят план работы над темой:
Положение серы в периодической таблице
Строение атома
Нахождение в природе
Физические свойства
Химические свойства
Применение
Значение для человека
Слайд №1
Изучение нового материала
20-23 мин.
Фронтальная
Беседа
Выдвижение проблемы
Практический метод
Предлагаю рассмотреть положение серы в периодической системе.
Задание: составьте схемы строения атома серы, электронную и графическую формулу. Определите степени окисления серы.
Вопрос: как вы считаете, в каком виде находится сера в природе?
Сера относится к группе «халькогенов», что переводится как «рождающие руды».
Выполните Лабораторный опыт № 4 «Ознакомление с образцами серы и ее природных соединений» (учебник с. 43).
Задание: рассмотрите образец серы. Определите агрегатное состояние, цвет серы. Испытайте растворимость серы в воде.
Работа с периодической таблицей
Ученик у доски составляет схему строения атома, электронную и графическую формулы,
Определяют степени окисления серы.
Ответ: в свободном виде и в виде химических соединений.
Учащиеся выполняют ЛО № 4, затем проводят проверку.
Работа в тетради: сера кристаллическое вещество, желтого цвета, нерастворимое в воде. Ток и тепло не проводит.
Слайд №3
Фронтальная
Самостоятельная работа с учебником
Индивидуальная работа
Выдвижение проблемы
Демонстрационный опыт: превращение кристаллической серы в пластическую.
Физкультминутка
Словесный
Индивидуальная работа
Сообщение учащихся
Беседа:
Что называется, аллотропией?
Какие виды аллотропии характерны для серы?
(Рассмотрите рисунок «Аллотропия серы» и стр. 29 учебника)
Нагреваю серу и выливаю в холодную воду.
Вопрос. О какой модификации серы идет речь в стихотворении:
У какой серы есть корона,
Но нет ни подданных, ни трона.
Корону сера надевает, когда устойчивой бывает.
Приглашаю всех провести физкультминутку.
Химические свойства серы.
Вопросы:
Какими свойствами окислительными или восстановительными обладает сера?
(ответ найти в учебнике на стр.30)
Задание : закончить уравнения реакций:
S + H 2 =
S + Na =
S + Fe =
S + Hg =
S + O 2 =
S + F 2 =
Вопрос: что называют демеркуризацией?
Несколько учащихся получают задание по карточке: осуществить превращение по схеме:
H 2 S→S→Al 2 S 3 →Al(OH) 3
Нам осталось рассмотреть вопрос о применении серы.
Таким образом, в процессе урока мы рассмотрели свойства серы. Обратимся к теме урока, на все ли вопросы мы нашли с вами ответ?
Ответ: аллотропия – это явление существования простых веществ, образованных одним и тем же химическим элементом.
Аллотропные модификации серы – кристаллическая и пластическая сера.
Записывают свойства аллотропных модификаций в тетрадь.
Учащиеся выполняют упражнения под видеоролик.
Учащиеся высказывают свои предположения.
В реакциях с кислородом сера – восстановитель. Проявляет степень окисления +4 и +6.
В реакциях с водородом и металлами сера окислитель. Проявляет степень окисления -2.
Учащиеся пишут реакции:
S + H 2 = H 2 S
S + 2Na = Na 2 S
S + Fe = FeS
S + Hg = HgS
S + O 2 =SO 2
S + 3 F 2 = SF 6
Ответ: Очистка помещений и предметов от загрязнений металлической ртутью и источников ртутных паров называется демеркуризацией.
Задания выполняют у доски и на местах.
Рассказ учащегося о биологической роли и применении серы:
В древности серу применяли для изготовления красок, косметики и пороха. В современном мире сера имеет широчайшее применение. Без нее невозможна жизнь в прямом смысле слова. Сера входит в состав органических веществ – белков, из которых состоит все живое. Очень скромно применение серы можно представить в виде схемы (слайд №9)
Примерные ответы учащихся:
Мы рассмотрели свойства серы: физические и химические
Выяснили, где встречается сера в природе
Рассмотрели аллотропию серы
Рассмотрели применение серы
Слайд №4
Слайд №5
Слайд №6
Слайд №7
и №8
Слайд №9
Первичное закрепление знаний
5 мин.
Групповая (парная)
Самостоятельная работа
Взаимопроверка в паре
Задание: выберите верные утверждения
(вопросы задания напечатаны на листочках)
1.Строение атома серы:
а) + 15)2)8)5
б) + 17)2)8)7
в) + 16)2)8)6
г) + 18)2)8)8
2. Для атома серы наиболее характерны степени окисления:
а) -2; +2; +4; +6
б) -2; +4; +5; +6
в) -2; +1; +3; +6
г) -2; +2; +4; +5
3. Какой модификации не существует:
а) ромбической
б) тетраэдрической
в) моноклинной
г) пластической
4. Сера не растворяется в:
а) ацетоне
б) воде
в) сероуглероде
г) толуоле
5. При комнатной температуре сера реагирует с металлом:
а) железом
б) цинком
в) алюминием
г) ртутью
Выполняют тест
Осуществляют процедуру само - и взаимооценки собственной учебной деятельности и своих товарищей на уроке
по ключу:
1 – в
2 – а
3 – б
4 – б
5 – г
Слайд №10
Рефлексия
3 мин.
Фронтальная работа
Предлагаю учащимся выбрать незаконченное предложение на экране и продолжить его.
(слайд № 11)
Заканчивают предложение, выказывая свое отношение к уроку, теме.
Слайд №11
Домашнее задание, комментирование оценок за урок
3 мин.
Фронтальная
Сера расположена в VIа группе Периодической системы химических элементов Д.И. Менделеева.
На внешнем энергетическом уровне серы содержится 6 электронов, которые имеют 3s 2 3p 4 . В соединениях с металлами и водородом сера проявляет отрицательную степень окисления элементов -2, в соединениях с кислородом и другими активными неметаллами – положительные +2, +4, +6. Сера – типичный неметалл, в зависимости от типа превращения может быть окислителем и восстановителем.
 Нахождение серы в природе
Нахождение серы в природе
Сера встречается в свободном (самородном) состоянии и связанном виде.
Важнейшие природные соединения серы:
FeS 2 - железный колчедан или пирит,
ZnS - цинковая обманка или сфалерит (вюрцит),
PbS - свинцовый блеск или галенит,
HgS - киноварь,
Sb 2 S 3 - антимонит.
Кроме того, сера присутствует в нефти, природном угле, природных газах, в природных водах (в виде сульфат-иона и обуславливает «постоянную» жёсткость пресной воды). Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.
Аллотропные модификации серы
Аллотропия
— это способность одного и того же элемента существовать в разных молекулярных формах (молекулы содержат разное количество атомов одного и того же элемента, например, О 2 и О 3 , S 2 и S 8 , Р 2 и Р 4 и т.д).
Сера отличается способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны S 8 , образующие ромбическую и моноклинную серу. Это кристаллическая сера - хрупкое вещество жёлтого цвета.
Открытые цепи имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую).
1) ромбическая — S 8
t°пл. = 113°C; r = 2,07 г/см 3
Наиболее устойчивая модификация.
2) моноклинная — темно-желтые иглы
t°пл. = 119°C; r = 1,96 г/см 3
Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую.
3) пластическая — коричневая резиноподобная (аморфная) масса
Неустойчива, при затвердевании превращается в ромбическую
Получение серы
- Промышленный метод — выплавление из руды с помощью водяного пара.
- Неполное окисление сероводорода (при недостатке кислорода):
2H 2 S + O 2 → 2S + 2H 2 O
- Реакция Вакенродера:
2H 2 S + SO 2 → 3S + 2H 2 O
Химические свойства серы
Окислительные свойства серы
(S
0
+ 2ē
→ S
-2
)
1) Сера реагирует со щелочными без нагревания:
S + O 2 – t° → S +4 O 2
2S + 3O 2 – t °; pt → 2S +6 O 3
4) (кроме йода):
S + Cl 2 → S +2 Cl 2
S + 3F 2 → SF 6
Со сложными веществами:
5) c кислотами — окислителями:
S + 2H 2 SO 4 (конц) → 3S +4 O 2 + 2H 2 O
S + 6HNO 3 (конц) → H 2 S +6 O 4 + 6NO 2 + 2H 2 O
Реакции диспропорционирования:
6) 3S 0 + 6KOH → K 2 S +4 O 3 + 2K 2 S -2 + 3H 2 O
7) сера растворяется в концентрированном растворе сульфита натрия:
S 0 + Na 2 S +4 O 3 → Na 2 S 2 O 3 тиосульфат натрия