Как можно обнаружить функциональные производные карбоновых кислот. Реферат: Функциональные производные карбоновых кислот
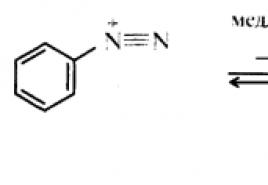
Ароматические диазосоединения.
Реакции солей арилдиазония с выделением азота.
Реакции, в результате которых диазогруппа замещается другими группировками , имеют большое синтетическое применение, поскольку позволяют в довольно мягких условиях ввести в ароматическое кольцо те функциональные группы, введение которых иными способами было бы сопряжено со значительными трудностями или просто неосуществимо. Кроме того, с помощью этих реакций можно получать производные ароматических углеводородов с таким взаимным расположением функций, которого нельзя достичь, используя непосредственно реакции электрофильного замещения. Реакции с выделением азота могут протекать по ионному или радикальному механизмам .
Замена диазогруппы на гидроксильную группу. При нагревании водных растворов арилдиазониевых солей, даже до комнатной температуры, происходит выделение азота и образуются соответствующие фенолы . Во многих случаях выходы в этой реакции высокие, поэтому она может служить препаративным способом получения фенолов. Во избежание замены диазогруппы другими нуклеофилами реакцию обычно проводят с использованием серной кислоты , анионы которой обладают низкой нуклеофильностью:
Реакция протекает по механизму мономолекулярного арильного нуклеофильного замещения S N 1 Ar который в основном характерен именно для солей диазония. На первой, медленной, стадии катион диазония обратимо диссоциирует с образованием арил-катиона (в частности, фенил-катиона) и молекулы азота. На второй стадии крайне неустойчивый арил-катион быстро соединяется с нуклеофилом. Неустойчивость арил-катиона обусловлена невозможностью участия π-электронов ароматического кольца в делокализации положительного заряда, так как p-орбитали кольца не могут взаимодействовать с расположенной в плоскости σ-скелета вакантной sp 2 -гибридной орбиталью:

Замена диазогруппы на фтор . При нагревании сухих борофторидов арилдиазония образуются арилфториды ( реакциея Шимана ) :

Эта реакция - один из лучших способов введения фтора в ароматическое кольцо. Полагают, что она протекает по ионному механизму с образованием промежуточного арил-катиона:
Замена диазогруппы на иод . При добавлении к растворам солей арилдиазония растворимой соли иодоводородной кислоты образуются соответствующие арилиодиды . Например, из п-фенилендиамина практически с количественным выходом получают п-дииодобензол, который другими методами получить довольно трудно:
Замена диазогруппы на хлор или бром. Для получения хлоро- или бромопроизводных соли диазония нагревают в присутствии солей меди(I) - CuCl или СиВr соответственно:

Обе реакции протекают по радикальному механизму . Ион Сu + легко окисляется в ион Сu 2+ , отдавая один электрон катиону диазония. Последний превращается при этом в свободный радикал (I), который отщепляет молекулу азота, образуя арил-радикал (II). При последующем взаимодействии арил-радикала (II) с галогенид-ионом образуется конечный арилгалогенид . Отщепившийся на последней стадии электрон затрачивается на восстановление иона Сu 2+ , за счет чего происходит регенерация катализатора.
Замена диазогруппы на цианогруппу. При обработке растворов ароматических солей диазония цианидом меди образуются арилнитрилы (арилцианиды ):

Замена диазогруппы на нитрогруппу. Реакцию проводят, добавляя твердый борофторид арилдиазония к раствору нитрита натрия, в котором суспендирован медный порошок. Этот способ позволяет ввести нитрогруппу в такие положения ароматического кольца, которые недоступны для прямого нитрования, например:
Замена диазогруппы на водород. При действии на соли арилдиазония такого восстановителя, как фосфорноватистая кислота Н 3 РO 2 , происходит замещение диазогруппы на атом водорода. В качестве примера приведена схема получения 2,4,6-трибромобензойной кислоты, которую невозможно получить прямым бромированием бензойной кислоты:
Замена диазогруппы на металл. Из солей диазония можно получить органические соединения некоторых металлов. Например, при восстановлении медью двойных ртутных солей получаются ртутьорганические соединения (реакция Несмеянова ):

Функциональные производные карбоновых кислот. Двухосновные карбоновые кислоты. a , b -Ненасыщенные кислоты
Производные карбоновых кислот
1. Галогенангидриды .
При действии галогенидов фосфора или хлористого тионила происходит образование галогенагидридов:
CH 3 COOH + PCl 5 ® CH 3 COCl + POCl 3 + HCl
Галоген в галогенангидридах обладает большой реакционной способностью. Сильный индукционный эффект определяет легкость замещения галогена другими нуклеофилами: - OH , - OR , - NH 2, - N 3, - CN и др.:
CH 3 COCl + CH 3 COOAg ® (CH 3 CO) 2 O уксусный ангидрид + AgCl
1. Ангидриды.
Ангидриды образуются при взаимодействии солей кислот с их галогенангидридами:
CH 3 COONa + CH 3 COCl ® NaCl + ( CH 3 CO ) 2 O
Ангидриды кислот обладают большой химической активностью и являются, как и галогенангидриды, хорошими ацилирующими агентами.
2. Амиды .
Амиды получают через галогенангидриды
CH 3 COCl +2 NH 3 ® CH 3 CONH 2 ацетамид + NH 4 Cl
или из аммонийных солей кислот, при сухой перегонке которых отщепляется вода и образуется амид кислоты. Также амиды кислот образуются как побочный продукт при гидролизе нитрилов. Процессы амидирования имеют важное значение в промышленности для производства ряда ценных соединений (N , N -диметилформамид, диметилацетамид, этаноламиды высших кислот).
4. Нитрилы . Важнейшими представителями нитрилов являются ацетонитрил CH 3 CN (применяется как полярный растворитель) и акрилонитрил CH 2 = CHCN (мономер для получения синтетического волокна нейрона и для производства дивинилнитрильного синтетического каучука, обладающего масло- и бензостойкостью). Основным способом получения нитрилов является дегидратация амидов на кислотных катализаторах:
CH 3 CONH 2 ® CH 3 C - CN + H 2 O
5. Сложные эфиры . Сложные эфиры карбоновых кислот имеют важное практическое значение в качестве растворителей, гидравлических жидкостей, смазочных масел, пластификаторов и мономеров. Их получают этерификацией спиртов кислотами, ангидридами и галогенангидридами или взаимодействием кислот и алкенов:
CH 3 -CH=CH 2 + CH 3 COOH ® CH 3 COOCH(CH 3) 2
Многие эфиры используются в качестве душистых веществ:
| CH 3 COOCH 2 CH 3 |
грушевая эссенция |
| CH 3 CH 2 CH 2 COOCH 2 CH 2 CH 2 CH 2 CH 3 |
ананасовая эссенция |
| HCOOCH 2 CH 3 |
ромовая эссенция |
Двухосновные насыщенные кислоты
Двухосновные предельные (насыщенные) кислоты имеют общую формулу C n H 2 n ( COOH ) 2 . Из них важнейшими являются:
НООС-СООН - щавелевая, этандикарбоновая кислота;
НООС-СН 2 -СООН - малоновая, пропандикарбоновая кислота;
НООС-СН 2 -СН 2 -СООН - янтарная, бутандикарбоновая кислота;
НООС-СН 2 -СН 2 -СН 2 -СООН - глутаровая, пентандикарбоновая кислота.
Способы получения
Общие методы получения двухосновных кислот аналогичны способам получения одноосновных кислот (окисление гликолей, гидролиз динитрилов, синтез Кольбе - см. Лекцию№27).
1. Окисление оксикислот :
OH-CH 2 CH 2 COOH ® HOCCH 2 COOH ® HOOC-CH 2 -COOH
2. Окисление циклоалканов .
Это промышленный способ получения адипиновой кислоты HOOC - CH 2 CH 2 CH 2 CH 2 - COOH из циклогексана.
Побочно образуются также янтарная и щавелевая кислоты. Адипиновая кислота применяется для синтеза волокна найлон 6,6 и пластификаторов.
Химические свойства
Двухосновные кислоты более сильные, чем одноосновные. Это объясняется взаимным влиянием карбоксильных групп, облегчающих диссоциацию:

В целом реакции дикарбоновых кислот и их монокарбоновых аналогов почти не различаются между собой. Механизм реакций образования диамидов, диэфиров и др. из карбоновых кислот тот же, что и для монокарбоновых кислот. Исключение составляют дикарбоновые кислоты, содержащие меньше четырех атомов углерода между карбоксильными группами. Такие кислоты, две карбоксильные группы которых способны реагировать с одной функциональной группой или друг с другом, обнаруживают необычное поведение в реакциях, протекающих с образованием пяти- или шестичленных замкнутых активированных комплексов или продуктов.
Примером необычного поведения карбоновых кислот могут служить реакции, протекающие при нагревании.
При 150 о С щавелевая кислота разлагается на муравьиную кислоту и СО 2 :
HOOC-COOH ® HCOOH + CO 2
2. Циклодегидратация .
При нагревании g -дикарбоновых кислот, у которых карбоксильные группы разделены атомами углерода, происходит циклодегидратация, в результате чего образуются циклические ангидриды:

3. Синтезы на основе малонового эфира .
Двухосновные кислоты с двумя карбоксильными группами при одном углеродном атоме, т.е. малоновая кислота и ее моно- и дизамещенные гомологи, при нагревании несколько выше их температур плавления разлагаются (подвергаются декарбоксилированию ) с отщеплением одной карбоксильной группы и образованием уксусной кислоты или ее моно- и дизамещенных гомологов:
HOOCCH 2 COOH ® CH 3 COOH + CO 2
HOOCCH(CH 3)COOH ® CH3CH2COOH + CO 2
HOOCC(CH 3) 2 COOH ® (CH3) 2 CHCOOH + CO 2
Атомы водорода метиленовой группы, находящейся между ацильными группами диэтилового эфира малоновой кислоты (малоновый эфир ), обладают кислотными свойствами и дают натриевую соль с этилатом натрия. Эту соль – натрий-малоновый эфир – алкилируют по механизму нуклеофильного замещения S N 2 . На основе натрий-малонового эфира получают одно- и двухосновные кислоты:
- Na + + RBr ® RCH(COOCH 2 CH 3) 2 + 2 H 2 O ®
R-CH(COOH) 2 алкилмалоновая кислота ® R-CH 2 COOH алкилуксусная кислота + CO 2
4. Пиролиз кальциевых и бариевых солей .
При пиролизе кальциевых или бариевых солей адипиновой (С 6 ), пимелиновой (С 7 ) и пробковой (С 8 ) кислот происходит отщепление СО 2 и образуются циклические кетоны:

Непредельные одноосновные карбоновые кислоты
Непредельные одноосновные кислоты этиленового ряда имеют общую формулу C n H 2 n -1 COOH , ацетиленового и диэтиленового рядов - C n H 2 n -3 COOH . Примеры непредельных одноосновных кислот:
Непредельные одноосновные кислоты отличаются от предельных большими константами диссоциации. Ненасыщенные кислоты образуют все обычные производные кислот - соли, ангидриды, галогенангидриды, амиды, сложные эфиры и др. Но за счет кратных связей они вступают в реакции присоединения, окисления и полимеризации.
Благодаря взаимному влиянию карбоксильной группы и кратной связи присоединение галогенводородов к a,b-непредельным кислотам происходит таким образом, что водород направляется к наименее гидрогенизированному атому углерода:
CH 2 = CHCOOH + HBr ® BrCH 2 CH 2 COOH b -бромпропионовая кислота

Этиленовые кислоты типа акриловой кислоты и их эфиры значительно легче подвергаются полимеризации, чем соответствующие углеводороды.
отдельные представители
Акриловую кислоту получают из этилена (через хлоргидрин или оксид этилена), гидролизом акрилонитрила или окислением пропилена, что более эффективно. В технике используются производные акриловой кислоты - ее эфиры, особенно метиловый (метилакрилат ). Метилакрилат легко полимеризуется с образованием прозрачных стекловидных веществ, поэтому его применяют в производстве органического стекла и других ценных полимеров.
Метакриловая кислота и ее эфиры получают в больших масштабах методами, сходными с методами синтеза акриловой кислоты и ее эфиров. Исходным продуктом является ацетон, из которого получают ацетонциангидрин, подвергают дегидратации и омылению с образованием метакриловой кислоты. Этерификацией метиловым спиртом получают метилметакрилат, который при полимеризации или сополимеризации образует стекловидные полимеры (органические стекла) с весьма ценными техническими свойствами.
Двухосновные ненасыщенные кислоты
Наиболее простые ненасыщенные двухосновные кислоты - фумаровая и малеиновая - имеют одну и ту же структурную формулу HOOCCH = CHCOOH , но разную пространственную конфигурацию: фумаровая - транс -, малеиновая - цис -. Малеиновая кислота (лабильная форма) под действием брома, йода, азотистой кислоты легко переходит в устойчивую (стабильную) форму - фумаровую кислоту. Обратный переход осуществляется под действием ультрафиолетовых лучей. Малеиновая кислота в технических масштабах получается каталитическим окислением бензола и нафталина кислородом воздуха.
Обе кислоты способны образовывать соли, сложные эфиры, амиды и некоторые другие производные кислот. Однако, малеиновая кислота, в отличие от фумаровой, легко образует циклический ангидрид, так как обе карбоксильные группы расположены по одну сторону от двойной связи (цис -изомер). Малеиновый ангидрид служит характерным реактивом для обнаружения 1,3-диеновых соединений: он легко вступает в реакцию диенового синтеза и во многих случаях дает ценные продукты. Малеиновый ангидрид широко применяется при производстве полиэфирных смол и сополимеров со стиролом, акриловым и метакриловым эфирами. Гидратацией малеинового ангидрида получают яблочную кислоту, применяемую в пищевой промышленности.
Монокарбоновые кислоты ароматического ряда
Ароматическими карбоновыми кислотами называются производные бензола, содержащие карбоксильные группы, непосредственно связанные с ароматическим ядром. Кислоты, содержащие карбоксильные группы в боковой цепи, рассматриваются как жирноароматические . По количеству карбокисльных групп ароматические кислоты делятся на одно-, двухосновные и т.д. Название кислоты производится от ароматического углеводорода (бензойная кислота, п -толуиловая кислота).
Способы получения
1. Окисление ароматических углеводородов .
Для синтеза ароматических кислот наиболее подходят метильные гомологи бензола, радикально-цепное окисление которых протекает через стадии первичного гидропероксида и альдегида:
ArCH 3 + O 2 ® ArCH 2 OOH ® ArCHO+ O 2 ® ArCOOH
Жидкофазным окислением метилбензолов кислородом воздуха в промышленности получают моно- и дикарбоновые ароматические кислоты.
2. Окисление спиртов, альдегидов и кетонов .
Ароматические спирты, альдегиды и кетоны окисляются легче, чем углеводороды. Окисление обычно ведут с помощью гипохлоритов по схеме:
C 6 H 5 - CO - CH 3 + 4 NaOCl ® C 6 H 5 - COOH + NaCl + H 2 O + CO 2
3. Гидролиз галогенпроизводных .
Этот способ широко применяется в технике.
C 6 H 5 CCl 3 + 2 H 2 O ® C 6 H 5 COOH + 3 HCl
При хлорировании толуола получают три вида галогенпроизводных: хлористый бензил для производства бензилового спирта; хлористый бензилиден – для получения бензальдегида; бензотрихлорид перерабатывается на бензойную кислоту.
4. Синтез Гриньяра .
C 6 H 5 Li + CO 2 ® C 6 H 5 COOLi + LiBr
Химические свойства
В водных растворах монокарбоновые кислоты обнаруживают большую степень диссоциации, чем алифатические кислоты (К а бензойная к-та =6,6×10 -5 , К а уксусная к-та =1,8×10 -5). Большая степень диссоциации бензойной кислоты обусловлена электрофильным характером бензольного кольца:

Кислотность ароматических кислот почти не зависит от резонансных эффектов.
Ароматические кислоты вступают во все те реакции, которые свойственны и кислотам жирного ряда. За счет карбоксильной группы образуются различные производные кислот: действием кислот на щелочи и карбонаты получаются соли , эфиры - нагреванием смеси кислоты и спирта в присутствии минеральной кислоты.
Если заместителей в орто -положении нет, то этерификация карбоксильной группы происходит так же легко, как и в случае алифатических кислот. Если одно из орто -положений замещено, то скорость этерификации сильно уменьшается, а если заняты оба орто -положения, то этерификация не идет.
Эфиры орто -замещенных бензойных кислот могут быть приготовлены при реакции серебряных солей с галогеналканами. Они с трудом подвергаются гидролизу. Такое явление носит название пространственных (стерических) затруднений. Группы, большие, чем водород, в такой степени заполняют пространство вокруг углеродного атома карбоксильной группы, что затрудняет переход в промежуточное состояние при образовании или омылении эфира.
Хлорангидриды получаются действием на кислоты хлористого тионила или пятихлористого фосфора:
C 6 H 5 COOH + SOCl 2 ® C 6 H 5 COCl + HCl + SO 2
Ангидриды получают перегонкой смеси кислоты с уксусным ангидридом или действием хлорангидридов на соли:
C 6 H 5 COCl + NaOOCC 6 H 5 ® ( C 6 H 5 CO ) 2 O + 2 NaCl
При сплавлении соли ароматической карбоновой кислоты со щелочью карбоксильная группа замещается на водород:
C 6 H 5 COONa + NaOH ® ArH + Na 2 CO 3
Важнейшие представители
1. Бензойная кислота . Основными способами получения бензойной кислоты являются окисление толуола и декарбоксилирование фталевой кислоты. Применяется в качестве консерванта в пищевой промышленности вследствие сильного антисептического действия, а также в производстве красителей и душистых веществ. Очень важным производным бензойной кислоты является ее хлорангидрид - хлористый бензоил . Это жидкость с характерным запахом и сильным лакриматорным действием.
2. п-трет -Бутилбензойная кислота получается в промышленных масштабах окислением трет -бутилтолуола в присутствии растворимой соли кобальта в качестве катализатора. Применяется в производстве полиэфирных смол.
Дикарбоновые ароматические кислоты
Известно три бензолдикарбоновых кислоты: фталевая (о -изомер), изофталевая (м -изомер) и терефталевая (п -изомер). Терефталевая кислота является кристаллическим веществом (Т возг . 300 о С), по сравнению с изомерными кислотами наименее растворима в воде и органических жидкостях. Терефталевая кислота и ее диметиловый эфир играют важную роль в производстве синтетического волокна лавсан (терилен ) - продукта их поликонденсации с этиленгликолем. Терефталевую кислоту получают окислением п -ксилола.
Изофталевая кислота применяется для производства полиэфиров. Ее получают аналогично терефталевой кислоте - жидкофазным окислением м -ксилола.
кислот - мезовинная не относится к числу оптически активных веществ. Гомологом щавелевой кислоты является адипиновая кислота НООС(СН 2) 4 СООН, которая получается окислением некоторых циклических соединений. Она входит в состав чистящих средств для удаления ржавчины, а также служит исходным веществом для производства полиамидных волокон (см. статью «Гиганты органического мира. Полимеры»).
КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
Хотя карбоксильная группа состоит из карбонильной и гидроксильной групп, карбоновые кислоты по свойствам сильно отличаются и от спиртов, и от карбонильных соединений. Взаимное влияние ОН- и -групп приводит
к перераспределению электронной плотности. В результате атом водорода гидроксильной группы приобретает кислотные свойства, т. е. легко отщепляется при растворении кислоты в воде. Карбоновые кислоты изменяют окраску индикаторов и проявляют все свойства, характерные для растворов неорганических кислот.
Все одноосновные кислоты, не содержащие заместителей (например, муравьиная и уксусная), являются слабыми - лишь в незначительной степени диссоциированными на ионы. Силу кислоты можно изменить, введя в a-положение к функциональной группе атом галогена. Так, трихлоруксусная кислота, образующаяся при хлорировании уксусной кислоты СН 3 СООН+3Сl 2 ®ССl 3 СООН+3НСl, в водном растворе в значительной степени диссоциирует на ионы.
Карбоновые кислоты могут образовывать функциональные производные, при гидролизе которых вновь получаются исходные кислоты. Так, при действии на карбоновые кислоты хлорида и оксида фосфора(V) образуются, соответственно, хлорангидриды и ангидриды; при действии аммиака и аминов - амиды; спиртов - сложные эфиры.
Кристаллы монохлоруксусной кислоты СН 2 ClСООН.
График зависимости температуры кипения алканов, спиртов, альдегидов и карбоновых кислот с неразветвлённой цепью от числа атомов углерода в молекуле.
Реакция образования сложных эфиров носит название этерификации (от греч. «этер» - «эфир»). Обычно её проводят в присутствии минеральной кислоты, играющей роль катализатора. При нагревании сложный эфир (или вода, если эфир кипит при температуре выше 100 °С) отгоняется из реакционной смеси, и равновесие смещается вправо. Так, из уксусной кислоты и этилового спирта получают этилацетат - растворитель, входящий в состав многих видов клея:
Многие сложные эфиры представляют собой бесцветные жидкости с приятным запахом. Так, изоамилацетат пахнет грушей, этилбутират - ананасом, изоамилбутират - абрикосом, бензилацетат - жасмином, а этилформиат - ромом. Многие сложные эфиры используются в качестве
вкусовых добавок при изготовлении различных напитков, а также в парфюмерии. Особенно нежный запах у производных 2-фенилэтилового спирта: эфир этого спирта и фенилуксусной кислоты пахнет мёдом и гиацинтами. А аромат эфира муравьиной кислоты заставляет вспомнить благоухание букета роз и хризантем. В присутствии щёлочи сложные эфиры могут быть гидролизованы - разложены на исходный спирт и соль карбоновой кислоты. При гидролизе жиров (сложных эфиров глицерина и высших карбоновых кислот) образуются основные компоненты мыла - пальмитат и стеарат натрия,
НАЗВАНИЯ НЕКОТОРЫХ КАРБОНОВЫХ КИСЛОТ И ИХ СОЛЕЙ
*Этилацетат- бесцветная нерастворимая в воде жидкость с приятным эфирным запахом (t кип =77,1 °C), смешивается с этиловым спиртом и другими органическими растворителями.
**Названия сложных эфиров образованы из названий соответствующих спиртов и кислот: этилацетат - эфир этилового спирта и уксусной кислоты (уксусноэтиловый эфир), изоамилформиат - эфир изоамилового спирта и муравьиной кислоты (муравьиноизоамиловый эфир).
ЛЕДЯНАЯ КИСЛОТА
В уксусе, который образуется при прокисании вина, содержится около 5% уксусной кислоты (столовым уксусом называют 3-15-процентный раствор). Перегонкой такого уксуса получают уксусную эссенцию - раствор с концентрацией уже 70-80%. А чистая (100-процентная) уксусная кислота выделяется в результате воздействия концентрированной серной кислоты на ацетаты: CH 3 COOHNa+H 2 SO 4 (конц.)= CH 3 COOH+NaHSO 4 .
Такая чистая уксусная кислота, не содержащая воды, при охлаждении до 16,8 °С превращается в прозрачные кристаллы, напоминающие лёд. Вот почему её иногда называют ледяной.
Сходство не только внешнее: в кристаллах молекулы уксусной кислоты,
Жидкая при комнатной температуре ледяная уксусная кислота при охлаждении ниже 1 7 °С превращается в бесцветные кристаллы, действительно похожие на лёд.
подобно молекулам воды, образуют систему водородных связей. Межмолекулярное взаимодействие оказывается настолько прочным, что даже в парах уксусной кислоты содержатся не отдельные молекулы, а их агломераты.
Многие соли уксусной кислоты неустойчивы к нагреванию. Так, при разложении ацетата кальция образуется ацетон:
А при нагревании смеси ацетата натрия со щёлочью выделяется метан:
В течение многих столетии главным методом синтеза уксусной кислоты было брожение. Таким способом и сейчас производят пищевой уксус. А для производства сложных эфиров и искусственных волокон в качестве сырья используют кислоту, которая получается при каталитическом окислении углеводородов, например бутана:
СН 3 -СН 2 -СН 2 -СН 3 +2,5О 2 ®2СН 3 -СООН+Н 2 О.
Вольтарен (ортофен, диклофенак натрия) может рассматриваться как лучший из современных НПВП. Он сочетает выраженный антивоспалительный эффект с особенно хорошей переносимостью, которая делает возможным длительный прием препарата.
В пищеварительном тракте всасывается практически полностью, максимальная концентрация достигается через 1-2 ч. Препарат активно метаболизируется и в виде связанных продуктов обмена (часть которых также обладает противовоспалительными свойствами) выделяется с мочой и желчью. Концентрация в плазме пропорциональна использованной дозе. Препарат накапливается в очагах воспаления, в частности в синовиальной жидкости при артрите, где он в отличие от плазмы длительно (до 7 ч) сохраняется в почти неизменной концентрации (концентрация в крови за этот период значительно снижается). При назначении кормящим женщинам он практически не обнаруживается в молоке. При одновременном назначении ацетилсалициловой кислоты и вольтарена максимальная концентрация последнего в плазме приблизительно на 30% снижается по сравнению с назначением одного вольтарена.
В основе тормозящего влияния вольтарена на воспаление лежит, по-видимому, активное угнетение синтеза простагландинов. Препарат является самым мощным ингибитором простагландинсинтетазы среди современных НПВП. Поскольку это ингибирование необратимо [Ки Е. et al., 1974], его антивоспалительный эффект сохраняется значительно дольше, чем держится высокая концентрация препарата в организме. Вольтарен способен также тормозить действие ряда ферментов, принимающих участие в развитии воспалительного процесса, в том числе лизосомных гидролаз. Имеются сведения об угнетении нейтральной протеазы, выделенной из человеческих гранулоцитов.
Своеобразием эффекта вольтарена можно считать столь быстро проявляющееся анальгетическое действие, что высказываются даже предположения о его частичной независимости от собственно антивоспалительного влияния. Важная особенность препарата установлена при изучении динамики спонтанного гонартроза у мышей. Оказалось, что он уменьшает его частоту развития и тяжесть процесса, в то время как остальные НПВП (в том числе и индометацин) усугубляют данную патологию.
Это связано, возможно, с тем, что вольтарен в отличие от остальных препаратов не влияет отрицательно на обмен хряща, в частности в эксперименте не тормозит включения серы в протеогликаны хряща.Вольтарен выпускается в разнообразных формах: таблетки с растворимым в кишечнике покрытием по 25 и 50 мг, таблетки с медленным освобождением препарата (вольтарен-ретард) по 100 мг, свечи по 50 и 100 мг, в ампулах для внутримышечного введения по 75 мг. Назначают препарат в основном внутрь в виде таблеток. Средняя терапевтическая доза 150 мг, реже - 100 мг, при необходимости дозу повышают до 200 мг. Поддерживающие дозы могут составлять 75-100 мг. Использование препарата в свечах (в тех же дозах) дает тождественные результаты. При желании добиться особенно быстрого эффекта в течение первого периода лечения используют внутримышечные инъекции вольтарена (самостоятельно или в дополнение к его приему внутрь либо в свечах) по 75 мг 1-2 раза в сутки. Боль заметно уменьшается через 10-45 мин после инъекции. В период поддерживающей терапии очень удобен вольтарен-ретард, который применяют по 100 мг (т. е. по 1 таблетке) 1 раз в сутки, препарат дает такой же эффект, как и прием обычных таблеток по 25 мг 4 раза в сутки.
Наиболее широко вольтарен применяют при ревматоидном артрите, при этом заболевании его можно использовать непрерывно в течение многих месяцев и лет. В нетяжелых случаях значительное улучшение наступает при назначении только одного этого препарата. У тяжелобольных в соответствии с общими принципами терапии ревматоидного артрита лечение вольтареном можно успешно сочетать с любым из длительно действующих (базисных) препаратов. Очень хорошие результаты получены также при лечении больных с артрозами. У больных болезнью Бехтерева вольтарен оказался столь же эффективным, как и считавшийся ранее лучшим препаратом индометацин, причем по переносимости преимущество вольтарена бесспорно. В достаточно высоких дозах (150-200 мг/сут) препарат используется для купирования острого приступа подагры; при этом особенно оправдано его внутримышечное введение.
За последнее время установлено, что в терапии острого ревматизма вольтарен, как и индометацин, способен оказать лечебный эффект, подобный эффекту преднизолона. Это относится ко всем проявлениям заболевания, в том числе и к ревмокардиту. Важно, что отдаленные результаты назначения трех указанных препаратов оказались одинаковыми. Было установлено, в частности, что на фоне лечения вольтареном может происходить полное обратное развитие вальвулита. Очевидное терапевтическое действие вольтарена отмечено и при других вариантах течения ревматизма, в том числе у ряда больных, резистентных к иным лекарственным препаратам.Хорошие результаты получены у больных так называемым ревматизмом мягких тканей (плечелопаточный периартрит, бурситы, тендиниты, теносиновиты), а также при радикулярных синдромах, в том числе с острой болью. В последних случаях показаны инъекции препарата.
С успехом препарат используется и при неревматических болезнях, проявляющихся воспалением, болью и лихорадкой, в частности у больных тромбофлебитами, аднекситами, инфекциями (в сочетании с адекватными антиинфекционными средствами), в послеоперационном периоде, при ушибах и т. д. Большое значение имеет лечебный эффект вольтарена при хроническом гломерулонефрите, установленный G. Lagrue и G. Hirbe (1979), М. Sasdelli и соавт. (1980). Эти исследователи считают, что препарат улучшает прогноз заболевания, замедляя темпы развития почечной недостаточности.
Вольтарен по своей переносимости превосходит все остальные НПВП. Он по существу не вызывает тяжелых осложнений и при необходимости применяется практически постоянно. Препарат с осторожностью можно использовать даже при язвенной болезни, хотя при этом, естественно, целесообразно его назначать в свечах.
Среди весьма редко встречающихся побочных эффектов следует иметь в виду нерезкие головную боль, тошноту, боль в животе, крапивницу, появление эритроцитов в моче (по-видимому, за счет слабого антикоагулянтного действия, свойственного всем НПВП). После уменьшения дозы или отмены препарата эти явления быстро исчезают. Абсолютных противопоказаний к назначению вольтарена нет; относительным противопоказанием для приема внутрь может считаться язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения.Толметин (толектин) - довольно популярный антиревматический препарат, представляющий собой 1-метил-5п-толуоилпиррол-2-уксусную кислоту. По некоторым деталям структурной формулы он напоминает индометацин. Толметин полностью всасывается в пищеварительном тракте, максимальная концентрация в крови наблюдается через 30-40 мин, период полуочищения плазмы длится около часа. Быстро выводится с мочой в виде глюкуронидов и неактивных метаболитов. Механизм лечебного действия изучен недостаточно, основное значение придается торможению синтеза простагландинов.
Выпускается в таблетках по 200 мг. Имеются сообщения о явном положительном эффекте у больных ревматоидным артритом, болезнью Бехтерева, остеоартрозом, плече-лопаточным периартритом, эпикондилитами и т. д. Доказана возможность длительного применения препарата, в частности при ревматоидном артрите до 2½ лет. Хорошие результаты были получены при лечении больных ювенильным ревматоидным артритом. Как известно, при этом заболевании новые нестероидные препараты изучаются редко. Оказалось, что по достигнутым результатам толметин не уступает ацетилсалициловой кислоте, считающейся пока стандартным противовоспалительным препаратом в терапии ювенильного ревматоидного артрита. Однако, несмотря на единодушно положительную суммарную оценку толметина, этот препарат относится к лекарственным средствам, анальгетические свойства которых преобладают над противовоспалительными.
Препарат хорошо переносится как при кратковременном, так и при длительном назначении. К нечасто встречающимся побочным явлениям относятся боль в эпигастрии, тошнота, рвота, головная боль, головокружение, шум в ушах, кожные сыпи, задержка жидкости, повышение АД.
Суточная доза 800-1600 мг (чаще около 1200 мг). Препарат чаще принимают 4 раза в сутки в связи с его быстрым выведением из организма.
Функциональные производные карбоновых кислот. Двухосновные карбоновые кислоты. a,b-Ненасыщенные кислоты
Производные карбоновых кислот
1. Галогенангидриды.
При действии галогенидов фосфора или хлористого тионила происходит образование галогенагидридов:
CH 3 COOH + PCl 5 ® CH 3 COCl + POCl 3 + HCl
Галоген в галогенангидридах обладает большой реакционной способностью. Сильный индукционный эффект определяет легкость замещения галогена другими нуклеофилами: -OH, -OR, -NH2, -N3, -CN и др.:
CH 3 COCl + CH 3 COOAg ® (CH 3 CO) 2 O уксусный ангидрид + AgCl
1. Ангидриды.
Ангидриды образуются при взаимодействии солей кислот с их галогенангидридами:
CH 3 COONa + CH 3 COCl ® NaCl + (CH 3 CO) 2 O
Ангидриды кислот обладают большой химической активностью и являются, как и галогенангидриды, хорошими ацилирующими агентами.
Амиды получают через галогенангидриды
CH 3 COCl +2 NH 3 ® CH 3 CONH 2 ацетамид + NH 4 Cl
или из аммонийных солей кислот, при сухой перегонке которых отщепляется вода и образуется амид кислоты. Также амиды кислот образуются как побочный продукт при гидролизе нитрилов. Процессы амидирования имеют важное значение в промышленности для производства ряда ценных соединений (N,N-диметилформамид, диметилацетамид, этаноламиды высших кислот).
4. Нитрилы. Важнейшими представителями нитрилов являются ацетонитрил CH 3 CN (применяется как полярный растворитель) и акрилонитрил CH 2 =CHCN (мономер для получения синтетического волокна нейрона и для производства дивинилнитрильного синтетического каучука, обладающего масло- и бензостойкостью). Основным способом получения нитрилов является дегидратация амидов на кислотных катализаторах:
CH 3 CONH 2 ® CH 3 C-CN + H 2 O
5. Сложные эфиры. Сложные эфиры карбоновых кислот имеют важное практическое значение в качестве растворителей, гидравлических жидкостей, смазочных масел, пластификаторов и мономеров. Их получают этерификацией спиртов кислотами, ангидридами и галогенангидридами или взаимодействием кислот и алкенов:
CH 3 -CH=CH 2 + CH 3 COOH ® CH 3 COOCH(CH 3) 2
Многие эфиры используются в качестве душистых веществ:
| CH 3 COOCH 2 CH 3 | грушевая эссенция |
| CH 3 CH 2 CH 2 COOCH 2 CH 2 CH 2 CH 2 CH 3 | ананасовая эссенция |
| ромовая эссенция |
Двухосновные насыщенные кислоты
Двухосновные предельные (насыщенные) кислоты имеют общую формулу C n H 2 n (COOH) 2 . Из них важнейшими являются:
НООС-СООН - щавелевая, этандикарбоновая кислота;
НООС-СН 2 -СООН - малоновая, пропандикарбоновая кислота;
НООС-СН 2 -СН 2 -СООН - янтарная, бутандикарбоновая кислота;
НООС-СН 2 -СН 2 -СН 2 -СООН - глутаровая, пентандикарбоновая кислота.
Способы получения
Общие методы получения двухосновных кислот аналогичны способам получения одноосновных кислот (окисление гликолей, гидролиз динитрилов, синтез Кольбе - см. Лекцию№27).
1. Окисление оксикислот:
OH-CH 2 CH 2 COOH ® HOCCH 2 COOH ® HOOC-CH 2 -COOH
2. Окисление циклоалканов.
Это промышленный способ получения адипиновой кислоты HOOC-CH 2 CH 2 CH 2 CH 2 -COOH из циклогексана.
Побочно образуются также янтарная и щавелевая кислоты. Адипиновая кислота применяется для синтеза волокна найлон 6,6 и пластификаторов.
Химические свойства
Двухосновные кислоты более сильные, чем одноосновные. Это объясняется взаимным влиянием карбоксильных групп, облегчающих диссоциацию:

В целом реакции дикарбоновых кислот и их монокарбоновых аналогов почти не различаются между собой. Механизм реакций образования диамидов, диэфиров и др. из карбоновых кислот тот же, что и для монокарбоновых кислот. Исключение составляют дикарбоновые кислоты, содержащие меньше четырех атомов углерода между карбоксильными группами. Такие кислоты, две карбоксильные группы которых способны реагировать с одной функциональной группой или друг с другом, обнаруживают необычное поведение в реакциях, протекающих с образованием пяти- или шестичленных замкнутых активированных комплексов или продуктов.
Примером необычного поведения карбоновых кислот могут служить реакции, протекающие при нагревании.
При 150 о С щавелевая кислота разлагается на муравьиную кислоту и СО 2:
HOOC-COOH ® HCOOH + CO 2
2. Циклодегидратация.
При нагревании g-дикарбоновых кислот, у которых карбоксильные группы разделены атомами углерода, происходит циклодегидратация, в результате чего образуются циклические ангидриды: